Etiopatogénese e aspectos epidemiológicos
A infecção bacteriana perinatal é, por definição, uma infecção de origem materna, geralmente adquirida por via ascendente. Os microrganismos causadores são, por isso, os colonizadores habituais do tracto genital feminino: as enterobacteriáceas – E. coli, Proteus, Klebsiella – e Streptococcus do grupo B (SGB). Este último é, de longe, o agente mais frequente da sépsis neonatal de origem materna nos países desenvolvidos.
Em Portugal, a taxa de mulheres em idade fértil portadoras de SGB varia, de acordo com as regiões, entre 15% a 30%. Num estudo realizado em 10 unidades neonatais portuguesas, o agente SGB contribuiu em 52% para os isolamentos em hemocultura nos casos de infecções de origem materna, seguido de E. coli (17%).
Num outro estudo, também nacional, a incidência de infecção comprovada por SGB nos primeiros 7 dias de vida foi de 0,44/1000 nados vivos. De referir que a letalidade pode ser superior a 8%, e as sequelas importantes caso haja meningite.
O diagnóstico precoce e correcto de infecção bacteriana no período neonatal continua a ser um dos grandes desafios da neonatologia. Os sinais clínicos são inespecíficos e insidiosos, e um atraso no início da terapêutica implica um risco elevado de morte evitável.
Risco infeccioso e sua interpretação
Gerdes define muito bem qual o papel do neonatologista no que respeita à infecção e risco infeccioso perinatais:
- desenvolver uma avaliação sistematizada do diagnóstico de sépsis, baseada na importância relativa dos sinais clínicos e dos factores de risco;
- não proceder a diagnósticos negativos falsos, o que implica tratar mais RN dos que os realmente infectados;
- evitar tratamentos desnecessários no RN com risco infeccioso, uma vez provado que não existe infecção.
A história clínica materna é de importância primordial para a identificação de situações de risco infeccioso, o qual deve ser valorizado de acordo com as circunstâncias, sempre com o objectivo de evitar o diagnóstico tardio de sépsis.
O risco infeccioso constitui, pois, um sinal de alerta e não uma doença; por conseguinte, o risco infeccioso não se trata, embora a sua ocorrência implique uma atitude de vigilância e pesquisa sistemáticas de exclusão de infecção. Implica também, frequentemente, a administração de antibióticos até prova de que não existe infecção.
Ou seja, a presença de determinados factores de risco legitima o início de terapêutica antimicrobiana considerando que, até prova em contrário, o RN está infectado.
Na prática, a dificuldade reside em determinar que condições maternas constituem realmente um risco infeccioso para o feto, que exames realizar, em que situações deve ser iniciada antibioticoterapia, e durante quanto tempo.
Gerdes calculou a frequência de sépsis, septicémia ou pneumonia de acordo com determinados parâmetros maternos do seguinte modo:
- ruptura prematura de membranas (RPM) >18-24h de 1% a 2%;
- mãe portadora de Streptococcus do grupo B (SGB) entre 0,5% e 2%;
- as duas condições associadas ou a existência de uma delas juntamente com parto pré-termo espontâneo, elevam a frequência para valores entre 4% e 11%;
- o estado de portador de SGB juntamente com a existência de febre materna têm uma frequência semelhante à RPM e corioamnionite ou RPM;
- sofrimento fetal, depressão neonatal/índice de Apgar < 6 aos 5 minutos, entre 3% e 10%.
Ainda, segundo o mesmo autor, tomando como base o estado de portadora de SGB, a associação a febre materna multiplica o risco de infecção neonatal 4 vezes, a associação a RPM ou prematuridade, 7 vezes.
Por outro lado, a associação de três factores – estado de portadora, prematuridade e RPM – eleva o risco entre 8 a 11 vezes.
O problema que se levanta em relação à corioamnionite clínica, definida por vários autores pela existência de febre materna, taquicárdia materna ou fetal, dor ou hiperestesia uterina, líquido amniótico (LA) fétido e leucocitose materna, é interpretar estes sinais e sintomas. Cada um deles, observado num contexto de trabalho de parto, pode ser devido a muitos outros factores que nada têm a ver com infecção.
Nota Importante: |
Para além das condições atrás mencionadas existem algumas causas extrínsecas que aumentam o risco de infecção intra-amniótica. São elas a monitorização fetal interna, a existência de mais de 4 toques vaginais ou o internamento prolongado em meio hospitalar, o trabalho de parto prolongado ou procedimentos obstétricos invasivos (como amniocentese, transfusão intrauterina ou cerclage), determinando por vezes que surja uma infecção neonatal precoce causada por agente hospitalar.
Um dos campos de investigação a nível mundial diz respeito ao estudo do microbioma na grávida e no RN, e da avaliação do seu impacte, através de diversas vias, no sistema imunitário e na infecção perinatal.
Manifestações clínicas
As manifestações clínicas da infecção sistémica do RN são muito variáveis. Sendo o RN um ser “imaturo” é lógico admitir que as manifestações possam ser escassas. Na realidade, o RN é oligossintomático, em geral exibindo aspecto de “não estar bem” em doenças muito diversas. O clínico deverá, pois, assumir uma atitude de suspeita, designadamente nas situações de risco atrás discriminadas.
As manifestações podem relacionar-se com todos os órgãos e sistemas, incluindo:
- a pele (cianose, icterícia, escleredema, celulite, abcesso, sufusões hemorrágicas, má perfusão capilar periférica, tempo de recoloração prolongado, etc.);
- aparelho respiratório (dificuldade respiratória, apneia, taquipneia, etc.);
- aparelho digestivo (intolerância alimentar, vómitos, diarreia, distensão abdominal, icterícia, etc.);
- aparelho cardiovascular (bradicárdia, taquicárdia, arritmia, hipertensão pulmonar, cardite, choque, etc.);
- sistema nervoso central (alterações do tono muscular, convulsões, etc.);
- sistema hematopoiético (diátese hemorrágica, anemia, hepatosplenomegália, etc.);
- sistema osteoarticular (artrite).
Estes sinais podem aparecer isoladamente ou em associação, o que depende essencialmente da duração da infecção, da virulência do germe causal, da maturidade do RN, e dos respectivos mecanismos de defesa imunitária.
Exames complementares
O isolamento do germe patogénico no sangue por meio de hemocultura constitui o método mais específico para o diagnóstico de infecção sistémica.
As colheitas para exames culturais devem ser sempre realizadas antes do início da antibioticoterapia; sempre que possível devem ser realizadas duas hemoculturas com volume de sangue suficiente – pelo menos 0,5 mL.
Outros exames a realizar em função do contexto clínico são:
- exames microbiológicos de exsudados periféricos;
- exame cultural do aspirado traqueal obtido na sala de partos ou nas primeiras horas de vida;
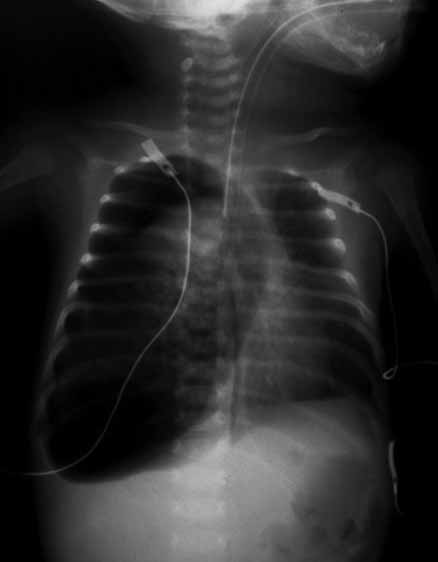
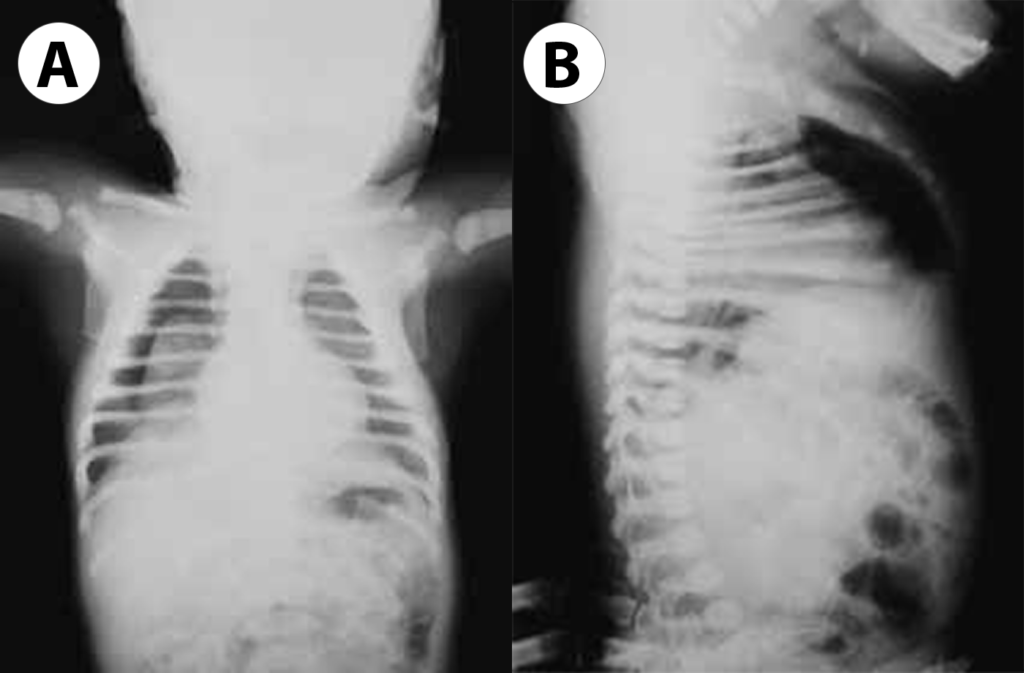
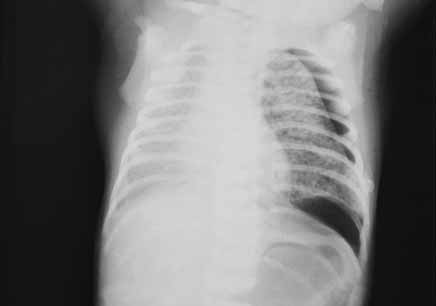
- exame cultural e citoquímico do LCR, caso haja clínica sugestiva de meningite e o estado clínico do RN permita a realização de punção lombar.
Contudo os resultados destes exames são demorados.
Entretanto, torna-se necessário realizar outros exames de resposta mais rápida que ajudem a consolidar a suspeita clínica de infecção: são os exames indirectos de infecção, nomeadamente os referentes aos reagentes de fase aguda (por ex. proteína C reactiva- PCR).
Contudo, não há nenhum marcador de infecção que, isoladamente, permita estabelecer um diagnóstico rápido e fidedigno de infecção precoce no RN. Por isso, muitos autores têm tentado estudar marcadores que, em conjunto, tenham elevado valor preditivo. Pouco se tem conseguido, mesmo considerando em conjunto critérios de gravidade baseados na clínica materna, neonatal, e vários parâmetros hematológicos e reagentes de fase aguda.
De acordo com a nossa experiência (MTN), o valor da proteína C reactiva (PCR), doseado seriadamente continua a ser o parâmetro analítico que melhor perfil apresenta. Três determinações negativas, com 12h a 24h de intervalo, permitirão interromper a antibioticoterapia às 72h com uma grande margem de segurança.
Mas, mais importante, segundo Remington, mesmo na era do diagnóstico molecular, continua a ser a experiência aliada à valorização dos dados clínicos: a história perinatal, o exame objectivo e a impressão clínica.
Tal como um único resultado de análise da PCR normal (até 1 mg/dL)(*) não deverá impedir o clínico de prescrever antibióticos se o RN evidenciar sinais sugestivos de doença – isto é, “não está bem”, também o resultado anormal de uma única análise não deve ser um indicativo absoluto para início de antibioticoterapia num RN evidenciando bom estado geral. Por outro lado, outros parâmetros laboratoriais poderão ser utilizados.
(*)Conquanto possa existir alguma variação dos valores de referência em diferentes laboratórios. |
Nota importante:
|
Publicações muito recentes, baseadas em meta-análises, apontam a vantagem de um marcador já usado em adultos, designado presepsina, relativamente à PCR e à PCT.
Tratamento
Ponderação de situações clínicas
A decisão de tratamento implica, primeiramente, valorizar a clínica. O médico poderá deparar com as seguintes situações:
- O RN está doente – Nesses casos, o risco “deixou de ser risco, passou a infecção”.
Nesta circunstância, a decisão é fácil de tomar: proceder a colheitas (hemocultura, cultura do aspirado traqueal colhido precocemente – sala de partos ou primeiras horas de vida) e iniciar antibioticoterapia. - O RN não evidencia sinais sugestivos de doença (ainda), mas há antecedentes de: a) amnionite; b) terapêutica materna com ampicilina e gentamicina no periparto (que obviamente atingiu o feto).
Em tal circunstância, na realidade, a terapêutica teve início in utero e ao pediatra basta prescrever ao RN os mesmos antibióticos prescritos à grávida anteriormente, de modo a dar continuidade ao referido tratamento. A hemocultura que, contudo deverá ser feita, será provavelmente negativa, uma vez que o feto transita para a vida extrauterina com antibióticos na sua circulação.
O RN não apresenta sinais sugestivos de doença, existe risco infeccioso perinatal, a mãe foi medicada com um antibiótico, ou não chegou a ser medicada.
Neste contexto, impõe-se uma vigilância clínica muito rigorosa e estudo seriado dos marcadores de infecção. A excepção a esta regra é o RN de mãe portadora de SGB a qual fora submetida a profilaxia da transmissão da infecção de modo adequado (2 ou mais administrações de ampicilina – 2 g seguidos de 1 g de 4 em 4h, ou penicilina); nesta última situação, em princípio, o RN não corre risco de infecção, não sendo necessário proceder a exames complementares – bastará a vigilância clínica rigorosa.
Nota Importante: |
Importa referir a decisão final, com base na seguinte constatação:
- níveis séricos fetais da penicilina, baixos e tardios – 1/3 dos níveis séricos maternos 120 minutos depois versus
- níveis séricos fetais da ampicilina, elevados e precoces, semelhantes aos maternos 60 a 90 minutos depois… conclui-se que deve ser recomendada a ampicilina.
Antibioticoterapia empírica
O tratamento empírico da infecção de origem materna é baseada nos possíveis agentes etiológicos. A penicilina ou ampicilina são antibióticos adequados para o tratamento da infecção por SGB, salientando-se que ainda se encontram estirpes de E. coli sensíveis também à ampicilina.
A administração conjunta de um aminoglicosídeo, habitualmente a gentamicina, alarga o espectro para as bactérias de Gram negativo, beneficiando-se ainda da potenciação do efeito bactericida quando se administra um beta-lactâmico juntamente com um aminoglicosídeo.
A ampicilina é usada na dose de 100 mg/kg/dia com periodicidade de 12 em 12h e a gentamicina na dose de 3 mg/kg/dia em administração única.
O tratamento deve durar 10 dias no caso de septicémia sem meningite. Se houver meningite por SGB, os antibióticos devem ser administrados durante 15 a 21 dias.
Nos casos de pneumonia, a terapêutica deve ser continuada até, pelo menos 2 dias, após desaparecimento dos sinais radiológicos.
Em situações clínicas muito graves – choque séptico, meningite grave – é admissível iniciar a terapêutica com 3 antibióticos: ampicilina, gentamicina e uma cefalosporina de 3ª geração, habitualmente cefotaxima (a ceftazidima deve ser reservada para infecções causadas por Pseudomonas), o que abrangerá com forte probabilidade todos os agentes mais comuns, incluindo os resistentes à ampicilina.
Quando o resultado da hemocultura estiver disponível ou, mais cedo ainda, quando tivermos o resultado do Gram, pode eventualmente ser possível, então, corrigir a terapêutica.
Como nota final, uma chamada de atenção para o conjunto de regras práticas para o clínico:
Atitudes que nunca deverão ser tomadas:
Em vez disso, escrever um pequeno resumo clínico com a hipótese diagnóstica ao colega do centro hospitalar mais próximo, enviando o doente para este;
|
BIBLIOGRAFIA
Abbas S, Lee K, Pakyz A, et al. Knowledge, attitudes, and practices of bedside nursing staff regarding antibiotic stewardship: A cross-sectional study. Am J Infect Control 2019;47:230-233
Adams-Chapman I. Long-term impact of infection on the preterm neonate. Semin Perinatol 2012;36:462-470
Beeram MD, Loughran C, Cipriani C, Govande V. Utilization of umbilical cord blood for the evaluation of group B streptococcal sepsis screening. Clin Peditar (Phila) 2012;51:447-453
Bellos I, Fitrou GL, Pergialiotis V, et al. The diagnostic accuracy of presepsin in neonatal sepsis: a meta-analysis. Eur J Pediatr 2018;177:625-632
Cantey JB, Milstone AM. Bloodstream infections. Epidemiology and resistance. Clin Perinatol 2015;42:1-16
Celik IH, Arifoglu I, Arslan Z, et al. The value of delta neutrophil index in neonatal sepsis diagnosis, follow-up and mortality prediction. Early Human Development 2019;131:6-9
Chau V, McFadden DE, Poskitt KJ, Miller SP. Chorioamnionitis in the pathogenesis of brain injury in preterm infants. Clin Perinatol 2014;41:83-103
Doyle LW, Cheong JLY. Does bovine lactoferrin prevent late-onset neonatal sepsis? Lancet 2019;393:382-384
Gerdes JS. Clinicopathologic approach to the diagnosis of neonatal sepsis. Clin Perinatol 1991:361-381
Gleason CA, Juul SE (eds). Avery’s Diseases of the Newborn. Philadelphia: Elsevier, 2018
Halliday HL. When to do a lumbar puncture in a neonate . Arch Dis Child 1989;64:313-316
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lichtenstern C, Brenner T, Bardenheuer HJ, Weigand MA. Predictors of survival in sepsis: what is the best inflammatory marker to measure? Curr Opin Infect Dis 2012;25:328-336
Lito D, Francisco T, Salva I, Tavares MN, Oliveira R, Neto MT. Análise das serologias para infeções do grupo TORCH e do rastreio para Streptococcus do Grupo B na população de grávidas de uma maternidade. Acta Med Port 2013;26:549-554
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Moro M, Málaga S, Madero L (eds): Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Neto MT, Serelha M, Nunes A, Guerreiro O, Braga AC, Lemos C, Afonso E, Carvalho C, Mateus M, Carreiro H, Garrote JM, Costa T. Mother-related infection in Portuguese newborn infants. Neonatal Branch of the Portuguese Society of Pediatrics. J Maternal-Fetal & Neonatal Medicine 2002;11 (Supp 1):260
Neto MT. Group B streptococcal disease in Portuguese infants younger than 90 days. Arch Dis Child Fetal Neonatal Ed 2008;93:90-93
N’Guessan R, Jellimann J-M, Hascoe J-M, et al.Value of gastric fluid to start antibiotics in premature babies suspected of having early neonatal bacterial infection Arch Pédiatr 2017;24:811-816
Özenci V, Schubert U. Earlier and more targeted treatment of neonatal sepsis. Acta Paediatrica 2019;108:160-170
Patel SJ, Saiman L. Principles and strategies of antimicrobial stewardship in the neonatal intensive care unit. Semin Perinatol 2012;36:431-6
Peeling RW, Ye H. Diagnostic tools for preventing and managing maternal and congenital syphilis: an overview. Bulletin W H O 2004;82:439-46
Pereira-da-Silva LP, Neto MT(eds). New Challenges in Foetal and Neonatal Infections. Trivandru, Kerala, India: Research Signapost Editors, 2011
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saunders, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Rosenfeld R, Shafer G, Scheid LM, et al. Screening and serial neutrophil counts do not contribute to the recognition or diagnosis of late onset neonatal sepsis. J Pediatr 2019;205:105-111
Russell ARB. Neonatal sepsis. Paediatr Child Health 2010;21:265-269
Saloojee H, Velaphi S, Goga Y, et al. The prevention and management of congenital syphilis: an overview on recommendations. Bulletin WHO 2004;82:424-430
Sasidharan R, Gupta N, Chawla D. Dopamine versus epinephrine for fluid-refractory septic shock in neonates. Eur J Pediatr 2019;178:113-114
Stoll B, Hansen NI, Adams-Chapman I, Fanaroff AA, et al. Neurodevelopmental and growth impairment among extremely low-birth-weight infants with neonatal infection. JAMA 2004;292:2357-2365
Valentine G, Chu DM, Stewart CJ, et al. Relationships between perinatal interventions, maternal-infant microbiomes, and neonatal outcomes. Clin Perinatol 2018;45:339-355
Walker O, Kenny CB, Goel N. Neonatal sepsis.Paediatr Child Health 2019;29:263-268
Wiswell T, Baumgart S, Gannon CM, Spitzer AR. No lumbar puncture in the evaluation for early neonatal sepsis: will meningitis be missed? Pediatrics 1995;95:803-806
Wu YW, Escobar GJ, Grether JK, Croen LA, Green JD, Newman TB. Chorioamnionitis and cerebral palsy in term and near-term infants. JAMA 2003;290:2677-2684
Zallocco F, Osimani P, Carloni I, et al. Assessment of clinical outcome of children with sepsis outside the intensive care unit. Eur J Pediatr 2018;177:1775-1783 https://doi.org/10.1007/s00431-018-3247-2
Zonnenberg IA, van Dijk-Lokkart EM. Neurodevelopmental outcome at 2 years of age in preterm infants with late-onset sepsis. Eur J Pediatr 2019;178:673-680