Definição e importância do problema
A síndroma de dificuldade respiratória (SDR) do RN pré-termo ou SDR do tipo I (anteriormente designada doença da membrana hialina/DMH), constitui um problema respiratório típico da imaturidade pulmonar resultante da deficiência em surfactante pulmonar (SP) endógeno.
O termo “surfactante” corresponde à designação funcional de um material heterogéneo e complexo de natureza lipoproteica, relativamente insolúvel, com grande plasticidade (distendendo-se em grau variável) cuja propriedade principal consiste em diminuir a tensão superficial na interface ar-líquido da porção respiratória do pulmão.
Constituindo a causa mais frequente de dificuldade respiratória no RN pré-termo, a sua gravidade (com repercussão na mortalidade) é inversamente proporcional à idade de gestação.
Globalmente, a DMH ocorre em cerca de 0,5 a 1% dos nados-vivos: em cerca de 60-80% dos RN pré-termo com <28 semanas, em cerca de 15-30% dos pré-termo com idades gestacionais compreendidas entre 32 e 36 semanas, raramente em RN de termo.
O Quadro 1 integra os factores clássicos que aumentam ou diminuem o risco de DMH.
QUADRO 1 – Factores de Risco de DMH.
|
Risco aumentado Prematuridade, sexo masculino, gemelaridade/ segundo gémeo, hipóxia e acidose, corioamnionite, cesariana electiva, diabetes materna, hidropisia fetal, etc.. |
|
Risco diminuído Hipóxia intrauterina crónica, ruptura prolongada de membranas ovulares, hipertensão materna, restrição do crescimento intrauterino (RCIU), administração de corticóides pré-natais, administração de tocolíticos, hormonas tiroideias, etc.. |
Etiopatogénese
Na génese do problema respiratório em análise importa realçar três factores relacionados com a imaturidade:
- Deficiência do surfactante pulmonar (SP) (da secreção, e/ou da inactivação ao nível do alvéolo pulmonar) conduzindo, como foi referido, a menor distensibilidade ou compliance alveolar/pulmonar – a causa primária.
Com efeito, possuindo este composto fosfolipídico-proteico um efeito regulador tensioactivo (diminuição da tensão superficial dos alvéolos e bronquíolos respiratórios durante a expiração), a sua presença no alvéolo (aumentando a compliance pulmonar e a relação V/P) evita o seu colapso durante a expiração e a sobredistensão durante a inspiração. Assim, garante a manutenção da capacidade residual funcional (CRF) e facilita as trocas gasosas em cada ciclo respiratório.
Por outro lado, importa relevar outra acção do SP: durante a inspiração, ao promover o recrutamento alveolar uniforme, reduz o gradiente de pressões entre o interstício e o alvéolo, diminuindo assim a probabilidade de formação de edema pulmonar.
A deficiente síntese ou libertação de surfactante associada à incapacidade de se criar uma capacidade residual adequada, e a particularidade de a parede torácica ser mais complacente, levam a atelectasia (atelectrauma), resultando em alvéolos perfundidos, mas não ventilados, o que conduz a hipóxia. (ver adiante Metabolismo do surfactante pulmonar)
A diminuição da compliance pulmonar, a redução do volume corrente, o aumento do espaço morto fisiológico, o aumento do trabalho respiratório, assim como a insuficiente ventilação alveolar conduzem a hipercápnia. A combinação de hipóxia, hipercápnia e acidose produz vasoconstrição arterial incrementando o shunt direita-esquerda através do foramen ovale, ductus arteriosus e no interior do próprio pulmão.
Verifica-se secundariamente redução do fluxo sanguíneo pulmonar com lesão isquémica, quer das células que produzem surfactante (pneumócitos de tipo II) e dos pneumócitos de tipo I, quer das células do leito vascular, o que favorece a saída de material proteico intravascular para o espaço alveolar. (Figura 1)
O colapso alveolar em áreas disseminadas do parênquima, a formação de depósitos hialinos e eosinófilos de fibrina agregando células alveolares necrosadas forrando os ductos alveolares e os bronquíolos terminais (daí o nome de “membranas hialinas”, conceito anatomopatológico, sendo que as mesmas são raramente observadas antes das 6-8 horas de vida extrauterina) e o edema intersticial contribuem para agravar a diminuição da compliance ou distensibilidade do pulmão, de tal modo que será necessária pressão mais elevada que a verificada em condições normais para expandir os alvéolos e vias terminais. (Figura 2)
A Figura 3 ilustra a consequência do défice ou disfunção do surfactante pulmonar, com alteração do formato da curva volume/ pressão (incapacidade distensão alveolar com o aumento da pressão intralveolar, e incapacidade de manutenção do volume residual). - Hipodesenvolvimento estrutural do pulmão
Reportando-nos às fases do desenvolvimento pulmonar embrionário e fetal, cabe referir que no RN pré-termo viável foi já atingido o estádio canalicular ou sacular. Nestes estádios as vias aéreas distais são de estrutura tubular, têm paredes espessas e a distância entre o leito capilar e o interstício é superior à que se verifica no termo da gestação, o que constitui factor limitativo quanto às trocas gasosas.
Por outro lado, sendo a área membranocapilar muito permeável, tal facto facilita a passagem de plasma para o interstício e espaço alveolar.
Figura 1. Patogénese da doença respiratória do RN por défice de surfactante.
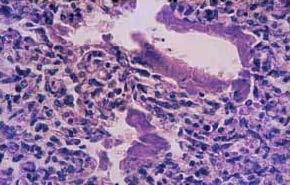
FIGURA 2. Aspecto histológico post-mortem de pulmão de RN pré-termo com DMH: parede dos alvéolos forrada por camada amorfa, homogénea, eosinófila (membranas hialinas). (URN-HDE)
FIGURA 3. Curva volume/ pressão no RN com SDR por DMH. (Défice de surfactante e incapacidade de manutenção do volume residual).
- Maior distensibilidade/compliance da parede torácica do RN pré-termo
Reiteram-se aqui as particularidades fisiológicas no RN pré-termo traduzidas essencialmente por maior tendência para a distorção da caixa torácica durante a respiração, o que contribui para aumentar o trabalho respiratório.
Nos RN afectados por DMH, a parte inferior da parede torácica é puxada para dentro ao mesmo tempo que o diafragma desce; consequentemente a pressão intratorácica torna-se negativa o que conduz à formação de atelectasia. A parede torácica altamente complacente do RN pré-termo, por outro lado, oferece menos resistência (em comparação com o que acontece no RN não imaturo) à tendência para o colapso, com incapacidade para a manutenção de ar residual no fim da expiração.
Outro aspecto particularmente relevante no RN pré-termo tem a ver com as características das fibras musculares do diafragma (teor diminuído em fibras do tipo I, menos resistentes à fadiga). Por outro lado, a hipotonia muscular em geral, própria do pré-termo, e em especial dos músculos intercostais, acentua-se nos períodos de sono REM (rapid eye movements), períodos que têm maior duração no pré-termo relativamente ao RN de termo.
Metabolismo do surfactante pulmonar
Para que as propriedades tensioactivas do SP sejam mantidas de forma constante na superfície alveolar existem mecanismos de regulação do seu metabolismo. Tal metabolismo engloba diversos estádios: síntese, armazenamento e secreção pelos pneumócitos do tipo II, eliminação e reciclagem ou recuperação. (Figura 4)
FIGURA 4. Metabolismo do surfactante pulmonar. Semivida ~12-18 horas. (CMV<> corpo multivesículas)
O surfactante extraído do pulmão (SP) tem uma composição semelhante em diversas espécies, incluindo a humana: fosfolípidos – cerca de 84%, lípidos neutros – cerca de 8%, e proteínas – cerca de 8%. Dos fosfolípidos, cerca de 65% corresponde a compostos de fosfatidilcolina saturada ou dipalmitoilfosfatidilcolina (DPPC), e 15% a fosfatidilglicerol (FG), a fosfatidilinositol (FI) e a fosfatidiletanolamina.
Os referidos lípidos estão associados a quatro proteínas específicas (apoproteínas) designadas como SP-A, SP-B, SP-C e SP-D. As SP-A e SP-D são hidrofílicas, ao passo que SP-B e SP-C são proteínas hidrofóbicas, sem afinidade para moléculas lipídicas; tais proteínas são fundamentais no metabolismo do surfactante.
De referir que o SP evidencia propriedades imunológicas antibacterianas e anti-inflamatórias, possivelmente relacionadas com as apoproteínas SP-A e SP-D.
O surfactante pulmonar (SP) é sintetizado a partir da 20ª – 22ª semana de gestação em células específicas – no retículo endoplásmico de células alveolares diferenciadas, os pneumócitos do tipo II – (SP intracelular) que, por sua vez, libertam aquele (exocitose) para o espaço alveolar – (SP extracelular). Apesar da sua concentração tecidual pulmonar, somente é detectado no líquido amniótico entre as 28 e 32 semanas.
A síntese do surfactante depende em parte do pH normal, da temperatura e da perfusão sanguínea. A asfixia, a hipoxémia e a isquémia pulmonar, particularmente se associadas a hipovolémia, hipotensão e estresse pelo frio, podem suprimir a síntese de surfactante. Por outro lado, o epitélio revestindo a via respiratória pode também ser lesado e sofrer necrose por elevadas concentrações do oxigénio e pelo trauma da ventilação artificial (efeitos do volume insuflado e da pressão gerada); estes eventos contribuem também para a lesão e hipoprodução de surfactante.
Até às 35 semanas, na biossíntese do SP tem papel primordial a enzima metil-transferase (transformação de fosfatidil-etanolamina em palmitil-miristil – lecitina); este surfactante é mais vulnerável a noxas. Após as 35 semanas tem papel primordial a enzima fosfocolina-transferase, a qual promove a transformação do diglicérido-fosfocolina em dipalmitoil-lecitina (SP de “melhor qualidade”), pois é mais resistente às noxas.
O aumento quantitativo do SP, com o desenrolar da gestação, é acompanhado de modificação na composição dos fosfolípidos e das apoproteínas; com efeito, no que respeita aos primeiros, inicialmente predomina FI, enquanto por volta da 35ª semana predomina FG; quanto às apoproteínas, verifica-se aumento de SP-A pela 35ª semana. Nas situações de DMH é menor o teor em FG e SP-A.
Progredindo a gestação, a monocamada fosfolipídica sofre catabolismo transformando-se em vesículas que sofrem endocitose (captação pelo pneumócito II) reorganizando-se de novo em corpos multivesiculares que irão ser submetidos a catabolismo nos lisossomas, formando-se ácidos gordos livres; uma parte destes é perdida, enquanto outra é reutilizada a partir do retículo endoplásmico, repetindo-se o ciclo. O coeficiente de reutilização ou reciclagem da monocamada fosfolipídica é cerca de 95%.
O SP de localização extracelular, em termos morfológicos, apresenta-se em 4 formas: corpos lamelares (estrutura semelhante a fios enrolados), mielina tubular, grandes vesículas precursoras da camada monomolecular e pequenas vesículas; as vesículas organizam-se em corpos multivesiculares (CMV). Os corpos lamelares, cujas lamelas uma vez no espaço extracelular se reorientam, dão origem à mielina tubular (estrutura semelhante a fios entrelaçados em malha), monocamada fosfolipídica rica em DPPC; ora é esta a forma estrutural de SP verdadeiramente responsável pela diminuição da tensão superficial na superfície alveolar.
Embora raras, determinadas alterações genéticas podem contribuir para síndroma de dificuldade respiratória por disfunção do surfactante pulmonar. Trata-se de alterações dos genes das proteínas B e C (SP-B e SP-C) e do gene duma proteína transportadora do surfactante através da membrana (transportador designado por ABCA3) que originam formas letais familiares de dificuldade respiratória fora do contexto de imaturidade.
Outras causas familiares raras de disfunção do surfactante incluem principalmente a displasia acinar, a displasia alveolar capilar, a linfangiectasia pulmonar e a proteinose alveolar (deficiência congénita da SP-B).
Manifestações clínicas e radiológicas
Os primeiros sinais de dificuldade respiratória são sempre precoces, muitas vezes não detectados; em percentagem significativa dos casos existe associação com um certo número de factores predisponentes; asfixia perinatal, sofrimento fetal, nascimento por cesariana, anestesia, hemorragias maternas e/ou “shock” no período pré-parto, diabetes materna, etc..
A dificuldade respiratória surge muito precocemente, sempre antes da 4ª hora de vida. Por vezes, a SDR surge imediatamente após o nascimento; se a SDR surgir após a 8ª hora de vida, poderá, em princípio, excluir-se a doença da membrana hialina.
Salienta-se que nos casos de prematuridade extrema (RN de peso <1000 gramas) as manifestações são menos exuberantes, por vezes traduzidas pelo aparecimento precoce de episódios de apneia e de cianose.
Um dos componentes da SDR, precoce e típico, é o gemido expiratório que testemunha esforço do RN no sentido de encerramento da glote e numa tentativa de impedimento de saída de ar dos alvéolos. O gemido tem também um significado prognóstico: a sua diminuição ao cabo de algumas horas de evolução, tal como verificação de diurese, poderão traduzir uma melhoria.
Uma vez iniciado o quadro, assiste-se a um agravamento progressivo: taquipneia crescente (que pode durar vários dias), retracções supra-esternal e intercostal, retracção esternal inferior originando o chamado “tórax em funil”, também de intensidade crescente, adejo nasal, e cianose cada vez mais difícil de melhorar numa atmosfera com O2.
A auscultação pulmonar evidencia uma diminuição do murmúrio vesicular e, por vezes, fervores finos, possivelmente causados pelo descolamento ou abertura alveolar, e não pela existência de líquido alveolar. A auscultação cardíaca pode evidenciar bradicárdia nas situações acompanhadas de hipoxémia grave.
Frequentemente existem os seguintes sinais acompanhantes:
- hipotonia, hipoactividade motora espontânea e reflexa, relacionadas com a gravidade da hipoxémia e acidémia e/ou lesões hemorrágicas do SNC associadas e secundárias àquelas.
A hipotonia extrema, hipotermia e hipotensão são consideradas sinais de mau prognóstico.
Quanto aos sinais radiológicos, a imagem típica é constituída por um retículo-granitado difuso, bilateral (zonas de atelectasia alveolares) a que se sobrepõe a imagem do desenho brônquico hiper-arejado (aerobroncograma). Classicamente, descrevem-se 4 estádios de gravidade:
- reticulogranitado fino e disperso;
- I + aerobroncograma ultrapassando a silhueta cardíaca;
- II + desaparecimento do contorno da silhueta cardíaca;
- III + desaparecimento dos limites do diafragma (imagem radiográfica chamada “pulmão branco”). (Figura 5)
O quadro radiológico é sobreponível ao que surge nos casos precoces de pneumonia por Streptococcus do grupo B.
Exames laboratoriais
A PaO2 é baixa (valor normal = 98-100 mmHg), sendo de mau prognóstico as situações em que é inferior a 45 mmHg. O pH é inferior a 7,35 em geral (normal ~7,35-7,45).
Quanto à PCO2, de início pode ser normal ou baixa (fase da taquipneia ou luta fisiológica contra a hipóxia); (valores normais compreendidos entre 33,5 e 41,1 mmHg). Depois das primeiras horas, os valores tendem a elevar-se, atingindo valores superiores a 65 mmHg nas formas mais graves, numa fase de exaustão.
O ionograma plasmático pode evidenciar valores elevados de potassémia, sintomáticos de lesão celular grave por hipoxémia.
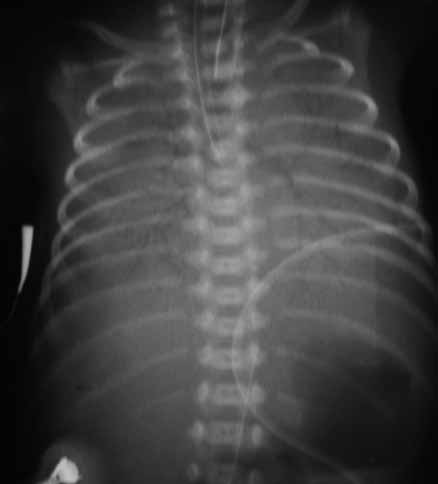
FIGURA 5. Imagem radiográfica de DMH (graus IV-III) – “Pulmão branco”. Aerobroncograma e hipoventilação global. (UCIN-HDE)
Evolução e complicações
Descrevem-se 3 períodos na evolução natural da doença:
- Agravamento progressivo em 24 a 36 horas;
- Manutenção da gravidade máxima entre as 24 e 48 horas;
- Melhoria pelo 3º – 4º dia, traduzindo tendência para reversibilidade da doença (o que é facilitado por terapêutica bem conduzida).
Tal melhoria traduz-se por diurese espontânea, melhoria da oxigenação e diminuição das necessidades de O2.
Além da hipoxémia e acidose existe a possibilidade de complicações: pneumotórax, sobreinfecção, hemorragia (pulmonar, do SNC, das supra-renais), ligadas ou não a coagulação intravascular disseminada.
Outra complicação é constituída pela doença pulmonar crónica.
Diagnóstico diferencial
Tendo em conta a evolução natural da DMH (fundamentalmente, SDR iniciada nas primeiras quatro horas de vida, com agravamento nas 24-36 horas subsequentes), o diagnóstico diferencial pode fazer-se com outros quadros respiratórios de início precoce tais como:
- Pneumonia por Streptococcus beta hemolítico do grupo B (surgindo em RN pré-termo e de termo), em que a infecção origina compromisso dos pneumócitos II e défice e/ou alteração do surfactante traduzida, designadamente, por quadro radiológico semelhante;
- Défice congénito total ou parcial da apoproteína SP-B (proteinose alveolar); taquipneia transitória (capítulo seguinte), salientando-se que a designação de SDR de tipo I dada à DMH, e de SDR de tipo II dada à taquipneia transitória surgiu por se admitir, até há algumas décadas que determinados quadros respiratórios de início precoce eram sempre explicados por défice de surfactante; para se estabelecer a destrinça, numa situação considerou-se tipo I, e na outra, tipo II);
- Cardiopatias congénitas;
- Anomalias congénitas do sistema respiratório inferior como por ex. hipoplasia pulmonar;
- Síndromas acompanhadas de hipertensão pulmonar persistente, etc. (ver atrás Etiopatogénese).
Para além da radiografia do tórax, a ecocardiografia pode ser útil como avaliação inicial para excluir quadros de hipertensão pulmonar, disfunção miocárdica ou canal arterial permeável com repercussão hemodinâmica.
Prevenção
Na sua essência, a prevenção da DMH baseia-se na prevenção da prematuridade o que implica, entre outras medidas, uma vigilância pré-natal adequada incluindo, claro está, a detecção sistemática de factores de risco.
Uma vez que está demonstrado o papel eficaz dos corticóides administrados à grávida em risco de parto prematuro no que respeita, designadamente à estimulação da maturidade pulmonar fetal, existe consenso quanto à aplicação de um conjunto de normas a seguir sintetizadas:
- À grávida em situação de risco de parto prematuro, a ACOG (American College of Obstetricians) recomenda a administração de corticóides entre as 24 e 36+6 semanas de gestação, com parto previsível dentro de 1 semana, sendo que se deverá ponderar a hipótese de eventuais contraindicações da respectiva administração;
- Tal actuação preventiva não é incompatível com a administração de tocolíticos à grávida com o objectivo de prevenir o parto prematuro;
- O corticóide indicado é a betametasona por via IM em duas doses de 12 mg com intervalo de 24 horas;
- Reforça-se a indicação de corticóide nos casos de ruptura prematura de membranas em idade gestacional inferior a 32 semanas na ausência de sinais de corioamnionite; tal actuação diminui o risco associado de hemorragia intraperiventricular;
- Há que atender ao possível risco de efeitos adversos sobre o crescimento e neurodesenvolvimento da criança resultantes de eventuais ciclos de tratamento ao longo da gravidez.
Tratamento
Algumas normas gerais quanto a cuidados, assim como aspectos essenciais da oxigenoterapia, assistência respiratória com CPAP nasal e ventiloterapia foram abordadas no capítulo anterior.
Relativamente à entidade clínica DMH, cabe mencionar algumas especificidades quanto a cuidados gerais e à terapêutica substitutiva com surfactante. Aliás, o RN pré-termo com tal patologia constitui um bom modelo no que respeita à administração de cuidados ao RN pré-termo em UCIN ou em unidade de cuidados especiais.
Cuidados gerais
- Estabilização na sala de partos
RN colocado em ambiente de termoneutralidade, sob fonte de calor ou em incubadora ou dentro de saco de polietileno, para evitar a hipotermia e o consumo de oxigénio (~34-35ºC); a hipertermia também deve ser evitada, sendo objectivo manter temperatura cutânea abdominal entre 36ºC e 37ºC; a fim de melhorar a distribuição de oxigénio aos tecidos, se possível, atrasar a laqueação do cordão ~30-45 segundos, com o RN em nível inferior ao da placenta no sentido de promover transfusão de sangue placentar. - Equilíbrio hidroelectrolítico e ácido-base
Nas primeiras 48 horas o suprimento hídrico deve ser da ordem de 50-70 mL/kg/dia e, depois, até 100-150 mL/kg/dia em função do balanço hídrico que deve ser rigoroso (registo das perdas insensíveis, da diurese e doutras perdas) com a finalidade de garantir diurese >1 mL/kg/hora, pressão arterial média ~30-50 mmHg, natrémia entre 135 e 145 mEq/L e hematócrito ~35-40%. A eventual acidose respiratória regride com ventiloterapia correcta; se surgir acidose metabólica haverá que ter precaução com a administração de alcalinizante (bicarbonato de sódio). - Equilíbrio hemodinâmico
Na DMH existindo elevada probabilidade de choque (hipotensão, oligoanúria, taquicárdia e acidose metabólica, mesmo sem diminuição da Pa O2) haverá, por vezes a indicação de administrar:- expansores da volémia: soro fisiológico na dose de 10 mL/kg em 20-30 minutos;
- inotrópicos em perfusão contínua (dopamina na dose de 2-8 mcg/kg/minuto, ou dobutamina: 5-15 mcg/kg/minuto).
- Suporte nutricional
Na fase inicial, até estabilização hemodinâmica, está contraindicada a alimentação por via entérica, havendo que providenciar suprimento energético para as necessidades básicas: em regra, perfusão de glucose IV na dose de 4-6 mg/kg/minuto acompanhada de vigilância da glicémia e glicosúria para reajustamentos; após estabilização hemodinâmica inicia-se a nutrição parentérica e a alimentação entérica mínima (não nutritiva) por sonda gástrica, idealmente com leite materno, com o objectivo de estimular a maturação das células do tubo digestivo. - Tratamento da infecção
As infecções perinatais constituem uma das causas de prematuridade, ou seja, podendo um parto pré-termo espontâneo constituir um epifenómeno de infecção. Assim, haverá que proceder à respectiva avaliação e actuar, entre outras medidas, com antibioticoterapia após colheitas de sangue (para hemograma, determinação da PCR, hemoculturas, etc.).
Particularidades da ventiloterapia
1. Convencional
Como particularidades da ventiloterapia (convencional, designadamente utilizando os ventiladores SIMV/ realizando ventilação mecânica intermitente sincronizada) na DMH cabe referir:
- Utilizar sempre a menor PIP (pressão positiva inspiratória ou pressão positiva intermitente, segundo a gíria habitual);
- Manter pH entre 7,20 e 7,35 e Pa CO2 entre 45 e 65 mmHg, (evitando valores inferiores a 40 mmHg, aceitando a chamada “hipercápnia permissiva” – acidose respiratória – na fase aguda da doença tendo como fundamento dados da medicina baseada na evidência: a hipocápnia nos primeiros dias de vida comporta alto risco de displasia broncopulmonar;
- A ventilação de alta frequência/HFV – designadamente nas modalidades oscilatória (HFOV) ou em jacto (HFJV) poderá melhorar a oxigenação e facilitar a eliminação de CO2 nos casos em que existe escassa resposta à ventilação convencional;
- Limitar a duração de FiO2 >60% e SpO2 entre 91% e 95%;
- Não retardar o início do “desmame” da ventiloterapia. (consultar adiante o capítulo sobre ventiloterapia)
2. CPAP nasal (nCPAP) ou estratégia minimamente invasiva
Pressupondo a necessidade de garantir os objectivos referidos em (I.) quanto a parâmetros bioquímicos e biofísicas, actualmente aconselha-se a utilização precoce, já na sala de partos, de nCPAP, o que garante melhor adaptação à vida extrauterina, estabilização hemodinâmica e redução da necessidade de ventilação mecânica. Surge assim o conceito de assistência respiratória minimamente invasiva.
Fazendo parte desta estratégia, realça-se que o surfactante, a administrar sempre que indicado, pode ser administrado através da cânula nasal/ sistema nCPAP – com pressão entre 5 e 10 cm H2O-, para além do método clássico através de tubo endotraqueal/TET através da cânula nasal. (ver adiante)
Administração de surfactante exógeno
Tipos
Na actualidade, os tipos de surfactante utilizados podem ser divididos em dois grandes grupos: os produtos contendo componentes do surfactante endógeno de pulmão animal, e os preparados sintéticos ou recombinantes.
Como exemplos de surfactantes naturais mais utilizados em Portugal citam-se: o Curosurf® (fracção fosfolipídica de pulmão porcino de cuja composição fazem parte: DPPC e fosfolípidos, e SP-B e SP-C) e o Survanta® (fracção fosfolipídica de pulmão bovino cuja composição inclui: DPPC e fosfolípidos, tripalmitina, acido palmítico, SP-B e SP-C).
Como exemplos de surfactantes sintéticos ou recombinantes sem apoproteínas citam-se: o ALEC® (Artificial Lung Expanding Compound) e o Exosurf® (palmitato de colfosceril).
De acordo com os estudos meta-analíticos frequentemente actualizados no âmbito da Cochrane Library verifica-se melhoria mais acentuada e mais precoce, assim como menor morbilidade e menor mortalidade, com a utilização dos surfactantes naturais como medida complementar da assistência ventilatória.
Posologia
No caso do Survanta® a dose de administração de fosfolípidos é 100 mg/kg/dose ou 4 ml/kg/dose. A repetição das doses, se necessário, deve ser de 6 – 6 horas, no máximo de 4 doses. Em situações graves de quadro radiológico de pulmão branco bilateral, é admissível a sua repetição ao fim de 4 horas.
No caso do Curosurf® a dose de administração de fosfolípidos é 100-200 mg/kg/dose ou 1,25 a 2,5 ml/kg/dose. A primeira dose de Curosurf® deve ser 200 m/kg, sendo que poderá proceder-se a repetição da administração com mais 2 doses de 100 mg/kg cada, com 6-12 horas de intervalo.
Em situações clínicas muito graves pode ser feita a administração com um intervalo mais curto (4-6 horas). Em circunstâncias especiais, de acordo com o quadro clínico-radiológico, poderá eventualmente ser necessário administrar mais 2 doses de 100 mg/kg cada, tendo em consideração que não se deverá ultrapassar a dose de 400 mg/kg.
Técnica de administração
Compreendendo-se que a administração do SP (por TET ou por cânula nasal-nCPAP) deverá ser feita em UCIN ou unidade de cuidados especiais com equipa treinada e apoio de monitorização, são referidos aspectos genéricos.
Os vários tipos de surfactante são administrados em bolus lento:
- Em circuito fechado através de um adaptador e sonda própria ligada a uma peça em Y colocada na extremidade proximal do tubo endotraqueal (TET);
- Ou em circuito aberto em 4 ou 5 bolus contínuos, através de um cateter colocado dentro do tubo endotraqueal;
- Ou em cânula nasal – modalidade nCPAP.
Mudanças na posição do corpo durante a administração das doses, podem contribuir para uma distribuição mais homogénea do surfactante.
Em situações graves, em doentes especialmente predispostos a situações de ar ectópico (por ex. pneumotórax), o surfactante pode ser administrado através dum sistema de infusão contínua lenta, durante 30 minutos a uma hora.
Estratégias clássicas de administração
A administração de surfactante pode ser:
- Profiláctica e precoce (no bloco de partos, imediatamente ao nascimento), por ex. nos RN de idade gestacional <28 semanas (que necessitam de entubação traqueal/TET ou que tenham aplicada nCPAP; ou
- De recuperação ou resgate, tardia, quando se verificarem critérios clínico-radiológicos de DMH ou quando se verificar agravamento da doença, designadamente considerando o défice de oxigenação objectivado pelo índice de oxigenação.
Salienta-se que nos RN pré-termo em risco de SDR, a nCPAP profiláctica aplicada no pós-parto imediato constitui a estratégia de eleição.
Efeitos colaterais da aplicação de surfactante
São descritos os seguintes:
- Hemorragia pulmonar e infecções pulmonares secundárias;
- Hiperinsuflação; este efeito pode ocorrer em RN com situações menos graves em que a administração do surfactante leva a melhoria rápida da compliance e do volume corrente, condicionando em certos casos, um estado de hiperinsuflação, o que poderá levar, especificamente, a enfisema intersticial e/ou pneumotórax;
- Outras complicações como aquelas relacionadas com a abertura do canal arterial, enterocolite necrosante ou hemorragia intraperiventricular não têm sido influenciadas pela terapêutica com surfactante;
- Obstrução das vias aéreas (“inundação” com surfactante); este efeito ser explicado pelo eventual volume excessivo do preparado de SP e pela viscosidade de alguns preparados; a este propósito salienta-se a eventual necessidade de ajustamento dos parâmetros de ventilação transitoriamente, até se ter comprovado distribuição homogénea daquele nas vias aéreas.
Variantes de actuação
Reconhecendo os benefícios da terapêutica substitutiva com surfactante, para além do efeito potencial protector da nCPAP profiláctica, nalguns centros são aplicadas as seguintes variantes:
- Método INSURE (intubate surfactant e extubate)
Entubação para adminitração de surfactante, profiláctica e precoce ou de recuperação ou resgate, seguida de extubação, seguindo-se de imediato (dentro de minutos ou <1 hora) a aplicação de nCPAP desde que exista quadro de estabilidade; - Método MIST (minimally invasive surfactant therapy)
Entubação com TET, instilando surfactante na traqueia, em RN com respiração espontânea e com nCPAP previamente aplicada; - Método LISA (less invasive surfactant therapy)
Aplicação de sonda fina de modo a não obstruir a traqueia (habitualmente itilizada para alimentação oro ou nasogástrica), instilando surfactante na traqueia, em RN com respiração espontânea ou em nCPAP. Como a sonda (fina) não obstrui totalmente a traqueia, deixando espaço em torno, esta variante pode efectivamente aplicar-se em RN com respiração espontânea ou em nCPAP.
Com estas estratégias têm-se verificado benefícios, tais como redução da duração de nCPAP, permitindo em geral o desmame da referida nCPAP mais precocemente.
Como nota final importa sintetizar que a ventiloterapia e a administração de surfactente estão indicadas nos casos em que não se consegue SpO2 >90% com FiO2 entre 40% e 70% e recebendo nCPAP.
Prognóstico
Os progressos realizados ao longo dos anos nos países com recursos no âmbito dos cuidados pré-natais, a corticoterapia pré-natal, a aplicação da filosofia do transporte in utero, a assistência intra-parto, os cuidados de terapia intensiva a cargo de equipas experientes (designadamente, a terapêutica de substituição pós-natal com surfactante e as estratégias de ventilação aperfeiçoadas) conduziram a diminuição significativa da mortalidade (<10%).
Embora cerca de 85%-90% dos sobreviventes com DMH e submetidos a ventilação mecânica não evidenciem sequelas quanto a função respiratória e neurodesenvolvimento, o prognóstico é globalmente mais favorável nos RN de peso >1.500 gramas.
BIBLIOGRAFIA
Bhayat S, Shetty S. Less-invasive surfactant administration (LISA). Paediatr Child Health 2020;30:144-148
Direcção Geral da Saúde. Administração de surfactante pulmonar na síndrome de dificuldade respiratória do recém-nascido. Lisboa: Departamento da Qualidade na Saúde/DGS, 2012. (www.dgs.pt/acesso em Outubro, 2019)
Ekhaguere O, Patel S, Kirpalani H. Nasal intermittent mandatory ventilation versus nasal continuous positive airway pressure before and after invasive ventilatory support. Clin Perinatol 2019;46:517-536
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Greenough A, Milner AD (eds). Neonatal Respiratory Disorders. London: Arnold, 2006
Hallman M. Lung surfactant, respiratory failure, and genes. NEJM 2004;350:1278-1280
Heiring C, Verder H, Schousboe P, et al. Predicting respiratory distress syndrome at birth using a fast test based on spectroscopy of gastric aspirates: 2. Clinical part. Acta Paediatrica 2020;109:285-290. DOI:10.1111/apa.14831
Kinsella JP, Greenough A, Abman SH. Bronchopulmonary dysplasia. Lancet 2006;367:1421-1430
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Leone TA, Finer NN, Rich W. Delivery room respiratory management of the term and preterm infant. Clin Perinatol 2012;39:431-440
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Martin RJ, Fanaroff AA, Walsh MC (eds). Neonatal-Perinatal Medicine. St Louis: Elsevier Mosby, 2011
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nanda D, Nangia S, Thukral A, et al. A new clinical respiratory distress score for surfactant therapy in preterm infants with respiratory distress. Eur J Pediatr 2020;179:603-610
Pillow JJ, Which CPAP system is best for the preterm infants with RDS. Clin Perinatol 2012;39:83-496
Poets CF. Noninvasive monitoring and assessment of oxygenation in infants Clin Perinatol 2019;46:417-434
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Polin RA, Yoder MC. Work Book in Practical Neonatology. Philadelphia: Elsevier, 2016
Schousboe P, Verder H, Jessen TE, et al. Predicting respiratory distress syndrome at birth using fast test based on spectroscopy of gastric aspirates. 1. Biochemical part. Acta Paediatrica 2020;109:280-284. DOI:10.1111/apa.14896
Soll RF, Barkhuff WE. Noninvasive ventilation in the age of surfactant administration. Clin Perinatol 2019; 46:493-517
Sweet DG, Carnielli V, Greisen G, et al. European Consensus Guidelines on the Management of Respiratory Distress Syndrome – 2016 Update. Neonatology 2017;111:107-125
Tarnow-Mordi W, Kirby A. Current recommendations and practice of oxygen therapy in preterm infants. Clin Perinatol 2019;46:621-631
Travers CP, Carlo WA. New methods for noninvasive oxygen administration. Clin Perinatol 2019;46:449-458
Warren JB, Anderson JDM. Newborn respiratory disorders. Pediatr Rev 2010;31:487-496