Definição, aspectos epidemiológicos e importância do problema
A trombocitopénia, problema frequente no RN, em particular no pré-termo, define-se como a situação clínica em que se verifica número de plaquetas inferior a 150.000/mm3; de referir que valores entre 100.000 e 150.000/mm3 são frequentes no RN aparentemente saudável, pelo que em tais circunstâncias se torna indispensável excluir falsa doença avaliando com rigor a evolução numérica de tais células sanguíneas.
Na maioria dos casos trata-se de situações clínicas de gravidade ligeira a moderada, com regressão espontânea e sem sequelas.
A forma clínica designada por trombocitopénia grave acompanha-se de valor inferior a 50.000/mm3; as manifestações hemorrágicas significativas estão habitualmente associadas apenas a valores inferiores a 20.000-30.000/mm3.
De acordo com vários estudos, a trombocitopénia está presente em cerca de 0,12% a 0,70% dos RN; nos internados em unidades de cuidados intensivos neonatais (UCIN), esta proporção oscila entre 20% e 50%; a trombocitopénia grave é observada em cerca de 8% dos RN pré-termo assistidos em UCIN.
Etiopatogénese e semiologia laboratorial
As plaquetas são pequenos elementos figurados do sangue circulante, com um diâmetro 14 vezes inferior ao do glóbulo vermelho. O seu número aumenta de forma linear com a evolução da gestação, pelo que é habitual verificar-se nos RN pré-termo um valor numérico de plaquetas ligeiramente inferior ao observado no RN de termo.
Embora existam vários reguladores da produção de tais células, tais como as interleucinas 3, 11 e 16, o factor que estimula de forma mais significativa esta produção, é a trombopoietina, glicoproteína que se liga ao receptor c-mpl expresso nos megacariócitos e nos seus precursores.
As alterações plaquetárias no período neonatal podem integrar os seguintes grupos:
- Qualitativas congénitas;
- Qualitativas adquiridas;
- Quantitativas:
- por aumento da destruição (trombocitopénias imunes e por aumento do consumo como na CIVD);
- por défice de produção (trombocitopénias de causa genética, associada a doenças infiltrativas ou a insuficiência placentar); ou
- por sequestração no baço aumentado de volume ou outro órgão (hiperesplenismo, síndroma de Kasabach-Merrit).
A relação entre a etiopatogénese e semiologia laboratorial pode ser tipificada por um conjunto de fenómenos biológicos com implicações práticas nas manifestações clínicas:
- Plaquetas revestidas por IgG, embora possam constituir um indicador de destruição plaquetária, são frequentemente encontradas em RN sem sinais de doença aparente;
- Níveis elevados de trombopoietina, o mais importante regulador da produção de plaquetas, podem ser um indicador de destruição aumentada;
- Nas chamadas “plaquetas reticuladas” correspondendo a plaquetas jovens, existe conteúdo elevado de ácido ribonucleico; em situações de maior destruição, o número destas plaquetas e de megacariócitos medulares está aumentado no sangue periférico; o inverso é possível em casos de diminuição da produção;
- O volume plaquetário médio (VPM), mais elevado nas plaquetas mais jovens, traduz em princípio um aumento de produção, secundário a destruição aumentada; no entanto, a sua maior utilidade, a par do exame morfológico das plaquetas, verifica-se no âmbito do diagnóstico de situações hereditárias (macrotrombocitopénias);
- A glicocalicina, fragmento proteolítico solúvel da subunidade a da glicoproteína Ib, é um componente, quer dos megacariócitos normais e maduros, quer das plaquetas; níveis elevados da referida glicocalicina verificam-se em situações de maior consumo de plaquetas, enquanto níveis reduzidos se associam a situações com diminuição da respectiva produção;
- Estudo medular: em casos especiais poderá ser elucidativo para avaliação da celularidade medular e da morfologia dos megacariócitos quando a trombocitopénia é prolongada e grave, e de causa desconhecida; em situações com aumento da destruição plaquetária, a medula evidencia número normal ou aumentado de megacariócitos; pelo contrário, em situações em que está afectada a produção, o número de megacariócitos está reduzido.
Ocasionalmente podem ser observados dados mais específicos: inclusões víricas sugerem infecção por CMV ou Parvovirus; megacariócitos picnóticos, sem citoplasma, são sugestivos de infecção por VIH; invasão medular ou diminuição das células mielóides e eritróides sugerem aplasia.
Notas importantes: Sendo muito difícil a realização de estudos da cinética plaquetária no recém-nascido, certos dados relacionados com a necessidade e frequência de transfusões permitem uma avaliação indirecta do mecanismo da trombocitopénia:
|
Classificação
Em cerca de 50% das situações acompanhadas de alterações quantitativas das plaquetas no RN (trombocitopénia relacionável com os mecanismos anteriormente referidos: aumento de destruição, diminuição de produção – o mecanismo mais frequente – ou sequestração), não é possível estabelecer o diagnóstico etiológico.
Nos restantes casos, no entanto, através de anamnese perinatal e de exame físico rigorosos, é possível identificar determinado factor etiológico, o qual poderá ser incluído num ou mais dos seguintes grupos: 1 – imunológico; 2 – infeccioso; 3 – genético; 4 – drogas; 5 – coagulação intravascular disseminada; 6 – insuficiência placentar; 7 – miscelânea.
Para além do mecanismo patológico em causa, as trombocitopénias podem também ser classificadas em função:
- Das dimensões das plaquetas (grandes, normais ou pequenas);
- Do modo de aquisição (congénitas ou adquiridas); ou
- Da data do aparecimento (precoce se antes das 72 horas de vida ou tardia se depois das 72 horas).
Perante determinado contexto clínico e o resultado analítico evidenciando valor diminuído de plaquetas, torna-se necessário, muitas vezes, excluir as chamadas “pseudotrombocitopénias” causadas pela agregação das plaquetas em colheitas feitas em tubos com EDTA; uma nova colheita em tubo citratado ou uma observação em lâmina, permitirá, na maioria dos casos, comprovar o diagnóstico de “trombocitopénia verdadeira”. |
Na perspectiva de se obter o diagnóstico etiológico torna-se fundamental uma anamnese rigorosa, designadamente inquirindo sobre determinados pontos:
Dados relativos à mãe/grávida
- Doença autoimune – PTI, LED? Existe história de esplenectomia? Na gravidez anterior, o RN teve trombocitopénia? As plaquetas maternas são normais ou evidenciam número diminuído? A que medicações foi submetida? Existe história de hipertensão ou de diabetes gestacional? Existe risco infeccioso?
Dados relativos ao RN
- Verifica-se bom estado geral? O RN evidencia sinais de doença ou anomalias congénitas, designadamente esqueléticas? Há antecedentes de asfixia? Há história de bradiarritmia sugestiva de LED? Existe restrição de crescimento fetal? A trombocitopénia tem início precoce (<72 horas de vida) ou tardio (depois deste período)?
A trombocitopénia é ligeira/moderada (50-150.000/mm3) ou grave?
A abordagem inicial do recém-nascido com trombocitopénia nesta perspectiva permite, em muitos casos, apontar para um dos grupos etiológicos apontados e, a partir daqui, avançar para os exames complementares específicos; o objectivo último é proceder ao tratamento adequado para prevenir a hemorragia grave com risco de vida.
De acordo com a etiopatogénese e a cronologia das manifestações clínicas – que, em cerca de 75% dos casos surgem até às 72 horas de vida – é estabelecida a classificação. (Quadro 1)
O fluxograma que integra a Figura 1 diz respeito a uma abordagem do RN com trombocitopénia precoce, orientando para as hipóteses de diagnóstico.
QUADRO 1 – Causas de trombocitopénia fetal e neonatal.
| Abreviaturas: TORCH – toxoplasmose, outras infecções congénitas (hepatite B, sífilis, herpes zóster), rubéola, citomegalovírus, herpes simplex VIH – vírus da imunodeficiência humana * → Causas mais frequentes (#) → por diminuição de produção (“) → por sequestração → As situações não assinaladas com os símbolos (#) ou (“) correspondem a mecanismo de destruição aumentada Em muitos casos coexistem mecanismos combinados (por ex. sépsis, asfixia, RCIU, pré-eclâmpsia, enterocolite, etc.) |
|
Fetal e neonatal precoce (≤72h)
|
|
Neonatal tardia (>72h)
|
FIGURA 1. Abordagem do RN com trombocitopénia precoce.
Formas clínicas
Seguidamente são descritas algumas formas clínicas de trombocitopénia neonatal.
Trombocitopénia aloimune
De mecanismo análogo ao da doença hemolítica por incompatibilidade Rh, a trombocitopénia aloimune é causada pela passagem transplacentar de anticorpos maternos contra antigénios existentes herdados do pai (na raça caucasiana: HPA-1a e HPA-5b positivos) destruindo as plaquetas fetais no decurso do segundo trimestre da gestação; o título de anticorpos antiplaquetários maternos não é preditivo da gravidade da trombocitopénia.
De referir que os antigénios plaquetários humanos HPA-1a e HPA-5b estão presentes em 98% da população sendo baixa a proporção de mulheres HPA-1a e HPA-5b-negativas. Em asiáticos, a causa mais frequente de trombocitopénia aloimune, tem a ver com o sistema HPA-4.
Ao contrário do que sucede na aloimunização Rh, em 40-50% dos casos ocorre na 1ª gravidez. O risco de recorrência em gravidez subsequente é elevado, dependendo do genótipo do pai: se homozigoto (HPA-1a/1a), o risco é de 100%; se heterozigoto (HPA-1a/1b), o risco é de 50%.
Esta situação tem uma prevalência oscilando entre 1/2.000 e 1/ 5.000, devendo ser considerada em todos os RN que evidenciem trombocitopénia inexplicada grave (<30.000/mm3) ou hemorragia intracraniana e cuja mãe, não tendo história de púrpura trombocitopénica idiopática, apresente valores normais de plaquetas.
Naturalmente, as manifestações clínicas no RN dependem da gravidade da trombocitopénia, desde uma trombocitopénia assintomática até formas graves causadoras de hemorragia intracraniana, a qual surge em 7 a 20% dos casos, frequentemente in utero.
O diagnóstico é habitualmente pós-natal, a menos que exista uma história prévia de aloimunização plaquetária na grávida ou numa irmã, seja detectada hemorragia fetal intracraniana ou seja feito rastreio pré-natal (habitualmente desaconselhado quando não existe uma possibilidade significativa).
Quando o diagnóstico é efectuado no decurso da gestação, o elevado risco de hemorragia fetal in utero justifica iniciar terapêutica com imunoglobulina intravenosa (IGIV) associada ou não a corticoterapia, com redução do risco de hemorragia intracraniana para menos de 3% dos casos.
A ecografia obstétrica a partir das 20 semanas de gestação permite monitorizar a existência de hemorragia intracraniana no feto, sendo as contagens plaquetárias e as transfusões intrauterinas de plaquetas efectuadas em último recurso.
A data do parto deve ter em conta a existência ou não de hemorragia intracraniana fetal em gravidez anterior e a maturação pulmonar do recém-nascido, sendo habitualmente programado a partir das 36-37 semanas; a cesariana é o método preferido, a menos que exista um valor plaquetário fetal superior a 100.000/mm3.
O diagnóstico no RN depende da demonstração de anticorpos maternos dirigidos contra as plaquetas do respectivo pai e da existência de antigénios plaquetários incompatíveis entre a mãe (HPA-1a negativa) e o pai (HPA-1a positivo); o recém-nascido evidenciará provavelmente o tipo plaquetário do pai, não sendo habitualmente possível colher uma quantidade de sangue suficiente para investigação adequada. A resolução ocorre com a completa destruição dos anticorpos maternos, alguns meses após o nascimento.
Por último, salienta-se ainda a importância do aconselhamento pré-natal nestes casais, uma vez que a gravidade da incompatibilidade tem tendência crescente, necessitando de rigorosa vigilância hematológica e ecográfica a partir das 20 semanas gestacionais.
Trombocitopénia autoimune
Grávidas com púrpura trombocitopénica idiopática, lúpus eritematoso sistémico ou que necessitaram de terapêutica farmacológica (heparina), produzem autoanticorpos plaquetários com a capacidade de transpor a placenta e provocar destruição das plaquetas fetais em cerca de 10% dos casos. O valor numérico das plaquetas do RN (relacionado com a gravidade da doença materna) diminui entre as 48 e as 96 horas após o nascimento, pelo que deverão ser realizadas determinações diárias durante a primeira semana de vida.
Posteriormente, é esperado um aumento espontâneo progressivo, com normalização do número das plaquetas até às 3 semanas de vida; por vezes tal normalização pode requerer mais tempo (meses), enquanto não se completar o catabolismo completo dos anticorpos.
Contrariamente à trombocitopénia aloimune, as manifestações clínicas são em geral ténues, com risco de hemorragia intracraniana muito mais baixo, inferior a 1%. Factores preditivos de maior gravidade são valores plaquetários maternos inferiores a 50.000/mm3 e a ocorrência de trombocitopénia num filho anterior.
Trombocitopénia associada a infecção
Em RN evidenciando sinais de doença e trombocitopénia precoce ou tardia, há que admitir como causa subjacente mais provável a infecciosa. Efectivamente, cerca de 80% das infecções sistémicas comprovadas evoluem com trombocitopénia.
O principal mecanismo responsável é a maior destruição secundária, quer por lesão do endotélio com adesão e agregação plaquetária, quer por diminuição da produção relacionada com lesão dos megacariócitos medulares.
Em relação às sépsis bacterianas, na data do diagnóstico, pelo menos 25% dos RN evidenciam trombocitopénia, podendo persistir durante alguns dias. As infecções víricas (incluindo por Coxsackie B, Echovírus 11, Parvovírus B19, VIH) e por germes do grupo TORCHS podem igualmente ser causadores de trombocitopénia.
Trombocitopénia congénita e hereditária
Na grande maioria dos casos, o mecanismo responsável pela trombocitopénia reside na diminuição da produção de plaquetas. Como exemplos citam-se a trombocitopénia amegacariocítica congénita (em geral associada a anomalias congénitas e a anomalias de forma e de dimensão das plaquetas), a síndroma TAR (trombocitopénia associada a aplasia do rádio) (Figuras 2 e 3), anemia de Fanconi, associada a trissomias 13, 18 ou 21, acidémia metilmalónica, etc..
Nas situações congénitas, o diagnóstico diferencial faz-se com outras síndromas congénitas cursando com diátese hemorrágica e alteração qualitativa das plaquetas, tais como:
- Síndroma de Bernard Soulier, transmitida de modo autossómico recessivo e caracterizada por défice de adesão plaquetária, e por plaquetas com volume aumentado;
- Trombastenia de Glanzmann, situação igualmente autossómica recessiva em que se verifica défice de adesão plaquetária;
- Síndroma de Wiskott-Aldrich, que corresponde a quadro hereditário ligado ao cromossoma X, associada a imunodeficiência, eczema e trombocitopénia moderada, com diminuição do volume e de adesão plaquetários.
Trombocitopénia induzida por drogas
Algumas drogas administradas durante a gravidez, como a azatioprina, o quinino, a cocaína, o ácido acetilsalicílico, a hidralazina ou tiazidas, são susceptíveis de causar trombocitopénia não só na grávida, como também no feto e RN, através de mecanismo imunológico.
Alguns medicamentos utilizados em recém-nascidos, como a indometacina, a vancomicina ou a heparina, podem igualmente ser responsáveis por trombocitopénia neonatal. (Quadro 1)
Insuficiência placentar
Situações de hipertensão induzida pela gravidez, restrição do crescimento fetal, diabetes gestacional ou hipóxia, são frequentes na grávida, constituindo uma causa comum de trombocitopénia no RN, em particular no pré-termo; o mecanismo em causa relaciona-se com défice de produção (diminuição da megacariocitopoiese).
A trombocitopénia, em geral ligeira ou moderada, e detectada no pós-parto, atinge valor mínimo entre o 2º e o 4º dia, e normaliza entre o 7º e 10º dia de vida. Não é habitualmente necessário qualquer tratamento.
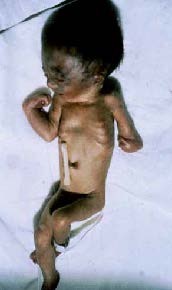
FIGURA 2. RN com síndroma TAR associada a RCIU e trissomia 18. (URN-HDE)
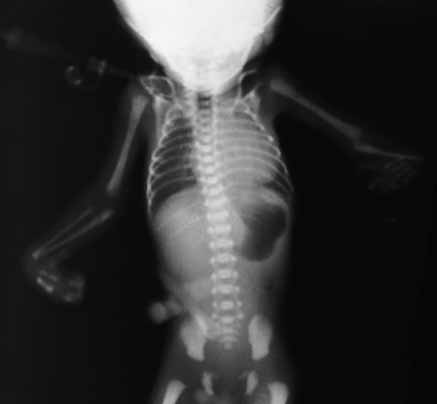
FIGURA 3. Aspecto radiográfico do caso da Figura 1: ausência do rádio esquerdo sendo notório sinal de cardiomegália relacionável com cardiopatia. (URN-HDE)
Idiopática
Tal como foi referido antes, em mais de metade dos casos, mesmo após investigação adequada, não se encontra uma causa evidente para a trombocitopénia. Habitualmente, o número de plaquetas é superior a 50.000/mm3, podendo a normalização ocorrer somente após várias semanas.
Tratamento
O tratamento da trombocitopénia é determinado pela etiologia subjacente; na maior parte dos casos, resolve-se espontaneamente ao fim de 1-2 semanas, sem necessidade de intervenção e sem sequelas; por vezes, a transfusão de plaquetas feita em situações de hemorragia activa, ou profilacticamente, em trombocitopénias graves, constitui o único tratamento possível.
O uso de factores de crescimento, nos quais se depositou inicialmente grande expectativa, tem algumas limitações que comprometem a sua utilização:
- Relativamente à interleucina 11 recombinante, tais limitações relacionam-se com surgimento de retenção hídrica e arritmia;
- Quanto à trombopoietina recombinante tem-se verificado o aparecimento de anticorpos neutralizantes e prolongado tempo de latência quanto ao efeito (cerca de 6 a 10 dias).
As indicações gerais de transfusão de plaquetas (concentrado plaquetário) em função do respectivo número verificado no sangue periférico não são totalmente consensuais em diversos centros mundiais.
Nesta perspectiva, sugere-se ao leitor a consulta do capítulo sobre trombocitopénias fora do período neonatal. Como regra geral, o RN é transfundido na base de 10-15 mL/kg de concentrado plaquetário CMV negativo, em 30 a 60 minutos; as plaquetas obtidas a partir de pool de dadores ou preferencialmente, de dador único, devem ser AB0 compatíveis e, sendo desleucocitadas, reduz-se o risco de transmissão de CMV a níveis semelhantes aos obtidos com o uso de sangue seronegativo; a utilização de concentrado unitário de plaquetas (CUP), obtido por aférese, embora mais caro e difícil de obter, tem a vantagem de ser proveniente de um único dador e ser seguro em relação ao CMV.
Na trombocitopénia aloimune, em situação de emergência, deve ser utilizado um concentrado plaquetário desleucocitado de modo a corrigir rapidamente o número de plaquetas, sabendo-se que a sobrevivência de plaquetas incompatíveis é curta; idealmente, em futuras transfusões ou, mesmo de início, quando o diagnóstico de aloimunização é conhecido, devem quando possível, ser utilizadas plaquetas maternas que são concentradas de modo a reduzir a quantidade de anticorpos existentes no soro, e que não serão destruídas pelos aloanticorpos; a lavagem no sentido de remover mais anticorpos, pode ser lesiva das plaquetas. Alternativamente, se existir um painel de dadores fenotipados, podem ser utilizadas plaquetas de dador HPA-1a e HPA 5b negativos.
A imunoglobulina intravenosa, em associação com transfusão plaquetária, ou como terapêutica única em trombocitopénias graves sem hemorragia, é usada na dose de 0,5-1 g/kg/dia durante 3 a 5 dias, ou até subida das plaquetas acima de 50.000/mm3.
Nas grávidas com antecedentes de filho anterior com trombocitopénia aloimune e hemorragia intracraniana, deve iniciar-se tratamento com imunoglobulina semanal, associada ou não a corticoterapia, a partir das 12 semanas de gestação; a necessidade de manter este tratamento pode ser confirmada a partir da tipagem plaquetária do feto, obtida por amniocentese a partir das 15 semanas de gestação.
Em centros especializados, quando o feto é HPA-1a positivo, a contagem das plaquetas fetais a partir de cordocentese e a monitorização ecográfica seriada permitem avaliar se a terapêutica está a ser eficaz; e, caso tal não aconteça, está indicada a realização de transfusões intrauterinas repetidas de plaquetas compatíveis.
Na trombocitopénia autoimune recomenda-se a administração de imunoglobulina intravenosa (IGIV: 1 g/kg/dia em dois dias consecutivos ou 0,5 g/kg/dia durante quatro dias), podendo associar-se prednisolona (3 mg/kg/dia durante 3 a 7 dias) na ausência de resposta à IGIV. A transfusão de plaquetas irradiadas na trombocitopénia auto-imune pode considerar-se ineficaz, pois as mesmas são prontamente destruídas independentemente do dador; no entanto, em situações extremas ou perante a verificação de valor de plaquetas inferior a 30.000/mm3, a referida transfusão poderá ser ponderada em associação à IGIV e prednisolona.
BIBLIOGRAFIA
Buchanan GR. Thrombocytopenia during childhood: what the pediatrician needs to know. Pediatrics in Review 2005;26, 11:401-408
Chakravorty S, Murray N, Roberts I. Neonatal thrombocytopenia. Early Human Development 2005;81:35-41
Christensen RD. Platelet transfusion in the neonatal intensive care unit: benefits, risks, alternatives. Neonatology 2011;100:311-318
Cloherty JP, Eichenwald EC, Strak AR. Manual of Neonatal Care. Philadelphia; Lippincott Williams & Wilkins, 2008
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gleason CA, Juul SE (eds). Avery’s Diseases of the Newborn. Philadelphia: Elsevier, 2018
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Hann IM, Gibson BES, Letsky EA (eds). Fetal and Neonatal Haematology. London: Baillière Tindall, 1991
Hayashi T, Hirayama F. Advances in alloimmune thrombocytopenia: perspectives on current concepts of human platelet antigens, antibody detection strategies, and genotyping. Blood Transfus 2015;13:380-390
Hoffman R, Benz EJ, Silberstein LE, et al (eds). Hematology: Basic Principles and Practice. Philadelphia: Elsevier, 2018
Kamphuis MM, Paridaans NP, Porcelijn L, et al. Incidence and consequences of neonatal alloimune thrombocytopenia: a systematic review. Pediatrics 2014;133: 715-721
Kaplan RN, Bussel J B. Differential diagnosis and management of thrombocytopenia in childhood. Pediatr Clin North Am 2004;51:1109-1140
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
McIntosh N, Helms P, Smyth R, Logan S (eds). Forfar and Arneil´s Textbook of Pediatrics. London: Churchill Livingstone, 2008
Moro M, Málaga S, Madero L (eds): Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Orkin SH, Nathan DG, Ginsburg D, et al (eds). Nathan and Oski’s Hematology and Oncology of Infancy and Chilhood. Philadelphia: Elsevier, 2015
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saunders, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Roberts I, Murray N A. Neonatal thrombocytopenia: causes and management. Arch Dis Child Fetal Neonatal Ed 2003; 88: F359 – F364.
Sola M C. Evaluation and treatment of severe and prolonged thrombocytopenia in neonates. Clin Perinatol 2004;31:114