Definição e importância do problema
A designação de síndroma de ar ectópico intratorácico (SAEIT) engloba um conjunto de situações clínicas nas quais se verifica a existência de ar fora da via respiratória (em zonas vizinhas ou circundantes da mesma), em geral como resultado de solução de continuidade do epitélio respiratório.
Dependendo da localização do ar fora da via respiratória (interstício do parênquima pulmonar, entre os dois folhetos da pleura, entre os dois folhetos do pericárdio, e/ou no mediastino), surgem as designações respectivamente de enfisema intersticial pulmonar, pneumotórax, pneumopericárdio, pneumomediastino. O pneumotórax (que pode surgir secundariamente a pneumomediastino) e o enfisema pulmonar intersticial explicam cerca de metade dos casos de SAEIT.
Pela continuidade anatómica do tecido intersticial pulmonar/torácico com o interstício das baínhas peribroncovasculares, ao longo dos vasos do pescoço ou dos grandes vasos que atravessam o diafragma, poderão surgir secundariamente situações caracterizadas por “ar ectópico” extra-torácico: tecido celular subcutâneo (enfisema subcutâneo), cavidade peritoneal (pneumoperitoneu), no interstício do escroto (pneumoscroto) (síndromas de ar ectópico extratorácico – SAEET), ou mesmo na circulação sistémica por ruptura de alvéolos na proximidade dos pequenos vasos pulmonares (embolia gasosa) que pode ter localização intra ou extra-torácica (síndroma de ar ectópico intra e extra-torácico).
Em pneumologia neonatal o aparecimento de SAEIT constitui factor de morbilidade e de mortalidade, sobretudo no RN pré-termo. Com efeito, as SAEIT desenvolvem-se em cerca de 1-2% dos RN, habitualmente como complicação da ventilação mecânica em pulmões imaturos e frágeis, afectando principalmente RN pré-termo, com uma incidência inversamente proporcional ao peso de nascimento e idade gestacional.
A frequência de SAEIT tem diminuído ao longo do tempo, o que é explicável pelos progressos realizados em cuidados perinatais, cada vez menos invasivos; salienta-se que aquela depende da existência de patologia respiratória de base: 50 vezes superior se tal se verificar.
Neste capítulo procede-se à abordagem das formas mais representativas de SAEIT, dando especial ênfase ao pneumotórax e ao enfisema pulmonar intersticial.
Esta patologia constitui um factor importante de morbilidade (hemorragia intraperiventricular e displasia broncopulmonar) e de mortalidade (20-30%) nesta população, pelo que a sua prevenção através do uso de corticóides pré-natais, surfactante pulmonar precoce e de estratégias de ventilação protectoras do pulmão, desde o nascimento, como a ventilação não invasiva precoce, a ventilação sincronizada, com volume controlado, volumes e pressões mais baixos, tempos inspiratórios mais curtos e frequências mais altas, é essencial, principalmente no RN pré-termo com patologia pulmonar. |
1. PNEUMOTÓRAX
Aspectos epidemiológicos
Em cerca de 1% dos RN de termo, saudáveis, pode surgir pneumotórax, em geral assintomático; as frequências de tal patologia, mais elevadas no período neonatal do que em qualquer outro período da vida, traduzem a magnitude do problema:
- Corresponde a cerca de 0,1- 0,25% da totalidade dos problemas respiratórios neonatais de acordo com estudos epidemiológicos;
- O pneumotórax espontâneo é cerca de 10 vezes mais frequente no RN em relação a outras idades;
- Surge em cerca de 5-10% dos casos de DMH, frequência que aumenta nos casos submetidos a ventilação mecânica;
- Em 10% dos casos, o pneumotórax é bilateral;
- Nas situações de síndroma de aspiração meconial, o pneumotórax pode surgir em 20 a 50% dos casos.
Etiopatogénese
As particularidades anatomofisiológicas do pulmão do RN constituem factores de vulnerabilidade, facilitando o aparecimento do ar entre os dois folhetos pleurais. Destacam-se os seguintes factores:
- Elevadas pressões inspiratórias utilizadas no pós-parto imediato;
- Imaturidade estrutural do parênquima pulmonar, mais notória no RN pré-termo, traduzida essencialmente por menor elasticidade e menor distensibilidade, sobretudo antes das 30-32 semanas (o que se explica pelo défice de elastina e de surfactante, respectivamente); o défice quantitativo ou qualitativo de surfactante obriga ao emprego de pressões inspiratórias mais elevadas ao proceder-se a ventilação artificial por problema respiratório prévio, o que aumenta a probabilidade de ruptura nas vias aéreas;
- Menor número de comunicações ou “canais” interalveolares (poros de Kohn) e entre bronquíolos mais distais (canais de Lambert), tanto mais notório quanto menor a idade gestacional, salientando-se que tais “derivações” ou “curto-circuitos fisiológicos” permitem distribuição mais homogénea, em volume e pressão, de ar nas vias terminais; inversamente, o défice de tais estruturas faz com que, com maior probabilidade, possa haver zonas hiper e hipodistendidas, com maior risco, quer de pneumotórax espontâneo, quer de volutrauma, atelectrauma e barotrauma nos casos de ventilação artificial;
- Maior susceptibilidade às infecções (que poderão ter origem pré-natal): como um dos fenómenos comuns às infecções, cabe salientar o papel dos neutrófilos recrutados e sequestrados na área do processo infeccioso que, através da produção de elastase, originam alteração e ruptura da elastina com as consequências atrás descritas;
- Nos casos de obstrução parcial ou total, por sangue, mecónio ou líquido amniótico, em certas áreas dos brônquios e bronquíolos, poderá verificar-se distribuição heterogénea do ar inspirado (zonas hiperventiladas e hiperdistendidas e zonas hipoventiladas); nos casos de obstrução parcial poderá gerar-se mecanismo valvular determinando acumulação progressiva de ar em certas áreas e ruptura alveolar consequente, mesmo sem manobras de reanimação (pneumotórax espontâneo); torna-se claro que as manobras de reanimação condicionando a génese de pressões inspiratórias elevadas aumentam a probabilidade de ruptura alveolar (Figura 1);
- O pneumotórax também poderá surgir como consequência de manobras intempestivas: perfuração das estruturas com sonda de aspiração no âmbito dos cuidados ao RN com SDR ou utilização de tempo inspiratório longo com baixa frequência em RN ventilados mecanicamente.
Como resultado da ruptura alveolar ou dos bronquíolos, o ar difunde-se através do espaço broncovascular atingindo a cavidade pleural após formação de pequenas “bolhas de distensão gasosa” por “descolamento” localizado do folheto visceral da pleura; tais bolhas, rompendo-se depois, levam à acumulação de ar entre os folhetos parietal e visceral da pleura.
A acumulação ectópica de ar na cavidade pleural conduz a:
- alteração da ventilação-perfusão por compressão das vias aéreas, levando a hipoxémia e hipercápnia;
- compressão dos vasos sanguíneos intersticiais, susceptível de originar quadro de hipertensão pulmonar e curto-circuito extrapulmonar, o que agrava a hipoxémia;
- aumento progressivo da pressão intratorácica levando a diminuição do retorno venoso e do débito cardíaco com hipotensão arterial e isquémia em territórios como o rim e encéfalo; de salientar que as variações da pressão arterial no contexto de quadro de dificuldade respiratória e manuseamento do RN, por vezes inadvertidamente intempestivo, podem provocar oscilações do débito cerebral, do que poderá resultar hemorragia intraperiventricular, sobretudo no pré-termo.
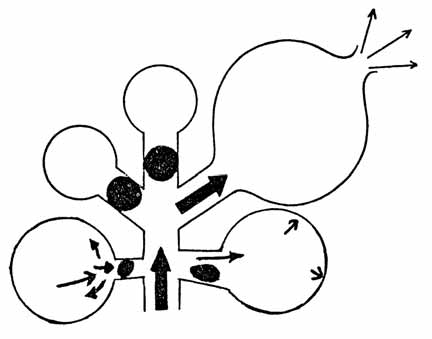
FIGURA 1. Mecanismo do pneumotórax do RN: obstrução total → hipoventilação; obstrução parcial → mecanismo valvular levando a acumulação progressiva de ar; ruptura alveolar.
Manifestações clínicas
O pneumotórax espontâneo poderá ser assintomático, constituindo um achado radiológico inesperado, ou traduzir-se por SDR ligeira.
Nos casos de pneumotórax sob tensão pode manifestar-se de modo agudo, com deterioração do estado geral, e agravamento do quadro de dificuldade respiratória inicial já instalado: cianose, agitação traduzindo hipoxémia grave, bradicárdia e choque; tal agravamento é muito sugestivo da patologia em análise se o RN estiver submetido a ventilação mecânica.
Tratando-se de pneumotórax unilateral, verifica-se hipersonoridade à percussão no lado afectado e desvio do choque da ponta, mais fácil de se notar à esquerda; de salientar que a semiologia auscultatória nem sempre fornece dados concludentes, uma vez que há possibilidade de transmissão do murmúrio vesicular do lado são, o que pode ser explicado pelas dimensões exíguas da caixa torácica do RN.
Um sinal indirecto é constituído pelo aparecimento abrupto de abdómen tenso e distendido (associado a hepato e esplenomegália) por empurramento do diafragma pela pressão do ar ectópico supradiafragmático.
Exames complementares
O exame complementar de eleição é a radiografia do tórax.
A imagem típica do pneumotórax corresponde a uma área de hipertransparência em que não se visualiza sinal de parênquima ou de vasos pulmonares na face lateral e/ou medial do hemitórax, uni ou bilateralmente, com desvio da silhueta cardíaca. (Figura 2)
Segundo o American College of Chest Physicians o pneumotórax classifica-se em: – pequeno (ocupando <20% do espaço pulmonar na radiografia); – moderado (20-40%) e; – grande (>40%). |
Nos casos de acumulação abundante de ar sob forte tensão (hipertensivo, ou seja, correspondente a situação em que o volume do ar ectópico aumenta progressivamente) pode observar-se colapso do pulmão homolateral e desvio mediastínico para o lado oposto, assim como rectificação ou inversão da curvatura da linha diafragmática. (Figura 3)
Tratando-se de pneumotórax de pequenas dimensões, a sua detecção poderá ser difícil tendo em conta que o referido exame é realizado classicamente no berço ou incubadora com o RN em decúbito dorsal. Assim, para confirmação, o exame deverá ser feito com o RN em decúbito lateral ou, em alternativa, em decúbito dorsal com a ampola de raios X colocada lateralmente (raios horizontais); em tais circunstâncias, poderá visualizar-se eventual transparência retrosternal, não notada na posição convencional (Figura 4). No pneumotórax de localização medial deverá fazer-se o diagnóstico diferencial com o pneumomediastino.
A técnica de transiluminação consiste em aplicar luz proveniente de lâmpada halogénia ou de fonte emissora de fibra óptica, cuja extremidade é circular e plana para se ajustar à pele, em contacto e perpendicularmente a esta. Com tal técnica obtém-se um halo luminoso na superfície torácica em torno da fonte luminosa: havendo conteúdo líquido ou gasoso sob a zona explorada (neste caso, parede do tórax), verifica-se maior dispersão da luz, formando-se um halo maior.
Este método não invasivo tem a vantagem de permitir tirar conclusões de modo rápido, mas implica experiência por parte do observador e ambiente semelhante a “câmara escura”, no decurso da execução do procedimento.
Tratando-se de pneumotórax de pequenas dimensões, a sua detecção poderá ser difícil tendo em conta que o referido exame é realizado classicamente no berço ou incubadora com o RN em decúbito dorsal. Assim, para confirmação, o exame deverá ser feito com o RN em decúbito lateral ou, em alternativa, em decúbito dorsal com a ampola de raios X colocada lateralmente (raios horizontais); em tais circunstâncias, poderá visualizar-se eventual transparência retrosternal, não notada na posição convencional (Figura 4). No pneumotórax de localização medial deverá fazer-se o diagnóstico diferencial com o pneumomediastino.
A técnica de transiluminação consiste em aplicar luz proveniente de lâmpada halogénia ou de fonte emissora de fibra óptica, cuja extremidade é circular e plana para se ajustar à pele, em contacto e perpendicularmente a esta. Com tal técnica obtém-se um halo luminoso na superfície torácica em torno da fonte luminosa: havendo conteúdo líquido ou gasoso sob a zona explorada (neste caso, parede do tórax), verifica-se maior dispersão da luz, formando-se um halo maior.
Este método não invasivo tem a vantagem de permitir tirar conclusões de modo rápido, mas implica experiência por parte do observador e ambiente semelhante a “câmara escura”, no decurso da execução do procedimento.
Tratamento
Se o RN não estiver submetido a ventilação mecânica e os sinais de dificuldade respiratória forem ligeiros, a administração de oxigenoterapia com FiO2 a 95% (monitorizando simultaneamente a SpO2) é, em geral, suficiente como estratégia que promove a reabsorção do ar no sentido cavidade pleural → capilares.
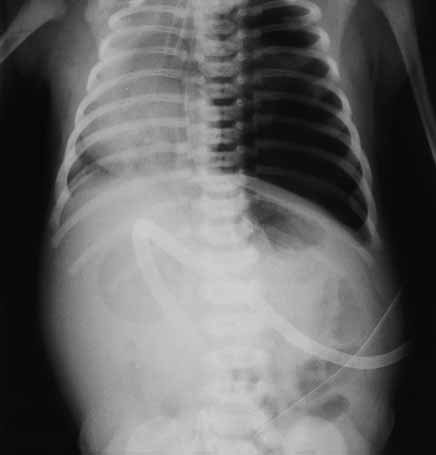
FIGURA 2. Imagem radiográfica de pneumotórax esquerdo com desvio da silhueta cardíaca para a direita. (URN-HDE)
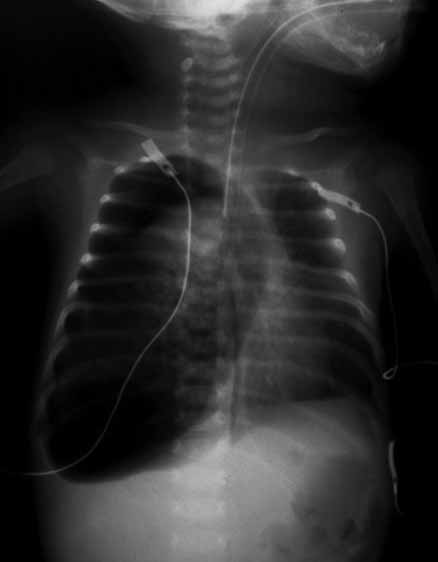
FIGURA 3. Pneumotórax sob tensão à direita; inversão da curva diafragmática respectiva. (NIHDE)
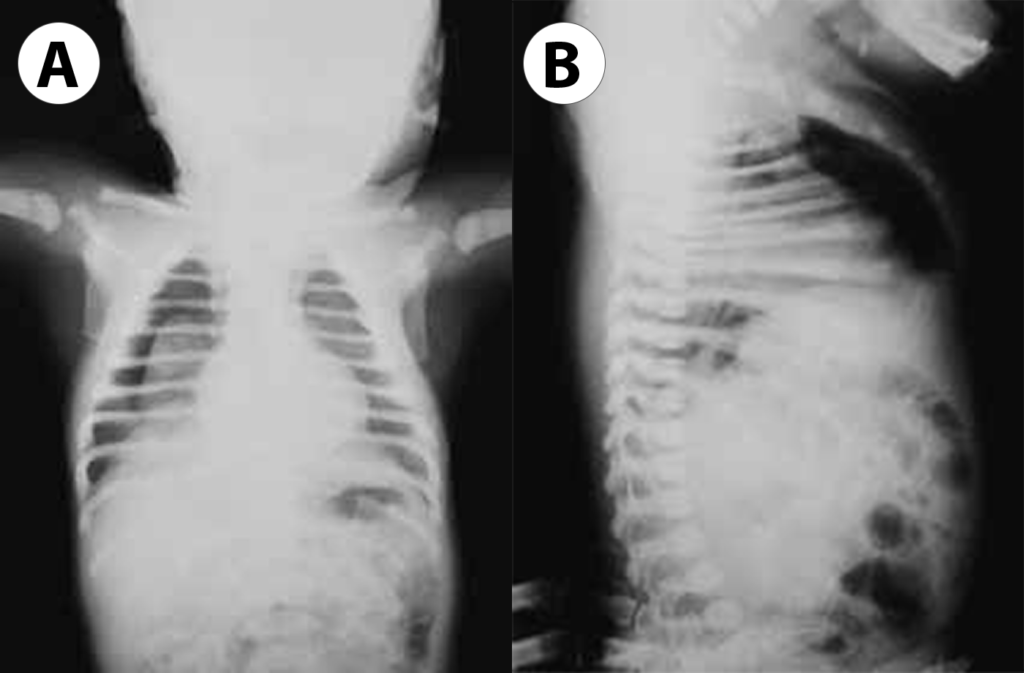
FIGURA 4. A – Pneumotórax de pequena dimensão mais visível à direita (incidência póstero-anterior); B – Sinal de ar ectópico retrosternal (incidência de perfil em decúbito dorsal a que corresponde incidência ântero-posterior sem alterações aparentes) noutro RN. (URN-HDE)
Com efeito, uma vez que a pressão do ar no espaço do pneumotórax é da ordem de 760 mmHg (correspondente à pressão atmosférica), e a pressão de oxigénio no sangue dos capilares pulmonares “em contacto” é mais baixa, criam-se condições para um fluxo de gás no sentido da zona de maior pressão para a zona de menor pressão, ou seja, no sentido pleura à capilar, viabilizando a diminuição progressiva do volume de ar pleural. Como precaução, com a oxigenação que se promove, a SpO2 não deve ultrapassar 93%.
Como medida emergente a realizar por especialista experiente, e em condições de assépsia, poderá utilizar-se uma cânula de calibre 19-21 G, aplicada a seringa de 20 mL com soro fisiológico intercalando torneira de 3 vias; a punção é feita no 4º espaço intercostal, na linha axilar anterior, aspirando-se o ar em repetidas operações (borbulhando no soro), com a precaução, de fechar a torneira ao retirar a seringa para extracção do ar aspirado.
O tratamento mais eficaz do pneumotórax sob tensão é a drenagem pleural ligada a um sistema de drenagem subaquática garantindo uma pressão negativa de aspiração entre [– 10 ]e [– 20 ] cm H2O (1-2 kPa). (Figura 5)
Prevenção
Para além das medidas de prevenção da infecção pré e pós-natal, susceptível de fragilizar o parênquima pulmonar, o emprego de manobras pouco agressivas na estabilização/reanimação do RN ao nascer, o uso precoce de surfactante pulmonar, de ventilação não invasiva (CPAP nasal) mais precoce, ventilação invasiva menos agressiva, com tolerância de hipoxemia e hipercápnia permissivas, e durante menos tempo, o uso de modos ventilatórios protectores (ventilação sincronizada, com volume controlado, pressões e tempos inspiratórios mais baixos e frequências respiratórias mais altas), são estratégias que ajudam a diminuir a incidência de pneumotórax.
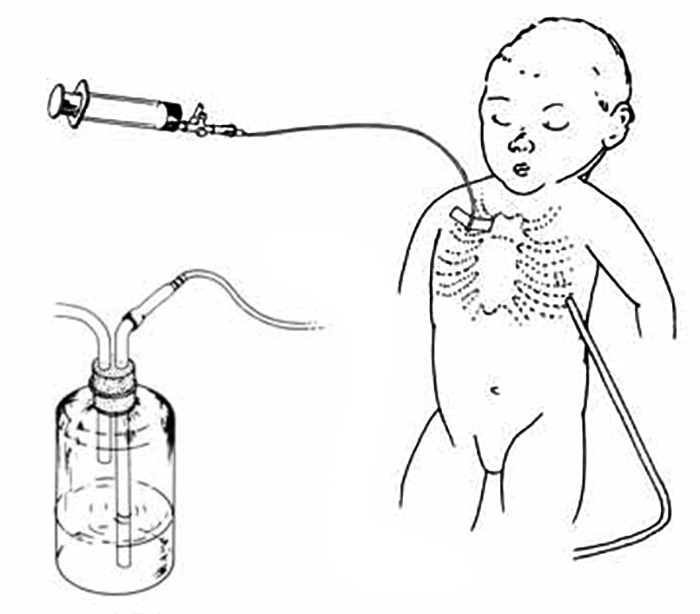
FIGURA 5. Localização dos drenos pleurais e ligação ao frasco com tubo introduzido abaixo do nível da água; o comprimento em cm deste tubo submerso na água corresponde à pressão negativa em cm de H2O. Outro tubo do frasco está acima do nível da água e aberto para atmosfera.
Prognóstico
O prognóstico em termos de morbilidade e de mortalidade depende fundamentalmente da doença de base, dos efeitos sistémicos do ar ectópico e da idade gestacional. De salientar que nos RN com prematuridade extrema (idade gestacional <28 semanas) a frequência de HIPV é cerca de 80-90% se surgir hipotensão durante o episódio de pneumotórax; por outro lado, tal frequência reduz-se para 10% se não surgir hipotensão.
2. ENFISEMA PULMONAR INTERSTICIAL
Definição
O enfisema pulmonar intersticial (EPI) é a presença de ar no interstício ou tecido perivascular do pulmão, como consequência da ruptura de alvéolos ou de bronquíolos.
Aspectos epidemiológicos
O EPI tem sido identificado em cerca de 10% das necrópsias de RN de termo e em cerca de 25% das de RN muito pré-termo (28-31 semanas) ou pré-termo extremo (22-27 semanas). Salienta-se que este problema clínico tem sido observado quase exclusivamente em RN ventilados e com antecedentes perinatais de corioamnionite.
Etiopatogénese
Após ruptura alveolar, o ar difunde-se para o interstício formando pequenas colecções quísticas com diâmetro variando entre 0,1 e 1 cm, localizadas nos septos interlobulares e estendendo-se do hilo para a periferia do pulmão; tais alterações podem ser localizadas ou difusas. Surgem mais frequentemente no contexto de RN com DMH ventilados e, menos frequentemente, em casos de síndromas de aspiração e de sépsis.
Como consequência das alterações descritas que comprimem o parênquima, verifica-se também diminuição da distensibilidade (compliance) pulmonar e do débito pulmonar.
O EPI está associado a elevação da elastase dos leucócitos nos aspirados traqueais, o que poderá sugerir o papel da infecção intrauterina na génese da doença.
Manifestações clínicas
Ao contrário do que acontece em certas formas de pneumotórax, o EPI manifesta-se de modo gradual: na sua forma mais típica, e no decurso da ventilação mecânica, agravamento do quadro clínico, o que leva à necessidade de intensificar o suporte ventilatório por alteração da ventilação-perfusão e hipoxémia. A semiologia clínica permite detectar, em geral, diminuição da amplitude dos movimentos torácicos, hiperinsuflação e diminuição da intensidade dos sons cardíacos.
Exames complementares e diagnóstico diferencial
A radiografia do tórax, exame complementar fundamental para o diagnóstico, evidencia sinais de pequenas colecções aéreas ou radiolucências de forma quística (tipo “esponjoso”, grosseiras) ou linear, de dimensões variadas. As lesões podem ser localizadas (sobretudo na periferia ou regiões médias), ou difusas, uni ou bilateralmente, não se ramificando.
Nas formas lineares, o diagnóstico diferencial faz-se com o chamado “broncograma aéreo”, típico da DMH; neste último, as lesões lineares hipertransparentes ramificam-se, predominam nas regiões hilares (não na periferia) e nos lobos inferiores. (Figura 6)
Prevenção e tratamento
A prevenção passa essencialmente pela adopção duma estratégia de suporte ventilatório mínimo para garantir oxigenação adequada.
Os princípios básicos do tratamento, que têm como objectivo fundamental reduzir o barotrauma, dizem respeito, sobretudo a:
- Diminuição da PEEP, do tempo inspiratório – cerca de 0,3 segundos (utilizando ventilação convencional);
- Estratégia de baixo volume (utilizando ventilação de alta frequência).
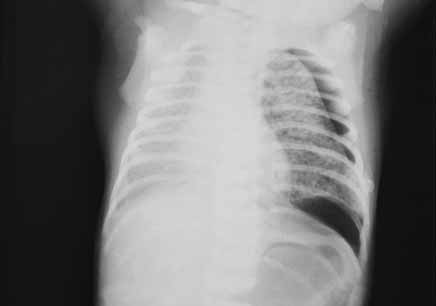
FIGURA 6. Sinais de enfisema intersticial pulmonar associados a pneumotórax. São notórias pequenas áreas quísticas intraparenquimatosas no campo pulmonar esquerdo. (URN-HDE)
Prognóstico
Chama-se a atenção para a mortalidade elevada nas formas de EPI de início nas primeiras 24-48 horas. A forma difusa de EPI está mais frequentemente associada a doença pulmonar crónica (ver adiante, capítulo sobre Displasia broncopulmonar).
3. PNEUMOMEDIASTINO
A presença de ar ectópico no mediastino é quase sempre precedida de enfisema pulmonar intersticial. A etiopatogénese é semelhante à descrita a propósito do pneumotórax e EPI.
Exceptuando nos casos de pneumotórax associado, o RN com quadro de pneumomediastino está habitualmente assintomático ou exibe sinais de dificuldade respiratória ligeira. Pode verificar-se aumento do diâmetro ântero-posterior do tórax, hipersonoridade do tórax à percussão e diminuição dos sons cardíacos.
Nos casos graves podem observar-se sinais de baixo débito cardíaco por repercussão hemodinâmica (compressão do coração e pulmões).
A radiografia do tórax em incidência póstero-anterior evidencia zona de hipertransparência na área mediastínica impedindo a visualização do pedículo vascular (Figura 7); contornando a silhueta cardíaca, exceptuando no contorno inferior; nalguns casos é possível observar-se imagem do timo “como que levantado ou subido” dando a imagem em “sinal da vela”. Através de ecografia é possível fazer a destrinça entre pneumomediastino e pneumotórax de localização medial.
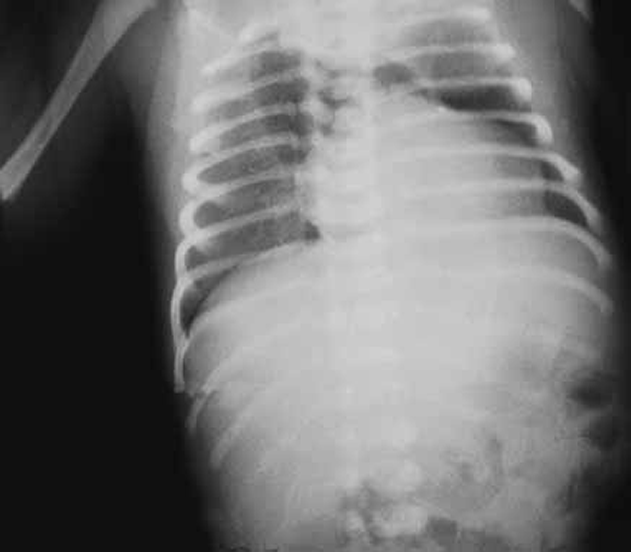
FIGURA 7. Imagem radiográfica de pneumomediastino: incidência póstero-anterior com sinais de acumulação de ar no mediastino impedindo a visualização de pedículo vascular cardíaco e compressão centrífuga do parênquima pulmonar bilateralmente. (URN-HDE)
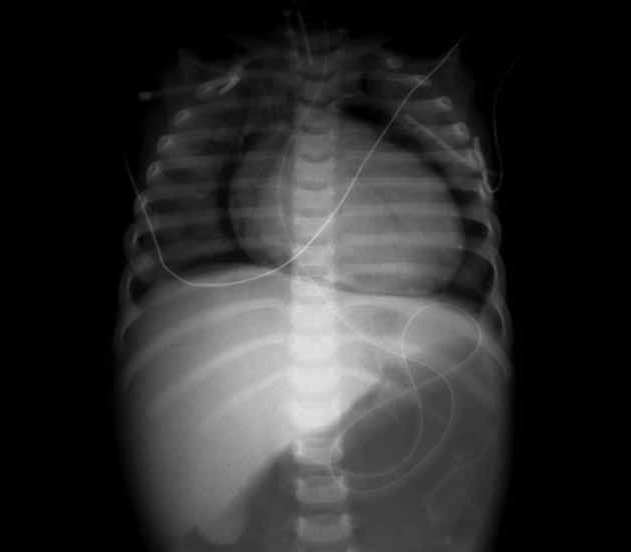
FIGURA 8. Imagem radiográfica de pneumopericárdio associado a pneumomediastino. (NIHDE)
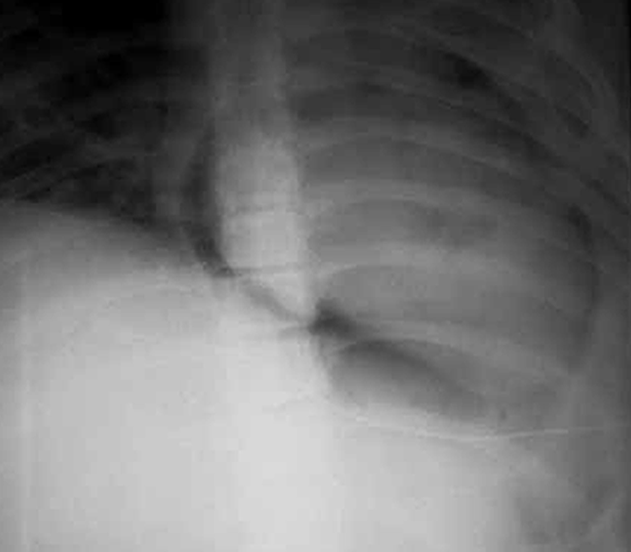
FIGURA 9. Imagem radiográfica de pneumopericárdio. (NIHDE)
A atitude a tomar deverá ser expectante, com vigilância rigorosa dos sinais vitais e grau de oxigenação, tendo em conta que a recuperação é espontânea na maioria dos casos.
4. PNEUMOPERICÁRDIO
Relativamente ao pneumopericárdio, caracterizado pela presença de ar no saco pericárdico, admite-se que o gás, sob alta pressão, possa penetrar na cavidade pericárdica ao nível da zona de rebatimento ou de transição do pericárdio visceral para o pericárdio parietal.
As manifestações clínicas, variáveis, dependem da rapidez com que se acumula o gás, sendo de notar que o primeiro sinal poderá ser hipotensão. Assim descrevem-se:
- Formas oligossintomáticas (correspondendo a acumulação lenta sem aumento significativo da pressão intrapericárdica); e
- Formas de início súbito com palidez, taquicárdia, hipotensão e choque, com ulterior bradicárdia e diminuição da amplitude do pulso; estas manifestações explicam-se por tamponamento com acumulação mais brusca e abundante de gás, sendo que a pressão intrapericárdica se aproxima da pressão venosa central, o que tem repercussão sobre a ejecção ventricular.
A radiografia do tórax evidencia área de hipertransparência envolvendo toda a silhueta cardíaca, inclusivamente no seu contorno inferior (supradiafragmático). Recorda-se que na imagem do pneumomediastino tal bordo é preservado. (Figuras 8 e 9)
A atitude nos casos de pneumopericárdio assintomático é “expectante armada”. O tratamento efectivo do pneumopericárdio sintomático com sinais de tamponamento cardíaco consiste na punção pericárdica ou drenagem com agulha e seringa ao nível da zona infraxifoideia, com inclinação da agulha para cima e para trás, em condições de assépsia com o apoio ecográfico e em UCIN. Trata-se, pois, dum procedimento que exige experiência.
BIBLIOGRAFIA
Cloherty JP, Stark AR (eds). Manual of Neonatal Care. Philadelphia; Wolters & Kluwer, 2017
Gardner SL, Carter BS, Enzman-Hines ME, Hernandez JA (eds). Merenstein &Gardner’s Handbook of Neonatal Intensive Care. St Louis, MO: Elsevier, 2018
Guimarães JC, Carneiro MJ, Loio P, Macedo A, Tuna ML, et al. Manual Prático de Neonatologia. Lisboa: Hospital de S. Francisco Xavier/Uriage, 2016
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
O´Neill Jr JA, Rowe MI, Grosfeld JL, et al (eds). Pediatric Surgery. Philadelphia: Elsevier, 2017
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Yu VYH (ed). Pulmonary Problems in the Perinatal Period and their Sequelae. London: Baillière Tindall, 2004