Definição, aspectos epidemiológicos e importância do problema
A síndroma de aspiração meconial (SAM) é um problema respiratório secundário à invasão das vias aéreas distais (bronquíolos terminais e alvéolos) por líquido amniótico com mecónio, de que resulta hipoventilação alveolar com hipóxia e acidose proporcional ao número de alvéolos obliterados.
A aspiração de líquido amniótico sem mecónio, por vezes acompanhada de sangue, ou contendo germes microbianos, pode surgir, quer nas extracções por cesariana, quer nos partos por via baixa e ainda nas situações de asfixia perinatal, em que se verifica respiração do tipo gasping. Refere-se, a propósito, a associação frequente entre líquido amniótico tinto de mecónio, listeriose e outras infecções congénitas.*
Em cerca de 5-12% de todos os nascimentos verifica-se líquido amniótico meconial, que se pode associar a depressão neonatal. No entanto, a presença de mecónio na traqueia – que se verifica apenas em metade daquele contingente – não implica necessariamente o aparecimento de disfunção respiratória; com efeito, só em cerca de 1/3 dos RN com mecónio na traqueia surge SDR.
*Existe a possibilidade de aspiração para a via aérea de conteúdo gástrico contendo secreções ácidas ou leite em qualquer momento do período neonatal ou mais tarde; este quadro é habitualmente designado “pneumonia de aspiração”. |
Na prática, a SAM surge em cerca de 5% dos RN com líquido amniótico tinto de mecónio, o que corresponde a incidência média de 2/1.000 nados-vivos. Aproximadamente 30% destes RN necessitam de apoio ventilatório, e em 3-5% o desfecho é fatal.
De salientar que a SAM constitui um problema respiratório típico no RN de termo ou quase de termo por razões apontadas adiante. É rara antes das 37 semanas de gestação e frequente após as 42 semanas.
Comprovou-se maior associação de SAM a mães fumadoras, diabetes mellitus materna, pré-eclâmpsia/eclâmpsia, oligoâmnio, restrição de crescimento fetal com disfunção placentar e pós-maturidade.
A importância da SAM deriva fundamentalmente da mortalidade significativa, sobretudo:
- Por hipertensão pulmonar persistente (HPP) surgindo em cerca de 2 a 30%, verificando-se as taxas mais elevadas nos países em desenvolvimento sem meios de terapia intensiva); e
- Pela morbilidade, relacionada principalmente com sequelas neurológicas e pulmonares.
Etiopatogénese
O mecónio, lesivo para os pulmões, é uma substância viscosa complexa, estéril, composta essencialmente de líquido amniótico deglutido, colesterol, ácidos e sais biliares, mucopolissacáridos, enzimas pancreáticas intestinais, vernix caseosa, lanugo e restos de células escamosas.
A palavra “mecónio”, que vem do tempo de Aristóteles, e deriva do grego “mekoniun”, significando “extracto de papoila ou ópio”; efectivamente, segundo o entendimento dos médicos da antiguidade, a associação entre depressão neonatal e mecónio era comparada ao efeito do ópio sobre a respiração do RN.
Comparativamente ao tipo de mecónio translúcido e fluido, o mecónio espesso tipo “puré de ervilhas” está mais frequentemente associado a complicações, designadamente por facilitar o crescimento bacteriano e a obstrução acentuada da via respiratória.
A eliminação de mecónio in utero é um acontecimento raro antes do termo da gestação (37 semanas); no entanto, tal eliminação é progressivamente mais provável depois desta idade, o que está em relação com o teor mais elevado, a partir de então, da motilina, hormona que promove o peristaltismo intestinal; ou seja, a maturidade intestinal e o nível plasmático de motilina constituem factores predisponentes de eliminação de mecónio.
Como factor desencadeante tem papel crucial a hipoxémia intrauterina que, gerando um estímulo vagal, promove o peristaltismo e o relaxamento do esfíncter anal.
Como foi referido antes, o mecónio pode ter acesso à via aérea/ser aspirado, ainda in utero, sendo que a hipoxémia intra-parto poderá constituir estímulo do centro respiratório originando gasping intraparto e antes da saída da cabeça.
Tradicionalmente a explicação fisiopatológica da SAM assenta em três pilares: obstrução mecânica da via aérea, inactivação do surfactante e hipertensão pulmonar arterial.
No entanto, nas últimas décadas, estudos científicos apontaram para o possível papel da activação do sistema imune como denominador comum na SAM. O mecónio, um potente activador de mediadores inflamatórios (citocinas, complemento, prostaglandinas, radicais livres de O2), reconhecido como “agente estranho” pelo sistema imune (complemento e toll-like receptors), desencadeia reacção inflamatória sistémica (ver adiante).
Assim, para além do processo obstrutivo das vias aéreas que se verifica, a etiopatogénese da SAM é abordada actualmente duma forma muito mais alargada; este facto tem implicações diagnósticas e terapêuticas.
O processo obstrutivo das vias aéreas por mecónio pode ser total ou parcial. Tratando-se de processo obstrutivo total nas vias aéreas de grande calibre, o mesmo poderá ser fatal se não revertido:
- Se o processo se verificar nas zonas de pequeno calibre, poderão surgir zonas de atelectasia;
- Se o processo obstrutivo for parcial, poderá gerar-se um mecanismo valvular facilitando a entrada do ar e dificultando a sua saída, o que comporta risco de ruptura da via aérea.
Verificando-se, em condições fisiológicas, redução do calibre das vias aéreas durante a expiração, o obstáculo intraluminal contribui para redução mais acentuada do referido calibre; por outro lado, a acumulação progressiva de ar pelo referido mecanismo valvular poderá levar a hiperinsuflação pulmonar e a situações diversas de ar ectópico como enfisema intersticial, pneumotórax e/ou pneumomediastino.
Outra consequência da presença de mecónio nas vias aéreas é o compromisso da ventilação-perfusão levando a hipóxia, hipercápnia e acidose.
Salienta-se que, no contexto de SAM, e considerando os antecedentes de hipóxia fetal, crónica ou subaguda, haverá que contar com o efeito da mesma hipóxia sobre a musculatura da parede arterial pulmonar (artérias intracinares) levando a hiperplasia, quer em espessura, quer em comprimento. Assim, será compreensível o surgimento de possível hipertensão pulmonar (arterial), agravando os efeitos atrás descritos.
Pormenorizando a já referida repercussão do mecónio aspirado no sistema imune, importa reter as seguintes noções:
- Depressão da função bactericida dos neutrófilos determinando susceptibilidade a infecções;
- Resposta inflamatória alveolar e parenquimatosa na qual intervêm macrófagos, neutrófilos, mediadores tais como citocinas (FNT-α, IL-1 β, e IL-8) e eicosanóides (tromboxano B2, leucotrienos B4 e D4, e 6-cetoprostaglandina F1-α, etc.);
- Outro efeito do processo inflamatório é a ruptura da barreira alvéolo-capilar com passagem de proteínas do soro para as vias aéreas;
- Efeitos vasculares (alteração da vasorreactividade, vasoconstrição das artérias pulmonares, shunt direito – esquerdo, etc.) em que intervêm mediadores vasoactivos (tais como endotelina-1, prostaglandina PGE2, tromboxano A2);
- Efeitos metabólicos traduzidos por disfunção e/ou inactivação do surfactante, sobressaindo a alteração e o défice das proteínas SP-A e SP-B, sendo que tais efeitos resultam essencialmente da acção lesiva dos sais biliares do mecónio sobre os pneumócitos do tipo II.
Manifestações clínicas
A SAM na sua forma mais típica corresponde a uma forma de SDR evidente no pós-parto imediato com as seguintes particularidades:
- RN impregnado de mecónio, por vezes com sinais de dismaturidade ou pós-maturidade (pele seca, unhas grandes também com mecónio, restrição de crescimento fetal, etc.), com depressão do sensório, que obriga a manobras de reanimação, e esboçando movimentos respiratórios de amplitude e ritmo irregulares e ineficazes (gasping);
- Evolução com gravidade crescente (taquipneia, cianose progressiva, com ulterior aparecimento de gemido, retracção costal e adejo nasal).
Podem ser notórios o aumento do diâmetro ântero-posterior do tórax por hiperinsuflação pulmonar e a auscultação de roncos e de fervores crepitantes e subcrepitantes dispersos.
Os sinais clínicos que poderão levantar a suspeita de hipertensão pulmonar persistente secundária são: cianose generalizada e intensa, hipoxémia refractária às medidas de oxigenoterapia/assistência respiratória, e labilidade dos parâmetros de oxigenação (por exemplo, diminuição acentuada da SpO2) após manuseamento do RN, por vezes atingindo 50-55%).
É frequente, neste tipo de SDR, a coexistência de:
- Sinais neurológicos concomitantes (tremores, convulsões, hiporreflexia, alteração do tono muscular);
- Sinais cardiocirculatórios: sopros transitórios (por shunt direita-esquerda em relação com hipertensão pulmonar, etc.), cardiomegália (por espoliação de reservas de glicogénio do miocárdio secundariamente à hipoxémia mantida);
- Hipoglicémia (por esgotamento das reservas de glicogénio: glicólise anaeróbia inicial e ulterior falência, também por hipoxémia mantida).
Exames complementares
Nos casos de SAM estão indicados os seguintes exames complementares (para além doutros a ponderar em função de cada situação específica):
- Gasometria – revelando sinais de hipoxémia, hipercápnia e acidose (de início, respiratória por retenção de CO2 e ulteriormente mista devida à produção de ácido láctico por glicólise anaeróbia face à falência do metabolismo aeróbio por hipoxémia);
- Hemograma – revelando, em geral, leucocitose com neutrofilia com aparecimento de bastonetes e outras formas mais jovens da série branca face ao estresse da hipoxémia; e trombocitopénia por sequestração e consumo de plaquetas no território pulmonar;
- Radiografia ântero-posterior do tórax – permitindo evidenciar alguns ou todos os seguintes achados:
- opacidades nodulares bilaterais de limites mal definidos, de densidade variável e confluentes, separadas por pequenas zonas de “hiperarejamento” (enfisema) ou de parênquima de aspecto normal, que, no conjunto, se assemelham a imagem em “favo de mel”;
- imagens de enfisema e de atelectasia (Figuras 1 e 2);
- cardiomegália;
- abaixamento das cúpulas diafragmáticas compatível com distensão enfisematosa;
- sinais de pneumotórax e/ou de pneumomediastino.
- Análise de urina – como particularidade deste tipo de SDR, cabe referir um método espectrofotométrico que pode identificar o tipo de pigmentos biliares presentes no mecónio (absorção a 405 nm) absorvidos ao nível do epitélio pulmonar e transportados pelo plasma até ao glomérulo renal;
- Ecocardiografia doppler – este exame é fundamental para avaliar a contractilidade cardíaca; poderão ser evidenciados sinais sugestivos de shunt direito-esquerdo em contexto de HPP; poderão eventualmente também ser detectados sinais de doença cardíaca estrutural associada , tais como síndroma de disfunção do ventrículo esquerdo, estenose aórtica e interrupção do arco aórtico;
- Electrocardiograma (ECG) – nas situações de asfixia intra-parto, o ECG pode evidenciar alterações do segmento ST sugerindo isquémia subendocárdica.
Tratamento
Medidas gerais
Pressupõe-se que as medidas gerais a seguir descritas são posteriores à actuação prioritária no bloco de partos no contexto de RN com líquido amniótico com mecónio (ver capítulo sobre reanimação do RN no bloco de partos).
Assim, procede-se à monitorização cardiorrespiratória e hemodinâmica reiterando-se a necessidade de vigilância em unidades de cuidados especiais ou intensivos.
É fundamental a estabilização hemodinâmica, a manutenção do equilíbrio hidroelectrolítico e acido – base e os suprimentos energético e hídrico adequados.
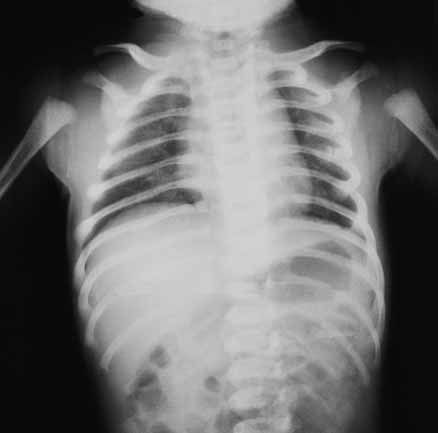
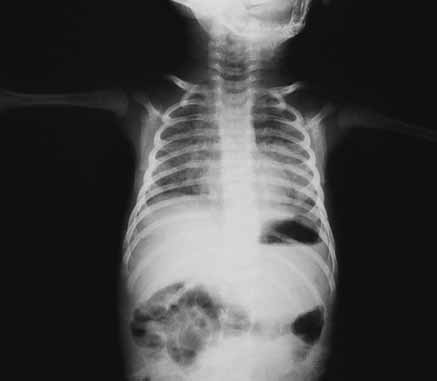
FIGURA 1 e 2. Síndroma de aspiração meconial: padrão radiográfico do tórax com opacidades nodulares irregulares alternando com áreas de enfisema e de parênquima de aspecto normal. (URN-HDE)
Medidas específicas (a ponderar caso a caso)
- Ventilação mecânica: alta frequência preferencialmente, ou convencional;
- Terapêutica substitutiva com surfactante, sobretudo nas SAM graves;
- Antibioticoterapia a aplicar em função do contexto clínico de cada caso;
- Óxido nítrico inalado (NOi) com acção relaxante específica sobre a musculatura vascular pulmonar – como estratégia de diminuição da pressão da artéria pulmonar e de melhoria da oxigenação arterial; a respectiva abordagem ultrapassa os objectivos do livro);
- ECMO (oxigenação por membrana extracorporal – em geral utilizando-se circuito de derivação veno-arterial) e indicada nos casos refractários às medidas anteriores e sempre que o IO seja igual ou superior a 40; a sua descrição ultrapassa os objectivos do livro.
No campo da investigação estão a decorrer estudos sobre:
- Terapêuticas para combater o processo inflamatório;
- Potenciais inibidores do sistema de complemento e dos chamados toll like receptors; e
- Anticorpos monoclonais específicos.
Prevenção
Os aspectos fundamentais da prevenção da SAM dizem respeito a:
- Vigilância pré-natal rigorosa:
- detecção de factores de risco (doenças maternas e fetais que possam conduzir a hipóxia fetal) e encaminhamento da grávida atempadamente para centro especializado, com unidade de cuidados especiais ou intensivos neonatais;
- Actuação correcta intraparto:
- a propósito da reanimação do RN, recorda-se que foi referido nas situações de “líquido amniótico com mecónio” com hipotonia, bradicárdia e diminuição do esforço respiratório: não está indicado o procedimento da rotina de entubação traqueal para aspiração por se ter demonstrado a sua ineficácia quanto a prevenção de SAM, associada a efeitos adversos major.
Prognóstico
Como complemento dos dados descritos atrás a propósito da importância do problema da SAM, importa dar ênfase a certos aspectos considerados relevantes quanto ao prognóstico:
- Risco de problemas neurológicos futuros, designadamente convulsões recorrentes;
- Prevalência de paralisia cerebral da ordem de 9%, havendo antecedentes concomitantes de asfixia perinatal grave;
- Disfunção pulmonar;
- Hiperreactividade brônquica.
BIBLIOGRAFIA
American Academy of Pediatrics (AAP), American College of Obstetricians and Gynecologists (ACOG). Guidelines for Perinatal Care. Washington DC: AAP/ACOG, 2002
Cloherty JP, Eichenwald EC, Strak AR. Manual of Neonatal Care. Philadelphia; Lippincott Williams & Wilkins, 2008
Cuttini M. Intrapartum prevention of meconium aspiration syndrome. Lancet 2004;364:560-561
Davis PG, Dawson JA. New concepts in neonatal resuscitation. Curr Opin Pediatr 2012;24:147-153
Chen DM, Wu LQ, Wang RQ. Efficiency of high frequency oscillatory ventilation combined with pulmonary surfactant in the treatment of neonatal meconium aspiration syndrome. Int J Clin Exp Med 2015;8:14490-14496
Chiruvolu A, Miklis KK, Chen E, et al. Delivery room management of meconium-stained newborns and respiratory support. Pediatrics Dec 2018, 142 (6) e20181485; DOI: 10.1542/peds.2018-1485
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gentle SJ, Abman SH, Ambalavanan N. Oxygen therapy and pulmonary hypertension in preterm infants. Clin Perinatol 2019;46:611-620
Hofer N, Jank K, Strenger V, et al. Inflamatory indices in meconium aspiration syndrome. Pediatric Pulmonology 2015; Wiley Periodicals, Inc; DOI 10.1002/ppul 23349
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Kumar A, Kumar P, Basu S. Endotracheal suctioning for prevention of meconium aspiration syndrome: a randomized controlled trial. Eur J Pediatr 2019;178:1825-1821
Lindenskov PHH, Castellheim A, Saugstad OD, Mollnes TE. Meconium aspiration Syndrome: possible pathophysiological mechanism and future potential therapies. Neonatology 2015;107:225-230
Lista G. Neonatologists and non-vigorous newborns with meconium-stained amniotic fluid (MSAF) in the delivery room: time for hands off? Eur J Pediatr 2019;178:1823-1824
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Montan S, Arul-Kumaran S. Neonatal respiratory distress syndrome. Lancet 2006;367:1878-1879
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nangia S, Mansi MP, Saili A, Gupta U. Effect of intrapartum oropharyngeal suction on meconium aspiration syndrome in developing country. Ressuscitation 2015;97:83-87
Paudel P, Sunny AK, PG, et al. Meconium aspiration syndrome: incidence, associated risk factors and outcome-evidence from a multicentric study in low-resource settings in Nepal. J Paediatr Child Health 2020;56:630-635
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saunders, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Saugstad OD. New guidelines for newborn resuscitation a critical evaluation. Acta Paediatr 2011;18:1-5
Vain NE, Szyld EG, Prudent LM. Oropharyngeal and nasopharyngeal suctioning of meconium-stained neonates before delivery of their shoulders: multicentre, randomized controlled trial. Lancet 2004;364:597-602
Warren JB, Anderson JDM. Newborn respiratory disorders. Pediatr Rev 2010;31:487-496
Wiswell TE. Appropriate management of the nonvigorous meconium-stained neonate: an unanswered question. Pediatrics Dec 2018, 142 (6) e20183052; DOI: 10.1542/peds.2018-3052
Yu VYH (ed). Pulmonary Problems in the Perinatal Period and their Sequelae. London: Baillière Tindall, 2004