Particularidades das infecções do grupo TORCHSZ e implicações práticas
Existe um grupo de infecções, frequentemente assintomáticas no adulto saudável e durante a gravidez, com a particularidade de as mesmas poderem provocar doença grave no feto/RN, sendo as respectivas manifestações clínicas muito semelhantes.
Entre tais infecções incluem-se as designadas por infecções do grupo TORCHSZ (toxoplasmose, outras, rubéola, vírus citomegálico humano, herpes simplex, sífilis e zica) já mencionadas atrás. Sendo as manifestações clínicas fetais e neonatais deste tipo de infecções muito semelhantes, para a sua destrinça torna-se fundamental a interpretação correcta do estudo serológico materno realizado durante a gravidez. Num RN com sinais de doença, a correcta interpretação dos resultados dos estudos serológicos realizados durante a gravidez condiciona poupança de gastos em trabalho de laboratório de imunologia, de virologia ou de parasitologia e, sobretudo, poupança em tempo de diagnóstico.
Neste capítulo são abordados aspectos fundamentais das infecções congénitas mais comuns numa perspectiva prática, com especial ênfase para o diagnóstico e o tratamento.
No que respeita às infecções que induzem imunidade e para as quais existe possível intervenção terapêutica, cabe salientar que o momento mais oportuno para avaliar o estado imunitário da mulher (imune versus não imune) é a consulta pré-concepcional.
Em tal circunstância, há tempo para esclarecer dúvidas, protelar uma gravidez se o contexto clínico o justificar, ou até proceder à imunização da futura grávida. Para algumas doenças infecciosas o conhecimento de que a mulher já teve contacto com o agente infeccioso torna desnecessária a repetição do estudo serológico.
Outro facto muito importante diz respeito ao local onde as análises são processadas; as mesmas deverão ser idealmente realizadas num laboratório idóneo, sempre o mesmo, com a mesma técnica, de modo a viabilizar a comparação de resultados seriados designadamente no que respeita a estudos serológicos. Facto não menos importante: os resultados devem ser observados e correctamente interpretados por quem os solicita.
Caso haja suspeita de infecção congénita, uma vez nascida a criança, devem ser solicitados exames no sangue do RN e da mãe no mesmo laboratório, de modo a comparar os resultados com os obtidos anteriormente. A interpretação dos resultados por parte do patologista clínico constitui também uma ajuda de grande importância.
Nas alíneas seguintes são abordados os seguintes tópicos:
- infecções que maiores polémicas e problemas ainda levantam na actualidade: sífilis congénita, toxoplasmose e infecção por vírus citomegálico humano;
- infecções que actualmente têm menor impacte em Saúde Pública face aos progressos realizados no nosso País no âmbito da prevenção e da terapêutica: rubéola e hepatites A, B e C;
- infecção por vírus Zica (ZICV), descoberto em África em 1947, com grande impacte em Saude Pública pelo seu carácter de doença emergente e epidémica, com difusão rápida nas Américas, sobretudo desde 2015.
1. SÍFILIS CONGÉNITA
Definição, etiopatogénese e aspectos epidemiológicos
A sífilis é uma doença de transmissão sexual provocada por um espiroqueta designado Treponema pallidum.
A sífilis congénita, adquirida pelo feto (muito mais frequentemente por via hematogénica transplacentar e mais raramente por contacto com lesão activa no canal do parto), evidencia relação com o estádio da doença materna.
A transmissão mãe/filho é tanto mais frequente quanto mais recente for a infecção materna. Na infecção materna precoce não tratada 70 a 100% dos fetos serão infectados. A maior parfcela de transmissão ocorre depois das 20 semanas, pelo que o tratamento da sífilis materna antes dessa idade gestacional previne a infecção fetal.
A sífilis pode causar morte fetal, nascimento de criança doente sintomática ou, se transmitida no final da gravidez, dar lugar ao nascimento de uma criança infectada mas assintomática.
Portanto, quanto mais recente a infecção materna e mais avançada a gravidez, maior o risco de infecção fetal.
Como a sífilis congénita é uma sífilis secundária adquirida por via hematogénica o agente Treponema pode atingir todos os órgãos, realçando-se o fígado, baço, pulmões, sistema nervoso central e sistema musculoesquelético, ao nível dos quais se verificam reacções inflamatórias intersticiais difusas e endarterite obliterante.
Com a descoberta da penicilina em 1943, a sífilis passou a ter tratamento específico; por isso, a partir de então, ficaram criadas as condições para a erradicação da sífilis congénita, a doença com melhor relação custo benefício no que respeita a diagnóstico e tratamento. Infelizmente, tal ainda não aconteceu, designadamente em Portugal.
O número de mulheres entre os 15 e os 44 anos de idade com sífilis aumentou de 33 em 2013 para 118 em 2016. No mesmo período, os casos de sífilis congénita variaram entre 6 e 12 casos por 100 000 nados-vivos correspondendo o valor máximo a 2014.
Com efeito, no nosso país a sífilis congénita continua a ser uma infecção que põe em risco a vida de recém-nascidos. A responsabilidade destes números é dos progenitores, dos médicos e do Sistema de Saúde. Dos primeiros, porque poderão não ter recorrido ao médico durante a gravidez por diversas razões, inclusivamente por défice de esclarecimento; dos médicos porque no caso de a gravidez ter tido acompanhamento médico, o diagnóstico deveria ter sido feito, a terapêutica prescrita e a cura da infecção materna comprovada; do Sistema de Saúde porque se a sífilis não foi diagnosticada nem tratada por falta de acompanhamento médico durante a gravidez, tal significa que o referido Sistema ainda não conseguiu fazer chegar os cuidados à população nos casos em que a população não procurou esses cuidados.
Manifestações clínicas
A sífilis congénita é uma doença com um espectro de manifestações muito amplo e formas de apresentação também variadas (exuberantes ou oligossintomáticas). Da infecção intrauterina pode resultar hidropisia fetal por anemia fetal grave, mortalidade fetal ou prematuridade. A criança pode, contudo, nascer assintomática surgindo as manifestações da doença mais tarde.
São a seguir sistematizadas as manifestações mais significativas da sífilis congénita precoce:
- Rinite mucóide, mucopurulenta ou mucopiossanguinolenta;
- Lesões cutaneomucosas ricas em Treponemas e, por isso, altamente contagiosas
- sifílides maculosas (roséola sifilítica) – máculas disseminadas, arredondadas, róseas
- pênfigo palmoplantar – bolhas de localização simétrica, de conteúdo seropurulento ulcerando e transformando-se em crostas (Figura 1)
- condiloma plano – lesões de tipo “vegetações” achatadas perianais.
- Lesões viscerais
- hepatomegália – hepatite neonatal, colestase (a causa mais frequente de colestase nos países em desenvolvimento é a sífilis congénita), eritropoiese extramedular, compromisso do SRE.
- esplenomegalia (Figura 2)
- linfadenopatia generalizada (sendo a localização epitroclear típica).
- Manifestações hematológicas
- anemia hemolítica com prova de Coombs negativa (por vezes a forma de apresentação no lactente)
- leucocitose (reacção leucemóide ou síndroma de Von Jachs Luzet)
- trombocitopénia
- CID nas formas graves.
- Manifestações respiratórias
- pneumonia intersticial (pneumonia alba).
- Manifestações renais
- síndroma nefrótica.
- Manifestações ósseas
- lesões simétricas, dolorosas ao tacto, com impotência funcional, muito frequentes; por vezes a forma de apresentação é a pseudo paralisia de Parrot com postura antiálgica do membro
- osteocondrite metafisária, a lesão mais frequente, em geral manifestada antes dos 3 meses, por vezes associada a fractura patológica
- sinal de Wimberger correspondente a rarefacção óssea evidente no bordo interno da extremidade proximal da tíbia (Figura 3)
- periostite (em geral manifestada após os 3 meses).
- Manifestações do sistema nervoso central
- compromisso assintomático na maioria dos casos (alteração bioquímica, citológica e serológica do LCR)
- leptomeningite aguda, compromisso meningovascular, compromisso dos pares cranianos.
Sucintamente, referem-se alguns sinais de complicações da sífilis congénita não tratada, manifestações residuais ou estigmas, hoje praticamente inexistentes no nosso meio e apenas citadas por razões históricas: reacções tardias (após 2 anos de idade) e de hipersensibilidade, correspondentes à sífilis terciária adquirida – a tríade de Hutchinson (dentes de Hutchinson, ceratite intersticial e surdez por lesão do VIII par craniano).
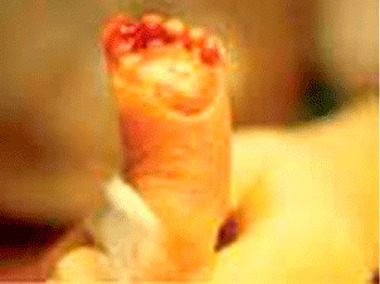
FIGURA 1. Lesões cutâneas características da sífilis congénita: pênfigo bolhoso / descamação plantar em RN pré-termo. Esta lesão [cutânea] é altamente contagiosa e deve ser manipulada com luvas, pelo menos durante as primeiras 24h de terapêutica com penicilina. (UCIN-HDE)
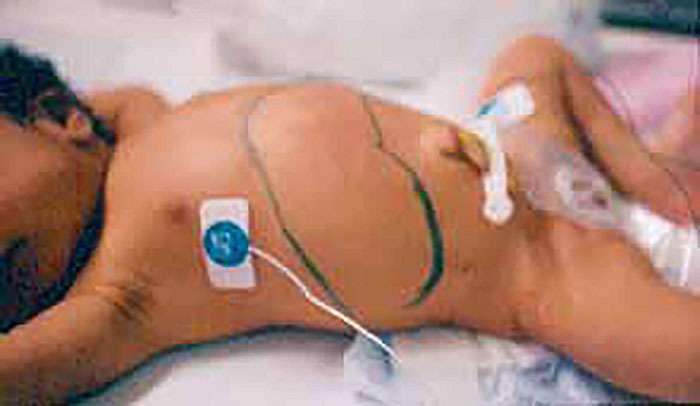
FIGURA 2. RN com sífilis congénita. São notórias hepatosplenomegália e petéquias na região inguinal direita. (UCIN-HDE)
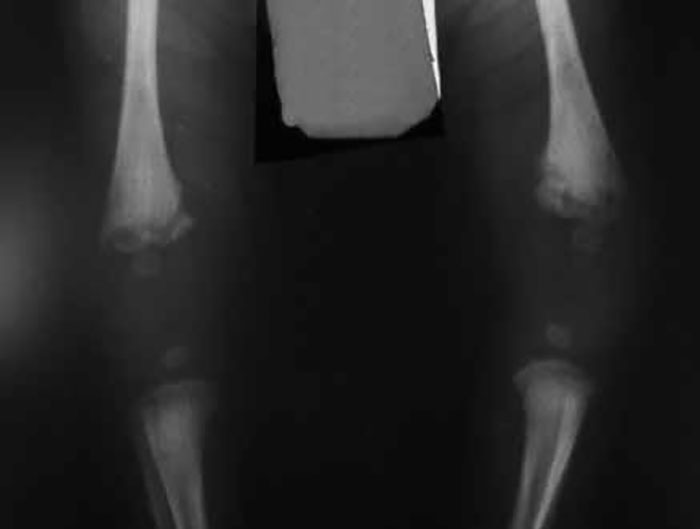
FIGURA 3. Lesões ósseas de osteocondrite e metafisite típicas da sífilis congénita (destruição esponjosa bilateral) podendo levar a descolamento epifisário. Apesar de exuberantes e extremamente dolorosas, regridem completamente após tratamento com penicilina. (UCIN-HDE)
Exames complementares
Para o diagnóstico da sífilis congénita torna-se fundamental atender aos antecedentes da gravidez: seguimento médico, resultados dos exames não treponémicos e treponémicos e terapêutica instituída e realizada em caso de resultados reactivos/positivos. É muito importante estudar a evolução dos títulos das provas não treponémicas, sendo sabido que, em caso de sífilis no adulto, as provas treponémicas se mantêm positivas para a vida e as provas não treponémicas devem negativar em caso de cura.
As manifestações clínicas atrás mencionadas, as alterações encontradas na radiografia dos ossos longos, no hemograma, no exame citoquímico do LCR, nas provas de função hepática, no exame de urina, completam o quadro que possibilita um diagnóstico de suspeição muito forte.
A suspeição clínica é muito fortalecida pelos resultados dos exames laboratoriais não treponémicos e treponémicos – VDRL titulado comparado com o da mãe e FTAabs ou TPHA.
O diagnóstico de certeza hoje em dia baseia-se, mais na pesquisa do DNA do Treponema pallidum por PCR, do que nos antiquados e abandonados métodos de pesquisa do microrganismo em campo escuro.
Salienta-se ainda que a suspeita de qualquer infecção congénita implica a obrigatoriedade de exame oftalmológico (referido de novo adiante, enquadrado no contexto clínico laboratorial).
A seguir, são sistematizadas as análises a realizar, o significado de cada uma delas, a interpretação dos respectivos resultados e a atitude a ter na grávida com resultado de VDRL reactivo e no RN de mãe com VDRL reactivo. Recorda-se, a propósito, que a presença de Treponema no organismo induz a formação de anticorpos não treponémicos ou reagínicos (inespecíficos), e de anticorpos treponémicos ou específicos.
- VDRL (Venereal Disease Research Laboratory) – É uma prova não treponémica. O resultado é dado como reactivo ou não reactivo, em diluições ou títulos (Ex: diluído a ¼ ou reactivo a 2 diluições, diluído a 1/8 ou reactivo a 4 diluições). Tendo a análise VDRL elevada sensibilidade é com a mesma que se procede ao rastreio. A especificidade é, no entanto, menor; ou seja, há a certeza de diagnosticar todos os casos verdadeiros, embora possam surgir resultados falsos reactivos.
Um resultado reactivo para VDRL deve ser sempre confirmado por provas treponémicas – FTA Abs (Fluorescent Treponemal Antibody Absoption test) ou TPHA (Treponema pallidum hemaglutination Assay).
Nota importante: a conversão do resultado do VDRL, de reactivo em não reactivo, constitui prova de cura; por isso, tal análise deve ser repetida até negativar; se a prova positivar novamente, tal corresponderá a reinfecção da grávida, o que implica novo tratamento. A infecção por Treponema pallidum não gera imunidade. |
- FTA- Abs ou TPHA – Trata-se de provas treponémicas, confirmando o diagnóstico das provas não treponémicas. Positivam mais precocemente que as não treponémicas; possuindo elevada especificidade, embora baixa sensibilidade, não estão indicadas para rastreio.
Nota importante: Um doente com sífilis tratada mantém provas treponémicas positivas durante toda a vida; por isso, torna-se desnecessário repetir a análise para avaliar se houve cura. |
Actuação prática
No período pré-concepcional e na grávida
- Rastreio → VDRL: pré concepcional; e durante 1º, 2º e 3º trimestres da gravidez.
Segundo a Norma 037/2011 da DGS, na gravidez de baixo risco a VDRL deve ser realizada apenas no 1º e 3º trimestres. Se existir história de múltiplos parceiros sexuais, deve realizar-se a análise também aquando da admissão na sala de partos. - Confirmação → Se a VDRL foi reactiva, o resultado deve ser titulado. A infecção deve ser confirmada através da realização da análise FTA Abs ou TPHA. A descida progressiva dos títulos de VDRL até à negativação são prova de cura. O parceiro sexual deve ser rastreado e tratado se infectado.
No RN de mãe com VDRL reactiva
- Determinar VDRL com titulação no soro do RN e da mãe.
- Se VDRL reactiva, realizar: punção lombar (se o número plaquetário for normal) para VDRL e exame citoquímico no LCR; radiografia dos ossos longos dos membros inferiores (detecção de sinais de osteocondrite e periostite, outros); provas de função renal e hepática; hemograma e proténa C reactiva (PCR); exame oftalmológico; ecografia transfontanelar.
Nota importante: não se deve recorrer à análise de FTA abs ou TPHA no LCR para esclarecimento da situação clínica. |
Tratamento
Dada a possibilidade de a neurossífilis não poder ser excluída na maior parte dos recém-nascidos, a penicilina benzatínica não deve ser utilizada pelo facto de não garantir níveis treponemicidas no LCR.
Assim, estão indicados os seguintes regimes no contexto de sífilis congénita provada ou altamente provável, designadamente nas seguintes situações:
- evidência clínica, laboratorial ou radiológica de sífilis congénita;
- RN de mãe com VDRL reactiva, não tratada;
- mãe tratada com outro antibiótico que não penicilina;
- mãe com tratamento no 9º mês de gestação (situação correspondente a feto não tratado);
- ausência de cura comprovada da infecção materna.
→ Antes dos 28 dias de vida: Penicilina G cristalina aquosa por via endovenosa; 50 000UI/kg/dose durante 10 dias; tomas de 12-12h nos primeiros 7 dias, e de 8-8h do 7º ao 10º dia de tratamento.
→ Depois dos 28 dias de vida: Penicilina G cristalina aquosa por via endovenosa: 200 000-300 000 UI/kg/dia: doses de 50 000 UI/kg/dose de 4-4h ou de 6-6h durante 10 dias.
Nota importante: |
Estudo evolutivo
A criança com sífilis congénita confirmada deve ser observada em consulta de seguimento mensalmente durante os 3 primeiros meses e, depois, de 3-3 meses até aos 12 meses.
Nos casos de neurossífilis, a punção lombar para exame do LCR deve ser repetida aos 6 meses.
Conclusões
O único modo de evitar casos de sífilis congénita é rastrear a grávida.
O rastreio é sempre realizado com provas não treponémicas – VDRL. Em Portugal, a norma da DGS para gravidezes de baixo risco preconiza que o VDRL seja realizado no 1º e 3º trimestres. Em países ou zonas de elevada incidência de sífilis o rastreio deve ser realizado uma vez por trimestre.
O VDRL deve ser sempre realizado após uma primeira diluição e titulado. A diluição previne que seja obtido um resultado falso negativo devido a fenómeno de pró-zona; a titulação permite seguir a evolução da infecção e a resposta ao tratamento.
O VDRL pode ser negativo se a infecção for muito recente. O resultado destes exames deve ser visto pelo médico ou outro profissional de saúde para isso habilitado, e correctamente interpretado.
A sífilis na grávida tem como único tratamento a penicilina. A penicilina trata a infecção materna e a fetal. Mesmo que a grávida alegue que é alérgica à penicilina deve ser este o antibiótico utilizado após dessensibilização. Outros antibióticos que não a penicilina tratam a grávida mas não tratam o feto.
A administração de penicilina pode desencadear reacção de Jarisch-Herxheimer na grávida – calafrios, febre, taquicardia, hipotensão, cefaleia, lesões cutâneas, leucocitose e taquipneia, sofrimento fetal e ameaça de parto pré-termo. Por isso há quem advogue que a penicilina deve ser administrada em meio hospitalar/Centro de Saúde e que a grávida deve estar monitorizada.
O parceiro sexual deve ser também tratado.
Em Portugal a sífilis congénita é uma infecção de notificação obrigatória.
Toda a situação deve ser transcrita para o boletim da grávida: resultados de análises, comprovativos de tratamento do casal e comprovativo de cura.
2. TOXOPLASMOSE
Definição, etiopatogénese e aspectos epidemiológicos
A toxoplasmose congénita é uma doença provocada por um protozoário, Toxoplasma gondii, parasita intracelular obrigatório. Este protozoário existe sob 3 formas: trofozoítos ou taquizoítos (forma proliferativa); quisto tecidual (bradizoíto); oocisto (produzindo trofozoítos).
A toxoplasmose é uma zoonose largamente difundida em todo o mundo, tendo como hospedeiro definitivo o gato; outros hospedeiros são ocasionais (todos os mamíferos, algumas aves e répteis, etc.).
O agente Toxoplasma transmite-se por ingestão de carne malcozida de animais parasitados contendo quistos teciduais; ingestão ou inalação de oocistos eliminados pelas fezes de gatos; mais raramente, a transmissão faz-se por transfusão de sangue ou transplantação de órgãos.
A prevenção primária é muito eficaz: ingestão de carne bem cozida, manipulação de carne crua com luvas, lavagem cuidadosa das superfícies onde foi cortada carne crua.
A lavagem cuidadosa de vegetais consumidos crus, a jardinagem com luvas e a manipulação de dejectos de gatos com luvas são medidas simples que poderão reduzir significativamente a taxa de seroconversão durante a gravidez.
É possível a transmissão ao feto em caso de primo-infecção da grávida ou de recrudescência de doença crónica da referida grávida em situações de imunodepressão.
Nota importante: raramente, num adulto saudável e imunocompetente se verifica reinfecção ou reactivação de infecção. |
O risco de transmissão durante a gravidez, crescente com o tempo de gestação, pode ser contabilizado do seguinte modo: cerca de 10% dos fetos serão afectados se a mãe se infectar no primeiro trimestre, 30% se no 2º trimestre, e 50 a 60% se no final da gravidez.
Quanto à gravidade da infecção fetal, ela é tanto maior quanto mais precoce for a transmissão materno-fetal: em situações extremas poderá surgir aborto e morte fetal.
Na grávida, a toxoplasmose pode ter manifestações semelhantes a uma gripe. Em imunodeprimidos a doença pode manifestar-se com gravidade (menigoencefalite, pneumonite, miocardite, coriorretinite).
A frequência de toxoplasmose varia muito nas diversas comunidades urbanas, o que depende dos hábitos alimentares, do contacto com animais portadores e das condições climáticas (o oocisto sobrevive bem ao calor).
Nota importante: |
No nosso país tem-se assistido a uma diminuição das taxas de seropositividade na população de mulheres grávidas, facto que pode ser atribuído a múltiplos factores, tais como: 1) o parasita é menos prevalente; 2) a população pratica melhor as normas básicas de higiene, nomeadamente no que respeita a lavagem das mãos e desinfecção de frutas e legumes; 3) existem menos animais de abate contaminados.
A taxa de seropositividade na população em geral induz preocupações diferentes: uma elevada prevalência indica grande frequência do parasita; por isso, apesar de haver baixa prevalência de indivíduos susceptíveis, incluindo mulheres em idade fértil, a possibilidade de seroconversão durante a gravidez é grande.
Uma prevalência baixa indica menor risco de infecção na população em geral mas, como a prevalência de mulheres susceptíveis é maior, o número de seroconversões durante a gravidez pode ser maior também.
Sob o ponto de vista económico, é mais rendível rastrear grávidas numa população de elevada prevalência de seropositivas – as grávidas a rastrear serão poucas e a possibilidade de diagnosticar uma seroconversão é elevada.
Sob o ponto de vista da saúde pública, como é obvio, interessará mais que a taxa de seroconversão na gravidez seja baixa.
A infecção do feto, em princípio, só ocorre se se verificar primo-infecção materna durante a gestação: a parasitémia materna origina infecção placentar (placentite) com consequente disseminação hematogénica para o feto. A passagem do parasita do sangue materno para a placenta, e desta para o feto, pode ser concomitante com a invasão da placenta ou não, podendo mediar algum tempo entre as duas ocorrências.
Salienta-se, no entanto que, em mães com imunossupressão e antecedentes de primo-infecção, pode verificar-se reactivação de infecção latente com ulterior parasitémia e risco de infecção fetal. Daí a importância da conhecer os resultados de estudos serológicos anteriores à gravidez.
Avaliação pré-concepcional
Se o estudo serológico da mulher evidenciar IgG positiva e IgM negativa não há necessidade de repetir a análise. Se se comprovar uma infecção recente poderá ser útil protelar uma eventual gestação.
Avaliação pré-natal
Se a mulher for seronegativa, deve investir-se na prevenção primária, altamente eficaz. Nesse sentido devem ser dadas indicações sobre o modo de transmissão da doença e realçar a importância de serem seguidas as medidas de prevenção primária.
Em Portugal, as normas da DGS preconizam a repetição de serologias em mulheres seronegativas, uma vez por trimestre; a manter-se a actual política de rastreio, idealmente, a serologia deveria ser repetida mensalmente com o objectivo de detecção precoce de eventual seroconversão.
Diagnóstico de infecção fetal
A infecção fetal é diagnosticada na sequência de seroconversão materna comprovada: IgM positiva com IgG ainda negativa ou, já positiva mas com avidez baixa.
Se tal acontecer, deve ser programada amniocentese para identificação do parasita no líquido amniótico por PCR (reacção em cadeia da polimerase).
Nota importante: |
Devem também ser programadas ecografias morfológicas seriadas para determinar o impacte da infecção no feto, nomeadamente hidrocefalia, calcificações intracranianas, hepatomegália, ascite e placentite.
O diagnóstico de infecção fetal e a comprovação ecográfica das alterações fetais daí decorrentes permitirão ao casal decidir sobre a realização de eventual abortamento medicamente assistido, de acordo com a legislação.
Manifestações clínicas e diagnóstico de infecção no RN
Na grande maioria dos casos de toxoplasmose congénita (cerca de 85%) a criança está assintomática ao nascer, podendo surgir, nos meses ou anos subsequentes, sinais isolados ou associados de modo diverso, os quais que se poderão relacionar com infecção adquirida intrauterina.
Nos casos de infecção no primeiro trimestre da gravidez, são notórios sinais neurológicos e oftalmológicos de gravidade variável, tais como, restrição de crescimento intrauterino (RCIU), microcefalia, hidrocefalia obstrutiva, calcificações intracranianas difusas, convulsões, alterações do LCR e retinocoroidite (Figura 4).
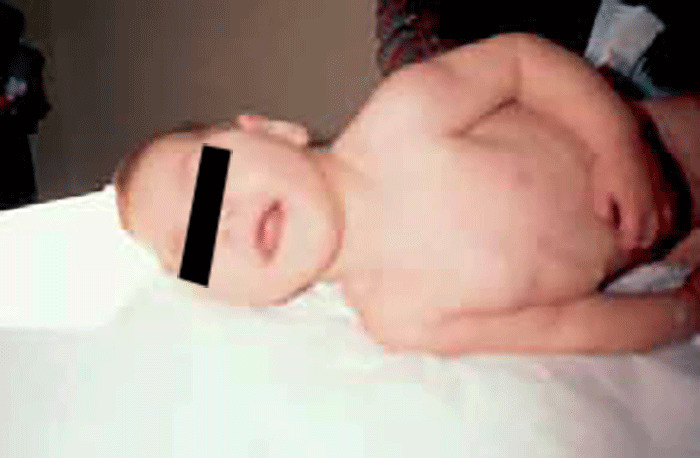
FIGURA 4. Microcefalia em criança com toxoplasmose congénita adquirida às 16 semanas de gestação. O diagnóstico e o tratamento da infecção congénita in utero podem impedir lesões graves do SNC. (UCIN-HDE)
Nos casos de infecção adquirida no segundo e terceiro trimestres poderá verificar-se, para além de retinocoroidite e de alterações do LCR, baixo peso de nascimento, RCIU, hepatosplenomegália, linfadenopatia, icterícia, hepatite, anemia hemolítica, trombocitopénia, hipoprotrombinémia, pneumonite intersticial, pancardite.
As lesões oculares primárias da retina e coroideia (presentes em 60 a 80% dos casos) podem acompanhar-se ou complicar-se de lesões secundárias tais como: iridociclite, catarata, glaucoma, estrabismo, nistagmo e descolamento da retina.
Os antecedentes epidemiológicos e obstétricos, assim como os sinais clínicos orientam para o diagnóstico, o qual deverá ser confirmado pela realização de exames complementares:
- Exames gerais (hemograma com contagem de plaquetas e reticulócitos, análise do LCR, provas de função e citólise hepáticas, bilirrubinémia total e conjugada, etc.);
- Exames específicos (a programar em função da forma de apresentação):
- ecografia transfontanelar para detecção de calcificações, dilatação venticular, outras;
- TAC para detecção de lesões parenquimatosas, etc.;
- radiografia do tórax para detecção de sinais de pneumonite intersticial;
- radiografia dos ossos longos para detecção de estrias longitudinais nas epífises e radioluscência óssea;
- exame oftalmológico para detecção das lesões já descritas;
- estudo serológico pós-natal: IgG positiva, por vezes com título superior ao da mãe, e IgM positiva confirmam o diagnóstico.
- identificação de ADN do parasita no sangue e LCR do RN, uma análise específica, de resposta rápida;
- inoculação no cobaio: técnica ainda utilizada mas pouco relevante na prática clínica.
Sobre algumas limitações do estudo serológico, importa reter algumas noções importantes:
Nota importante: |
Tratamento
Infecção da grávida
Os autores franceses defendem que infecção fetal tratada tem muito melhor prognóstico do que a não tratada. Por isso, salienta-se a importância do rastreio da grávida, do diagnóstico da infecção na mulher e, depois, no feto.
Se se verificar seroconversão durante a gravidez, a mulher deve ser encaminhada para um centro de diagnóstico pré-natal e seguida em consulta de alto risco.
O tratamento com espiramicina trata a infecção materna e impede a disseminação do parasita para o feto, mas não trata a infecção fetal se ela já estiver estabelecida.
Assim, o tratamento na grávida é feito com espiramicina durante toda a gravidez caso não se comprove infecção fetal (3 g/dia de 12/12h). A terapêutica deve ser iniciada logo que seja feito o diagnóstico de seroconversão.
Infecção fetal
A infecção fetal deve ser tratada com pirimetamina e sulfadiazina (25 mg/dia e 4 g/dia respectivamente). Este tratamento deve ser iniciado logo que haja diagnóstico de infecção fetal e mantido até ao nascimento. A grávida deve receber também suplemento de ácido folínico.
Infecção no RN
Atendendo a que a espiramicina é um bacteriostático, no RN sintomático o tratamento deve ser iniciado com pirimetamina (1mg/kg por via oral de 2/2 dias) e sulfadiazina (100 mg/kg/dia por via oral de 12/12h) que actuam de modo sinérgico contra Toxoplasma.
O tratamento com pirimetamina deve ser interrompido se o valor plaquetário for inferior a 90 000/mm3 e a sulfadiazina interrompida se o valor dos neutrófilos for inferior a 1000/mm3.
Sendo, pois, estes medicamentos depressores medulares, a terapêutica deve ser complementada com a administração de ácido folínico (10 mg por via oral de 3/3 dias) sendo indispensável realizar um hemograma duas vezes por semana, pelo menos no início.
A comprovação de doença ocular (retinocoroidite) ou do SNC obrigará à administração de corticóides – prednisona – 1,5 mg/kg/dia por via oral de 12/12h.
Estudo evolutivo
Uma criança com suspeita de toxoplasmose congénita deve ser vigiada regularmente com estudo serológico seriado de 3-3 meses no primeiro ano de tratamento – que é o primeiro ano de vida – e com exame oftalmológico, igualmente seriado e regular, até ao início de idade adulta.
3. INFECÇÃO PELO VÍRUS CITOMEGÁLICO HUMANO (CMV)
Etiopatogénese, aspectos epidemiológicos e importância do problema
O vírus citomegálico humano (CMV), originando uma infecção conhecida por doença de inclusão citomegálica, é um vírus que pertence à família dos vírus Herpes.
A infecção por CMV é endémica, com elevada prevalência nos países em desenvolvimento e em populações com condições socioeconómicas precárias, variando entre os 45 e os 100%. Em Portugal, diversos estudos mostram taxas que se situam entre os 80% e os 90%. Estudos realizados na maternidade do Hospital de Dona Estefânia revelaram que a taxa de puérperas com IgG positiva para CMV era de 85% em 1988, 60% em 2003 e 62% em 2010.
As infecções transmitem-se de modo directo ou indirecto de pessoa a pessoa, podendo o vírus ser veiculado através da urina, secreções da orofaringe, secreções vaginais, sémen, saliva, suor, lágrimas, leite materno e sangue.
A infecção pode ser congénita, adquirida no período perinatal ou, após o nascimento, ainda no período neonatal ou já durante a fase de lactente. As principais fontes de transmissão do vírus no período perinatal são a infecção do tracto genital e o leite materno.
Actualmente, nos países desenvolvidos, a infecção neonatal adquirida por transfusão sanguínea é negligenciável. A dificuldade e raridade em encontrar dadores seronegativos foi contornada com a administração de sangue irradiado nos RN de extremo baixo peso e sangue desleucocitado a todos os RN.
A prevalência da infecção congénita nos EUA varia entre 0,5 e 2% de todos os nados-vivos, afectando cerca de 30.000 crianças por ano. Destas, 10% a 15% são sintomáticas ao nascer. Das restantes, aparentemente saudáveis, 15 a 20% terão manifestações da doença mais tarde.
São descritos dois tipos de infecção na grávida/adulto: primária (primo-infecção) ou recorrente (secundária). Neste último caso poderá tratar-se de reactivação da infecção primária com estirpe latente, ou reinfecção com nova estirpe.
A infecção por CMV confere imunidade cruzada com novas linhagens de CMV, mas esta protecção não é completa, sendo que tem sido demonstrada reinfecção com outras linhagens através de análise do ADN vírico.
Tanto a infecção materna primária (ocorrendo em 0,6 a 4% de todas as gravidezes) como a recorrente, podem resultar em infecção congénita; contudo, no feto a taxa de infecção e a gravidade das lesões após a infecção materna primária são muito maiores (cerca de 40 a 50%) do que após infecção recorrente (cerca de 1%).
Ao contrário doutras infecções como rubéola e toxoplasmose, o achado de IgG positiva para CMV não protege o feto, havendo probabilidade de infecção em 50% dos casos; todavia, verifica-se diminuição da gravidade da infecção que, na maior parte dos casos, é subclínica.
A transmissão materno-fetal do CMV pode ocorrer com igual frequência em todas as fases da gestação, salientando-se que na maioria destes casos não se verifica qualquer sintomatologia ou a sintomatolgia é ligeira, semelhante a síndroma gripal.
O RN pode ainda infectar-se através do leite materno de uma mãe IgG positiva. Na realidade durante a lactogénese existe replicação vírica na glândula mamária com excreção de vírus.
Nota importante: |
A excreção do vírus persiste durante anos, quer nas infecções congénitas e perinatais, quer nas pós-natais precoces e até nas infecções primárias de crianças mais velhas e adultos.
Manifestações clínicas
As manifestações clínicas mais típicas da infecção congénita por CMV são:
- nas situações de infecção materna precoce: RCIU, microcefalia, calcificações intracranianas periventriculares (Figura 6);
- nas situações de infecção materna tardia: ausência de sintomatologia ou hepatosplenomegália, pneumonia, icterícia colestática, anemia, trombocitopénia grave, sinais sugestivos de sépsis, etc..
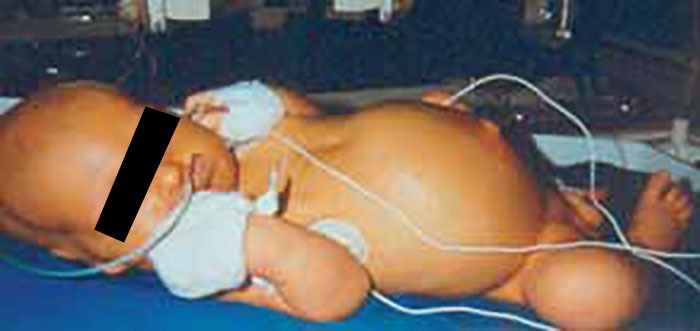
FIGURA 5. Hepatosplenomegália com distensão abdominal, icterícia mista (com aumento da bilirrubina directa e indirecta), anemia e hiperesplenismo em RN com infecção congénita por CMV adquirida no final da gestação.
Rastreio universal da grávida
Esta questão é polémica e ainda não resolvida: alguns autores defendem com muita convicção o rastreio, enquanto outros tomam uma posição diametralmente oposta.
Os defensores da sua realização entendem que não rastrear é não reconhecer o problema, salientando que o rastreio permite um conhecimento precoce do risco de infecção, com implicações práticas nas estratégias para a prevenção primária e para o diagnóstico de infecção fetal em fase mais precoce.
Pelo contrário, os defensores do “não” argumentam, nomeadamente:
- Que a prevenção primária e a educação para a saúde são uma inerência dos cuidados primários de higiene, salientando, por exemplo, que a lavagem das mãos previne muitas outras doenças;
- Que o feto sintomático será sempre diagnosticado se a gravidez for correctamente vigiada e as ecografias correctamente executadas e interpretadas;
- Que o diagnóstico de certeza de infecção fetal é difícil e baseado na pesquisa de CMV no líquido amniótico obtido por amniocentese;
- Que o facto de a pesquisa ser negativa em determinado período, não implica que a mesma se mantenha negativa durante toda a gravidez;
- Que não existe tratamento específico para a infecção uma vez diagnosticada.
Em Portugal a Direcção Geral da Saúde preconiza que o rastreio seja realizado em consulta pré-concepcional.
Se a grávida for seronegativa antes da gravidez devem ser dadas indicações sobre prevenção primária que, segundo alguns autores, pode evitar até 3/4 de todas as seroconversões.
Essas medidas dizem respeito à lavagem cuidadosa das mãos após muda de fralda ou limpeza do períneo de um lactente, limpeza de lágrimas e secreções nasais, evitar dar beijos na boca de lactentes e não partilhar comida, bebidas, talheres ou pratos.
Às mulheres de maior risco – funcionárias de creches ou mães seronegativas com filho pequeno em infantário e mulheres com síndroma gripal na gravidez pode ser oferecido rastreio serológico trimestral durante a gravidez. Claro que, se forem observadas alterações fetais ecográficas sugestivas de infecção por CMV, devem ser pedidas análises e programados outros procedimentos.
Em conclusão, na ausência de vacina contra CMV, o rastreio universal das grávidas não tem indicação. Deve, sim, ser realizado rastreio pré-concepcional e feito investimento na prevenção primária.
Nota importante: |
Diagnóstico pré-natal
O diagnóstico pré-natal baseia-se nos seguintes critérios:
- detecção de anomalias na ecografia fetal;
- detecção de seroconversão para CMV na grávida (IgG positiva “de novo” com IgM positiva) e achado de avidez baixa das IgG.
Os meios de diagnóstico de infecção fetal são os seguintes:
- Ecografia fetal detalhada;
- Pesquisa de vírus por PCR (reacção em cadeia da polimerase) no líquido amniótico obtido por amniocentese;
- Estudo da infecção fetal e da repercussão da mesma sobre o feto, através do sangue obtido por cordocentese (PCR, serologia, alterações hematológicas e da função hepática).
Diagnóstico neonatal
Se a infecção neonatal for sintomática – por ex. hepatite, sépsis vírica, pneumonite – ou se se verificarem já sequelas da infecção intra uterina – RCIU, microcefalia, calcificações periventriculares (Figura 6) – é fácil admitir como hipótese diagnóstica uma das infecções do grupo TORCHS. Se a mãe tiver feito as análises adequadas, restam escassas hipóteses acerca do agente etiológico.
Uma vez que a infecção congénita por CMV poderá levar a defeitos de migração neuronal, em todos os RN com lisencefalia, polimicrogiria, etc. deve proceder-se ao estudo para detecção de infecção por CMV.
Se a infecção for assintomática, habitualmente não é diagnosticada.
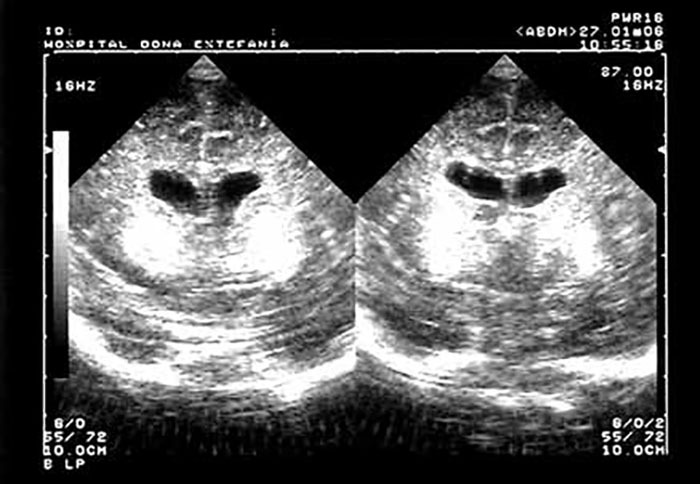
FIGURA 6. Aspecto ecográfico de calcificações periventriculares no contexto de infecção por CMV. (UCIN-HDE)
Actualmente existem técnicas que permitem diagnóstico mais rápido e mais preciso de infecção por CMV.
- Identificação do ADN vírico por técnica de PCR na urina ou saliva.
- Microcultura em Shell Vial a partir de urina do RN com identificação do antigénio do CMV.
- O estudo da serologia da mãe e do RN (não de sangue do cordão), comparado e evolutivo, assim como a avaliação da avidez das IgG maternas, podem contribuir para o diagnóstico. De salientar que no RN a IgM pode evidenciar valor falso negativo, ou falso positivo por reacção cruzada com outros vírus herpes.
- O estudo no sangue do RN utilizado para o rastreio de doenças metabólicas torna possível fazer o diagnóstico de infecção congénita muito para além do período neonatal.
No sentido de avaliar a repercussão da infecção por CMV nos órgãos e, designadamente, no SNC e órgãos dos sentidos, devem ser realizados os exames complementares mencionados a propósito da toxoplasmose (ver atrás).
Tratamento
Fetal
Tem havido tentativas ditas de sucesso em iniciar a terapêutica ainda in utero, quer com imunoglobulina específica, quer com antivíricos. Apesar de os primeiros resultados parecerem promissores, a terapêutica antivírica só deverá ter lugar em estudos controlados. Por outro lado, está actualmente estabelecido que a administração de imunoglobulina específica à grávida não tem indicação.
Neonatal
Após o diagnóstico de uma infecção congénita por CMV deve tentar-se estabelecer a gravidade da doença de modo a decidir se deve ou não ser iniciada terapêutica.
A administração de gamaglobulina específica hiperimune só tem interesse nos RN que adquiriram a infecção no final da gestação e que ainda evidenciam IgG negativa. Os infectados no primeiro e segundo trimestres não terão benefício com a sua administração, uma vez que já receberam IgG maternas exercendo efeito no combate à infecção.
Estudos recentes têm vindo a modificar as indicações para o uso de antivíricos nas infecções congénitas por CMV.
Em contraponto à época em que o uso de ganciclovir era muito limitado atendendo aos respectivos efeitos acessórios, provou-se posteriormente que, com os succedâneos actuais, mais inócuos e eficazes foi possível mudar a estratégia.
Nota sobre certos efeitos deletérios do ganciclovir:
|
Sabia-se que, durante a terapêutica com ganciclovir, a virúria diminuia para reaparecer após interrupção do fármaco. Por isso, muitos autores intrerrogavam-se se não seria correcto manter terapêutica durante mais tempo do que as 6 semanas estipuladas de modo a controlar a virúria durante os primeiros mese de vida. Havia, no entanto, uma limitação, que era a necessidade de manter permeável um acesso venoso por período prolongado.
Depois de se comprovar que a terapêutica com valganciclovir em administração oral, na dose de 16 mg/kg/dose duas vezes por dia atingia níveis sistémicos comparáveis aos do ganciclovir endovenoso, com menores efeitos acessórios, concluiu-se que se tinha chegado à solução para o tratamento das infecções congénitas por CMV.
Concluindo, na actualidade está estipulado que:
- Em crianças assintomáticas não se deve iniciar terapêutica. Em tais casos, uma vez identificadas, o importante é serem vigiadas sob o ponto de vista da acuidade auditiva de modo a programar intervenção precoce caso sobrevenha surdez;
- Em crianças sintomáticas deve iniciar-se terapêutica. Em tais circunstâncias, os quadros clínicos devem ser discutidos caso a caso, ponderando os eventuais efeitos secundários (designadamente, a neutropénia, os efeitos carcinogénicos e a toxicidade das gónadas) e os benefícios potenciais (nomeadamente, sobre a audição e o neurodesenvolvimento);
- A terapêutica deve ser feita com valganciclovir oral, 16 mg/kg/dose de 12-12h durante 6 meses.
Estudo evolutivo
As crianças sintomáticas devem ser acompanhadas nas seguintes áreas:
- Medicina física e reabilitação para rastreio e tratamento de eventuais alterações motoras;
- Otorrinolaringologia para estudo da audição – a surdez é evolutiva e poderá não existir ainda na data do rastreio universal neonatal;
- Oftalmologia para rastreio e correcção de estrabismo convergente ou défice visual;
- Ensino especial nas crianças com défices cognitivos ou de aprendizagem.
Relativamente às crianças infectadas assintomáticas, Remington chama a atenção para a eventual necessidade do mesmo número de apoios numa fase tardia, uma vez que é altamente provável que estas crianças venham a ter surdez neurossensorial e atraso do neurodesenvolvimento, ou da linguagem.
Kimberlin recomenda exames audiológicos cada 6 meses durante 3 anos e, depois, anualmente durante mais 1 a 2 anos. Qualquer desvio da normalidade deve ser rapidamente sujeito a intervenção apropriada.
4. RUBÉOLA e HEPATITES
Importância do problema
Em comparação com as infecções descritas nas alíneas anteriores (1., 2., e 3.) os problemas respeitantes às hepatites e à rubéola são bem diferentes.
A rubéola congénita é uma raridade em Portugal (2 casos nos últimos 15 anos) e as hepatites deixaram de ter importância epidemiológica por razões diferentes: ou o RN não corre risco importante (hepatite A, prevenção conhecida), ou as mulheres em idade fértil estão protegidas/vacinadas (Hepatite B) ou pouco há ainda a fazer, a não ser vigiar (hepatite C).
Quanto à hepatite C, o quadro está em vias de melhoria nítida atendendo ao surgimento de novas terapêuticas.
Em todas as situações enumeradas nesta alínea 4., a via do parto deve seguir a da indicação obstétrica e em todas é permitido o aleitamento materno.
Rubéola
No que respeita à rubéola pode afirmar-se que o problema não é preocupante uma vez que todas as mulheres em idade fértil estão vacinadas. A vacina ficou disponível para adolescentes do sexo feminino desde 1984 e passou a universal em 1987.
Num estudo realizado na maternidade do Hospital de Dona Estefânia, em 3.100 mulheres a taxa de imunidade rondava os 95%. Com esta taxa de imunidade tão elevada o vírus não circula e não provoca doença.
A situação grave pode ocorrer quando o vírus atinge um grupo populacional não imunizado. A probabilidade de provocar doença com graves sequelas é então muito grande porque se trata verdadeiramente de um vírus “selvagem”.
Tais vírus podem ser introduzidos no País por povos vindos de outras regiões onde não são seguidos os mesmos programas vacinais. Daí a necessidade de vigilância contínua.
Hepatite A
A infecção pelo vírus da hepatite A somente tem importância clínica em Perinatologia se a infecção ocorrer no periparto ou imediatamente após o parto. Na realidade, a transmissão faz-se por via fecal-oral e a maior contagiosidade ocorre nas duas semanas que precedem o início da icterícia. Por isso, muitas vezes, o maior perigo já passou quando é feito o diagnóstico de hepatite A na puérpera. Não é conhecido o estado de portador.
Alguns autores preconizam a administração de imunoglobulina inespecífica ao RN – 0,02 mL/kg por via IM – se os sintomas maternos tiverem tido início duas semanas antes ou uma semana depois do parto; mas a eficácia desta medida não está comprovada.
É fundamental que sejam cumpridas as regras básicas de higiene, nomeadamente a preocupação por parte da mãe de uma lavagem cuidadosa das mãos.
Hepatite B
Espera-se e é desejável que cada vez mais a infecção por este vírus tenha menor importância. Com efeito, muitas mulheres em idade fértil estão já vacinadas. Desde 1995 que a vacina foi incluída no PNV para todos os adolescentes e, desde 2000, todas as crianças são vacinados ao nascer.
O problema remanescente diz respeito às mães com positividade do antigénio AgHBs, sobretudo se associada a positividade do AgHBe. Em ambas as situações, é preconizada a administração de imunoglobulina específica ao RN logo após o nascimento na dose de 1 mL por via IM.
Hepatite C
A infecção por este tipo de vírus é muito mais prevalente na população em geral do que se admitia. No que respeita aos cuidados perinatais não há indicações para qualquer medida especial ou adicional. A criança deve ser dirigida para consulta de hepatologia para ser vigiada até por volta dos 18 meses de idade.
Deve, contudo, alertar-se para dois factos:
- As novas terapêuticas poderão gerar uma nova dinâmica no que respeita à necessidade de um diagnóstico mais precoce uma vez que se admite que as crianças infectadas também possam vir a beneficiar delas;
- As novas terapêuticas poderão ser utilizadas na prevenção da transmissão vertical através da respectiva administração às grávidas positivas.
5. INFECÇÃO POR VÍRUS ZICA
Epidemiologia, etiopatogénese e importância do problema
O vírus Zica (ZIKV) foi isolado de macacos pela primeira vez em 1947 na floresta Zica no Uganda. Tal agente microbiano foi considerado um patogénio humano após terem surgido os primeiros surtos epidémicos duma doença infecciosa emergente, em 2007, nas ilhas Yap, Micronésia, no Pacífico Sul.
Ulteriormente (Maio de 2015), foi relatada a sua transmissão nas Américas do Sul e Central, Caraíbas, México e, a partir de Novembro do mesmo ano, no Sueste Asiático, Brasil (sobretudo no Nordeste) e, de novo em África, Cabo Verde. Tratando-se duma doença infecciosa emergente de enorme magnitude, disseminando-se por mais de 30 países, (e estimando-se que afectou cerca de dois milhões de pessoas no Brasil), em 2016 a OMS declarou a infecção por vírus Zica uma emergência em saúde pública a nível mundial.
O ZIKV é um arbovírus ARN da família Flaviviridae, (tal como os vírus da dengue, da febre amarela, da encefalite japonesa, da febre do Nilo Ocidental e da doença chikungunya). O vírus é transmitido por artrópodos hematófagos (mosquitos Aedes aegypti e Aedes albopictus) os quais se reproduzem em áreas com água parada e picam o ser humano, sobretudo durante o dia.
Os mosquitos podem adquirir o vírus quando picam pessoas infectadas. Após a picada do mosquito com inoculação vírica, o ZICV está presente no sangue (virémia). Viajantes infectados, regressando das zonas onde existe a doença para a zona de residência onde não existe a doença, poderão, pois, ser portadores do vírus no sangue.
Se no local de residência existirem mosquitos vectores, a transmissão de ZICV em tal contexto também é possível.
Embora o ZICV seja principalmente transmitido por mosquitos, outros modos de transmissão são possíveis: sexual, por transfusão sanguínea, por transplante de órgãos ou tecidos, e intrauterina, da mãe (infectada) para o feto, resultando em infecção congénita.
O ZICV está presente no sémen (ver adiante) e secreções vaginais após período de virémia; pode, por isso, ser transmitido por homens e mulheres para os parceiros por meio de relações sexuais, incluindo sexo vaginal e anal e, provavelmente, sexo oral.
Manifestações clínicas
Na maioria dos casos a infecção é assintomática ou cursa com sinais e sintomas ligeiros. Importa, contudo, salientar a sintomatologia mais frequentemente associada, em geral com a duração de 4-7 dias: febre, exantema maculopapular, prurido, artralgia, mialgia, conjuntivite não purulenta, e edema das extremidades. Raramente há necessidade de hospitalização e a taxa de mortalidade é muito baixa.
Muito raramente, poderá ocorrer como complicação por mecanismo autoimune, polineuropatia inflamatória – síndroma de Guillain-Barré – rapidamente progressiva, mas autolimitada.
De referir que a sintomatologia descrita é também comum nos casos de Dengue ou de Doença por vírus Chikungunya.
Se a infecção por ZICV surgir durante a gravidez, pelo efeito teratogénico do mesmo, poderá verificar-se uma embriofetopatia, com um espectro variável de manifestações que integram uma síndroma congénita por ZICV, cuja gravidade é tanto maior quanto mais precoce for a infecção da grávida.
Esta forma de infecção materno-fetal pode ter expressão variável no feto/recém-nascido. Para além das manifestações já descritas anteriormente (designadamente febrícula, exantema maculopapular, conjuntivite não purulenta), apontam-se hepatosplenomegália, defeitos congénitos vários incluindo como mais marcantes os que resultam de alterações do desenvolvimento do sistema nervosos central: microcefalia (aspecto clínico mais típico, tendo constituído um alerta aquando da epidemia no Brasil), atrofia do córtex cerebral, retinopatia, calcificações subcorticais, e sinais neurológicos diversos como contracturas.
Exames complementares
Perante a suspeita clínica, impõe-se a realização de exames laboratoriais para confirmação do diagnóstico, os quais incluem fundamentalmente:
- provas serológicas (ensaio imunoenzimático ligado à enzima [ELISA] para IgM, e a prova de neutralização por redução de placas [PRNT] para anticorpos contra ZICV);
- detecção de ARN vírico no soro por PCR-TR (PCR por transcriptase reversa); tal detecção poderá ser feita também na urina, saliva, líquido amniótico, e nos tecidos fetais.
Relativamente à prova ELISA para determinação dos níveis de anticorpos anti-ZICV, importa referir que os resultados não são específicos para ZICV, pois existe reactividade cruzada com outros flavivírus.
Segundo o CDC, define-se “caso confirmado de infecção por ZICV” através da identificação de ARN de ZIKV no plasma/soro por PCR-TR, o que somente é possível no período de tempo muito curto na sequência do período, ou em pleno período de sintomas.
O estudo analítico por PCR-TR na urina e saliva tem a vantagem de ser um método diagnóstico não invasivo, permitindo obter positividade de ARN de cerca de 93% entre 5 a 14 dias após os sintomas (portanto, probabilidade de período mais longo de positividade em comparação com o método descrito de análise no plasma ou soro).
A virémia e a virúria durante a gravidez e o período neonatal podem ter duração superior a 14 dias.
De referir que, no estado actual dos conhecimentos, se desconhece o período de tempo de permanência do vírus no organismo em caso de infecção e se da infecção resulta imunidade.
No sémen, o vírus pode manter-se por um período de 6 meses após infecção.
Prevenção e tratamento
Como medidas preventivas gerais citam-se as seguintes:
- evitar picadas de mosquitos, limitando a exposição aos mesmos;
- restringir as viagens a áreas endémicas, incluindo, claro, das grávidas;
- usar vestuário protector e repelentes de insectos;
- providenciar ambiente interior com ar condicionado;
- evitar sexo desprotegido com parceiro, eventualmente assintomático, mas contagioso, e/ou com risco de ter infecção por ZICV;
- criar a rotina de pesquisa sistemática de ZIKV no âmbito das normas de segurança nos bancos de sangue.
Como medidas preventivas específicas, cumpre referir que a vacina anti-ZIKV está em investigação, na sequência de estudos realizados no âmbito das vacinas para outros flavivírus.
No estado actual dos conhecimentos, está em estudo uma estratégia de imunoterapia passiva através da administração de anticorpos anti-ZIKV.
Quanto ao tratamento, perante a inexistência de fármacos anti-ZICV, são adoptadas medidas gerais de suporte.
6. INFECÇÃO POR CORONAVÍRUS 2/ COVID-19 – [SARS-CoV-2]
Procedendo-se à actualização desta obra em plena pandemia por COVID-19 e verificando-se casos de doença pelo referido vírus em grávidas e recém-nascidos, importa salientar alguns tópicos com base na literatura científica consultada sobre o que se apurou sobre a morbilidade em RN e a eventualidade de transmissão do agente mãe-filho (feto/RN):
- Mecanismo de infecção neonatal pouco claro. Maior probabilidade de transmissão horizontal mãe-filho, admitindo-se como pouco provável (baixo risco a transmissão vertical, embora possível.
- Na maioria dos casos o RN está assintomático. Verificando-se manifestações clínicas, as mais frequentes são dificuldade respiratória [que poderá por vezes obrigar a ventilação invasiva], vómitos, diarreia, febre, tosse e, raramente, choque.
- Resultados negativos de testes víricos por PCR realizados para SARS-CoV-2 ao nível da placenta, cordão umbilical, líquido amniótico, secreções vaginais e amostras de leite materno. Eventualmente, positividade detectada em secreções nasofaríngeas.
- Quanto a resultados de exames laboratoriais, estão descritos casos evidenciando leucocitose com linfopenia e trombocitopenia, além de elevação de creatina-fosfo-quinase MB/CPK MB.
- De acordo com a maioria dos estudos não é recomendada a separação mãe-filho.
- Admite-se que os RN poderão estar relativamente protegidos da infecção materna por transmissão passiva transplacentar de IgG com efeito semelhante ao que se obtém com transfusão de plasma de convalescente.
- Praticáveis os cuidados gerais habituais, designadamente contacto pele com pele, aleitamento materno [recomendado pela AAP] e permissível tempo retardado de laqueação do cordão.
- A eventual sintomatologia de doença neonatal é ligeira.
- À mãe devem ser aplicadas as medidas preventivas habituais, como uso de máscara e lavagem correcta das mãos.
BIBLIOGRAFIA
Adler SP. Congenital cytomegalovirus screening. Pediatr Infect Dis J 2005;24:1105-1116
Adeyinka A, Bailey K, Pierre L, Kondamudi N. COVID 19 infection: Pediatric perspectives. JACEP Open 2021;2:e12375. https://doi.org/10.1002/emp2.12375
Barbi M, Binda S, Caroppo S, Primache V. Neonatal screening for congenital cytomegalovirus infection and hearing loss. J Clin Virol 2006;35:206-209
Boscia C. Skin-to-skin care and COVID-19. Pediatrics 2020;146(2):e20201836
Bryson Y. Zica virus congenital syndrome, the new Z in TORCHZ? Prospects for diagnosis, prevention and treatment. Curr Opin Pediatr 2017;29:94-96
Carbillon L. Passive immunization against cytomegalovirus during pregnancy. N Engl J Med 2005; 29: 2818-2820
Cardoso TFJr, Santos RS, Correa RM, et al. Congenital Zika infection: neurology can occur without microcephaly. Arch Dis Child 2019;104:199-200
Coronado Munoz A, Nawaratne U, McMann D, et al. Late-onset neonatal sepsis in a patient with Covid-19. N Engl J Med. 2020;382(19):e49
Deseda CC. Epidemiology of Zica. Curr Opin Pediatr 2017;29:97-101
Dumitriu D, Ukachi N Emeruwa UN, Hanft E, et al. Outcomes of neonates born to mothers with severe acute respiratory syndrome Coronavirus 2 infection at a large medical center in New York city. JAMA Pediatr 2021;175:157-167. doi: 10.1001/jamapediatrics.2020.4298.
Fernandes C, Neto AS, Ferreira AR, Lito D, Paixão P, et al. Saliva pools for screening of human cytomegalovirus using real-time PCR. Eur J Pediatr 2021;180:1067-1072. https://doi.org/10.1007/s00431-020-03842-x
Gabaglia CR. Zica virus and diagnosis. Curr Opin Pediatr 2017;29:107-113
Gaensbauer J, Grubenhoff JA. Neonatal Herpes simplex virus infections: new data, old conundrum. Pediatrics Apr 2019, 143 (4) e20190159; DOI: 10.1542/peds.2019-0159
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gerdes JS. Clinicopathologic approach to the diagnosis of neonatal sepsis. Clin Perinatol 1991:361-381
Griffiths PD, McLean A. Emery VC. Encouraging prospects for immunisation against primary CMV infection. Vaccine 2001;8:1356-1362
Grossi-Soyster EN, LaBeaud AD. Clinical aspects of Zica virus. Curr Opin Pediatr 2017; 102-106
Gupta M, Zupancic JAF, Pursley DM. Caring for newborns born to mothers with COVID- 19: more questions than answers. Pediatrics. 2020;146(2):e20200018
Halliday HL. When to do a lumbar puncture in a neonate. Arch Dis Child 1989;64:313-316
Hamprecht K, Goelz R, Maschmann J. Breast milk and cytomegalovirus infection in preterm infants. Early Hum Dev 2005; 8: 989-996
Hamprecht K, Maschmann J, Vochem M, et al. Epidemiology of transmission of cytomegalovirus from mother to preterm infant by breastfeeding. Lancet 2001;357:513-518
Honein MA, Cetron MS, Meaney-Delman D. Endemic Zika virus transmission: implications for travellers. Lancet Infect Dis 2019;19:349-351
Hudak ML. Consequences of the SARS-CoV-2 pandemic in the perinatal period. Curr Opin Pediatr 2021;33:181-187
Instituto Nacional de Saúde Doutor Ricardo Jorge. Inquérito Serológico Nacional 2015-2016: Doenças evitáveis por vacinação. Lisboa: INSA, 2017
Iqbal A, Burrin C, Austin T. Generation COVID-19 – Should the foetus be worried? Acta Paediatrica. 2021;110:759–764
Isaacs D. Neonates and COVID-19. J Paediatr Child Health 2021;57:167-169
Jacobs K, Vu DM, Mony V, et al. Congenital syphilis misdiagnosed as suspected nonaccidental trauma. Pediatrics 2019; 144 (4) e20191564; DOI: 10.1542/peds.2019-1564
James SH, Kimberlin DW. Advances in the prevention and treatment of congenital cytomegalovirus infection. Curr Opin Pediatr 2016, 28:81-85
Karwowski MP, Nelson JM, Staples JE, et al. Zica virus disease: a CDC update for pediatric health care providers. Pediatrics 2016; 137: e20160621
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Krah NM, Hersh AL. OPAT for avoidance of hospitalisation in children. Lancet Infect Dis 2019; 19: 450-451
Lanzieri T, Chung W, Fores M, et al. Hearing loss in children with asymptomatic congenital cytomegalovirus infection. Pediatrics 2017; 139: e 20162610
Lito D, Francisco T, Salva I, Tavares MN, Oliveira R, Neto MT. Análise das serologias para infeções do grupo TORCH e do rastreio para Streptococcus do Grupo B na população de grávidas de uma maternidade. Acta Med Port 2013; 26: 549-554
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Lu C, Tsao P, Ke Y, Lin Y-H et al. Concurrent hearing, genetic and cytomegalovirus screening in newborns. J Pediatr 2018;199: 144-150
Maschmann J, Hamprecht K, Dietz K, Jahn G, Speer C. Cytomegalovirus infection of extremely low-birth weight infants via breast milk. Clin Infect Dis 2001; 33: 1998-2003
Moscoso J, Marçal M, Tuna M. SARS-CoV-2 infection in neonates: what do we know so far? Acta Med Port 2020;33:444
Neto MT, Serelha M, Nunes A, Guerreiro O, et al. Mother-related infection in Portuguese newborn infants. Neonatal Branch of the Portuguese Society of Pediatrics. J Maternal-Fetal & Neonatal Med 2002;11 (Supp 1):260
Neto MT. Group B streptococcal disease in Portuguese infants younger than 90 days. Arch Dis Child Fetal Neonatal Ed 2008; 93: 90-93
Nunes ML, Carlini CR, Marinowic D, et al. Microcephaly and Zica virus: a clinical and epidemiological analysis of the current outbreak in Brazil. J Pediatr (Rio de Janeiro) 2016; 92: 217-234
Oeser C, Ladhani S. An update on Zika Virus and congenital Zika Syndrome Paediatr Child Health 2019; 29: 34-37
Ohmer A, Honegger J. New prospects for the treatment and prevention of hepatitis C in children. Curr Opin Pediatr 2016, 28: 93–100
Oliveira J, Cunha S, Real RC, Sampaio L, Dias N, Meliço-Silvestre A. Prevalência da toxoplasmose numa população hospitalar. Rev Port D Infec 1994;17: 205-213
Özenci V, Schubert U. Earlier and more targeted treatment of neonatal sepsis. Acta Paediatrica 2019; 108: 160-170
Pasternak Y, Ziv L, Attias J, Amir J, Bilavsky E. Valganciclovir has potential benefit in children with congenital cytomegalovirus and isolated hearing loss. J Pediatr 2018;199:166-170
Peeling RW, Ye H. Diagnostic tools for preventing and managing maternal and congenital syphilis: an overview. Bulletin W H O 2004; 82: 439-46
Pereira-da-Silva LP, Neto MT (eds). New Challenges in Foetal and Neonatal Infections. Trivandru, Kerala, India: Research Signapost Editors, 2011
Peters A, Tartari E, Mai SHC, et al. 2019 WHO hand hygiene campaign and global survey: clean care for all—it’s in your hands. Lancet Infect Dis 2019; 19: 463-464
Poland GA, Ovsyannikova IG, Kennedy RB. Zika vaccine development: current status. Mayo Clin Proc 2019; 94: 2572-2586
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saunders, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Quanquin N, Wang L, Cheng G. Potential for treatment and a zica virus vaccine. Curr Opin Pediatr 2017; 29: 114-121
Rabi FA, Al Zoubi MS, Al-Iede MM, et al. Coronaviruses in children: A review of potential mechanisms of childhood protection. Acta Paediatrica. 2021;110: 765–772
Redbook. Report of the Committee on Infectious Diseases. Elk Grove Village: American Academy of Pediatrics edition, 2009
Revellon MG. Passive immunization against cytomegalovirus during pregnancy. NEJM 2005; 29: 2818-2820
Saloojee H, Velaphi S, Goga Y, Afadapa N, Steen R, Lincetto O. The prevention and management of congenital syphilis: an overview on recommendations. Bulletin WHO 2004; 82: 424-430
Salvatore CM, Han J-Y, Acker KP, et al. Neonatal management and outcomes during the COVID-19 pandemic: An observation cohort study. Lancet Child Adolesc. Health 2020 https://doi.org/10.1016/S2352-4642 (20)30235-2
Sanchez-Luna M, Colomer BF, Romero CA, et al. Neonates born to mothers with COVID-19: data from the Spanish Society of Neonatology Registry. Pediatrics 2021, 147 (2) e2020015065; DOI: https://doi.org/10.1542/peds.2020-015065
Schleiss MR. Progress in cytomegalovirus vaccine development. Herpes 2005; 12: 66-75
Schleiss MR. Role of breast milk in acquisition of cytomegalovirus infection: recent advances. Curr Opin Pediatr 2006; 18:48-52
Schmid G. Economic and programmatic aspects of congenital syphilis prevention. Bulletin WHO 2004; 82: 402-409
Silverman NS, Puliyanda D, Lehman D. Passive immunization against cytomegalovirus during pregnancy. NEJM 2005; 29: 2818-2820
Simonovich VA, Burgos Pratx LD, Scibona P, et al. A randomized trial of convalescent plasma in Covid-19 severe pneumonia. NEJM 2021;384: 619-629
Stoll B, Hansen NI, Adams-Chapman I, Fanaroff AA, et al. Neurodevelopmental and growth impairment among extremely low-birth-weight infants with neonatal infection. JAMA 2004; 292: 2357-2365
Swearingen C, Colvin ZA, Leuthner SR. Nonimmune hydrops fetalis. Clin Perinatol 2020; 47: 105-122
Tanaka-Kitajima N, Sugaya N, Futatani T, et al. Ganciclovir therapy for congenital cytomegalovirus infection in six infants. Pediatr Infect Dis J 2005; 24:782-785
Vardhelli V, Pandita A, Pillai A, Badatya SK. Perinatal COVID-19: review of current evidence and practical approach towards prevention and management. Eur J Pediatr 2021; 180:1009–1031. https://doi.org/10.1007/s00431-020-03866-3
Vochem M, Hamprecht K, Jahn G, Speer C. Transmission of cytomegalovirus to preterm infants through breast milk. Pediatr Infect Dis J 1998; 17: 53-58
Williams JEP, Bazan JA, Turner AN, et al. Reverse sequence syphilis screening and discordant results in pregnancy. J Pediatr 2020; 219: 263-266
Zallocco F, Osimani P, Carloni I, et al. Assessment of clinical outcome of children with sepsis outside the intensive care unit. Eur J Pediatr 2018; 177:1775–1783 https://doi.org/10.1007/s00431-018-3247-2