Definição e aspectos epidemiológicos
A designação de doença meningocócica engloba as situações clínicas associadas à infecção pela Neisseria meningitidis ou meningococo. Trata-se dum importante problema de saúde pública mundial, estimando-se 500.000 casos por ano, do que resultam 50.000 óbitos.
A incidência de doença meningocócica relatada pelos Centers for Disease Control and Prevention em 2006 referente aos EUA foi de 0,3 casos/100.000 habitantes e, em 2011, de 0,2/100.000; tal indicador varia conforme o grupo etário: mais elevada incidência em crianças com menos de 1 ano, – 6,4/100.000. Em determinadas zonas do mundo são atingidos valores de 14/100.000/ano. A doença invasiva aparece mais frequentemente em crianças pequenas (~ 9/100.000 no primeiro ano de vida ~ 25 casos/100.000 nos primeiros 4 meses de vida).
Em Portugal, no quinquénio 2003-2007, foram notificados 387 casos de doença meningocócica, ocorrendo 26% dos casos em crianças com menos de 1 ano, 34% entre 1-4 anos e 18% entre 5 e 14 anos. A doença tem no nosso país um carácter esporádico, com casos ocorrendo ao longo do ano, com maior frequência no Inverno e Primavera, não havendo relato de qualquer epidemia (definida como o aparecimento de > 3 casos no período de 3 meses na mesma comunidade e > 10 casos/100.000 pessoas) ou surto em anos recentes.
Os dados nacionais mais recentes da vigilância epidemiológica de base laboratorial do Instituto Nacional de Saúde Doutor Ricardo Jorge (IRJ), mostram uma redução da incidência global da doença invasiva meningocócica (DIM) de 1,99 casos por 100.000 habitantes em 2003, para 0,53 em 2014 e 0,41 em 2016. Esta descida poderá ser explicada pela natureza cíclica da doença causada pelo meningococo B e pela utilização da vacina contra o meningococo C.
De realçar que a incidência de DIM é máxima nos lactentes (com redução nos últimos anos: 24 por 100.000 habitantes de 2008 a 2013 para 15,8 em 2014), diminui de forma acentuada até a adolescência e mantém-se relativamente estável, em valores baixos, durante a idade adulta.
Na última década, o serogrupo predominante foi sempre o B, com percentagens que variaram, entre 47,9% e 90,5%, respectivamente, em 2003 e 2008.
Em 2015 e 2016, respectivamente 72,7% e 77,5% das estirpes identificadas pertenciam a este serogrupo (B), com um número total de casos tendencialmente crescente.
Os dados de distribuição por grupo etário mostram que a DIM causada pelo serogrupo B tem um perfil característico, com um pico de incidência aos 6 meses de idade. Em crianças com menos de 1 ano de idade, entre 2003 e 2013, 67,1% (159/237) dos casos de DIM causados pelo grupo B ocorreram até aos 6 meses de idade, inclusivé.
Em Portugal foram realizados dois estudos para avaliação da taxa de colonização numa população de estudantes universitários, na mesma área geográfica, em anos diferentes, utilizando a técnica da polymerase chain reaction (PCR).
No primeiro estudo, em 2012, a taxa de colonização global foi de 14,5%, correspondendo 2,5% ao grupo B. No segundo estudo, em 2016, as respectivas taxas foram 12,5% e 1,7%.
A taxa de letalidade global por DIM entre 2003 e 2014 variou entre 2,2% e 10,6% (média <> 7,0%), salientando-se que a referida taxa é crescente a partir dos 45 anos, verificando-se proporções superiores a 30%.
Situações associadas a doenças crónicas, infecções por vírus, especialmente influenza, condições precárias higiénicas, socioeconómicas e habitacionais com convívio promíscuo, exposição ao fumo do tabaco e hábitos tabágicos constituem factores de risco.
No RN a doença surge raramente.
Etiopatogénese
Considerando a relação entre hospedeiro humano e microrganismo, existem diversas variantes quanto ao efeito deste sobre aquele: 1) estado de colonização assintomática da orofaringe ou de portador; o estado de portador assintomático por um período geralmente curto é mais frequente no adolescente e adulto jovem e constitui um factor de disseminação da infecção; 2) infecções localizadas; 3) doença invasiva, sem dúvida a mais frequente e mais grave, cursando por vezes de modo agudo e fulminante, podendo conduzir à morte em poucas horas.
Na maior parte dos casos a colonização da nasofaringe resulta em resposta do organismo hospedeiro com formação de anticorpos (IgM, IgG e IgA), o que confere imunidade natural (protecção) contra diversos serótipos. Numa minoria de casos, especialmente nas crianças pequenas, N. meningitidis penetra na mucosa e, atingindo a circulação sanguínea, causa doença sistémica. A colonização intestinal de enterobacteriáceas produz o mesmo efeito de protecção (imunidade cruzada). A estirpe não patogénica (N. lactamica) confere igual protecção.
O meningococo é um diplococo Gram-negativo aeróbio, oxidase positivo e produtor de catalase. Possui um invólucro com 3 camadas (membrana citoplásmica, parede celular de peptidoglicano, e membrana externa com fosfolípidos, proteínas e lipo-oligossacárido); tal invólucro está rodeado por uma cápsula polissacarídea.
As características estruturais da cápsula determinam a existência de, pelo menos, 12 (anteriormente considerados em número de 13) serogrupos (a que correspondem diversas variantes antigénicas) de meningococo, dos quais seis – A, B, C, W (anteriormente designada W135), X, e Y – são os responsáveis pela maioria dos casos da doença sistémica.
Cada serogrupo divide-se em serótipos e subtipos em função das proteínas porinas da membrana externa (porA e porB, respectivamente), que contribuem para a virulência do microrganismo. O imunotipo é definido pela estrutura do lipo-oligossacárido/LOS ou endotoxina, crucial na cascata inflamatória activada através do Toll-like 4 receptor (TLR-4).*
*O Toll-like receptor 4 (Receptor TLR-4) é uma proteína codificada pelo gene TLR-4. Reconhecendo determinados compostos como por exemplo o lipopolissacárido (LPS), um componente presente em muitas bactérias Gram-negativas, é responsável pela activação do sistema imune inato. |
A cápsula contendo, na sua composição, polissacáridos tem capacidade para resistir à fagocitose e à acção de depuração, com a participação do ferro através da lactoferrina e transferrina.
Através de técnicas genéticas concluiu-se que existem sete linhagens hiperinvasivas, causadoras da maior parte dos casos de doença meningocócica invasiva.
De salientar a maior prevalência dos serogrupos B e C nos países industrializados (com incidência ~ 1-3/100.00 nas duas últimas décadas) e a do serogrupo A nos países em desenvolvimento, os quais têm registado incidência anual de ~ 25 casos/100.000.
A nível mundial, em diversos continentes, e relativamente aos serogrupos, verifica-se a seguinte distribuição predominante: América do Norte: B, C, Y; América do Sul, Austrália e Europa: B, C; Ásia: A, B, C; África: A, W, C, X.
Da interacção meningococo – célula endotelial – complemento resulta a produção de citocinas pró-inflamatórias- TNF-alfa, IL-1 beta, IL-7, IL-8, e activação das vias intrínseca e extrínseca da coagulação culminando em CID e vasculite difusa. O LOS, com acção antigénica, induz a produção de IL-12 e resposta de tipo Th1. São também produzidos anticorpos bacterianos contra o polissacárido capsular, as proteínas da camada externa da membrana e o próprio LOS.
A transferência de IgG materno-fetal confere protecção ao lactente nos primeiros 3 meses de vida; contudo, o défice de complemento confere risco aumentado de meningococcémia em tais crianças.
Como factores de risco de doença meningocócica grave/invasiva, descrevem-se como principais: infecção respiratória vírica prévia, défice congénito de properdina ou factor D, défice congénito de componentes terminais do complemento (C5-C9) e contacto com pessoa afectada pela doença.
Manifestações clínicas
O espectro clínico da doença meningocócica varia muito, desde o estado de portador assintomático, à forma aguda fulminante, levando à morte após escassas horas de evolução. As formas mais frequentes são a meningite (30%-50% dos casos) e a septicémia/sépsis.
Outras formas clínicas incluem bacteriémia sem sépsis, sépsis com ou sem meningite, pneumonia, bacteriémia crónica e bacteriémia oculta e infecções focais com diversas localizações.
As entidades meningite meningocócica e sépsis meningocócica, acompanhada ou não de meningite integram o conceito da chamada doença invasiva. (ver adiante “diagnóstico de meningococcémia)
Uma vez que aspectos gerais da meningite bacteriana relacionada com N. meningitidis foram abordados em capítulo anterior (meningite bacteriana pós-neonatal), o objectivo essencial deste capítulo é incidir sobre a sépsis meningocócica e outras manifestações de gravidade aparentemente intermédia.
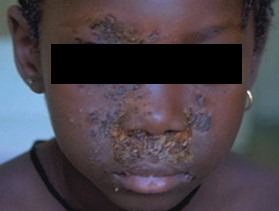
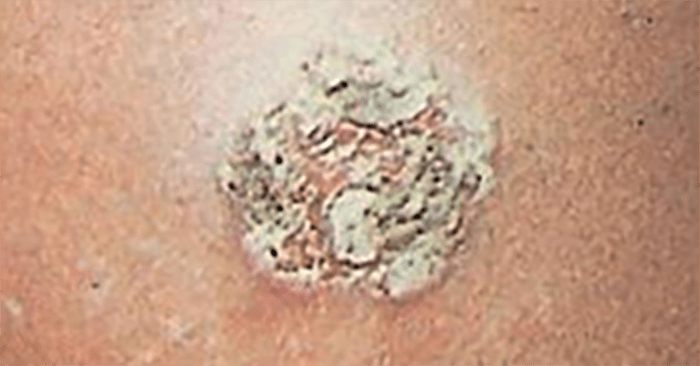
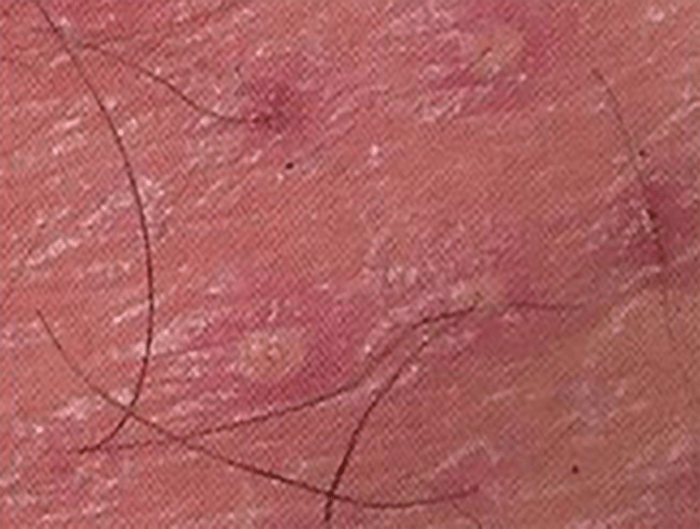
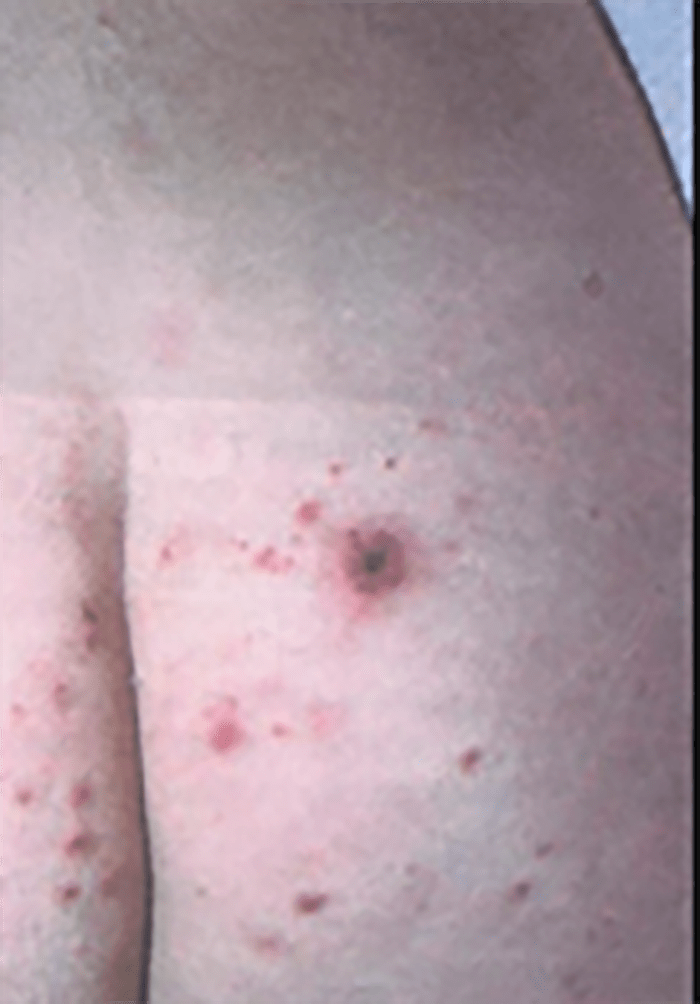
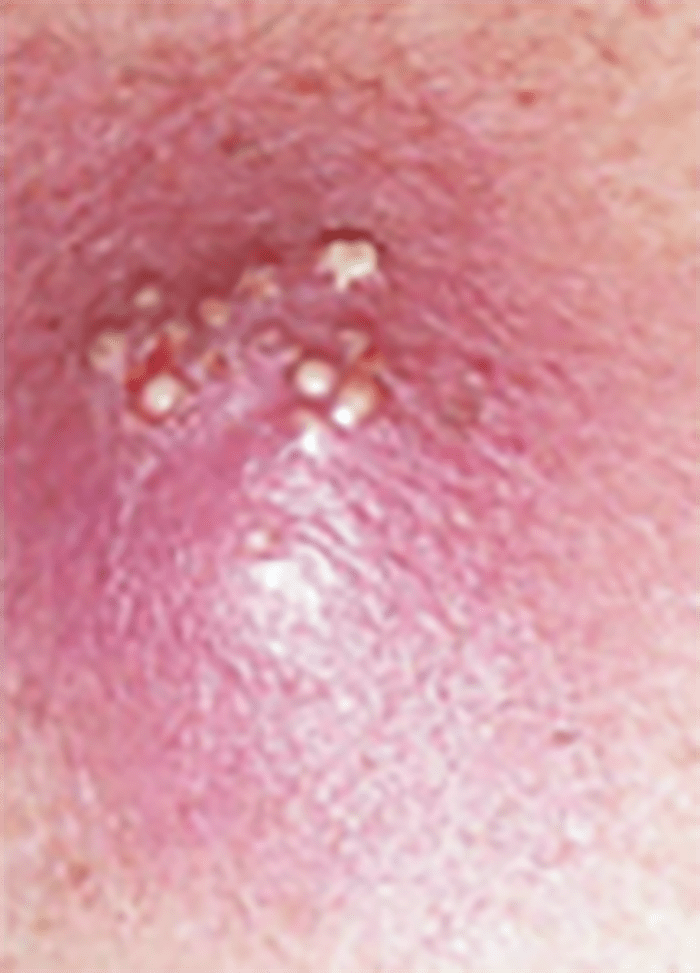
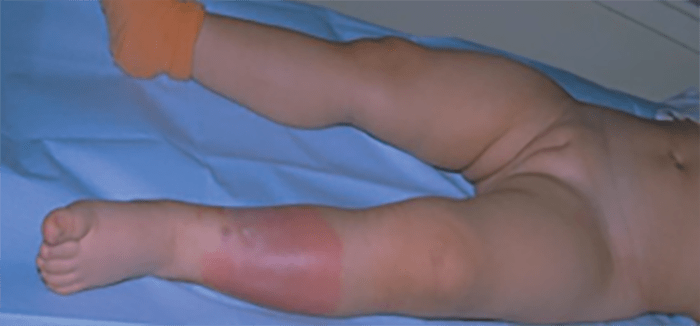
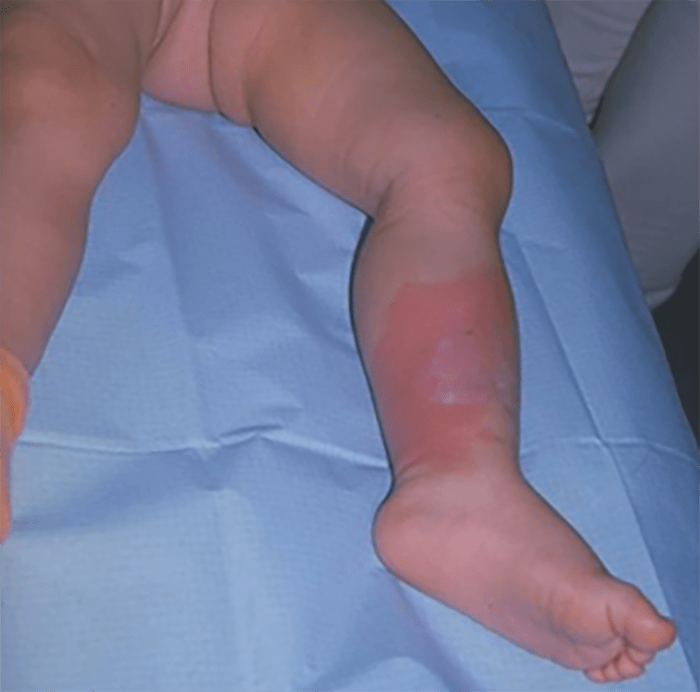
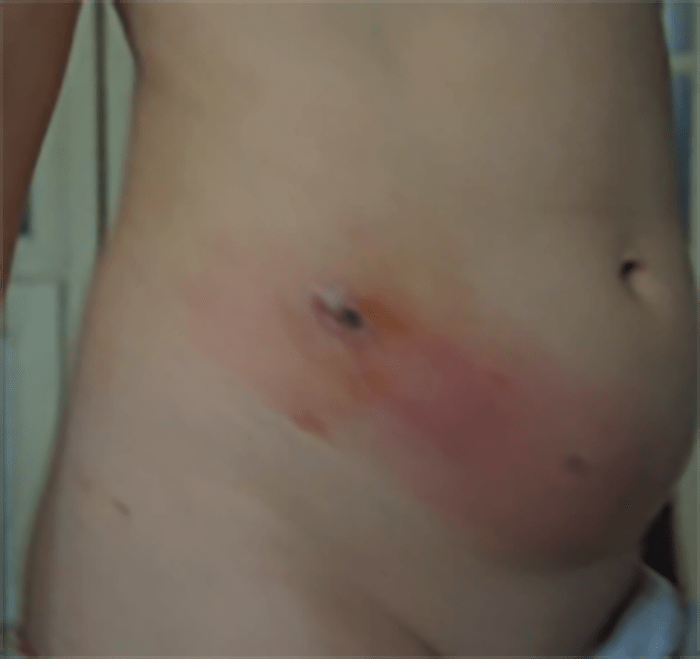
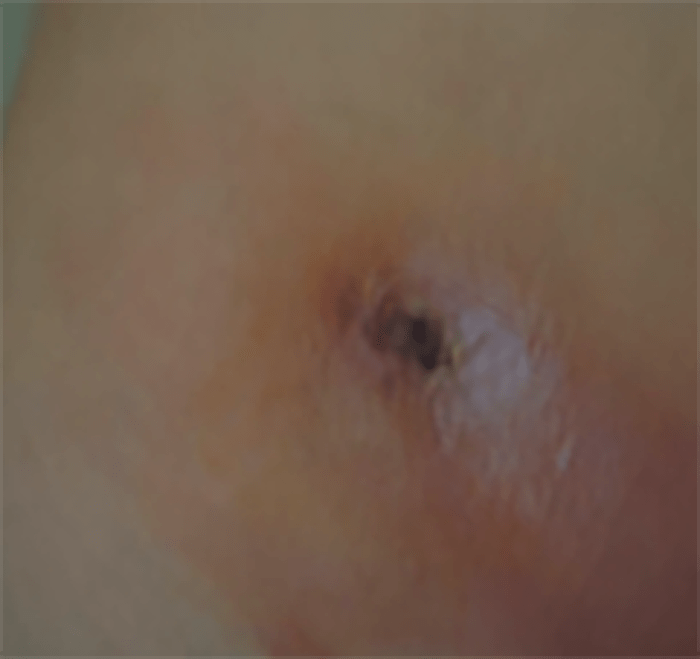
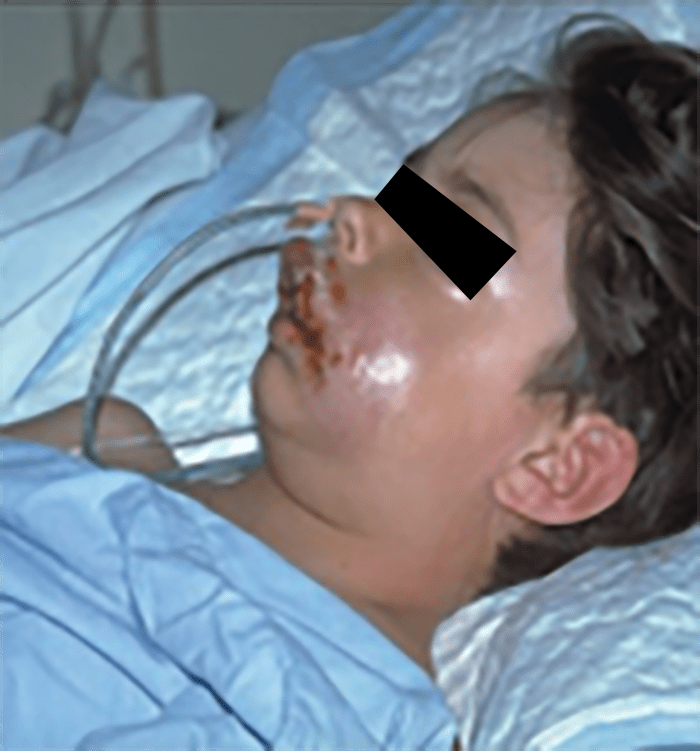
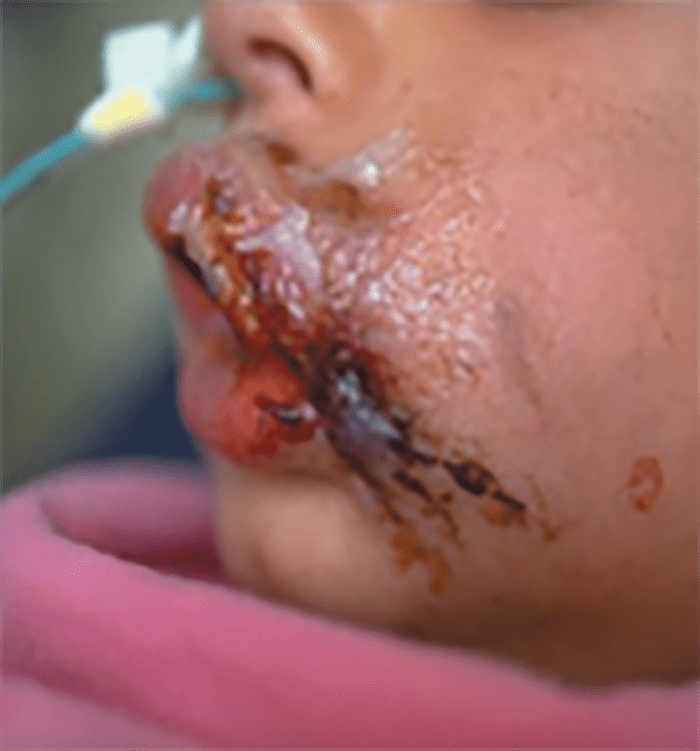
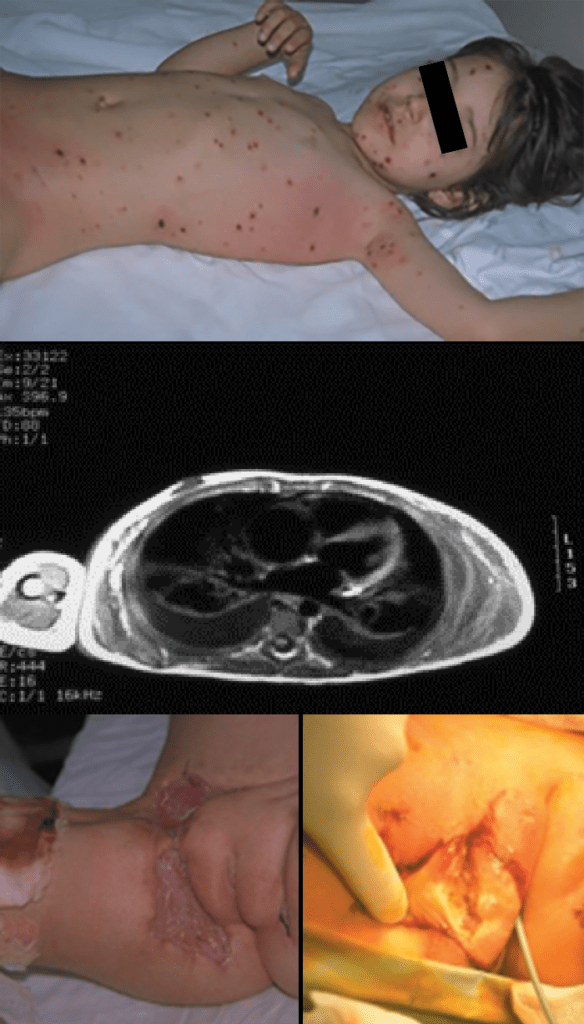
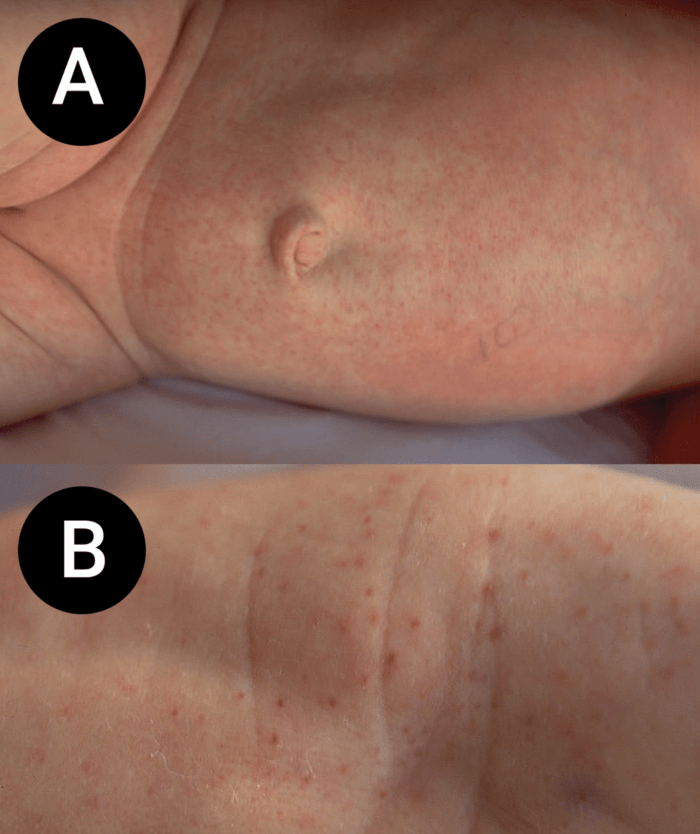
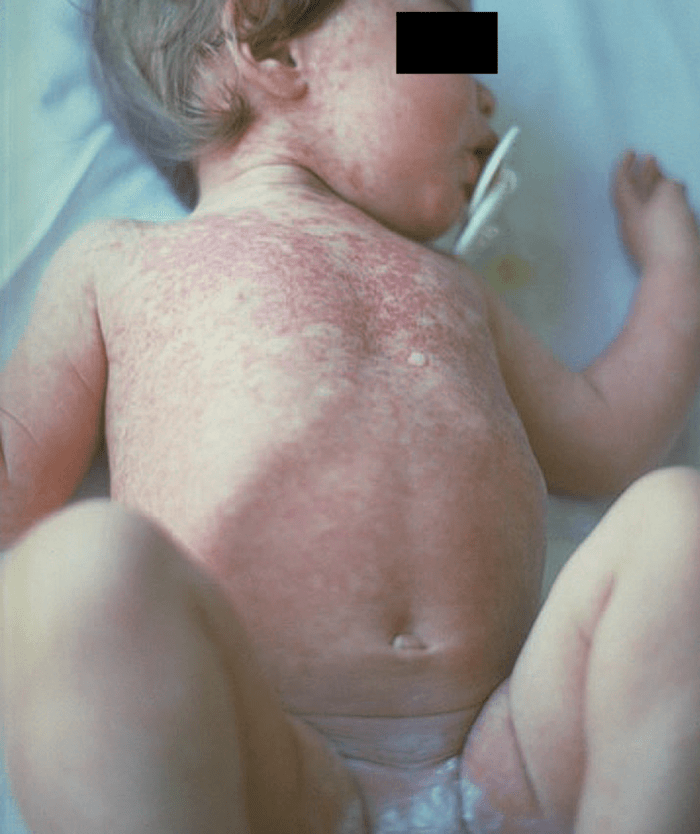
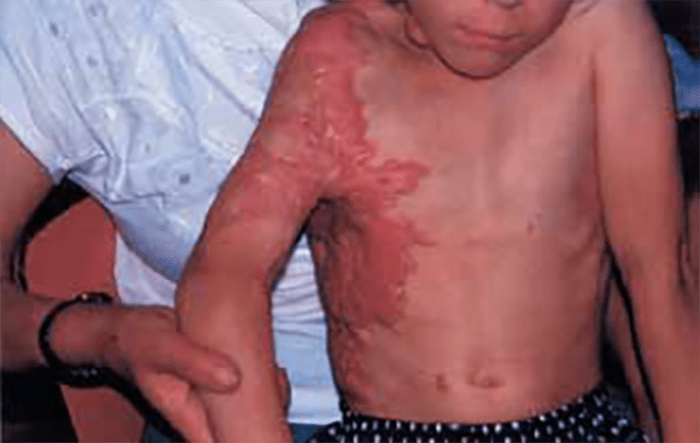
- O quadro clínico de apresentação mais comum integra a febre acompanhada de exantema petequial na proporção variável entre 28% e 77% dos casos, com predomínio no tronco e extremidades inferiores (início como exantema maculopapular convertendo-se em petéquias após algumas horas. Nos casos graves, estas lesões podem evoluir para equimoses e púrpura disseminada, embora nem todos os casos letais evidenciem exantema. A febre está geralmente associada a mialgias, calafrios, vómitos, diarreia, rinite, disfagia e artralgias; este quadro pode coincidir com o aparecimento das lesões cutâneas.
- A bacteriémia/menigococcémia oculta manifesta-se por febre associada ou não a outros sintomas, sugerindo quadro de infecção vírica. A bacteriémia poderá regredir sem antibioticoterapia, ou evoluir para meningite ou para infecção focal com diversas localizações.
- Outras manifestações incluem sintomatologia associada a infecções focais: pneumonia com ou sem derrame, artrite séptica com isolamento do meningococo do líquido sinovial, artrite reactiva, estéril, de etiopatogénese imunológica, pericardite, miocardite, etc..
- A meningococcémia crónica constitui uma forma de apresentação rara, caracterizada por febre, artralgias, aspecto geral “não tóxico”, cefaleias, e exantema. A sintomatologia é intermitente, podendo durar cerca de 6 a 8 semanas. As hemoculturas são geralmente positivas, embora inicialmente estéreis. Nos casos não tratados poderá surgir meningite.
- As manifestações que sugerem o quadro da sépsis meningocócica na sua fase inicial são: febre, lesões cutâneas, e mau estado geral de instalação aguda. Por parte do clínico, reitera-se que deverá existir um elevado índice de suspeita no âmbito da avaliação de cada caso.
Tratando-se de criança mais pequena (lactente), as lesões cutâneas associadas ao mau estado geral podem constituir a primeira suspeita. As mesmas podem ser constituídas por petéquias localizadas ou disseminadas e confluentes, purpúricas.
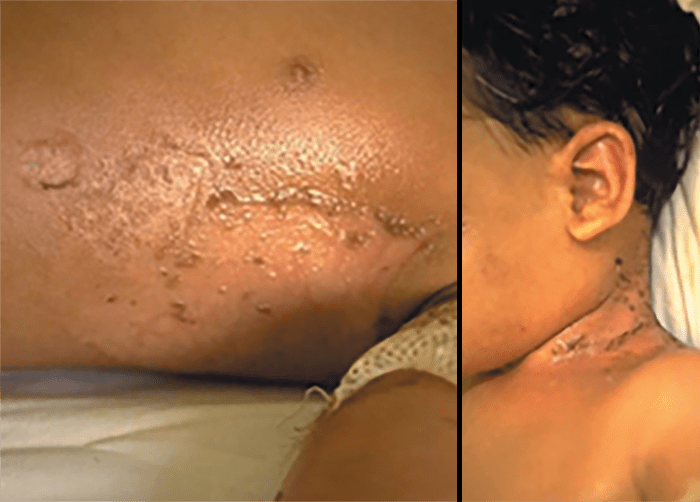
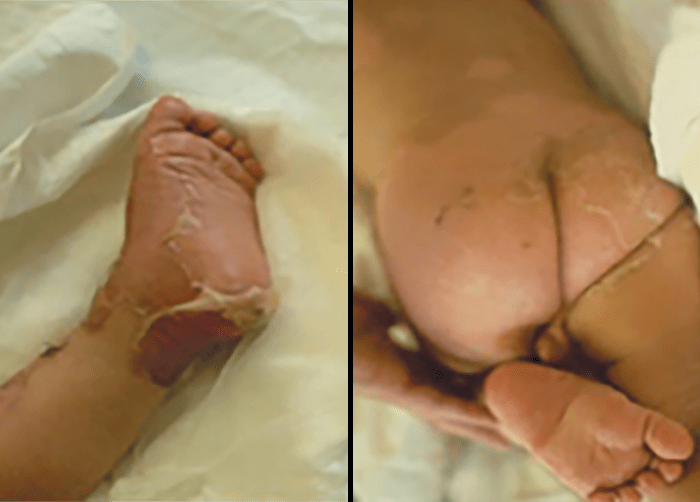
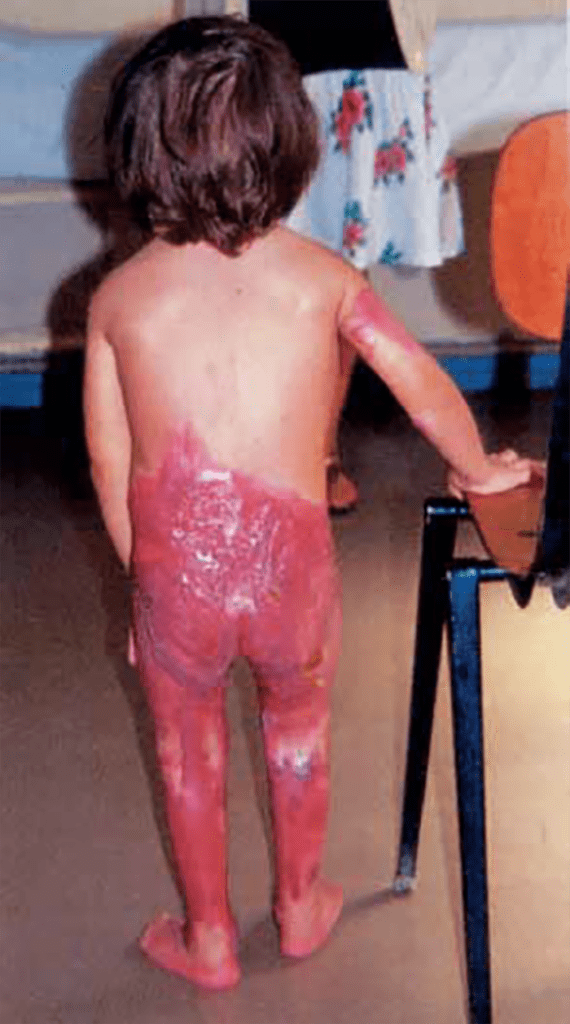
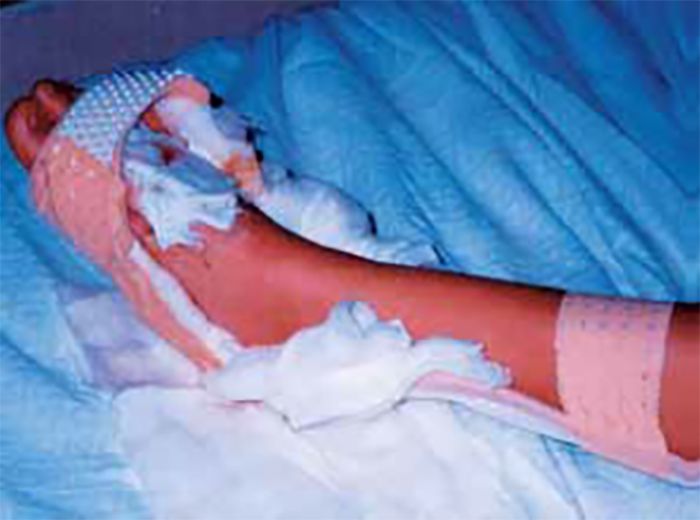
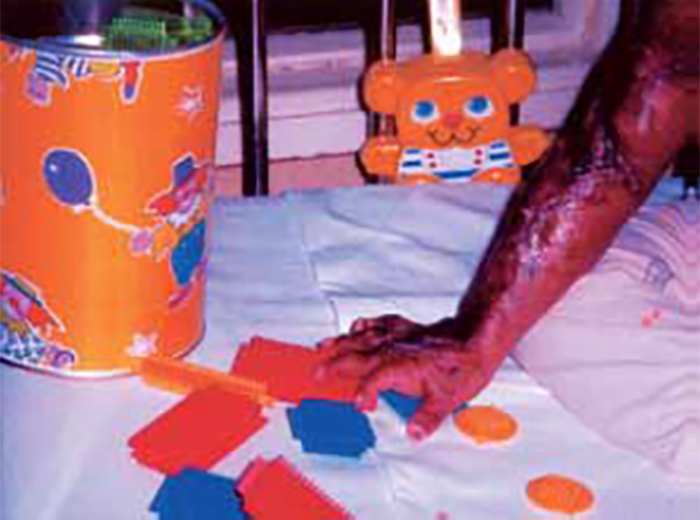
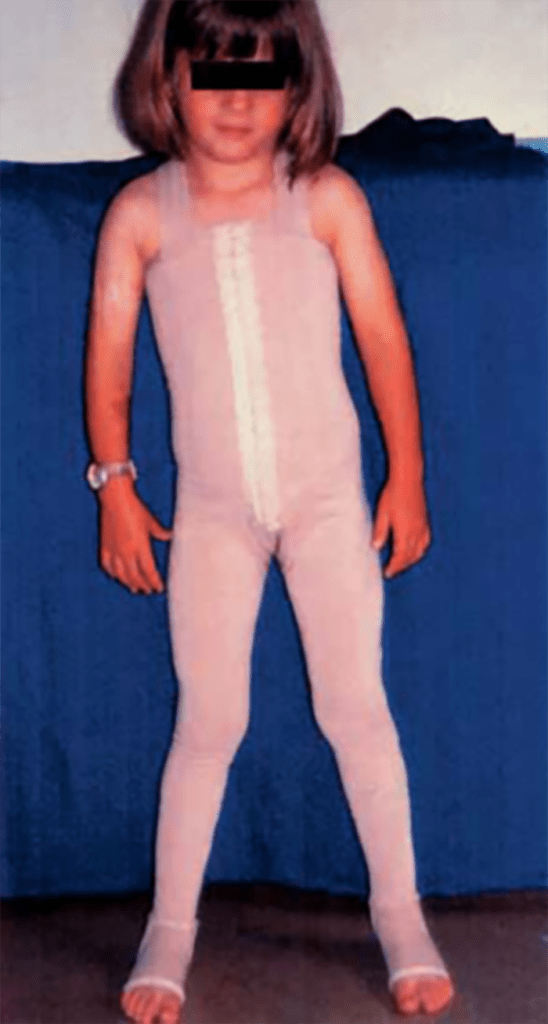
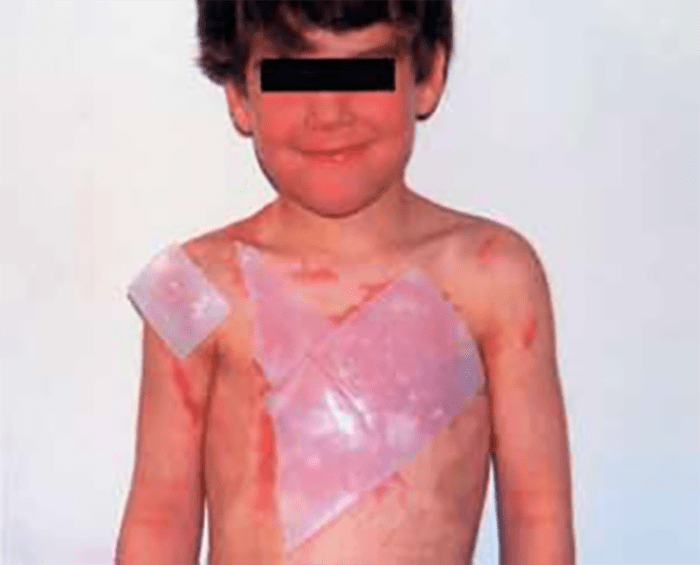
As lesões petequiais iniciais em poucas horas aumentam em número e podem evoluir para exantema purpúrico equimótico (púrpura fulminante) com consequentes sequelas de necrose em vários territórios do organismo, podendo culminar em amputação das extremidades e obrigando a enxertos. Pode deduzir-se que, quanto mais rápida a evolução, pior o prognóstico. (Figura 3 do Capítulo sobre CIVD)
O mau estado geral corresponde a situação de choque, razão pela qual é importante pesquisar os respectivos sinais (oligúria, má perfusão periférica com tempo de reposição de circulação capilar pós-compressão da pele > três segundos, taquicárdia, taquipneia) – choque compensado. Com a evolução da situação pode passar-se para a fase de descompensação do choque potencialmente fatal, traduzida essencialmente por hipotensão arterial e falência multiorgânica.
As situações acompanhadas de insuficiência suprarrenal aguda integram a chamada síndroma de Waterhouse-Friderichsen.
Salienta-se que:
- as formas subagudas e crónicas de doença meningocócica são raras (ver adiante);
- em 80% dos casos, a doença meningocócica é acompanhada de sinais clínicos sugestivos;
- o agente meningitidis é isolado do sangue em cerca de 2/3 dos casos de doença, em cerca de 50% do LCR e, em ~ 1%, do líquido articular.
Diagnóstico
O diagnóstico de meningococcémia baseia-se no isolamento da N. meningitidis do sangue, LCR, líquidos sinovial, pleural, pericárdio e lesões da pele por “técnicas de raspagem”.
Tal como noutras formas de sépsis a positividade dos exames culturais depende de vários factores, designadamente o eventual início de antibioticoterapia prévia e condições da colheita do produto a analisar.
A propósito da sépsis, cabe referir que estão indicados, em princípio, os exames complementares descritos a propósito de sépsis e meningite; salienta-se, no entanto, o interesse da PCR (técnica molecular de reacção em cadeia da polimerase) que permite aumentar a taxa de confirmação diagnóstica e quantificar a carga bacteriana com valor no prognóstico. Por outro lado, considerada a elevada probabilidade de CIVD, aconselha-se a consulta do capítulo sobre este tópico.
No que respeita a marcadores clássicos de gravidade em infecções sistémicas, determinados estudos demonstraram que, no caso da doença meningocócica, a procalcitonina (PCT) tem maior especificidade e sensibilidade que a proteína C reactiva (sigla igual à referida anteriormente para a reacção em cadeia da polimerase), considerando como valores de corte/cut off respectivamente 2 ng/mL (PCT) e 3 mg/dL (Prot CR). No que respeita à PCT, em situações de normalidade as concentrações séricas são geralmente < 0,01 ng/mL, em situações inflamatórias ligeiras, eventualmente de causa vírica raramente > 1 ng/mL, e em situações de doença menigocócica ou de infecção sistémica grave, em geral > 500 ng/mL.
Diagnóstico diferencial
O diagnóstico diferencial deve estabelecer-se com outras causas de sépsis ou meningite (por enterobacteriáceas, S. pneumoniae, S. aureus, etc.) e de exantemas petequiais relacionados com infecções víricas, infecções por S. viridans, púrpura de Henoch-Schonlein, síndroma hemolítica urémica, púrpura trombocitopénica idiopática, reacções farmacológicas, etc..
Tratamento
Os aspectos do tratamento a propósito da meningite bacteriana, choque e coagulação intravascular disseminada, são aplicáveis à sépsis meningocócica.
O tratamento empírico deve iniciar-se imediatamente ante a suspeita de doença meningocócica. De facto, o tratamento antibiótico pré-hospitalar com estabilização hemodinâmica (prioritários), seguido de transporte medicalizado para hospital com unidade de cuidados intensivos, têm contribuído para melhorar o prognóstico, diminuindo a mortalidade e as sequelas.
Sintetizam-se aqui aspectos essenciais da antibioticoterapia que, reitera-se, se deve iniciar precocemente em regime de internamento hospitalar:
→ de eleição
- penicilina G via IV (250.000-400.000U/kg/ dia IV em 4-6 doses);
- cefotaxima via IV (200 mg/kg/dia) em 4-6 doses;
- ceftriaxona via IV (100 mg/kg/dia) em 2 doses;
- ampicilina via IV (200-400 mg/kg/dia) em 4-6 doses.
→ de alternativa (se alergia grave a beta-lactâmicos)
- ciprofloxacina via IV (18-30 mg/kg/dia) em 2-3 doses;
- meropenem via IV (60-120 mg/kg/dia) em 3 doses;
- cloranfenicol via IV (75-100 mg/kg/dia) em 4 doses.
A duração varia entre 5 e 7 dias.
Notas importantes:
|
Prevenção
Medidas não imunológicas
As medidas não imunológicas incluem:
- isolamento de doentes com doença invasiva;
- quimioprofilaxia com rifampicina na dose de 20 mg/kg/dia (não excedendo 600 mg/dose), em 2 tomas diárias, durante 2 dias. No adulto a dose é 600 mg/dia, 1 toma diária. A profilaxia não é recomendada a grávidas.
Como alternativa, pode utilizar-se uma única injecção de ceftriaxona ou 1 dose oral de ciprofloxacina (neste último caso, somente a partir dos 18 anos).
Em Portugal, as infecções por meningococos são de notificação obrigatória. Todas estas medidas deverão ser comunicadas aos pais ou responsáveis pela criança, assim como a professores e educadores em geral. |
Medidas imunológicas
Em Portugal, as vacinas meningocócicas C (Men C) e B (Men B) fazem parte do actual PNV, sendo que, esta última, a partir de 2020.
Existem, também, comercializadas vacinas polissacarídeas anti-N. meningitidis dos grupos A, C, W e Y (Men ACWY- vacina conjugada tetravalente, por ex. Nimenrix®), designadamente para indivíduos residentes ou que façam viagens para áreas endémicas ou epidémicas.
A Comissão de Vacinas da Sociedade Portuguesa de Infecciologia Pediátrica, ramo da Sociedade Portuguesa de Pediatria (CV-SPP/SIP), recomenda igualmente a administração da referida vacina conjugada nas seguintes situações: as crianças e adolescentes com asplenia anatómica ou funcional, hiposplenismo, défice congénito do complemento e submetidas a tratamento com inibidores do complemento (Eculizamab).
Segundo a referida CV, a administração duma dose de Men ACWY aos 12 meses de idade dispensa a administração da Men C incluída no PNV. A mesma pode ser administrada a partir das 6 semanas de idade.
Prognóstico
A taxa de mortalidade da doença meningocócica invasiva situa-se entre 5%-10%, sendo que os óbitos se verificam predominantemente nas situações de elevada carga bacteriana infectante.
Constituem factores de mau prognóstico: hipotermia, hipertermia, hipotensão, choque, púrpura fulminante, convulsões, leucopénia, trombocitopénia, CIVD, acidose, e elevados níveis circulantes de TNF-alfa e de endotoxinas. A presença de petéquias de início precoce (< 12 horas), ausência de meningite e baixa ou normal velocidade de sedimentação, são indicadores de rápida progressão da doença e de prognóstico mau.
Após resolução de episódio de infecção meningocócica aguda está indicado o rastreio de défice de complemento, sobretudo na segunda infância e adolescência, dado o risco de recorrência de infecções graves, caso se verifique tal défice.
BIBLIOGRAFIA
Brouwer MC, Read RC, van de Beck D. Host genetics and outcome in meningococcal disease: a systematic review and meta-analysis. Lancet Infect Dis 2010;10:262-274
Carol ED, Newland P, Riordan FAI, et al. Procalcitonin as a marker for meningococcal disease diagnosis among children with fever and rash. Arch Dis Child 2002;86:282-285
Carlotti AP, Troster EJ, Fernandes JC, et al. A critical appraisal of the guidelines for the management of pediatric and neonatal patients with septic shock. Crit Care Med 2005;33:1182
Dellinger RP, Carlet JM, Masur H, et al. Surviving sepsis campaign guidelines for management of severe sepsis and septic shock. Crit Care Med 2004;32:858-873
Direcção Geral da Saúde (DGS). Doenças de Declaração Obrigatória . Lisboa: DGS, 2017
Direcção Geral da Saúde (DGS). Recomendações sobre Vacinas extra Programa Nacional de Vacinação – Actualização de 2018. Lisboa: DGS, 2018
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gardner P. Prevention of meningococcal disease. NEJM 2006; 355:1466-1473
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Helfaer MA, Nichols DG. Roger´s Handbook of Pediatric Intensive Care. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins, 2009
Javouhey E, Baudin F, Hees L, Gillet Y. Infections invasives à méningocoque chez l’enfant. J Pédiatrie Puéricult 2019;32:232-251
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Marshall HS, et al. Meningococcal B vaccine and meningococcal carriage in adolescents in Australia. NEJM 2020;382:318-327
Mathew S, Overturf GD. Complement and properdine deficiencies in meningococcal disease. Pediatr Infect Dis J 2006;25:255-256
Mbaeyi SA, Joseph SJ, Blain A, et al. Meningococcal disease among college-aged young adults: 2014-2016. Pediatrics 2019:143: e20182130; DOI: 10.1542/peds.2018-2130
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Pace D, Pollard AJ. Meningococcal disease: clinical presentation and sequelae. Vaccine 2012;30S:B3-B9
Pizarro CF, Troster EJ, Damiani D, Carcillo JA. Absolute and relative adrenal insufficiency in children with septic shock. Crit Care Med 2005;33:855-859
Russel JA. Management of sepsis. NEJM 2006;355:1699-1713
Varandas L, Prata F. Recomendações extra- PNV. Lisboa: Sociedade de Infecciologia Pediátrica, 2016
Welch SB, Nadel S. Treatment of meningococcal infection. Arch Dis Child 2003;88:608-614
World Health Organization. Meningococcal vaccines: WHO position paper. Wkly Epidemiol Rec 2011:47:521-540
Yazdankhan S, Caugant DA. Neisseria meningitides: an overview of the carriage state. J Med Microbiol 2004;54:821-832