Definição e importância do problema
As infecções de pele e tecidos moles são processos inflamatórios que podem atingir todas as camadas da pele (epiderme, derme, folículos pilosos, hipoderme* e tecido celular subcutâneo).
Trata-se de patologia frequente em todas as idades pediátricas, correspondendo a cerca de 25% dos motivos de recurso aos serviços de urgência e de ambulatório. O diagnóstico precoce é fundamental, pois sem tratamento a morbilidade e mortalidade associadas são elevadas. Globalmente, Staphylococcus aureus e Streptococcus pyogenes são os agentes mais frequentes; no entanto, são raras as entidades clínicas exclusivamente associadas a um destes agentes.
A lista de causas de infecções bacterianas da pele é extensa; neste capítulo são focadas as situações mais comuns e apenas as infecções bacterianas, tendo em conta a localização, profundidade, agente etiológico e clínica. (Quadro 1)
* As paniculites (ou hipodermites) são quadros clinicopatológicos em que se verifica inflamação do panículo adiposo (hipoderme) de etiopatogénese diversa (infecções, doenças inflamatórias e administração de fármacos). Por vezes associadas a vasculite, nesta obra optou-se pela inclusão de tal nosologia na Parte sobre Reumatologia. |
QUADRO 1 – Infeções da pele e tecidos moles: estruturas atingidas e microrganismos envolvidos
| Estrutura | Microrganismos | ||
| Impetigo | Simples | Epiderme | Staphylococcus aureus Streptococcus pyogenes |
| Bolhoso | S. aureus | ||
| Síndroma da Pele Escaldada | Sistémico | S. aureus | |
| Éctima | Epiderme/Derme | Streptococcus pyogenes/S. aureus | |
| Éctima gangrenosa | Epiderme/Derme | Pseudomonas aeruginosa | |
| Dermatite perianal | Epiderme | S. pyogenes/S. aureus | |
| Foliculite | Folículo piloso superficial (epiderme e derme) | S. aureus Staphylococcus coagulase negativos Klebsiella spp Enterobacter spp Escherichia coli Pseudomonas aeruginosa Proteus spp | |
| Furúnculo | Folículo piloso profundo (derme e hipoderme) | S. aureus | |
| Carbúnculo | Bacillus anthracis | ||
| Erisipela | Derme Tecido celular subcutâneo (Vasos linfáticos) | S. pyogenes Streptococcus grupo B, C e G S. aureus Streptococcus pneumoniae | |
| Celulite | Hipoderme Tecido celular subcutâneo | S. pyogenes S. aureus Haemophilus influenzae tipo b Streptococcus pneumoniae | |
| Abcesso e Fleimão | Derme e hipoderme | S. aureus S. pyogenes | |
| Fascite Necrotizante | Tecido celular subcutâneo Fáscia | S. pyogenes S. aureus Polimicrobiano | |
| Gangrena Gasosa | Hipoderme Tecido celular subcutâneo | Clostridium perfringens | |
| Piomiosite | Músculo | S. aureus S. pyogenes Streptococcus pneumoniae | |
Aspectos semiológicos
Para melhor compreensão da terminologia relacionada com as infecções da pele e dos tecidos moles a analisar, importa ter em consideração alguns aspectos semiológicos.
Lesões cutâneas primárias
- Sem relevo na superfície cutânea, atingindo a epiderme e derme (mancha ou mácula).
- Com relevo na superfície cutânea.
a) sólidas (sem conteúdo líquido)
- pápula (atingindo a epiderme e derme);
- nódulo (atingindo a epiderme, derme profunda até à hipoderme);
- tumor (semelhante ao nódulo, mas de maiores dimensões.
b) com conteúdo líquido (atingindo a epiderme ou derme e epiderme)
- vesícula;
- bolha ou flictena;
- pústula.
Entre pápulas, nódulos e tumores existem principalmente diferenças quantitativas; assim sucede entre vesícula e bolha (ou flictena). A pústula refere-se à natureza do conteúdo líquido (pus).
A Figura 1 e o Quadro 1 ilustram esquematicamente as principais formas clínicas de infecção da pele e tecidos moles.
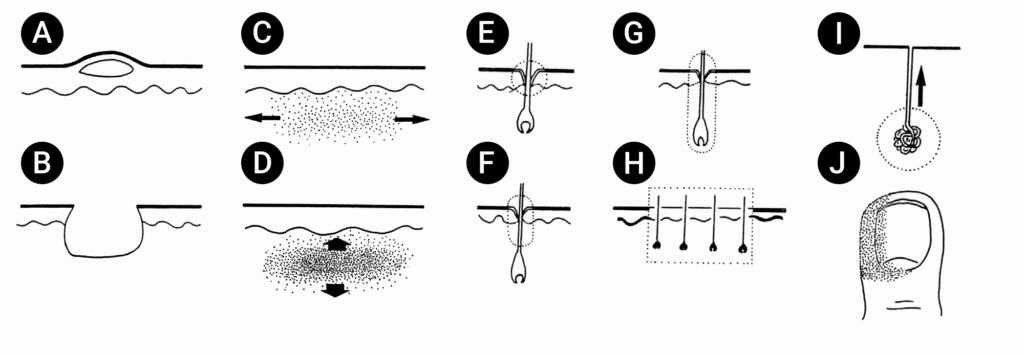
| A – Impétigo | B – Éctima | C – Erisipela | D – Abcesso e fleimão | E – Ostiofoliculite | F – Foliculite | G – Furúnculo | H – Antraz | I – Hidrosadenite | J – Perioniquia |
FIGURA 1. Principais formas clínicas das infeções da pele e tecidos moles.
Lesões cutâneas secundárias
- Escama (pequena lâmina epidérmica seca que se destaca da superfície da pele em caso de perturbação da sua queratinização).
Conforme o tamanho e aspecto, as escamas podem ser farinosas, furfuráceas, pitiriásicas e psoriásicas). - Crosta (pequena formação sólida constituída na superfície da pele ou de uma mucosa por serosidade, sangue ou pus secos.
- Escoriação ou erosão (perda de substância limitada às camadas superficiais da pele, de uma mucosa ou de uma membrana superficial tal como a córnea). Na pele pode ser provocada por coceira.
- Fenda ou fissura (solução de continuidade ou abertura estreita e linear).
- Ulceração (processo patológico que leva à formação de úlcera ou a própria quando está em vias de constituição); o conceito, em comparação com escoriação, implica maior profundidade e maior dificuldade de cicatrização.
- Cicatriz (tecido fibroso neoformado substituindo perda de substância, tecido inflamatório, ou reunindo as partes divididas duma ferida ou uma incisão operatória).
- Atrofia (redução das dimensões de tecido ou de lesão anterior).
Etiopatogénese
Microbiota cutânea
O termo colonização refere-se à presença de microrganismos na pele, sem sinais ou sintomas associados. As bactérias colonizadoras podem ser residentes ou comensais; raramente condicionando doença, constituem a maior parte da microbiota dita normal ou saprófita (Staphylococcus epidermidis e Propionibacterium acnes). As bactérias transitórias ou contaminantes provêm da flora patogénica do meio ambiente (S. aureus, Streptococcus spp, microrganismos entéricos gram-negativos e Candida albicans) que se multiplicam e persistem na pele por tempo variado e podem causar doença ao hospedeiro. Esta distinção tem implicações clínicas importantes na interpretação dos resultados dos exames bacteriológicos cutâneos visto que, por vezes, é difícil distinguir entre colonização e infecção secundária.
Mecanismos de defesa
A pele íntegra constitui uma barreira anatómica eficaz contra a infecção. Fissuras ou escoriações, que podem ter múltiplas causas – picada, mordedura, traumatismo, queimadura, infecções (varicela), infestações e lesões de coceira (escabiose), ou ainda dermatoses primárias (eczema ou psoríase) – são a porta de entrada para múltiplos microrganismos que predispõem a infecção. São também factores predisponentes importantes as síndromas de imunodeficiência congénita ou adquirida, prematuridade, diabetes mellitus e terapêutica imunossupressora (por ex. corticoterapia).
Para além de barreira anatómica, a pele também funciona como barreira imunológica, integrando mecanismos de imunidade inata e adaptativa. A resposta inata, a linha de defesa inicial contra os microrganismos patogénicos, é rápida, inespecífica e limitada. Os queratinócitos da epiderme produzem péptidos cutâneos microbicidas em resposta a padrões moleculares associados a patogénios (PAMP ou DAMP) e citocinas pro-inflamatórias (IL-1, IL-6, TNFa) em resposta à infecção. As células de Langerhans integram no citoplasma os microrganismos e produzem Il-1b, Il-6. Esta resposta integra ainda a produção de citocinas imunomoduladoras (IL-10, TGF-β) (que mantêm a integridade da barreira), proteínas do complemento (promovendo a opsonização de microrganismos extracelulares), células fagocitárias (neutrófilos e macrófagos), células Natural Killer e outras células “promovendo a apresentação” de antigénios.
Sendo a resposta imune inata a primeira linha de defesa, a resposta imune adaptativa é mais tardia, específica para o antigénio e com capacidade de memória. Em infecções da pele a resposta imunitária adaptativa é efectuada principalmente por células T e anticorpos IgE. Em resposta aos antigénios apresentados pelas células dendríticas, as células T activadas expandem-se e formam vários subtipos, de que se destacam as células T CD4+, Th1, Th2, Th17 e Tregs.
Patogenicidade
Sendo os agentes S. aureus e S. pyogenes os principais microrganismos responsáveis pelas infecções da pele e tecidos moles, é importante salientar os principais mecanismos de patogenicidade.
S. aureus – adere à pele e, na presença de lesão, pode invadir o epitélio, atingir os tecidos mais superficiais e estender-se aos mais profundos, causando infecção. Este patogénio tem capacidade de produção de múltiplos factores de virulência, nomeadamente diferentes toxinas – enterotoxinas, TSST-1(toxic shock syndrome toxin-1) e toxinas esfoliativas (A e B) – que funcionam como superantigénios e induzem resposta inflamatória sistémica que é responsável pelas manifestações clínicas características do processo infeccioso. A leucocidina de Panton-Valentine (LPV) é uma citotoxina particularmente virulenta que provoca destruição leucocitária e necrose tecidual; tem sido encontrada nas infeções mais graves. A resistência à meticilina – S. aureus meticilino-resistente (SAMR) – tem aumentado nos últimos anos, principalmente no âmbito dos cuidados de saúde, mas também na comunidade. Pode estar associada a um aumento de virulência relacionada com vários factores, como a produção da toxina LPV. Esta capacidade de resistência é conferida pela PBP2a (penicillin-binding protein 2a), que é codificada pelo gene mecA.
S. pyogenes – adere à superfície das células do hospedeiro e invade as células epiteliais, utilizando uma variedade de estratégias para se difundir e causar infecção. A virulência deste organismo depende sobretudo da proteína M que promove a adesão, confere resistência à fagocitose e ilude a resposta inata do organismo. Com base nesta proteína de superfície, com características antigénicas, estão identificados cerca de 200 serótipos distintos, sendo que os tipos associados a infecções cutâneas raramente causam faringite. Existem outros mecanismos de evasão como a cápsula de ácido hialurónico, exotoxinas, hemolisinas estreptocócicas O e S, leucocidina, estreptoquinase, desoxirribonuclease, hialuronidase, peptidase C5a e estreptodornase – descritos noutro capítulo.
Actualmente tem surgido o conceito de reguladores da expressão de factores de virulência, os quais controlam de forma complexa a síntese destes factores ao longo do tempo e sob determinadas situações, como o designado CovRS. A transmissão de infecções estreptocócicas e estafilocócicas faz-se sobretudo por contacto direto.
Formas clínicas
1. Impetigo
Trata-se duma infecção superficial da epiderme, muito contagiosa, caracterizada por vesículas, pústulas e posteriormente crostas. É a infecção cutânea mais frequente na idade pediátrica, correspondendo a cerca de 10% de todos os problemas dermatológicos. Descrevem-se duas formas de impetigo: – o superficial simples não bolhoso, que é o mais frequente (70% dos casos); e – o impetigo bolhoso.
Impetigo não bolhoso
O impetigo superficial simples não bolhoso corresponde a uma infecção superficial da pele, com atingimento da epiderme. Tem uma incidência máxima entre os 2 e os 5 anos, sendo raro abaixo dos 2 anos.
Atinge preferencialmente crianças e jovens em condições precárias de higiene ou classe social baixa. Tem maior prevalência no verão e em climas tropicais (quente e húmido) e pode ocorrer em epidemias familiares ou em escolas e infantários.
O agente etiológico mais frequente é S. aureus, seguido por S. pyogenes. Em cerca de 15% dos casos de impetigo, estes dois microrganismos encontram-se associados.
Clinicamente estas duas entidades são de muito difícil distinção. As lesões típicas começam na face, com predomínio periorificial, ou membros inferiores, em pele previamente traumatizada; inicia-se por uma lesão maculopapular eritematosa que rapidamente evolui para vesícula e pústula com crosta do tipo “cor de mel”. Habitualmente de diâmetro inferior a 2 cm e com halo eritematoso não é dolorosa, evoluindo com prurido ocasional e sem repercussão sistémica. Na maioria dos casos pode ter associada adenopatia regional.
Ao fim de algum tempo as crostas destacam-se e, na superfície da pele, pode surgir ligeira descamação e alteração da pigmentação, sem ulterior formação de cicatriz (Figura 2). O diagnóstico é clínico e o diagnóstico diferencial inclui infecções por herpes, tinha e eczema agudizado.
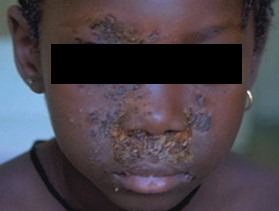
FIGURA 2. Impetigo.
Impetigo bolhoso
O impetigo bolhoso tem maior incidência em lactentes e crianças pequenas. É causado quase exclusivamente por uma toxina esfoliativa produzida por S. aureus (cerca de 80% pertence ao grupo fágico II, produtor da toxina epidermolítica A e B).
Surgindo vesículas em pele previamente sã, as mesmas rapidamente aumentam de tamanho e formam bolhas transparentes, de parede fina, flácida, não dolorosas, habitualmente de diâmetro superior a 1 cm, com conteúdo amarelo claro (Figura 3) que se pode tornar turvo e purulento. A ruptura da bolha deixa uma base eritematosa e húmida que posteriormente seca e fica com um aspecto acastanhado e brilhante (Figura 4).
Tratamento
O impetigo dissemina-se a outras zonas do corpo por autoinoculação, pelo que é importante respeitar certos princípios gerais; o objectivo é evitar a propagação e recidiva, assim como limitar as probabilidades de transmissão. As lesões devem ser lavadas com água e sabão ou antissépticos, e eventualmente tapadas. O tratamento tópico é lícito nas lesões localizadas, com ácido fusídico ou mupirocina, durante 5 a 7 dias. Havendo ineficácia do tratamento tópico, lesões múltiplas e dispersas, localização periorificial (olhos e boca), ou outros casos de impetigo em familiares ou conviventes, está indicada a antibioticoterapia sistémica durante 5 a 7 dias. O antibiótico de primeira linha é a flucloxacilina oral 50-100 mg/kg/dia de 8 em 8 horas. Como tratamento de segunda linha, ou havendo suspeita de infecção por S. pyogenes, deve optar-se pela amoxicilina com ácido clavulânico, sendo 50 mg/kg/dia de amoxicilina de 8 em 8 horas. Apesar de raros, nos casos de alergia à penicilina, poderá optar-se pela clindamicina (20 a 40 mg/kg/dia), ou por uma cefalosporina de 1ª geração como a cefradina (25-100 mg/kg/dia) (este princípio também é válido para as patologias descritas adiante).
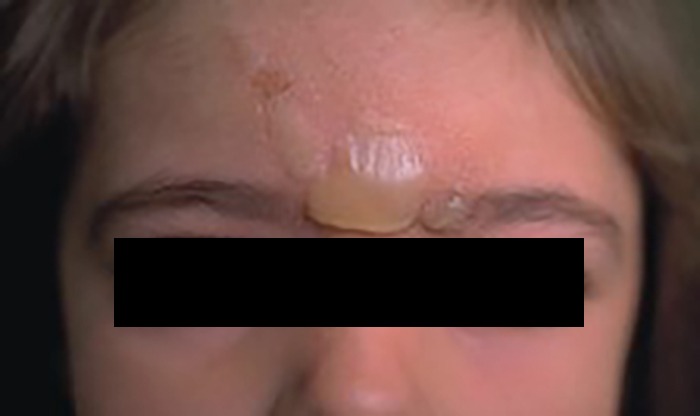
FIGURA 3. Impetigo bolhoso.

FIGURA 4. Impetigo bolhoso após ruptura da bolha.
Quando não tratado, pode curar sem sequelas ou evoluir durante semanas em surtos sucessivos. Em menos de 10% dos casos evolui para infecções mais profundas, como celulite e linfadenite. O aparecimento de glomerulonefrite está relacionado com as estirpes estreptocócicas nefritogénicas (sobretudo tipo M 2, 31, 49, 53, 55, 56, 57 e 60), surgindo 10 a 21 dias após o aparecimento do impetigo. Pelo contrário, as infecções cutâneas por Streptococcus não estão associadas a ulterior febre reumática.
O impetigo é uma doença de evicção escolar; a lesão deve ser coberta e a evicção deve ser concretizada até 24 horas após o início da antibioticoterapia.
Nos casos de impetigo recorrente deve-se considerar a pesquisa de colonização por S. aureus (ver abcessos recorrentes).
2. Síndroma da pele escaldada estafilocócica
Considerada a variante sistémica do impetigo bolhoso, é causada pelas toxinas esfoliativas A e B produzidas por S. aureus, afectando geralmente crianças até aos 5 anos. (Figura 5)
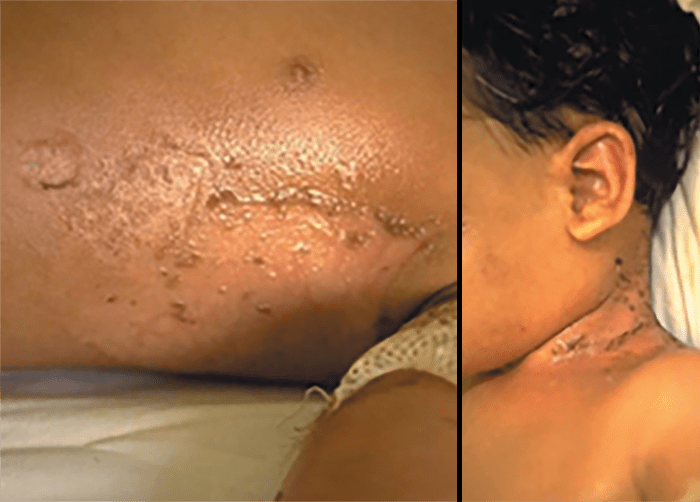
FIGURA 5. Síndroma de pele escaldada.

FIGURA 5A. Escarlatina estafilocócica.
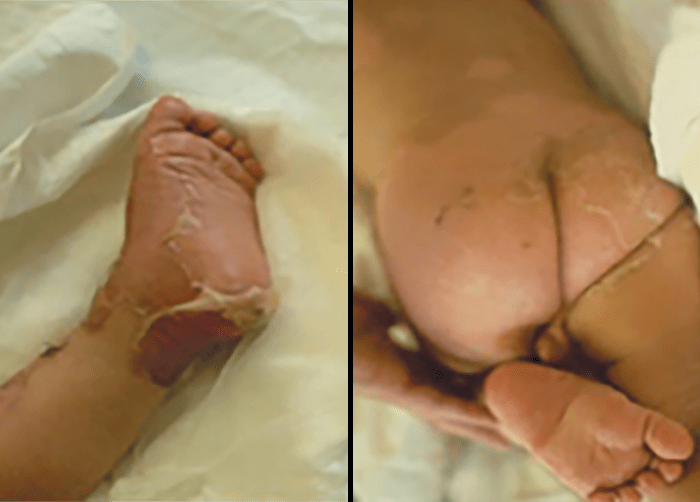
FIGURA 6. Síndroma de Ritter.
Tem início súbito, habitualmente, após uma infecção estafilocócica primária (umbigo, conjuntiva). Caracteriza-se por mau estado geral aparente, febre alta, prostração, eritema difuso e doloroso, tipo escarlatiniforme. Verifica-se descamação superficial da pele ao toque (sinal de Nikolsky, correspondendo à clivagem epiderme-derme, característica desta situação); a evolução é muito rápida, com aparecimento de bolhas de conteúdo claro em grandes áreas da pele; após rotura evidenciam uma base eritematosa que cicatriza com restitutio ad integrum.
No RN este quadro clínico, surge entre o 4º e 10º dia de vida, por vezes assumindo carácter epidémico nas unidades neonatais; é denominado síndroma de Ritter ou impetigo neonatal. Traduz-se por descolamento epidérmico de grandes áreas do corpo. Por vezes surge septicemia, pneumonia e meningite. (Figura 6)
Dada a gravidade clínica e possibilidade de complicações, a síndroma da pele escaldada estafilocócica exige internamento hospitalar. A pele requer os mesmos cuidados que a de um grande queimado: deve ser mantida limpa e húmida com compressas esterilizadas embebidas em soro fisiológico, e aplicação de emoliente em função do contexto clínico. A assepsia deve ser rigorosa, usando sempre material esterilizado. A antibioticoterapia sistémica IV, está sempre indicada, sendo a primeira escolha a associação de flucloxacilina, 150-200 mg/kg/dia de 6 em 6 horas, com clindamicina, 40 mg/kg/dia de 6 em 6 horas (este último antibiótico inibindo a síntese da toxina bacteriana), durante 10 a 14 dias.
Com o tratamento adequado a recuperação habitualmente é rápida; no entanto, por vezes são necessárias medidas de ressuscitação e suporte hemodinâmico. É essencial ter em atenção as complicações, nomeadamente alterações hidroelectrolíticas, perturbações da termorregulação e infecções bacterianas secundárias graves.
Nota importante: A chamada escarlatina estafilocócica tem afinidades com a síndroma de pele escaldada; com efeito, a sua etiopatogénese está também relacionada com a toxina epidermolítica estafilocócica. Manifesta-se em crianças mais velhas e com maior experiência imunológica: febre, eritrodermia difusa, dolorosa e áspera, não evidenciando – ao contrário da escarlatina estreptocócica – nem “língua de fambroesa” nem petéquias no véu do paladar. Evolui para descamação em grandes retalhos. (Figura 5A) |
3. Éctima
A éctima é uma infeção ulcerosa da pele, atingindo a epiderme e derme. Surgindo, sobretudo em crianças e idosos, tem como localização mais frequente os membros inferiores. É causada por S. pyogenes, sendo que o agente S. aureus também poderá actuar secundariamente com efeito sinérgico e contribuir para manutenção da infecção.
Trata-se duma situação semelhante ao impetigo, com evolução mais arrastada e erosão da epiderme, levando à ulceração e atingimento da derme. (Quadro 1) Frequentemente surge num local traumatizado, forma-se uma vesícula ou vesicopústula que se cobre de crosta dura, necrótica, elevada e aderente. Cura com formação de cicatriz, geralmente pouco evidente (Figura 7). O tratamento, semelhante ao do impetigo, deve ser sistémico.
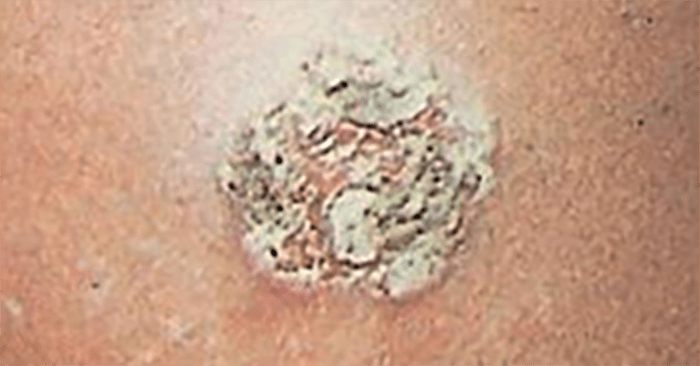
FIGURA 7. Éctima.
A éctima deve ser distinguida da éctima gangrenosa, que tem uma apresentação mais exuberante, com bacteriémia e múltiplas lesões na pele que correspondem a vasculite necrosante bacteriana. Esta entidade tem sido associada a infecção por Pseudomonas aeruginosa e é rara em crianças saudáveis; por isso, quando presente, deve ser feito estudo para detecção de imunodeficiência primária (IDP) subjacente.
4. Dermatite perianal
É uma infeção superficial da epiderme, localizada e bem delimitada na região perianal, muito contagiosa. Mais frequente em crianças entre os 6 meses e os 10 anos, com maior frequência entre os 3 e 5 anos, e predomínio no sexo masculino (70%).
Causada classicamente por S. pyogenes, nos últimos anos tem-se verificado incremento do número de casos por S. aureus.
Clinicamente cursa com eritema perianal (90%) bem delimitado, sem induração, e confluente com o orifício anal.
Posteriormente, na ausência de tratamento, começam a aparecer fissuras dolorosas, com dejecções mucosas e placas “cor de mel” na periferia. Pode estar associada a prurido (80%), dor (50%) e, em 1/3 dos casos, pode haver fezes com sangue.
Em geral não se verifica elevação dos títulos de antiestreptolisina O, nem de DNAase B. Pode ser feita cultura da zaragatoa perianal, mas o diagnóstico é essencialmente clínico.
O diagnóstico diferencial, em função da idade e do contexto ambiental, deve ser feito com dermatite seborreica, psoríase, candidíase, doença inflamatória intestinal e abuso sexual.
O tratamento de escolha é realizado com amoxicilina (50 mg/kg/dia de 8 em 8 horas, 7 dias). Se houver suspeita de S. aureus, deve utilizar-se amoxicilina com ácido clavulânico ou flucloxacilina.
A dermatite perianal é muito contagiosa e em mais de 40% dos casos é recorrente.
5. Foliculite, furúnculo e antraz
Estas entidades representam um grupo de infecções que têm em comum a sua origem nos folículos pilosos com formação de abcessos. Factores como humidade, higiene precária e maceração da pele predispõem à infeção por S. aureus, o principal agente patogénico envolvido. Esta patologia pode ser sistematizada como se segue.
Foliculite
Infecção piogénica dos folículos pilosos com atingimento da derme e epiderme. Invade apenas a porção superficial de um único folículo e pode atingir com maior profundidade o bulbo piloso, mas com reacção tecidual mínima (Figura 8). Pode observar-se, em zonas contíguas da pele, lesões em vários estádios evolutivos.
Formam-se pápulas eritematosas que evoluem para pústulas de localização folicular. Habitualmente atinge as zonas com maior número de folículos pilosos, barba (sicose vulgar), couro cabeludo, regiões pilosas das nádegas e extremidades.
O tratamento da foliculite inclui a eliminação dos factores patogénicos e a limpeza da pele. Como medidas locais citam-se: cuidados de assepsia, protecção com pensos, limpeza da pele com cloro-hexidina e aplicação de antibioticoterapia tópica (ácido fusídico, bacitracina ou mupirocina). O uso de depilação com laser ou pinça devem ser os métodos preferidos; os métodos que utilizam cera ou lâmina agravam a foliculite, pelo que devem ser evitados.
A foliculite é, na sua maioria, autolimitada; pode regredir com a terapêutica tópica, ou ainda, evoluir para formas mais profundas (furúnculo) e necessitar de antibioticoterapia sistémica.
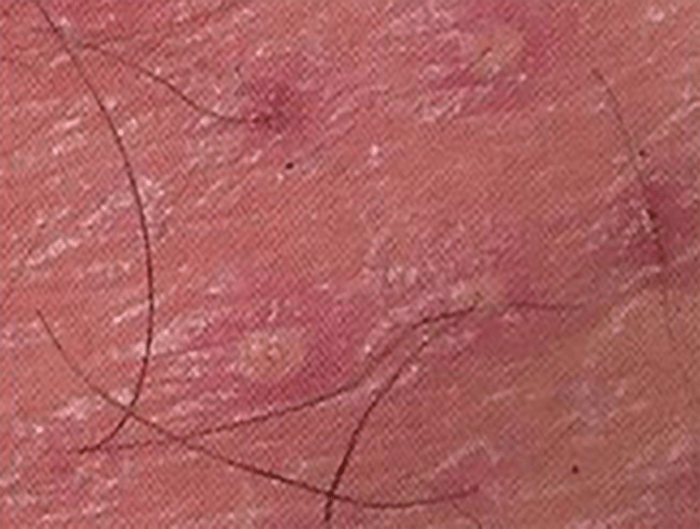
FIGURA 8. Foliculite.
Furúnculo e antraz*
– Furúnculo é a inflamação estafilocócica perifolicular global. Trata-se dum processo mais profundo (derme e hipoderme) (Quadro 1) com necrose do folículo e tecidos adjacentes (Figura 9). O furúnculo da pálpebra ou terçol constitui um exemplo deste tipo de lesão, com localização particular.
– Antraz é uma lesão de maiores dimensões, profunda (derme e hipoderme), com reacção tecidual mais extensa e podendo estar associado a sintomas sistémicos. É a aglomeração de vários furúnculos separados por septos que drenam à superfície da pele por orifícios independentes e com locas que comunicam entre si. (Figura 10)
*Na linguagem em língua inglesa, a aglomeração de diversos furúnculos com tendência necrosante é designada carbuncle. Na literatura científica portuguesa clássica o referido quadro clínico-patológico é designado antraz, o que por vezes pode gerar confusão. O termo carbúnculo, segundo a linguagem clássica portuguesa diz respeito à doença infecciosa, hoje rara, comum ao gado e à espécie humana provocada por “bactéria carbunculosa” – bacilo Gram positivo (Bacilus anthracis) – cujos esporos, muito resistentes, contaminam o solo e diversos produtos de origem animal. Esta infecção é designada na literatura de língua inglesa por anthrax. O microrganismo em causa constitui uma arma potencial no âmbito do bioterrorismo. |
Havendo tendência para localização em áreas pilosas e mais expostas a atrito (nádegas, pescoço, axilas, região da cintura), a lesão inicia-se em volta dum folículo piloso por nódulo doloroso eritematoso. Após alguns dias surge massa necrótica a que se sucede colecção purulenta central com flutuação. A ruptura dá lugar à expulsão do rolhão de tecido necrosado, com destruição do folículo piloso e cicatriz residual.
O furúnculo e o antraz comportam risco de celulite, bacteriémia, e de focos infecciosos à distância como osteomielite, endocardite e abcessos cerebrais. Os furúnculos da asa do nariz, lábio superior e canal auditivo externo podem associar-se a trombose do seio cavernoso com risco de extensão à veia angular e propagação ao cérebro.
O tratamento destas entidades consiste nas medidas gerais aplicáveis à foliculite: aplicar compressas esterilizadas húmidas e quentes (facilitando a drenagem) e evitar manipulação de lesões, nomeadamente as localizadas na face. Nas lesões mais profundas, bem localizadas e com flutuação, está indicada drenagem cirúrgica e a antibioticoterapia é habitualmente desnecessária.
Quando a drenagem não é possível, ou há sintomas sistémicos associados, utiliza-se como primeira escolha a flucloxacilina durante 5 a 10 dias. Se houver atingimento sistémico, deve iniciar-se antibioticoterapia endovenosa e, após melhoria, passar-se a oral.
Na ausência de tratamento, o que é actualmente raro, pode haver evolução por surtos, com aparecimento sucessivo de novas lesões durante semanas ou meses. Nos casos recorrentes, deve ser feita a pesquisa de colonização por SAMR ou S. aureus produtor de LPV; se presente, deve ser ponderada a descolonização adequada. A abordagem da furunculose recorrente será focada na alínea dedicada a “abcessos recorrentes”.
6. Erisipela
A erisipela é definida como inflamação superficial da pele, que envolve a camada profunda da derme e pode estender-se até à camada superficial do tecido celular subcutâneo, com atingimento dos vasos linfáticos. (Quadro 1)
É mais frequente nos extremos etários (crianças e idosos) e em imunocomprometidos. Nas crianças parece ser mais frequente no sexo masculino e, com o avançar da idade, passa a ser mais comum nas mulheres. Em 70 a 80% dos casos são os membros inferiores e superiores que estão envolvidos, sendo a face afectada em apenas 5 a 20% dos casos.
A erisipela é maioritariamente causada por S. pyogenes, sendo menos frequentes outros Streptococcus dos grupos B, C e G. Mais recentemente tem-se atribuído o envolvimento do agente S. aureus e outros microrganismos gram-negativos em cerca de 10% dos casos.
As manifestações clínicas surgem de modo aparatoso após um período de incubação de 2 a 5 dias, com sintomas sistémicos inespecíficos, febre, cefaleia, astenia e vómitos. Posteriormente, surge uma placa eritematosa, edemaciada, quente, dolorosa, circunscrita com os limites muito bem definidos e com bordo nítido, elevado, com tendência para extensão periférica. Por vezes surgem vesículas, bolhas, linfangite superficial (aspecto “casca de laranja”) e adenite satélite (Figura 11). Na fase inicial, a erisipela pode ser facilmente confundida com celulite, a diferenciação é feita com a evolução da doença.
O diagnóstico é clínico e em regra o quadro acompanha-se de leucocitose com neutrofilia e elevação do valor da PCR. O resultado do exame cultural da lesão raramente é positivo, pelo que é desnecessário para o diagnóstico.
É fundamental o repouso com elevação do membro afectado e manobras de diminuição da estase linfática. O tratamento da eventual “porta de entrada” (fissuras, dermatofitoses) é indispensável e obrigatório. Outras medidas de suporte incluem analgésicos e antipiréticos (paracetamol); localmente podem ser aplicados emolientes.
Quando a apresentação clínica é exuberante, o tratamento deve ser iniciado em internamento hospitalar.
A antibioticoterapia de primeira escolha é a penicilina G cristalina 150.000 – 200.000 UI/kg/dia IV, de 6 em 6 horas; após melhoria clínica, o tratamento antimicrobiano pode completar-se com 7 a 10 dias de antibioticoterapia no domicílio, com amoxicilina 50 mg/kg/dia PO de 8 em 8 horas. Se se suspeitar de infecção por S. aureus (aspecto geral tóxico), deve ser associada a clindamicina.
A erisipela pode apresentar recorrência em cerca de 20 a 30% dos casos em que há condições predisponentes (diabetes, linfoma, síndroma nefrótica, estase venosa e hipogamaglobulinémia). Nestas formas recidivantes poderá estar indicada a profilaxia com penicilina G benzatínica intramuscular ou amoxicilina oral.
Sem tratamento adequado a situação pode complicar-se com septicemia, focos infecciosos metastáticos (pneumonia, meningite e osteomielite), abcesso, tromboflebite, fascite necrosante ou choque tóxico.
Nota importante: A propósito da designação “erisipela” chama-se a atenção para uma entidade clínica designada erisipelóide, a qual é provocada por uma bactéria da família Corynebacteriaceae chamada Erysipelothrix rhusiopathiae. Trata-se duma infecção aguda (rara, autolimitada, localizada nos dedos das mãos, não ultrapassando a porção proximal do pulso), resultante da inoculação do microrganismo por contacto com peixes, aves ou os seus produtos contaminados. Traduz-se por edema e eritema azulado, com compromisso articular. O tratamento específico de escolha inclui eritromicina ou penicilina. |
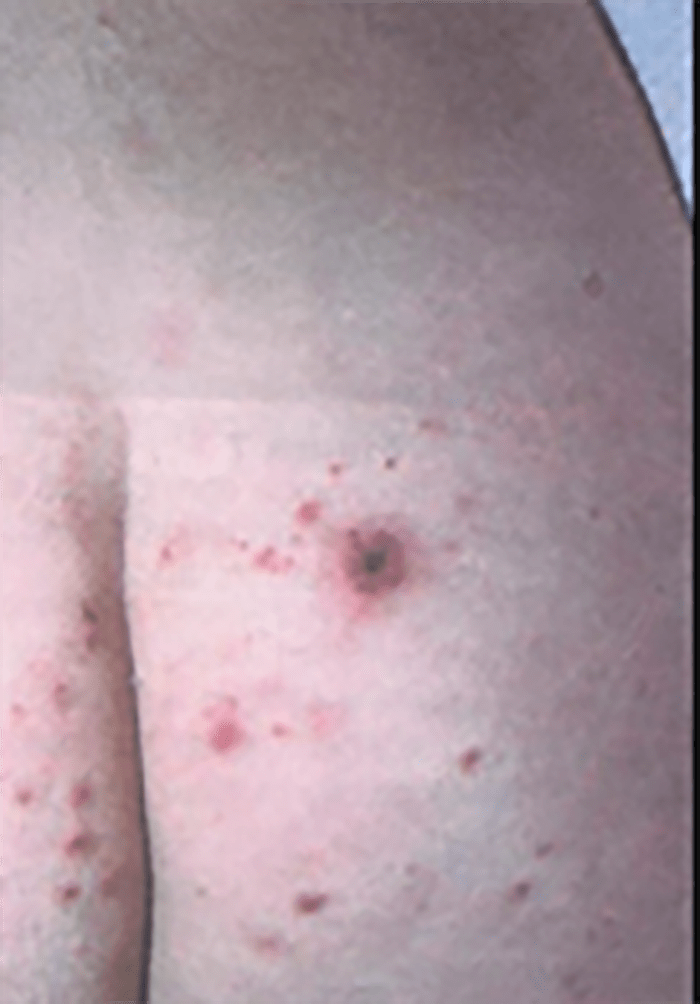
FIGURA 9. Furúnculo.
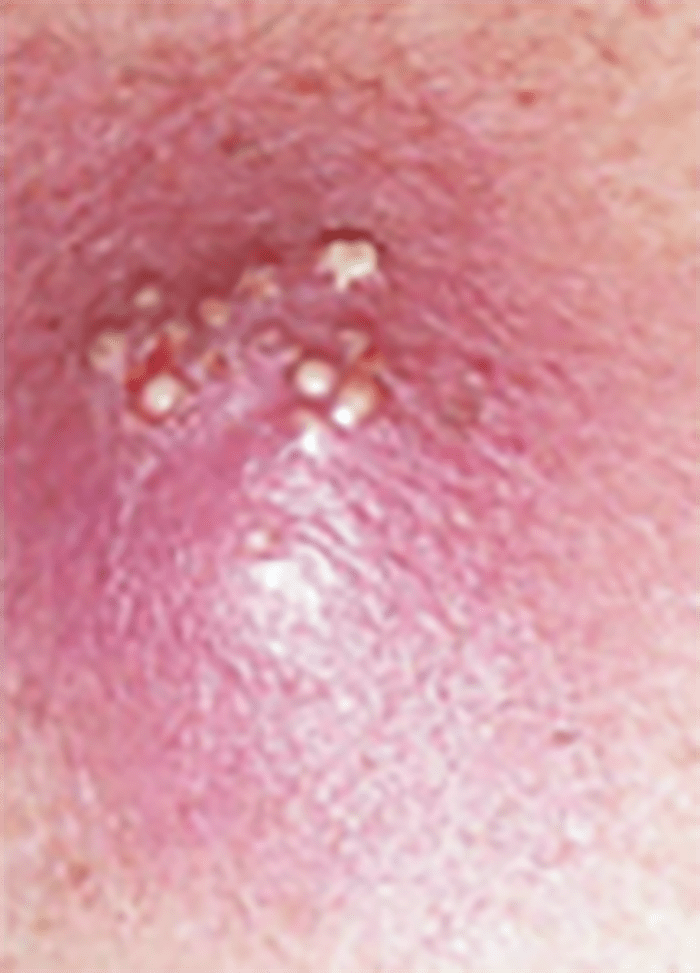
FIGURA 10. Antraz.
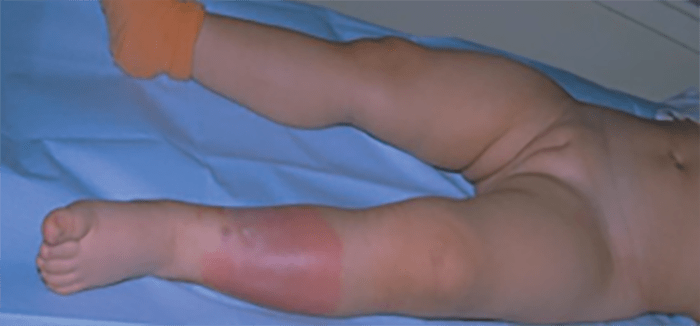
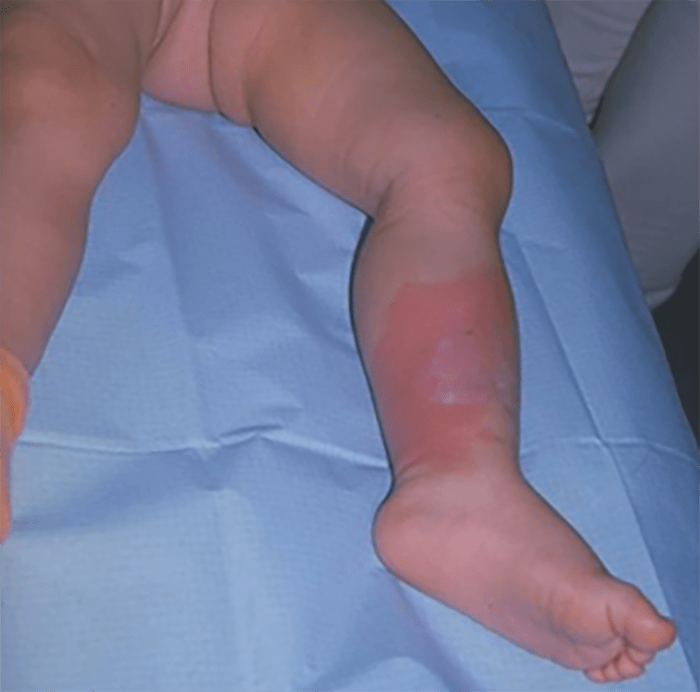
FIGURA 11. Erisipela.
7. Celulite
A celulite é uma inflamação aguda da hipoderme e do tecido celular subcutâneo (Quadro 1). Pode manifestar-se em qualquer idade sendo mais frequente nos membros inferiores; (39,9%), seguem-se em frequência a face e os membros superiores.
Os agentes etiológicos mais comuns são S. pyogenes e S. aureus; e mais raros, Streptococcus pneumoniae e Pseudomonas aeruginosa.
A celulite surge frequentemente como sobreinfecção de uma lesão da pele. Manifesta-se por área edematosa, vermelho vivo, quente, de propagação insidiosa, associada a dor ligeira, com limites mal definidos, ao contrário da erisipela. Concomitantemente pode aparecer febre (inconstante) e outros sinais sistémicos inespecíficos que, quando presentes, são brandos. Pode haver linfadenopatia regional associada. Nas formas mais graves podem surgir lesões bolhosas, hemorrágicas e necrose.
Após a introdução duma vacina conjugada, a celulite por Haemophilus influenzae tipo b tornou-se rara. Surgindo no decurso de bacteriémia, a observação da pele mostra zona de aspecto violáceo, por alguns considerado patognomónico. A face e o pescoço são as áreas mais afectadas.
Se idênticos sinais surgirem no RN, admite-se como hipótese mais provável, infecção por Streptococcus agalactiae ou Escherichia coli.
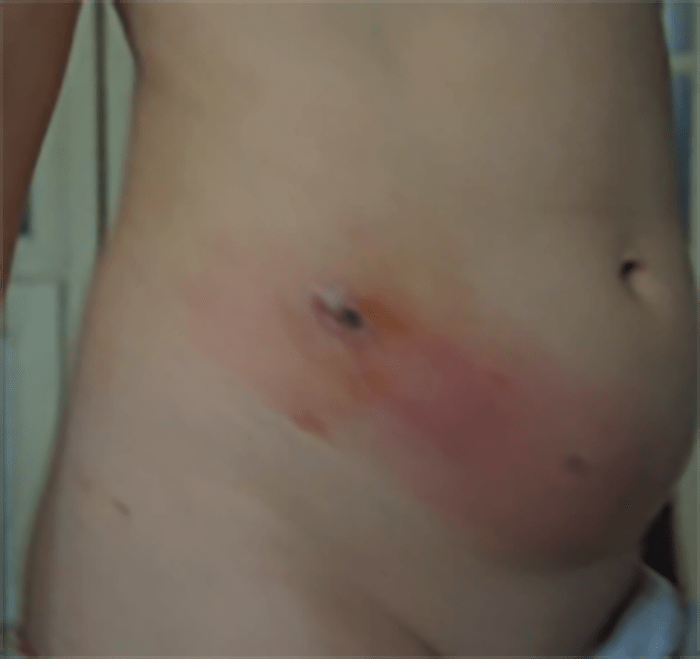
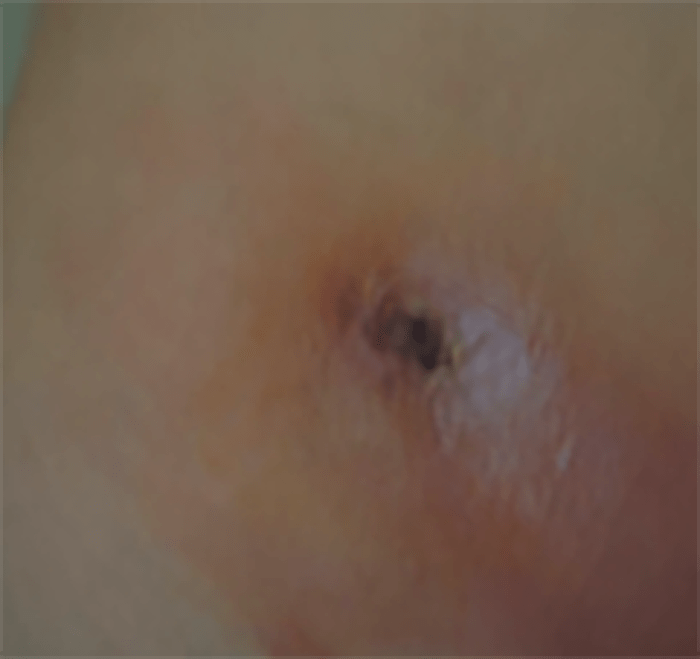
FIGURA 12. Celulite localizada.
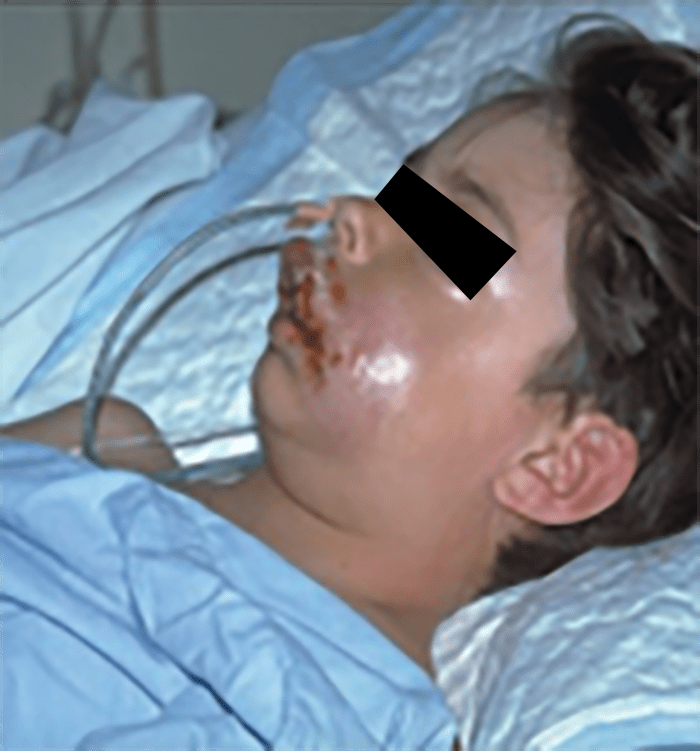
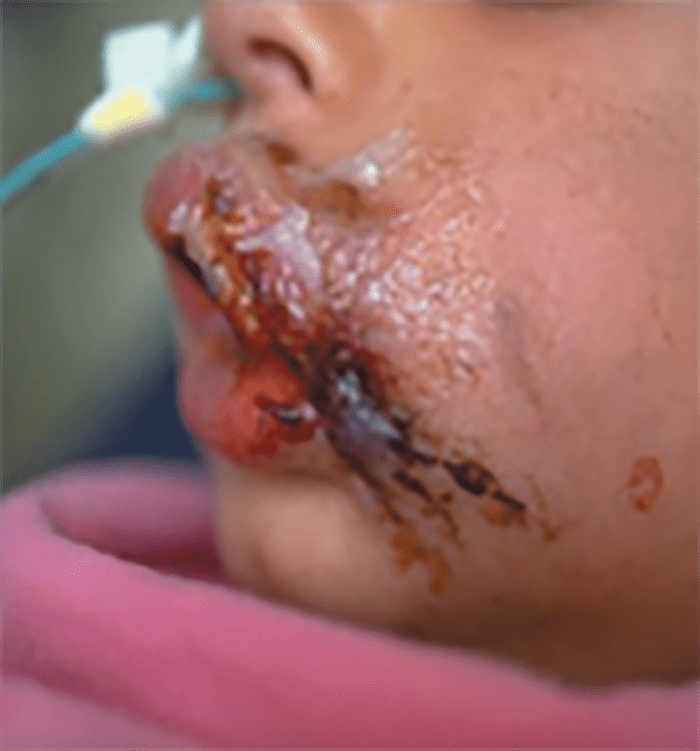
FIGURA 13. Celulite com sinais sistémicos.
→ Celulite sem sinais sistémicos: mais provavelmente provocada pelo agente S. aureus, é mais localizada, mais rapidamente supurada, mas sem sinais sistémicos (Figura 12).
→ Celulite com sinais sistémicos: distribuição mais difusa, com linfangite e adenite associadas a sintomas sistémicos mais graves; o agente causal mais provável é S. pyogenes; existe elevado risco de produção de toxina necrosante. (Figura 13)
O diagnóstico é clínico; no entanto, deve proceder-se a hemocultura nos casos com sinais sistémicos mais graves, pois em cerca de 5% dos casos pode haver associação a bacteriémia.
O diagnóstico diferencial faz-se com erisipela, reação inflamatória a picadas de insetos, tromboflebite superficial e piomiosite.
Nas formas não acompanhadas de sinais sistémicos, localizadas, está indicada flucloxacilina (100-150 mg/kg/dia PO de 8 em 8 horas (no RN e lactente, via IV), durante 7 a 10 dias.
Havendo sinais sistémicos deve ser feito tratamento com penicilina G cristalina IV (100.000-200.000 UI/kg/dia) de 6 em 6 horas ou uma cefalosporina, associada a clindamicina IV. Após melhoria clínica (habitualmente três a cinco dias) o tratamento pode ser completado em ambulatório com flucloxacilina, amoxicilina ou clindamicina PO.
Na maioria dos casos de celulite não complicada pode verificar-se evolução para abcesso, osteomielite ou artrite séptica. Sem tratamento, a situação poderá evoluir para infecção mais profunda e grave, como a fascite necrosante.
8. Abcesso e fleimão
Numa perspectiva global, abcesso e fleimão são infeções purulentas com atingimento da derme e hipoderme (Quadro 1). Verifica-se acentuada destruição tecidual, com rápida propagação (sobretudo no fleimão) e possível repercussão no estado geral, por vezes grave. Nas crianças as localizações mais frequentes são mama, região perianal, glândulas sudoríparas e couro cabeludo.
Habitualmente o quadro inflamatório localizado é precedido por manifestações sistémicas: calafrio, mal-estar geral e febre.
O fleimão caracteriza-se por maior tendência para empastamento tecidual difuso e propagação da afecção para a profundidade. Surge como área de eritema que rapidamente se torna viva, adquire tumefação edematosa de bordo mal definido, no início dura, que pode evoluir para abcesso. Quando o fleimão tem localização ganglionar denomina-se adenofleimão. S. aureus e S. pyogenes são os agentes etiológicos implicados.
No abcesso, ao eritema e tumefação localizados com aumento da temperatura local seguem-se flutuação, ruptura e fistulização com consequente descarga purulenta; geralmente verifica-se adenite regional. Em causa está habitualmente o microrganismo S. aureus.
Estas duas entidades correspondem a situações clínicas de urgência; a sua evolução é por vezes grave, podendo ser ponto de partida para complicações viscerais; em consequência da metastização bacteriana poderá instalar-se quadro de sépsis.
As bases do tratamento do abcesso podem ser assim sintetizadas:
- Incisão e drenagem – é o procedimento de primeira escolha e fundamental para evitar complicações; deve ser feita cultura do material drenado.
- Antibioticoterapia – o uso adicional de antibiótico após drenagem não parece trazer vantagens na melhoria clínica; assim, só deve ser iniciada nos abcessos múltiplos ou com mais de 5 cm, nos abcessos persistentes após drenagem, ou se houver sinais de resposta inflamatória sistémica, risco de endocardite, celulite extensa associada, presença de comorbilidades ou imunossupressão, ou ainda, se se tratar de um lactente; o antimicrobiano de escolha é a flucloxacilina (100-200 mg/kg/dia) PO de 8 em 8 horas durante 7 dias; demonstrando-se etiologia estreptocócica, aplicam-se os princípios da antibioticoterapia referidos a propósito da erisipela.
No tratamento do fleimão aplicam-se os mesmos princípios, sendo que a duração da antibioticoterapia deverá durar, no mínimo, 10 dias.
Notas importantes: |
9. Fascite necrosante
A fascite necrosante ou “gangrena estreptocócica” é a infeção bacteriana aguda do tecido celular subcutâneo, hipoderme e fáscia, com tendência para difusão rápida e grande destruição tecidual com necrose maciça. É uma entidade rara na idade pediátrica, localizando-se principalmente no tronco e nos membros superiores ou inferiores. (Figura 14)
S. pyogenes é o agente causal mais frequente, de forma isolada ou combinado com S. aureus verificando-se efeito sinérgico (tipo 2). Muitas vezes a etiologia pode ser mista, polimicrobiana (tipo 1).
Esta infecção pode implantar-se em lesões cutâneas prévias (por ex. feridas, queimaduras, escoriações, ulcerações de diversa natureza, eczema ou mais frequentemente varicela). O uso de ibuprofeno, ou outros anti-inflamatórios não esteróides, no contexto de varicela tem sido associado a risco mais elevado de fascite necrosante; no entanto, os dados disponíveis não são consistentes.
A apresentação clínica pode ser subaguda, aguda ou fulminante. Na fase inicial pode começar como uma celulite, com sinais locais mínimos mas com dor intensa desproporcional, podendo atrasar o diagnóstico. Posteriormente surge sintomatologia sistémica, como febre, prostração, mau estado geral, por vezes choque e falência multiorgânica.
Cerca de dois a quatro dias depois, coincidindo com agravamento do estado geral, verifica-se evolução da lesão tecidual: área edematosa com rubor vivo, de bordo mal definido que fica com aspecto violáceo, extensão centrífuga rápida e aparecimento de bolhas hemorrágicas e necrose.
O diagnóstico é clínico, com tradução imagiológica. A TAC pode mostrar a referida necrose, como pode não mostrar alterações. A ressonância magnética é o exame de escolha para visualização dos tecidos moles; contudo, a impossibilidade de a realizar, não deve atrasar o início da terapêutica. No que respeita a exames complementares, cabe referir que o número de leucócitos é geralmente normal e o valor da PCR está elevado. Pode haver trombocitopenia, coagulopatia e hipoalbuminemia com hipocalcemia. Deve ser colhida hemocultura antes de se iniciar a antibioticoterapia. Mais frequentemente, o agente S. pyogenes é isolado do sangue e do líquido das bolhas. Em casos raros a etiologia é polimicrobiana, particularmente na gangrena de Fournier, ou fascite necrosante do períneo. Nestes casos, para além de S. aureus e S. pyogenes, os anaeróbios, incluindo Peptotreptococcus, Prevotella e Bacterioides fragilis estão geralmente implicados.
O diagnóstico diferencial realiza-se com outras gangrenas (designadamente, gangrena gasosa, abordada adiante). O exame histológico evidencia sinais de necrose subcutânea que se estende ao longo das fáscias com trombose e necrose fibrinóide das paredes vasculares.
A fascite necrosante é uma emergência que obriga a terapia em cuidados intensivos, com apoio da cirurgia. Muitas vezes é necessário adoptar várias medidas já descritas no tratamento de quadros de choque e sépsis, tais como expansão de volume, medidas de suporte inotrópico, sedação e analgesia.
A antibioticoterapia deve ser iniciada de forma empírica. Admitindo a etiologia por S. pyogenes deve ser iniciada, penicilina G aquosa (300.000 a 400.000 UI/kg/dia IV, de 4 em 4 ou de 6 em 6 horas) associada a clindamicina (40 mg/kg/dia IV, de 6 em 6 ou de 8 em 8 horas); deverá ponderar-se adicionar a flucloxacilina se houver suspeita de infecção por S. aureus.
Nos casos em que se suspeita de infecção polimicrobiana deve ser iniciada antibioticoterapia de largo espectro com cefotaxima, clindamicina e gentamicina. Nos doentes neutropénicos é importante a administração de antimicrobianos com actividade contra P. aeruginosa.
Verificando-se alergia à penicilina, importa adoptar o seguinte esquema: cefalosporina de 3ª geração IV – cefotaxima (150 mg/kg/dia) ou ceftriaxona (75 mg/kg/dia), em 2 doses + clindamicina IV (20 a 40 mg/kg/dia) em 3-4 doses, durante 15 a 21 dias.
A excisão cirúrgica da área afectada deve ser precoce e seriada a cada 24 a 48 horas, até haver controlo da infecção.
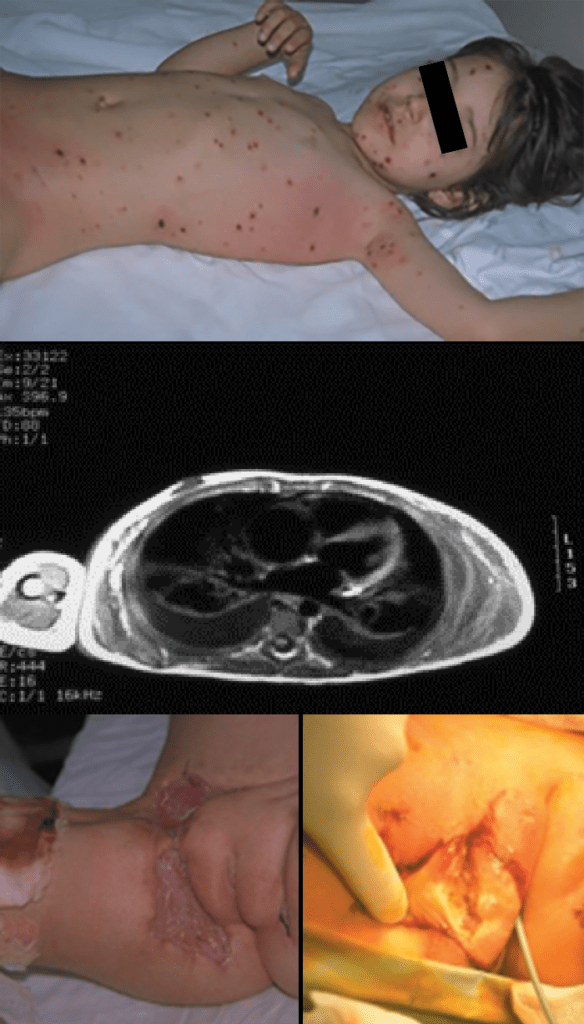
FIGURA 14. Fascite necrosante no contexto de varicela. TAC evidenciando sinais de necrose da hipoderme ao longo das fáscias.
Posteriormente, e quando possível, a antibioticoterapia deve ser ajustada de acordo com o TSA e manter-se até: – não ser necessário proceder a mais excisões; ou – haver melhoria clínica significativa e; – se verificar apirexia de 3 a 5 dias (mínimo: 15 dias de antibioticoterapia). O uso de imunoglobulina não é consensual e deve ser ponderado caso a caso.
Esta entidade clínica comporta morbilidade e mortalidade elevadas.
10. Gangrena gasosa ou mionecrose
A gangrena gasosa é uma infecção bacteriana aguda da hipoderme e tecido subcutâneo com evolução para necrose do tecido muscular. Em cerca de 90-95% dos casos está implicado o agente Clostridium perfringens. (Figura 15)
Na maioria dos casos, a etiopatogénese desta infecção relaciona-se com lesões traumáticas que atingem o músculo e são a forma de entrada do agente microbiano. Por outro lado, a infecção pode ter origem endógena através de agentes anaeróbios, com ponto de partida no tracto gastrintestinal e invasão da corrente sanguínea (bacteriémia).
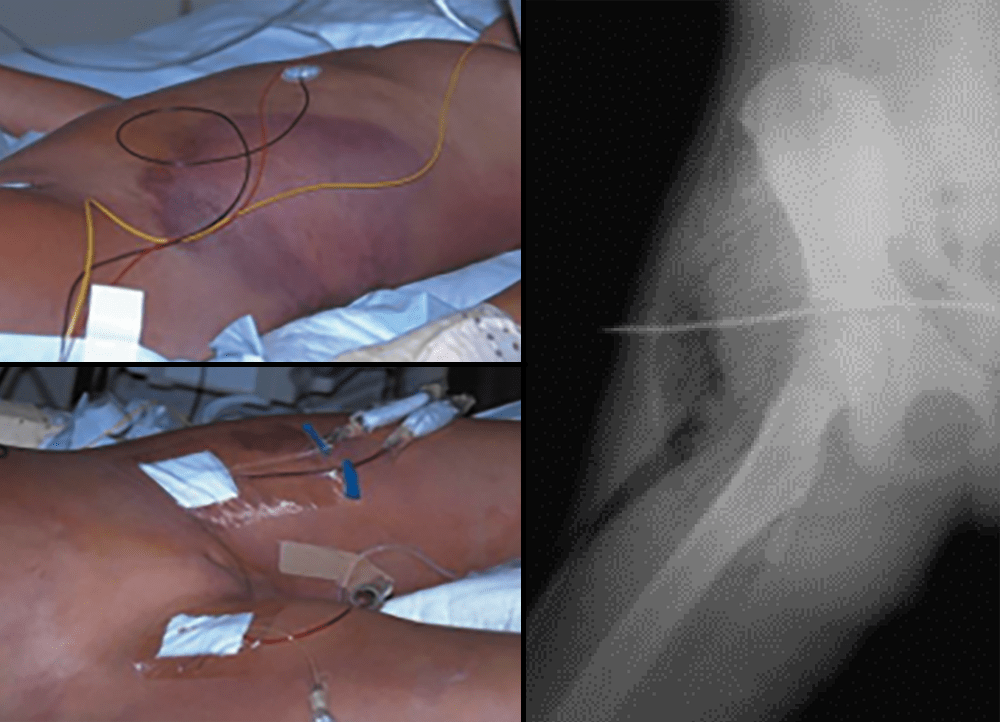
FIGURA 15. Gangrena gasosa ou mionecrose.
Clinicamente surge quadro de mau estado geral e sépsis. O doente pode evidenciar dor intensa na área do músculo afectado, a qual se apresenta edemaciada e pálida, tornando-se posteriormente violácea. Pode ser notado odor característico, aparecendo, entretanto, bolhas de conteúdo purpúrico; à palpação da pele nota-se crepitação. Trata-se duma situação clínica muito grave, com evolução rápida para choque séptico.
Para além das medidas de terapia intensiva de suporte (ressuscitação, ventilação, estabilização hemodinâmica), a antibioticoterapia de escolha, no pressuposto de que Clostridium perfringens é o agente etiológico: penicilina G aquosa (250.000 UI/kg/dia IV, de 6 em 6 horas) associada a clindamicina (40 mg/kg/dia IV, de 8 em 8 horas) durante 15 a 21 dias.
11. Piomiosite
A piomiosite é uma infeção bacteriana primária, aguda e supurada do músculo esquelético. Relativamente comum em regiões tropicais (4% das admissões hospitalares nestes países), salienta-se que a incidência tem aumentado em climas temperados nas últimas décadas. A emergência de estirpes de S. aureus produtoras da toxina LPV e o aumento global da temperatura, têm sido factores apontados.
Surge habitualmente em crianças até então saudáveis, embora possa estar associada a imunodeficiência (por ex. VIH, diabetes) ou a infecções concomitantes em 25% dos casos.
Os músculos dos membros inferiores e cintura pélvica são os mais frequentemente atingidos.
S. aureus é o agente mais comum (95%). Em situações associadas a varicela, S. pyogenes pode ser agente causal. Agentes mais raros são: S. pneumoniae, E. coli, Salmonella typhi, Bacteroides fragilis, N. gonorroeae e Mycobacterium tuberculosis.
Na maioria dos casos surge como consequência de bacteriemia, com consequente metastização nos grandes músculos estriados; raramente, por difusão a partir de foco infeccioso contíguo ao músculo.
Sobre a patogénese, não totalmente esclarecida, admite-se que o esforço muscular, lesão muscular e status pós-hipóxia-isquémia muscular constituam factores predisponentes.
As manifestações clínicas incluem fundamentalmente febre, dores e rigidez musculares, cãibras, rubor e edema ao nível da pele suprajacente. Verifica-se leucocitose e aumento da velocidade de sedimentação que podem durar mais de duas semanas. Os aspirados musculares somente evidenciando material purulento, permitem o isolamento do agente infeccioso após formação de abcessos.
Curiosamente não se verifica adenopatia satélite.
O diagnóstico diferencial faz-se com osteoartrite, hematoma, neoplasia, polimiosite e celulite; nesta última, ao contrário da piomiosite, bacteriémia, a velocidade de sedimentação elevada e a leucocitose são raras, e as adenopatias frequentes.
A piomiosite não tratada evolui para choque séptico.
Com a progressão da infecção, os sinais de toxicidade sistémica tornam-se evidentes. Verifica-se leucocitose e aumento dos valores da PCR e da velocidade de sedimentação, podendo durar mais de duas semanas. As enzimas musculares (CK e AST) estão habitualmente com valores normais.
A hemocultura é positiva em 10 a 35% dos casos e o exame cultural após aspiração do conteúdo dos abcessos pode contribuir decisivamente para o diagnóstico. Nos primeiros estádios da doença a RM é o exame mais sensível, sendo muito útil na determinação da localização e extensão.
Para além das medidas gerais de suporte, em função da gravidade, deve ser iniciada antibioticoterapia com flucloxacilina IV 150 a 200 mg/kg/dia de 6 em 6 horas, associada a clindamicina 40 mg/kg/dia de 8 em 8 horas, até melhoria clínica, seguida de flucloxacilina oral. A duração total da terapêutica é variável, consoante a evolução clínica e analítica, sendo habitualmente de 15 dias.
12. Outras formas clínicas
O panarício ou perioniquia é uma inflamação dos tecidos periungueais, com etiologia polimicrobiana. A hidrosadenite é uma infecção rara, crónica e recidivante das glândulas sudoríparas apócrinas (derme e hipoderme) que pode surgir na adolescência. O terçol (terçolho ou hordéolo) e o calázio foram descritos na Parte sobre Oftalmologia. As infecções da pele e dos tecidos moles com ponto de partida nos dentes e tecidos envolventes (infecções odontogénicas) constam da Parte sobre Estomatologia. Às infecções relacionadas com mordeduras foi feita referência na Parte sobre Urgências e emergências.
AGRADECIMENTOS
Ao Professor F. Guerra Rodrigo co-autor do livro Dermatologia, citado na Bibliografia, o agradecimento do coordenador- editor pela cedência da Figura 1.
BIBLIOGRAFIA
American Academy of Pediatrics. Staphylococcal infections . In Pickering LK, Baker CJ, Kimberlin DW, Long SS (eds). Red Book 2012. Report of the Committee on Infectious Diseases. Elk Grove Village, IL: American Academy of Pediatrics, 2012
American Academy of Pediatrics. Group A Streptococcal Infections. In Pickering LK, Baker CJ, Kimberlin DW, Long SS (eds). Red Book 2012. Report of the Committee on Infectious Diseases. Elk Grove Village, IL: American Academy of Pediatrics, 2012
Bergelson JM, Shah SS, Zaoutis TE. Pediatric Infectious Diseases. The Requisites in Pediatrics. Philadelphia: Mosby Elsevier, 2008
Dias P G, Valente P. Antibióticos em Pediatria. Lisboa: SmithKline Beecham, 2000
Feijin R D, Cherry J D, Demmler G J, Kaplan S L (eds). Textbook of Pediatric Infectious Diseases. Philadelphia: Saunders, 2014
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Grass C F, Dan-Goor M, Maly A, Eran Y, Kwinn L A, et al. Effect of a bacterial pheromone peptide on host chemokine degradations in group A Streptococcal necrotising soft tissue infections. Lancet 2004;363:696-703
Guerra-Rodrigo F, Marques Gomes M, Mayer-da-Silva A, Filipe P I. Dermatologia. Lisboa: Fundação Calouste Gulbenkian, 2010
Helfaer MA, Nichols DG. Roger´s Handbook of Pediatric Intensive Care. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins, 2009
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Larru B, Gerber JS. Cutaneous bacterial infections caused by Staphylococcus aureus and Streptococcus pyogenes in infants and children. Pediatr Clin North Am 2014;61:457-478
Levine PJ, Elman MR, Kullar R, et al. Use of electronic health record data to identify skin and soft tissue infections in primary care settings: a validation study. BMC Infect Dis 2013. 13:171 Doi: 10.1186/1471-2334-13-171
Lucet J, Regnier B. Screening and decolonization: lessons for methicillin-resistant S. aureus? Clin Infect Dis 2010;51:585-590
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Rajan S. Skin and soft-tissue infections: classifying and treating a spectrum. Cleve Clin J Med 2012;79: 57-66
Sladden MJ, Johnston GA. Common skin infections in children. BMJ 2004;329:95-99
Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the infectious diseases society of America. Clin Infect Dis 2014 15; 59:147- 159
Williams DJ, Cooper WO, Kaltenbach LA, et al. Comparative effectiveness of antibiotic treatment strategies for pediatric skin and soft-tissue infections. Pediatrics 2011;128: e479 – e487
Wong CH, Wang US. The diagnosis of necrotizing fasciitis. Curr Opin Infect Dis 2005;18:101-106