Etiopatogénese e importância do problema
A glicose constitui a principal fonte energética para o metabolismo fetal e, designadamente, para a função do encéfalo. Toda a glucose utilizada no feto é transportada através de gradiente de difusão facilitada, sendo que a concentração de glucose no sangue fetal é cerca de 70% da concentração no sangue materno.
Para a compreensão das alterações do metabolismo da glicose no período neonatal imediato é fundamental reter as seguintes noções:
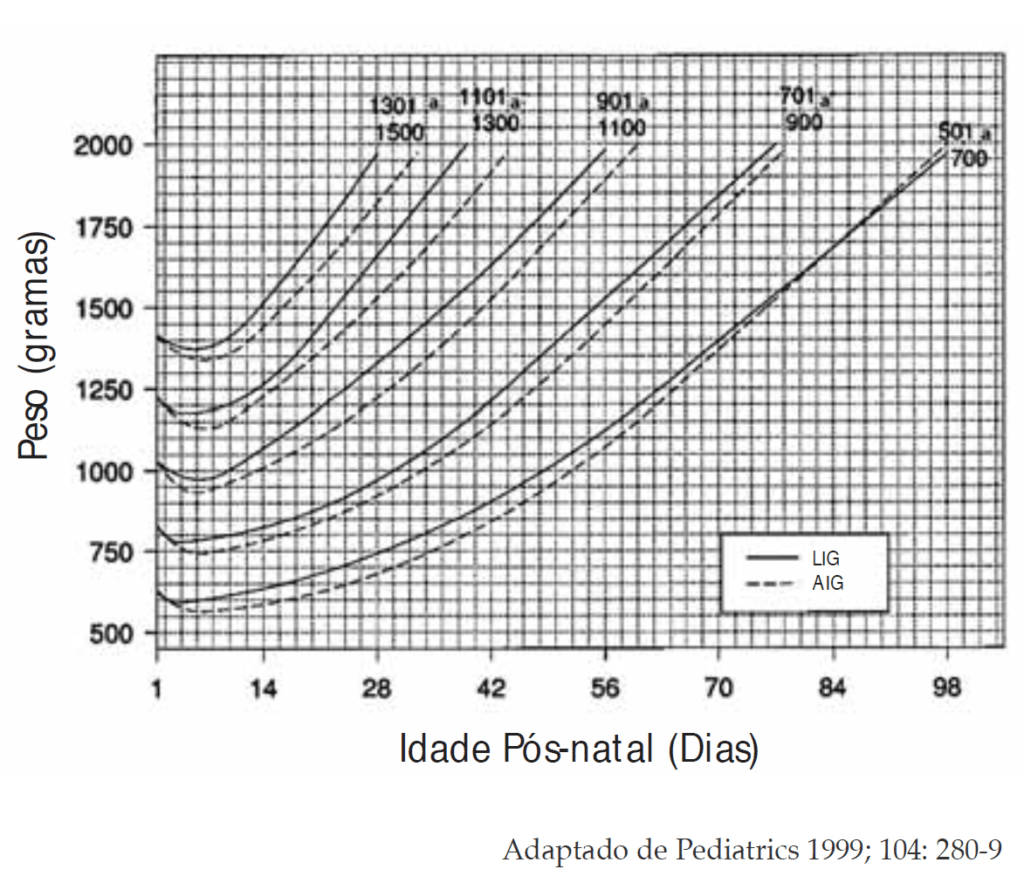
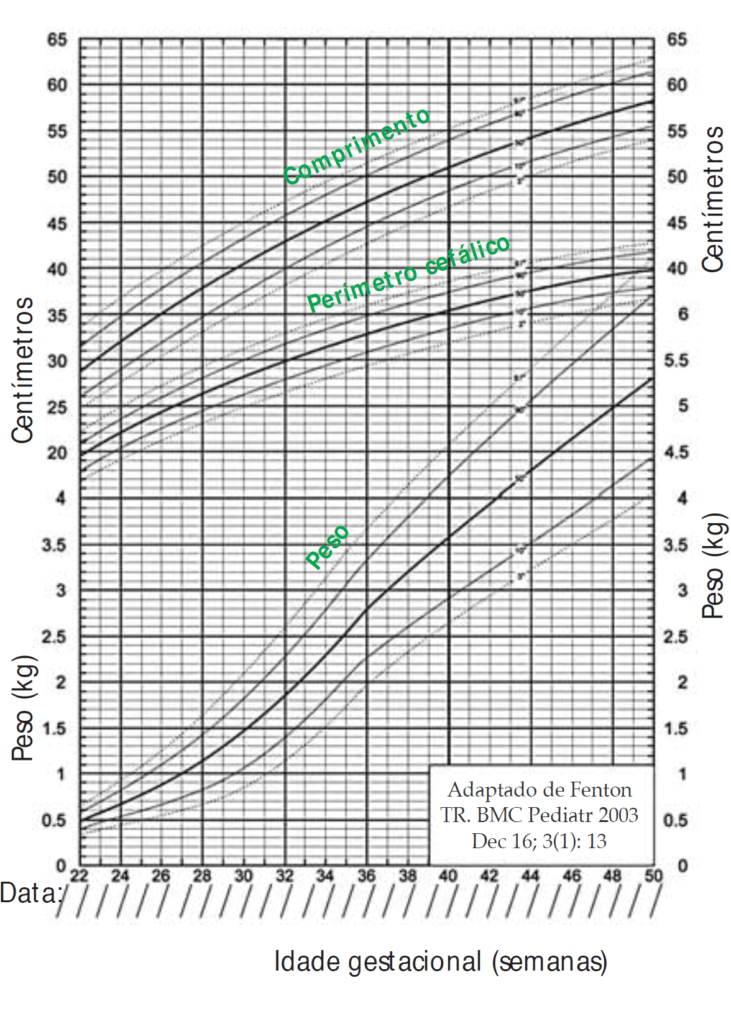
- As reservas de glicogénio, fonte de glucose, em vários órgãos, principalmente fígado e músculo estriado, no feto/RN de termo e de peso adequado para a idade gestacional, são escassas; e tal escassez das mesmas é mais acentuada no RN pré-termo de baixo peso e/ou no RN com restrição de crescimento fetal;
- Não existe produção significativa de glucose pelo próprio feto apesar de as enzimas da neoglucogénese e da glicogenólise estarem relativamente funcionantes no termo da gestação (excluindo as situações de doenças hereditárias do metabolismo);
- Na vida fetal o teor em glucose proveniente da mãe cifra-se em cerca de 4-6 mg/kg/minuto.
Após o nascimento, verificando-se uma interrupção brusca da glicose fornecida por via umbilical, coincidindo com a laqueação do cordão, a concentração de glicose sanguínea (glicémia) no RN desce rapidamente para níveis inferiores aos da vida fetal, estimando-se então as necessidades em glicose da ordem de 5-8 mg/kg/minuto, superiores às do feto, e cerca de 3 a 4 vezes superiores às do adulto.
Para que a glicémia se mantenha em níveis normais, é necessária uma interacção complexa de vários mecanismos hormonais, a saber:
- A elevação do glucagom e das catecolaminas estimulando a glicogenólise hepática;
- A elevação do cortisol e da hormona de crescimento estimulando a neoglucogénese e;
- A diminuição da secreção de insulina cuja acção é a utilização da glucose pelos tecidos, reduzindo a glicémia (antagonista da do glucagom).
A glicogenólise contribui para a espoliação das reservas de glicogénio, o que, por sua vez, activa a neoglucogénese.
Como alternativa ao “substrato energético glucose” existem outros substratos (lactato, aminoácidos – sobretudo alanina -, ácidos gordos livres, corpos cetónicos), salientando-se que o RN – sobretudo o pré-termo e o de baixo peso – evidencia resposta limitada à utilização de tais compostos.
Em suma:
- Este processo de adaptação fetal endócrino-metabólica à vida extrauterina é mais limitado no RN pré-termo e no RN de baixo peso com restrição de crescimento fetal tendo em conta, nomeadamente, a imaturidade das enzimas da glicogenólise e da neoglicogénese, assim como a escassez mais acentuada das reservas de glicogénio e de músculo (fonte de aminoácidos);
- A concentração da glicose no sangue do RN depende da integridade e maturidade dos mecanismos reguladores referidos.
A importância deste problema decorre sobretudo da possibilidade de lesão neuronal e de sequelas neurológicas, atribuíveis à diminuição da glicémia abaixo de determinados valores (hipoglicémia), associada por vezes a alterações da microcirculação e a factores como hipóxia ou infecção. De realçar que a hipoglicémia grave no RN se associa a necrose neuronal selectiva em múltiplas regiões do encéfalo, incluindo designadamente o córtex superficial, o hipocampo e o putamen caudato. As principais consequências histopatológicas dizem respeito, sobretudo, a necrose neuronal com ruptura das sinapses e membrana celular comprometendo seriamente a transmissão sináptica.
Por outro lado, valores elevados (hiperglicémia) podem ter igualmente efeitos deletérios no SNC e de diurese osmótica, entre outros.
A alimentação precoce com colostro e leite materno contribui para evitar a tendência do RN para a diminuição da glicémia, e até elevando-a, pelas seguintes razões: estimulação dos precursores neoglucogénicos como o aminoácido alanina, estimulação de enzimas necessárias à cetogénese como a lactase, e diminuição da secreção de insulina.
Pelo contrário a prática habitual de administração de soro glucosado a 5% ou 10%, de “sabor doce”, que deve ser desencorajada – para além de desmotivar o RN para a sucção de colostro de “sabor salgado” – diminui a secreção de glucagom e a neoglicogénese, sem garantir valor da glicémia dentro da normalidade e estável.
Neste capítulo são abordados dois problemas clínicos relacionados com alteração do metabolismo da glicose (hipoglicémia e hiperglicémia) no RN.
HIPOGLICÉMIA
Definição
A definição de hipoglicémia (não totalmente consensual entre os vários grupos de investigação) é biológica: depende dos valores laboratoriais obtidos de amostras de sangue ou plasma, uma vez que nem sempre é sintomática; conceptualmente, considera-se baixo o valor plasmático de glicose a que corresponde elevada probabilidade de lesão funcional.
No recém-nascido saudável, o valor limite de normalidade mais consensual em amostra de plasma é 40 mg/dL (2,2 mmol/L) após as 12 horas de vida, com valores fisiologicamente mais baixos nas primeiras 3 horas de vida, sendo que se atinge o mínimo cerca das 1-2 horas (1,5 mmol/L, 27 mg/dL) com recuperação espontânea pelas 3 horas de vida.
Este limite tem sido definido em função de determinados parâmetros: epidemiológico (dois desvios padrão abaixo da média), clínico (nível para o qual surge sintomatologia), metabólico (valor para o qual surge contrarregulação metabólica) ou neurofisiológico (valor para o qual surgem alterações do fluxo cerebral).
Nesta perspectiva, a definição mais útil é a dita operacional, ou seja, a que corresponde ao limiar que obrigue a intervenção terapêutica, de acordo com a situação clínica do recém-nascido e a presença de factores de risco.
Assim, considera-se valor limite inferior de normalidade da glicémia (determinada em amostra de plasma) justificando intervenção terapêutica:
- No RN saudável com mais de 3h de vida: < 2 mmol/L (36 mg/dL);
- No RN sintomático: < 2,5 mmol/L (45 mg/dL);
- No RN com hiperinsulinismo: < 3,5 mmol/L (64 mg/dL).
A determinação da glicémia deve ser feita utilizando um método rápido, sensível e barato, exequível à cabeceira do doente, e com pequena quantidade de sangue capilar (na prática, para rastreio, utiliza-se micrométodo com tiras-reagente pelo método da glucose-oxidase – Dextrostix®, BMtest®, etc.); de salientar que, com sangue total, o valor obtido é cerca de 10-15% inferior ao do plasma.
Considera-se actualmente que a determinação plasmática é a mais correcta, já que a determinação em sangue total é afectada pelo hematócrito (valores de glicémia respectivamente decrescentes no sangue: arterial > capilar > venoso).
São salientadas as seguintes regras práticas:
|
Aspectos epidemiológicos
A hipoglicémia constitui o problema metabólico mais frequente no RN.
De acordo com diversos estudos epidemiológicos, estima-se incidência entre 2 a 3/1.000 nados-vivos. Tendo em conta as particularidades fisiopatológicas da prematuridade e da restrição do crescimento intrauterino, não é de estranhar que em tais grupos de RN se verifiquem incidências maiores (5-10%).
Etiopatogénese e classificação
A hipoglicémia pode surgir de forma transitória no recém-nascido por diversos mecanismos em que predominam, relativamente à glucose: diminuição da oferta; ou consumo excessivo.
Diminuição da oferta de glicose
Como grupos de risco ou de grande probabilidade de hipoglicémia em que prevalece este mecanismo, citam-se:
Prematuridade (gravidez encurtada)
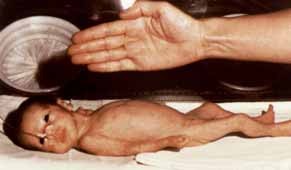
No RNPT a probabilidade de hipoglicémia explica-se sobretudo pelo défice de reservas de glicogénio (fonte de glicose) e de gordura, cujo acréscimo se verifica sobretudo no terceiro trimestre.
São também determinantes a imaturidade da neoglucogénese (sobretudo por défice da actividade da fosfoenolpiruvatoquinase) e de várias enzimas implicadas no metabolismo da glucose. Verifica-se igualmente imaturidade da cetogénese.
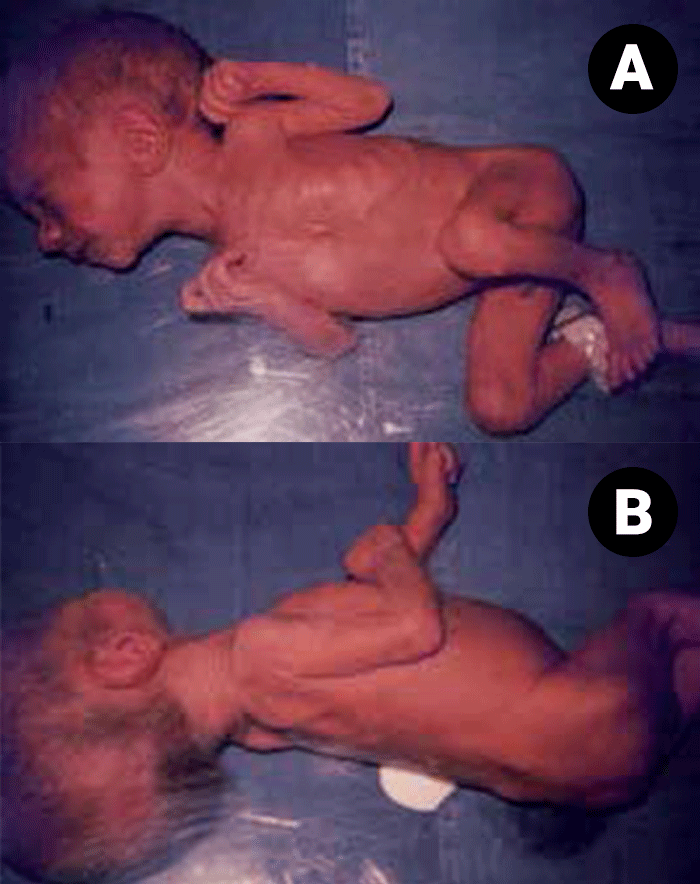
Restrição de crescimento fetal ou intrauterino (RCIU)
Nos RN com RCIU os mecanismos são semelhantes aos descritos no RNPT, tendo menor relevância a imaturidade enzimática caso não exista prematuridade concomitante.
Verifica-se o papel preponderante das reservas diminuídas de glicogénio e de gordura, e do défice de neoglucogénese. De salientar que frequentemente existem situações associadas susceptíveis de aumentarem o consumo pré- e pós-parto como a asfixia perinatal. Uma das particularidades da hipoglicémia na RCIU é a tendência para se prolongar por cerca de 48-72 horas.
Asfixia perinatal
Nestas circunstâncias, a hipóxia e a acidose, incrementando a actividade e a libertação de catecolaminas, levam a glicogenólise e aumento de consumo da glicose por glicólise anaeróbia, baixando, por isso, a glucose no sangue. Tal acontece por necessidade de suprimento energético (glucose) à célula cerebral face ao défice de oxigenação.
Este mecanismo é, na generalidade, comum a outras situações, como infecção perinatal, hipotermia e RN com cardiopatia congénita cianótica (neste último caso em situações acompanhadas de défice de fluxo sanguíneo hepático dificultando a glicogenólise e a saída de glicose para o sangue).
Consumo excessivo de glucose
Como grupos de risco ou de grande probabilidade de hipoglicémia em que prevalece este mecanismo, citam-se:
RN de mãe diabética
O exemplo paradigmático deste mecanismo é o hiperinsulinismo fetal/neonatal por hiperplasia das células b dos ilhéus de Langerhans face à hiperglicémia materna no contexto de diabetes; o efeito no RN quanto a valor glicémico verifica-se após a laqueação do cordão umbilical (hipoglicémia nas primeiras horas e tanto mais acentuada e mais duradoira quanto mais elevada a hiperglicémia materna).
Outros efeitos do hiperinsulinismo são: incremento da síntese de proteínas e de glicogénio hepático causando macrossomia, cardiomiopatia com hipertrofia do septo e parede ventricular e hematopoiese extramedular.
A síndroma de policitémia/hiperviscosidade, isoladamente ou muitas vezes associada a problemas do RNMD, constitui também exemplo de consumo incrementado de glucose pela maior massa eritrocitária.
Outras situações acompanhadas de hiperinsulinismo
Cabe referir fundamentalmente:
- A utilização de medicamentos administrados à mãe grávida estimulando a produção de insulina e a libertação de catecolaminas (por ex. corticóides, beta-simpaticomiméticos, propranolol, tiazidas, etc.);
- A utilização de perfusão de dextrose intra-parto com suprimento de glucose superior a 8-10 gramas/hora originando estimulação das células b dos ilhéus pancreáticos;
- Certas formas clínicas de doença hemolítica por incompatibilidade Rh em que se admite que a hemólise maciça, originando incremento da glutationa reduzida, provoque estimulação das referidas células beta e hiperprodução transitória de insulina;
- Nutrição parentérica com cateter central, empregando soluções com elevada concentração de glucose, poderá estimular a secreção de insulina com consequente hipoglicémia; nos casos de cateter arterial umbilical (com solução de dextrose para manutenção da permeabilidade do mesmo) em posição incorrecta (entre D11 e L1), dirigido para o tronco celíaco que irriga directamente o pâncreas, poderá verificar-se igualmente estimulação da secreção de insulina com idênticas consequências;
- Exsanguinotransfusão com sangue hiperglicémico contendo citrato-fosfato-dextrose.
Outros mecanismos
A hipoglicémia pode surgir também de forma persistente ou recorrente por diversos mecanismos tais como: doenças hereditárias da neoglucogénese, da cetogénese, da glicogenólise, alterações endócrinas (hipopituitarismo, insuficiência adrenocortical, défice de hormona de crescimento, hiperinsulinismo congénito, certas formas da chamada síndroma de Beckwith – Wiedemann, etc.).
O hiperinsulinismo congénito (anteriormente designado nesidioblastose), constituindo a causa mais comum de hipoglicémia persistente no recém-nascido, deve ser destacado. A sua base etiopatogénica engloba várias entidades clínicas a que correspondem outros tantos mecanismos: alteração na regulação da secreção de insulina, defeitos dos canais de potássio regulados pelo ATP, formas autossómicas recessivas e dominantes (em relação com mutações de genes no cromossoma 11), défice da activação da glucoquinase, défice da activação do glutamato desidrogenase, défice da isomerase da fosfomanose, etc..
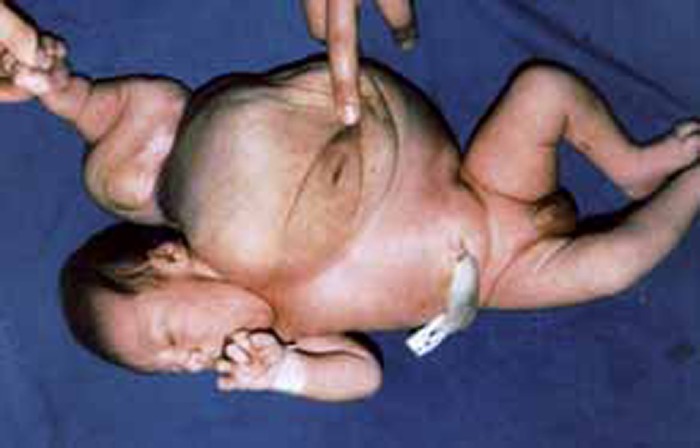
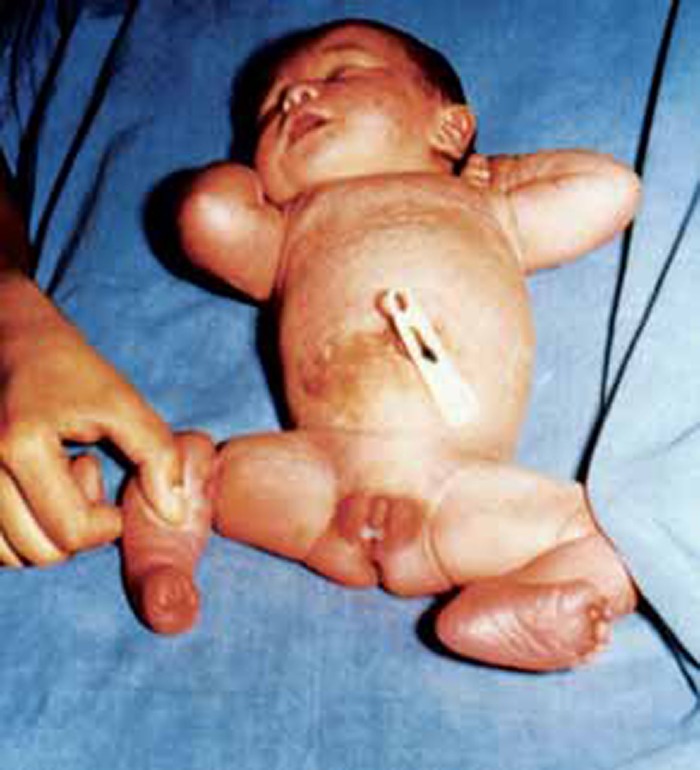
A síndroma de Beckwith-Wiedemann também merece ser destacada por cursar em 50% dos casos com hipoglicémia hiperinsulinémica por hiperplasia das células beta dos ilhéus; caracteriza-se fundamentalmente por visceromegália, onfalocele, macroglóssia, gigantismo e microcefalia.
O gigantismo é relacionado com mutações no cromossoma 11p15.5 em região próxima à dos genes da insulina e do IGF-2. Por outro lado, associa-se a tendência para certas neoplasias como tumor de Wilms, hepatoblastoma, carcinoma da suprarrenal, rabdomiossarcoma, etc..
Como será fácil depreender, as formas persistentes e recorrentes de hipoglicémia, estão habitualmente associadas a manifestações clínicas mais graves e a maior probabilidade de sequelas neurológicas.
Os Quadros 1 e 2 sintetizam as principais situações clínicas com risco elevado de hipoglicémia neonatal, especificando-se, nalgumas delas, a respectiva etiopatogénese.
| [Nota referente à terminologia de hiperinsulinismo: Embora no RNMD exista hiperinsulinismo fetal (congénito), o mesmo não é considerado de causa genética (permanente), mas adquirido in utero (transitório)]. |
QUADRO 1 – Hipoglicémia neonatal (formas transitórias).
(*) Consultar texto sobre a etiopatogénese e o Capítulo sobre Embriofetopatia Diabética |
Problemas maternos (*)
|
Problemas neonatais (*)
|
QUADRO 2 – Hipoglicémia neonatal (formas persistentes).
Causas endócrinas e doenças hereditárias do metabolismo |
Hiperinsulinismo
|
Défice de regulação hormonal
|
Défice de oxidação dos ácidos gordos
|
Doenças por erros da neoglucogénese
|
Glicogenoses
|
Outras
|
Manifestações clínicas
Na maioria dos casos a hipoglicémia é assintomática, não se verificando sequelas. Tal poderá explicar-se pelas circunstâncias de aquela não persistir para além de 2-3 horas, e de se verificar a utilização de lactato e corpos cetónicos como substratos metabólicos alternativos.
As manifestações clínicas de hipoglicémia – que são inespecíficas – globalmente constituem um epifenómeno da libertação de catecolaminas (por ex. taquicárdia e sudação), e do défice de glicose cerebral (por ex. tremores, hiperexcitabilidade, letargia, convulsões, coma, etc.). Outros sinais associados incluem: apneia, cianose, dificuldade respiratória, recusa alimentar, hipotensão, mioclonias, etc..
Diagnóstico
Uma vez que, como foi referido, a hipoglicémia nem sempre é sintomática, torna-se imprescindível proceder ao rastreio através de fitas reagentes-Dextrostix®, BMtest®, etc. – (colheita de sangue capilar na região calcaneana) – a partir das 3 horas de vida e nas primeiras 24-72 horas, – nos RN considerados de risco elevado, com prioridade para: RN PT e/ou de MBP, RN com RCIU, RNMD, RN macrossomáticos (> 4.000 gramas), RN grandes ou de peso excessivo para a idade gestacional.
Por outro lado, tal determinação é obrigatória sempre que exista qualquer sinal suspeito.
Chama-se a atenção para a necessidade de a técnica de colheita de sangue capilar ser realizada correctamente (cuidados de assépsia e aquecimento prévio do pé com o objectivo de promover vasodilatação e facilitar o fluxo de sangue).
No RN sem factores de risco, uma determinação confirmada de glicémia plasmática muito baixa deve levantar a suspeita de hipoglicémia de causa metabólica ou endócrina.
Determinadas situações obrigarão a esclarecimento etiológico mais complexo (investigação alargada incluindo outros exames laboratoriais), nomeadamente: hipoglicémia sintomática no recém-nascido de termo, alterações da consciência ou convulsões, hipoglicémia persistente ou recorrente, necessidade de perfusão endovenosa de glicémia com valores superiores a 10 mg/kg/minuto (ver adiante), síndroma malformativa associada a hiperinsulinismo, e história familiar de morte súbita ou de síndroma de Reye.
O Quadro 3 resume os exames complementares e parâmetros laboratoriais a investigar nos casos de hipoglicémia persistente ou recorrente (suspeita de doença endócrina ou hereditária do metabolismo).
QUADRO 3 – Investigação em casos de suspeita de doença endócrina ou doença hereditária do metabolismo (hipoglicémia persistente ou recorrente).
Sangue
|
Urina
|
Outros
|
Constituem principais critérios de diagnóstico de hiperinsulinismo perante glicose no sangue < 50 mg/dL:
- Insulina no plasma < 2 uU/mL;
- Ácidos gordos no plasma < 1,5 mmol/L;
- Beta-hidroxibutirato < 2,0 mmol/L.
A elevação da glucose em 40 mg/dL, ou mais, após administração de glucagom (50 mcg/kg até máximo de 1 mg IV ou IM), coincidindo com hipoglicémia, sugere estado hiperinsulinémico com reservas de glicogénio adequadas e enzimas da glicogenólise intactas.
Se a amoniémia estiver elevada, atingindo 200 mmol/L, há que admitir mutação nos genes implicados na activação da glutamato desidrogenase/ deficiência desta enzima (ver atrás).
Tratamento
O principal objectivo do tratamento da hipoglicémia neonatal é manter o nível de glucose plasmática superior a 45 mg/dL.
Hipoglicémia sintomática
Uma vez diagnosticada, e independentemente do factor etiológico, é utilizado o seguinte procedimento:
- Administração de glucose IV em bolus: 200 mg/kg (2 ml/kg de soro glicosado a 10%) em cerca de 2 a 3 minutos; de salientar que este procedimento (200 mg/kg em bolus inicial) é desaconselhado por certos autores, como Rozance (bibliografia de 2020);
- O referido bolus deve ser sempre seguido de administração contínua de glicose IV na dose de ~ 8 mg/kg/minuto durante cerca de 1 hora, ao fim da qual se deve proceder à determinação da glicémia com fita reagente.
Se o valor da glicémia for > 45 mg/dL, a dose de glucose deve ser reduzida para 6 mg/kg/minuto durante três horas; se o valor da glicémia se mantiver > 45 mg/dL, deve reduzir-se progressivamente o suprimento de glucose em 1 mg/kg/minuto cada 12 horas (verificando a glicémia com tira reagente cerca de 1 hora após redução da dose) até se atingir a dose de glucose IV de 4 mg/kg/minuto, a manter durante mais cerca de 24 horas com determinações da glicémia de 8-8 horas; se durante a administração IV da solução de glucose neste período os valores da glicémia forem > 45 mg/dL, suspende-se a perfusão de glucose com ulteriores determinações da glicémia, três a 4 vezes por dia em função do contexto clínico.
Se o valor da glicémia se mantiver < 45 mg/dL após bolus inicial e início de perfusão de glucose na dose de 8 mg/kg/minuto, deve repetir-se o bolus e aumentar a dose de glucose progressivamente, não ultrapassando 12 mg/kg/minuto.
No RN com hiperinsulinismo persistente (demonstração de níveis excessivos de insulina para as concentrações séricas simultâneas de glicose) adopta-se o seguinte procedimento: – deve manter-se a glicémia > 64 mg/dL (> 3,5 mmol/L), o que poderá obrigar à necessidade de suprimento de glucose da ordem de 15 a 20 mg/kg/min e de soluções glucosadas com concentração superior a 10%; – deve igualmente manter-se o suprimento alimentar por via entérica sempre que possível (preferência para o leite materno, se necessário com a utilização de sonda orogástrica) assegurando acesso venoso permanente.
Regras práticas importantes:
|
Hipoglicémia assintomática
No caso de glicémia < 36 mg/dL (< 2 mmol/L) tratando-se de RN de termo, assintomático, de peso adequado para a idade gestacional e sem factores de risco, com idade superior a 3 horas de vida, o RN deve ser alimentado – de preferência com leite materno – determinando-se a glicémia ao cabo de 2-3 horas após a refeição. Alguns autores empregam uma dose de dextrose em gel bucal (200 mg/kg, podendo ser repetida), precedendo a alimentação oral descrita.
No caso de glicémia mantida < 36 mg/dL, ao mesmo tempo que é providenciada a alimentação entérica (por via oral ou por sonda em função do contexto clínico) deve ser iniciada administração de soluto de glucose IV na dose de 6 mg/kg/minuto, procedendo-se depois de modo idêntico ao descrito anteriormente para o tratamento da hipoglicémia sintomática.
Prevenção
As medidas de prevenção da hipoglicémia neonatal têm em vista facilitar a adaptação metabólica do feto à vida extrauterina na perspectiva dos eventos descritos a propósito da etiopatogénese.
- No RN saudável sem factores de risco: promoção do aleitamento materno colocando aquele ao peito da mãe já no bloco de partos para estímulo da secreção do colostro e leite; com efeito, o leite materno diminui o consumo de glicose, fomentando a cetogénese.
- RN com RCIU e RNPT com idade gestacional inferior a 32 semanas: suprimento de glicose endovenosa a 10% em dose semelhante à produção hepática endógena (> 6 mg/kg/minuto) e início precoce da alimentação com leite materno.
No RNPT em que não haja contra-indicação de alimentação entérica, a administração de triglicéridos de cadeia média promove a elevação da glicose no sangue; por outro lado, deve ser evitado o suplemento de polímeros de glicose pelo risco de intolerância alimentar e pelos riscos associados à hiperosmolaridade (por ex. enterocolite necrosante). - RN de mãe diabética (RNMD): o nadir esperado da hipoglicémia verifica-se em geral cerca das 4-6 horas de vida, podendo manter-se até às 48 horas, particularmente nos casos de glicémia materna pré-intraparto > 8 mmol/L (> 144 mg/dL).
O procedimento preventivo inclui início precoce da alimentação e determinação da glicémia imediatamente antes da mamada, esperando obter-se valores estáveis e boa adaptação ao peito ou biberão. - Nalguns centros existe experiência, com bons resultados, da utilização de gel de dextrose por via bucal.
Prognóstico
A probabilidade de sequelas neurológicas depende fundamentalmente da gravidade da hipoglicémia, da sua duração sem tratamento correctivo e especialmente da eventualidade de surgimento de convulsões.
As sequelas neurológicas descritas em estudos epidemiológicos dizem respeito a alterações do desenvolvimento cognitivo, a anomalias motoras e a convulsões recorrentes.
HIPERGLICÉMIA
Definição e importância do problema
O diagnóstico de hiperglicémia neonatal é biológico: define-se pela verificação de glicose plasmática em concentração > 125 mg/dL no RN de termo e > 150 mg/dL (> 8,2 mmol/L) no RNPT.
Trata-se duma alteração metabólica neonatal menos frequente que a hipoglicémia, embora ocorra com elevada prevalência nos RNPT submetidos a terapia intensiva, especialmente nos de peso inferior a 1.250 gramas (cerca de 30%-40%). Nalguns estudos tem-se verificado elevação da mortalidade e da duração do internamento quando os valores da glicémia ultrapassam 150 mg/dL nas primeiras 24 horas de internamento.
A importância deste problema clínico, com implicações prognósticas, decorre fundamentalmente das repercussões na osmolaridade do soro (o incremento de 18 mg/dL de glicémia provoca elevação de 1 mOsm/L) com consequências em vários territórios, nomeadamente SNC (probabilidade de hemorragia intraperiventricular-HIPV).
Etiopatogénese
O suprimento excessivo de glicose endovenosa é um factor causal frequente de hiperglicémia, sobretudo no RNPT, em relação inversa com a idade gestacional; a frequência atinge o acme nos RN pré-termo extremo (22-27 semanas).
Com efeito, em tais circunstâncias, há que valorizar as seguintes particularidades da fisiopatologia:
- Neoglucogénese não totalmente inibida pela presença de glicose;
- Insuficiência de insulina;
- Certo grau de resistência periférica à acção da insulina e;
- Elevação dos níveis circulatórios de catecolaminas e cortisol.
A administração parentérica de lípidos constitui outro factor etiológico: aumenta a neoglucogénese fundamentalmente através do aumento da oxidação de ácidos gordos.
Determinados fármacos, tais como a dexametasona, aminofilina e cafeína poderão originar hiperglicémia transitória através do estímulo de enzimas da neoglicogénese; no caso da cafeína verifica-se concomitantemente estimulação de enzimas da glicogenólise hepática.
Nas infecções sistémicas (em que existe igualmente probabilidade de hipoglicémia) o mecanismo da hiperglicémia relaciona-se com anomalias da resposta da insulina à elevação da glicose sanguínea, assim como da neoglicogénese e da glicogenólise por acção de mediadores inflamatórios.
No âmbito de procedimentos cirúrgicos, a hiperglicémia explica-se pela dor e estresse que originam libertação de catecolaminas, glucagom e cortisol favorecendo a glicogenólise hepática. Noutras situações acompanhadas de estresse (asfixia perinatal, SDR, etc.) verifica-se idêntico mecanismo.
A hiperglicémia pode igualmente constituir um epifenómeno duma entidade clínica rara designada por diabetes mellitus transitória neonatal (englobando outras alterações para além da hiperglicémia: desidratação, acidose metabólica e cetonémia), associada em cerca de 30% dos casos a antecedentes familiares de diabetes mellitus. Mais frequente nos RN com RCIU, o mecanismo relaciona-se essencialmente com atraso na maturação dos mecanismos libertadores de insulina das células beta dos ilhéus pancreáticas. Habitualmente verifica-se regressão completa do quadro clínico ao cabo de 1-3 meses de vida extrauterina.
Em suma, no Quadro 4 são discriminados os factores etiológicos mais comuns da hiperglicémia neonatal.
QUADRO 4 – Factores etiológicos mais comuns de hiperglicémia neonatal.
Administração endovenosa
|
Fármacos
|
Estresse, dor
|
Manifestações clínicas e diagnóstico diferencial
Em geral a hiperglicémia não se acompanha de manifestações clínicas específicas. A glicosúria secundária a hiperglicémia pode levar a poliúria.
Nos casos de diabetes mellitus transitória, como foi descrito, pode verificar-se perda de peso, desidratação e acidose metabólica.
No âmbito da vigilância laboratorial da urina para pesquisa de glicosúria, há que reter uma noção prática importante: algumas tiras reagentes de diagnóstico rápido detectam “açúcares” em geral, os quais poderão englobar outros para além da glicose (como por ex. a galactose, o que indicaria a presença de galactosémia).
Tratamento
A actuação no caso da hiperglicémia deve ser sobretudo preventiva, ponderando o possível efeito dos factores etiológicos descritos eventualmente presentes. Como norma geral, deve providenciar-se nutrição adequada, mantendo a glicémia no intervalo de valores que não originem diurese osmótica ou necessidade de intervenção agressiva (no caso de glicémia entre 150-180 mg/dL).
Com a utilização de bombas de perfusão permitindo doses e ritmos de administração e concentrações de glicose bem controlados, monitorizando a glicose plasmática e urinária, não será necessária a utilização de insulina.
Se, apesar dos referidos procedimentos, a glicémia persistir > 300 mg/dL, mesmo reduzindo a glicose administrada, deve ser utilizada insulina regular na dose de 0,05-0,1 Unidades/kg IV, com monitorização rigorosa da glicémia.
Nos casos comprovados de diabetes mellitus transitória neonatal pode utilizar-se insulina regular IV ou SC: em regra 0,1-0,5 U/kg/dose IV ou SC de 6-6 ou 8-8 horas, ou de modo contínuo na dose de 0,1 U/kg/hora.
BIBLIOGRAFIA
Cloherty JP, Stark AR (eds). Manual of Neonatal Care. Philadelphia; Wolters & Kluwer, 2017
Cowett RM, Farrag HM. Selected principles of perinatal-neonatal glucose metabolism. Semin Neonatol 2004; 9: 37-47
Cornblath M, Hawdon JM, Williams AF, et al. Controversies regarding definition of neonatal hypoglycemia: suggested operational thresholds. Pediatrics 2000; 105: 1141-1145
Cornblath M, Ichord R. Hypoglycemia in the neonate. Semin Perinatol 2000; 24:136-149
Delonlay P. Neonatal hyperinsulinism: Clinicopathologic correlation. Hum Pathol 2007; 38: 387-399
Deshpande S, Platt MW. The investigation and management of neonatal hypoglycaemia. Semin Fetal Neonatal Med 2005; 10: 351-361
Eidelman A. Hypoglycemia and the breastfed neonate. Pediatr Clin North Am 2001; 48: 377-387
Gardner SL, Carter BS, Enzman-Hines ME, Hernandez JA (eds). Merenstein & Gardner’s Handbook of Neonatal Intensive Care. St Louis, MO: Elsevier, 2018
Guimarães JC, Carneiro MJ, Loio P, Macedo A, Tuna ML, et al. Manual Prático de Neonatologia. Lisboa: Hospital de S. Francisco Xavier/Uriage, 2016
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Levene I, Wilkinson D. Identification and management of neonatal hypoglycaemia in full-term infant. Arch Dis Child Education & Practice 2018 on-line June 14. Doi: 10.1136/archdischild-2018-314050
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Rozance PJ, Hay WW Jr. New approaches to management of neonatal hypoglycemia. Matern Health Neonatol Perinatol 2016; 2:3
Rozance PJ, Wolfsdorf JI. Hypoglycemia in the newborn. Pediatr Clin N Am 2019; 66: 333-342
Sperling MA., Menon RK. Differential diagnosis and management of neonatal hypoglycemia. Pediatr Clin North Am 2004; 51: 703-723
Wackernagel D, Gustafsson A, Bonamy A-KE. Swedish national guideline for prevention and treatment of neonatal hypoglycaemia in newborn infants with gestational age ≥35 weeks. Acta Paediatrica 2020; 109: 31-44
Williams A F. Neonatal hypoglycaemia: Clinical and legal aspects. Semin Fetal Neonatal Med 2005; 10: 363-368
Yeung MY. Glucose intolerance and insulin resistance in extremely premature newborns, and implications for nutritional management. Acta Paediatr 2006; 95: 1540-1547