Importância do problema
A terapêutica transfusional é determinante em clínica pediátrica, nomeadamente no tratamento de situações clínicas do foro hemato-oncológico e em vários procedimentos cirúrgicos.
Embora se trate de uma terapêutica indispensável na medicina moderna, a mesma não é isenta de riscos, relacionados designadamente com erros de identificação, colheita da amostra para testes pré-transfusionais, erros de administração do componente ou reacções transfusionais imprevisíveis.
Para minorar estes problemas, há que chamar a atenção para alguns pontos críticos do processo transfusional:
A. Prescrição
- Implementar, sempre que possível, uma estratégia restritiva, ponderando criteriosamente a necessidade de prescrição de cada componente sanguíneo e do registo no processo clínico.
- Considerar os riscos e benefícios desta terapêutica utilizando preferencialmente as terapêuticas alternativas mais seguras, se existirem.
- Prescrever segundo as Normas de Orientação Clínica Nacionais sobre a temática a abordar, pressupondo que as mesmas são actualizadas e auditadas periodicamente.
- Obter o consentimento esclarecido do doente e/ou da família.
B. Colheita da amostra para testes pré-transfusionais
- Promover uma política restritiva em relação ao número e volume de amostras colhidas.
- Só efectuar a colheita de amostra para testes pré-transfusionais após a decisão da prescrição.
- Antes da colheita da amostra, proceder sempre à identificação do doente e da amostra (à cabeceira deste) e verificar a concordância da identificação com o pedido/requisição.
C. Testes pré-transfusionais e selecção do componente a transfundir
- Executar os testes pré-transfusionais preconizados de acordo com a idade do doente.
- Implementar uma estratégia restritiva do número de dadores por doente submetido a transfusão, subdividindo as unidades, utilizando a mesma unidade durante todo o seu período de validade, sempre que possível.
D. Administração do componente
- Proceder à identificação do doente verificando a concordância com a identificação do componente, evitando erros de administração que podem ser fatais.
- Monitorizar os parâmetros vitais durante a transfusão e efectuar os respectivos registos no processo clínico.
Nos últimos anos tem havido uma evolução muito significativa na prática transfusional graças a implementação de programas de Patient Blood Management, que contemplam a sempre actual redução do volume e número de amostras colhidas, a prática transfusional restritiva e a correcção atempada das alterações da hematopoiese e coagulação, a doentes que irão ser submetidos a procedimentos cirúrgicos potencialmente muito hemorrágicos.
Neste capítulo, para melhor compreensão da problemática da terapêutica transfusional, alguns aspectos dos procedimentos e das atitudes a tomar são acompanhados pela abordagem dos respectivos fundamentos na fisiopatologia e nas particularidades do grupo etário pediátrico. (ver adiante Glossário).
Particularidades fisiológicas influenciando a terapêutica transfusional
Anemia fisiológica da infância
Um recém-nascido (RN) de termo saudável apresenta valores médios de hemoglobina de 16,8 ± 1,6 g/dL. Se se tratar de RN pré-termo, os valores diminuem para 15,8 ± 2,4 g/dL.
Durante as primeiras semanas de vida verifica-se um declínio do teor da hemoglobina (Hb). Tal declínio fisiológico da hemoglobina (que pode atingir 9 g/dL e o nadir por volta das 10-12 semanas), é bem tolerado no RN de termo. Esta situação corresponde à chamada anemia fisiológica do lactente.
Na criança nascida prematuramente (antes das 37 semanas de gestação), este declínio ocorre mais cedo (4-6 semanas), é mais pronunciado e habitualmente é exacerbado pelas múltiplas flebotomias necessárias para a realização de estudos analíticos. Pode, assim verificar-se, anemia sintomática (por exemplo, episódios de apneia, taquicárdia, taquipneia, défice ou ausência de progressão ponderal), podendo implicar terapêutica transfusional.
Os factores que influenciam a anemia fisiológica da infância são:
- Diminuição da síntese de eritropoietina, pois no RN saudável a PO2 do sangue arterial é elevada, permitindo uma melhor oxigenação dos tecidos;
- Menor sobrevida dos eritrócitos fetais (60 a 90 dias no RN de termo e 35 a 50 dias no pré-termo vs 100 a 120 dias em crianças mais velhas e adultos);
- Aumento rápido da volémia, acompanhando o crescimento do bebé.
Resposta fisiológica à hipovolémia
A volémia depende do peso corporal e da idade gestacional. Num RN de termo é cerca de 85 ml/kg e, no RN pré-termo, cerca de 100 ml/kg.
A hipovolémia é menos bem tolerada pelo RN comparativamente ao adulto, uma vez que após perdas > 10% da volémia, o débito cardíaco diminui sem que haja aumento compensatório da frequência cardíaca. Assim, a pressão arterial do RN é mantida a custo do aumento da resistência vascular periférica, com consequente diminuição da perfusão tecidual e acidose metabólica.
Imaturidade do sistema imunitário
Somente por volta dos 3 meses de idade as crianças começam a adquirir capacidade de sintetizar imunoglobulinas. Até aí, a imunidade humoral depende dos anticorpos que foram adquiridos a partir da mãe, por transferência placentária.
Por outro lado, se a mãe for portadora de anticorpos antieritrocitários ou antiplaquetários, estes estarão presentes em circulação durante este período, o que pode ter repercussão clinicamente significativa.
Assim, os testes pré-transfusionais realizados até aos 4 meses de idade são distintos dos praticados nos restantes grupos etários.
A imunidade celular também não se encontra devidamente desenvolvida, pelo que há maior susceptibilidade associada à transfusão, sobretudo após transfusões intra-uterinas ou em RN com quadros de imunodeficiência congénita.
Transfusão nos primeiros 4 meses de idade
Procedimentos pré-transfusionais
Os testes pré-transfusionais nos primeiros 4 meses de vida diferem dos realizados nos restantes grupos etários devido a:
- Fraca expressão dos antigénios eritrocitários do sistema AB0, não se podendo garantir uma correcta determinação do grupo sanguíneo da criança;
- Ausência de produção de anticorpos, nomeadamente as aglutininas anti-A ou anti-B, cuja determinação é necessária para uma correcta determinação do grupo AB0;
- Presença de anticorpos de origem materna, com eventual significado clínico.
Assim, antes da primeira transfusão deve adoptar-se o seguinte procedimento:
- Tipagem AB0 – apenas a prova globular (determinação dos antigénios do sistema AB0, expressos na superfície do eritrócito), não se efectuando a prova sérica (determinação das aglutininas);
- Tipagem Rh e Kell. Nos recém-nascidos de mãe Rh (D) negativa, a determinação do antigénio D deve incluir a pesquisa de D variante e, se necessário, deve administrar-se imunoglobulina anti-D à mãe;
- Teste de anti-globulina humana directo com soro poliespecífico – para identificar eventuais anticorpos de origem materna ligados aos eritrócitos do RN. Se positivo, deve efectuar-se eluição e testar o eluído contra um painel de células dos grupos 0, A e B. Se for identificado o anticorpo no soro materno, estes estudos não são necessários;
- Pesquisa de anticorpos irregulares – utilizando preferencialmente o soro/plasma materno. Se a amostra da mãe não estiver disponível, deve efectuar-se com soro/plasma do RN;
- Prova de compatibilidade – utilizando preferencialmente o soro/plasma materno e os eritrócitos do dador. Se a amostra da mãe não estiver disponível, deve efectuar-se com soro/plasma do RN.
Concentrado eritrocitário
O concentrado eritrocitário (CE) é o componente mais transfundido no período neonatal, sendo a indicação mais frequente a anemia sintomática.
A dose preconizada é de 10-15 mL/kg, sendo expectável um incremento de 2 a 3 g/dL no valor de Hb.
Os níveis de Hb abaixo dos quais se recomenda a transfusão de CE dependem não só da idade cronológica, como da idade gestacional e da situação cardiorrespiratória da criança.
Em geral, as transfusões são realizadas para manter um nível de hemoglobina e de hematócrito (Ht) que se pensa ser o mais benéfico para a situação clínica de cada doente, permitindo uma adequada oxigenação dos tecidos. É largamente reconhecido que a decisão de transfusão baseada nestes princípios é imprecisa; contudo, não existe ainda a possibilidade de fundamentar a decisão transfusional em critérios mais fisiológicos, como a determinação da massa eritrocitária circulante ou a capacidade de extracção de oxigénio pelos tecidos.
No Quadro 1 apresentam-se recomendações quanto à transfusão de CE em crianças com idade ≤ 4 meses.
QUADRO 1 – Critérios para transfusão de concentrado eritrocitário em crianças com idade ≤ 4 meses
| 1. Hb ≤ 7 g/dL ou Ht ≤ 20%, com reticulócitos < 4%, se assintomático. |
2. Hb ≤ 9 g/dL ou Ht ≤ 30%, na presença de um dos seguintes:
|
3. Hb ≤ 12 g/dL ou Ht ≤ 35%
|
4. Hb ≤ 13 g/dL ou Ht ≤ 40%
|
Após ter sido tomada a decisão de transfundir, é importante dispor de um produto de boa qualidade e de baixo risco, pelo que os CE administrados devem ser desleucocitados (conteúdo de leucócitos < 1 milhão de elementos por unidade), e provenientes de dadores regulares.
No período neonatal devem ser desenvolvidas estratégias que minorem as perdas sanguíneas em flebotomias, com meticuloso controlo e ponderação de todas as colheitas efectuadas. As flebotomias contribuem para agravar a anemia e estão associadas a maiores necessidades transfusionais.
Para minorar os riscos tranfusionais, nas transfusões de pequeno volume, deverão ser utilizadas estratégias que reduzam a exposição a dadores por transfusão, subdividindo as unidades em múltiplas fracções, e utilizando o componente durante todo o seu período de viabilidade. Deste modo, quando se selecciona um CE para este grupo etário dever-se-á escolher um colhido recentemente de forma a poder ser utilizado durante os 42 dias de viabilidade.
Quando há necessidade de transfusão de grandes volumes, há risco de hipercaliémia e hipocalcémia; em tal cicunstância recomenda-se a transfusão de concentrados eritrocitários colhidos há menos de 5 dias, com monitorização do potássio e cálcio séricos. (Duração da transfusão: 60-120 minutos, com vigilância cardiovascular, nunca > 6 horas).
As particularidades da transfusão intra-uterina e exsanguinotransfusão neonatal são abordadas na alínea sobre “situações especiais”.
Concentrado plaquetário
O valor da contagem plaquetária do RN é semelhante ao do adulto, com valores de referência que oscilam entre 150 a 450 x 109/L.
A trombocitopénia é uma das alterações hematológicas mais comuns no período neonatal, afectando cerca de 20% dos RN internados em cuidados intensivos. Múltiplos mecanismos podem estar envolvidos na sua etiopatogénese, sendo alguns dos principais: acelerada destruição de plaquetas, a deficiente produção de trombopoietina, o efeito de diluição secundário à transfusão maciça, ou exsanguinotransfusão (ET). (ver Capítulo sobre Trombocitopénia e Trombocitose)
O Quadro 2 resume as principais situações em que a transfusão de plaquetas está indicada.
QUADRO 2 – Critérios para transfusão de plaquetas
| 1. Contagem plaquetária ≤ 30 x 109/L em RN assintomático |
| 2. Contagem plaquetária ≤ 10 x 109/L após o período neonatal, se assintomático |
3. Contagem plaquetária ≤ 50 x 109/L na presença de um dos seguintes factores:
|
| 4. Contagem plaquetária ≤ 100 x 109/L, antes do início de ECMO |
5. Independentemente do nº plaquetário, na presença de um dos seguintes factores:
|
O concentrado plaquetário deve ser administrado na dose de 5-10 mL/Kg (~1 U/5 kg de peso). Na ausência de destruição periférica aumentada ou perdas hemáticas mantidas, admite-se um aumento na contagem plaquetária até 50 x 109/L.
É também aconselhável que as plaquetas a transfundir sejam do mesmo grupo do do doente no sistema AB0, para evitar eventual hemólise provocada pela exposição a aglutininas anti-A e anti-B presentes no componente. Actualmente, contudo, na maioria dos casos os componentes produzidos não são suspensos em plasma do dador, mas sim numa solução aditiva própria, pelo que a quantidade de anticorpos presentes é reduzida.
Como referido anteriormente, é importantíssimo minorar a exposição a múltiplos dadores pelo que, preferencialmente, as crianças deverão ser transfundidas com concentrados unitários de plaquetas (CUP). Sempre que necessário os CUP, poderão igualmente ser subdivididos em pequenas porções e utilizados durante todo o seu período de conservação. (Duração da transfusão: 20-30 minutos, sem alteração cardiovascular, nunca > 4 horas).
Plasma fresco congelado
A proporção de factores da coagulação que atravessa a placenta durante a gravidez não é suficiente para manter a hemostase após o parto; tais factores serão progressivamente sintetizados pelo RN no período pós-natal.
Habitualmente, durante a primeira semana de vida, os níveis fisiológicos dos factores de coagulação vitamina-K dependentes (II, VII, IX e X) e da via de contacto (XI, XII, pré-calicreína e cininogénio de baixo peso molecular) são baixos, o que explica que o tempo de protrombina (TP) e tempo parcial de tromboplastina activada (TTPa) estejam prolongados comparativamente aos de crianças mais velhas e adultos.
Por outro lado, os inibidores naturais da coagulação (antitrombina III, proteínas C e S) também apresentam níveis baixos. Estes dois sistemas equilibram-se e, por isso, hemorragias espontâneas e tromboses são raras no recém-nascido saudável.
Nesta fase, qualquer perturbação neste sistema, pode levar à ocorrência de hemorragias significativas.
O Quadro 3 mostra as idades em que determinados testes de coagulação mais comuns evidenciam valores semelhantes aos do adulto.
QUADRO 3 – Idades em que os testes de coagulação evidenciam valores semelhantes aos do adulto
| Teste laboratorial | Idade em que se atingem valores semelhantes aos do adulto |
| TTPa | 16 anos |
| TP | 16 anos |
| INR | 16 anos |
| TT | 5 anos |
| PFA-100 | 1 mês |
Nos países desenvolvidos, a introdução da administração profiláctica de vitamina K intramuscular a todos os RN após o parto levou a que a incidência de doença hemorrágica do recém-nascido diminuísse drasticamente, passando a ser uma raridade.
O plasma fresco congelado (PFC) pode ser utilizado para substituir os factores da coagulação, particularmente quando estão envolvidas deficiências múltiplas.
O Quadro 4 refere as indicações para transfusão de PFC no período neonatal, que são semelhantes às preconizadas em crianças mais velhas e adultos.
QUADRO 4 – Indicações para transfusão de PFC
| 1. Reposição de deficiência congénita de um factor procoagulante ou anticoagulante, quando não existam disponíveis concentrados específicos |
| 2. Reposição de deficiência isolada de factor V |
| 3. Hemorragia activa devida a deficiência múltipla de factores, incluindo coagulação intravascular disseminada (CIVD), trauma, transfusão maciça ou cirurgia de bypass cardiovascular |
Salienta-se, pois, que a transfusão de PFC não deve ser utilizada para correcção de alterações laboratoriais sem expressão clínica, reposição ou expansão de volume, reposição de proteínas ou suporte nutricional. Após administração da dose recomendada (10-20 mL/kg), obtém-se um aumento da actividade de cada factor na ordem de 15 a 20%, excepto se na presença de CIVD.
O plasma deve ser AB0 compatível e livre de anticorpos clinicamente significativos. Pela ausência de aglutininas anti-A ou anti-B, o plasma do grupo AB é muitas vezes o utilizado, neste grupo etário. (Duração da transfusão: 20-30 minutos, nunca > 2 horas).
Transfusão na idade superior a 4 meses, incluindo o adolescente
Os testes pré-transfusionais recomendados em crianças com mais de 4 meses de idade são idênticos aos recomendados para o doente adulto: grupagem AB0, Rh e Kell (prova globular e prova sérica), pesquisa de anticorpos irregulares e provas de compatibilidade. Com validade de 72 horas, os mesmos devem ser efectuados antes de qualquer transfusão.
Concentrado eritrocitário
As indicações transfusionais de CE na criança com mais de 4 meses são muito semelhantes às do adulto, devendo no entanto ter-se em consideração determinadas especificidades: idade, volémia, capacidade de tolerância e de recuperação da anemia e etiologia da mesma.
Tal como no recém-nascido e lactente, o CE é o componente mais transfundido. É utilizado para aumentar a capacidade de transporte de oxigénio e manter uma adequada oxigenação dos tecidos, prevenindo a hipóxia.
Como referido anteriormente, a partir dos 3 meses começam a ser sintetizadas imunoglobulinas, pelo que as crianças deste grupo etário já apresentam anticorpos naturais do sistema AB0 e têm capacidade imunológica para formar alo-anticorpos anticorpos anti-eritrocitários, ou outros, dependendo do componente transfundido. Os glóbulos vermelhos transfundidos devem ser AB0 e Rh idênticos ou compatíveis, evitando o risco de reacções transfusionais hemolíticas agudas.
Na maioria dos casos, não é necessário utilizar CE com menos de 7 dias.
Contudo, existem situações clínicas especiais em que tal medida é essencial: na cirurgia cardíaca e nos doentes em regime de transfusões crónicas, de forma a que as células transfundidas, com maior durabilidade, viabilizem maior intervalo transfusional.
Políticas transfusionais restritivas têm permitido diminuir a utilização de CE, sem aumento da mortalidade ou morbilidade. Em crianças que não estejam em hemorragia activa ou sob regime de transfusões crónicas, a administração de uma unidade de CE, em doentes com mais de 25-30 kg, ou 10 mL/Kg nos de peso inferior, é suficiente para aumentar a Hb em cerca de +2 g/dL e aliviar a sintomatologia.
Neste grupo etário, verifica-se uma maior capacidade fisiológica de compensação da anemia do que nos adultos, pelo que, de uma forma geral, existe tolerância do organismo para níveis de Hb mais baixos.
As indicações para transfusão de concentrado eritrocitário em crianças com idade > 4 meses encontram-se discriminadas no Quadro 5. Dever-se-á ter em conta, não apenas o valor da Hb, mas também a presença de:
- Sinais e sintomas de anemia e a capacidade funcional do doente;
- Presença ou ausência de doença cardiorrespiratória e do sistema nervoso central;
- Etiologia da doença de base e ineficácia da terapêutica médica anterior;
- Terapêuticas alternativas, por exemplo ferro e eritropoietina.
Tal como no lactente com idade < 4 meses, devem ser desenvolvidas estratégias que minorem as perdas sanguíneas em flebotomias.
QUADRO 5 – Critérios para transfusão de concentrado eritrocitário em crianças com idade > 4 meses e adolescente
| 1. Hb ≤ 7 g/Dl ou Ht ≤ 20%, se assintomático |
2. Hb ≤ 9 g/dL ou Ht ≤ 30%, na presença de um dos factores seguintes:
|
3. Hb ≤ 13 g/dL ou Ht ≤ 40%, na presença de um dos factores seguintes:
|
| 4. Hemorragia aguda > 15% da volémia sanguínea total |
5. Anemia de células falciformes, na presença de um dos factores seguintes:
|
Na anemia aguda, contrariamente ao definido nos anos 90, em que a utilização agressiva de cristalóides e CE era o tratamento de base, actualmente recomenda-se a utilização precoce de CE, plasma e plaquetas, diminuindo o recurso aos cristalóides e dando ênfase à correcção da tríade letal de acidose, hipotermia e coagulopatia.
Em cirurgia pediátrica, as necessidades de CE são determinadas com base no “consumo standard” e “consumo máximo de CE” por procedimento cirúrgico. Estes últimos critérios são indicadores muito informativos sobre a necessidade de utilização de CE num determinado procedimento cirúrgico, evitando gastos desnecessários em reservas de componentes sanguíneos, bem como em reagentes e recursos humanos.
As maiores perdas ocorrem na cirurgia craniofacial, escoliose e cirurgia cardíaca. Os sinais e sintomas relacionados com anemia podem ser mais difíceis de avaliar em cirurgia, realçando-se que perdas superiores a 15% da volémia são indicadoras da necessidade transfusional.
A previsão das necessidades transfusionais pode ainda fazer-se numa base individual, calculando a perda máxima de sangue (PMS) tolerada, através da seguinte fórmula:
PMS = V (Ht i – Ht min) |
V = volémia
Ht i = hematócrito inicial
Ht min = hematócrito mínimo que o doente pode tolerar
Ht m = hematócrito médio
Sendo a anemia pré-operatória associada a maior necessidade transfusional, a realização de transfusão constitui um factor preditivo do aumento do tempo de internamento hospitalar, da maior susceptibilidade a infeccões, e de mortalidade mais elevada.
Assim, os doentes candidatos a cirurgia programada devem ser englobados em programas de gestão da administração de sangue e derivados (Patient Blood Management), conceito que consiste em reduzir o recurso à terapêutica transfusional, através da rendibilização da hematopoiese e da hemostase, tentando, a par, minorar as perdas. Tal estratégia concretiza-se com: – o uso de suplementos de ferro, oral ou endovenoso (EV), com ou sem estimulantes da eritropoiese; – o recurso a técnicas cirúrgicas e anestésicas que comportem menos perdas; e – a utilização de fármacos antifibrinolíticos, como o ácido tranexâmico.
Na anemia crónica, os efeitos metabólicos repercutem-se na afinidade da hemoglobina para o oxigénio, com implicações na sua libertação aos tecidos periféricos. Em tais circunstâncias, as crianças podem tolerar níveis muito baixos de Hb. Em tais circunstâncias, a correcção da anemia deve ser lenta, reavaliando o doente após cada unidade administrada.
Antes de iniciar um regime de transfusões regulares, os pacientes devem ser vacinados contra a hepatite B, determinando igualmente fenótipo eritrocitário detalhado, no sentido de evitar eventual alo-imunização eritrocitária na sequência de transfusões subsequentes.
A abordagem do problema da transfusão crónica nos doentes com doença de células falciformes e β-talassémia major será feita adiante.
No doente cardíaco, o compromisso na libertação de oxigénio aos órgãos críticos pode ocorrer antes de haver compensação fisiológica. Assim, nestes doentes, com limitada reserva fisiológica, poderá ser necessário manter o nível de Hb mais elevado.
Em oncologia, a anemia é frequente e de etiologia multifactorial: eritropoiese ineficaz, infiltração medular, défice de eritropoietina e vitaminas, assim como libertação de citocinas, entre outros factores. Apesar de não estar provado cientificamente qual o nível óptimo de Hb para estes doentes, com a transfusão restritiva, mantendo valores de 7-8 g/dL, têm sido obtidos resultados equivalentes aos que se obtêm com a prática liberal. As terapêuticas alternativas, como o ferro endovenoso e estimulantes da eritropoiese, devem ser consideradas.
A anemia hemolítica autoimune, definida pela destruição precoce dos glóbulos vermelhos, associada à presença de autoanticorpos, é rara na criança e difere da do adulto. As diferenças quanto à especificidade dos autoanticorpos envolvidos constituem os factores responsáveis pela grande variabilidade clínica. De salientar, a propósito, que os doentes com anemia hemolítica por autoanticorpos “quentes” poderão não ter hemólise grave.
O risco transfusional neste contexto é elevado pelas dificuldades nos testes pré-transfusionais. Os autoanticorpos reagem com todas as células-reagentes, tornando as provas de compatibilidade sempre positivas e, por vezes, os padrões de aglutinação são semelhantes aos verificados nos casos caracterizados pela presença de aloanticorpos.
Assim, perante a eventualidade de se proceder a transfusão com CE, a destrinça das duas situações é fundamental antes de seleccionar um CE para transfundir. Como se depreende, havendo destruição aumentada de eritrócitos a transfundir, a sobrevida dos mesmos é muito inferior.
Em suma, a transfusão nestes doentes deve ser restritiva e cingir-se a situações extremas e absolutamente indispensáveis, após estudos imuno-hematológicos adequados, os quais são difíceis e morosos.
Concentrado plaquetário
A decisão de transfundir plaquetas, controversa, depende da causa da hemorragia, da situação clínica do doente, assim como do número e da função das plaquetas circulantes.
Havendo hemorragia, a verificação de alterações qualitativas das plaquetas (hereditárias ou adquiridas) justificam a transfusão independentemente do número.
Na sua maioria, as transfusões de plaquetas são administradas a doentes do foro hemato-oncológico, e submetidos a cirurgia cardíaca.
A administração profiláctica de concentrados plaquetários deve ser bem ponderada devido ao risco de aloimunização e eventual ausência de resposta a transfusões ulteriores.
As indicações para a transfusão de plaquetas, bem como a dose recomendada para a criança e adolescente, são idênticas às do adulto (Quadro 2).
Tal como referido anteriormente, as plaquetas devem ser AB0 compatíveis com o receptor, e preferencialmente provenientes de um único dador, por colheita de aférese.
Na presença de aloimunização, devem ser utilizadas plaquetas de dador único, compatíveis no sistema HLA.
A trombocitopénia de etiologia imune não deve ser tratada com transfusões, excepto em caso de hemorragia intracraniana ou outras situações de risco de vida.
Na púrpura trombocitopénica trombótica e na trombocitopénia induzida pela heparina, poderá ocorrer a formação de trombos plaquetários ou outras complicações trombóticas após as transfusões de plaquetas, pelo que estas não estão indicadas.
Plasma fresco congelado
O plasma fresco pode ser obtido através de uma dádiva de sangue total ou por aférese.
Em Portugal, estão disponíveis três tipos de plasma, cujas propriedades são equivalentes:
- Plasma de quarentena – proveniente de um único dador com, pelo menos, duas dádivas, submetidas a controlos víricos. A primeira dádiva só é libertada após resultados negativos em ambas as colheitas;
- Plasma fresco com redução patogénica – resultante da junção de 2-3 dádivas, submetidas a redução patogénica com amotosaleno e a luz ultra-violeta; tal redução promove a destruição de todas as cadeias de ADN existentes, independentemente de se tratar de leucócitos, vírus ou fungos;
- Plasma solvente-detergente – produzido industrialmente, por junção de múltiplas dádivas (600 a 2000), filtradas e tratadas com tri(n-butyl) fosfato e octoxinol, de forma a eliminar bactérias, vírus e priões.
Uma vez que o plasma contém níveis fisiológicos dos factores lábeis e estáveis da coagulação, recomenda-se a sua utilização nas deficiências isoladas ou múltiplas da coagulação para as quais não exista ainda factor específico (Quadro 4).
As principais indicações para a transfusão de plasma são: plasmaféreses em doentes com PTT/SHU e na reversão de coagulopatias. Na transfusão maciça (transfusão superior a uma volémia em menos de 24 horas) é necessário administrar plasma fresco congelado, não só devido ao consumo de factores motivado pelas perdas hemorrágicas, mas também, pelo próprio efeito de diluição provocado pela transfusão.
As transfusões profilácticas de plasma, antes da realização de procedimentos invasivos, em doentes sem hemorragia activa, não está documentada.
Salienta-se, a propósito, que as provas científicas legitimando a realização de transfusões de plasma são muito limitadas.
Situações particulares
Transfusão intrauterina
As transfusões intrauterinas (TIU) são procedimentos invasivos cujo risco associado de morte fetal, em geral, cerca de 1 a 3%, pode atingir 20% em situações de hidropisia fetal.
Pelas dificuldades técnicas e riscos envolvidos, só devem ser realizadas entre as 16 e as 35 semanas de gestação, em centros especializados e com experiência na sua execução.
Após a colheita de sangue fetal, este deve ser imediatamente avaliado, com determinação do valor de hemoglobina e hematócrito fetal ou da contagem plaquetária, de acordo com a situação específica. Somente depois da obtenção destes resultados, a decisão de transfundir deverá ser tomada.
Aos pacientes que tenham sido submetidos a TIU devem ser administrados componentes sanguíneos irradiados até aos 6 meses de vida.
A TIU de concentrado eritrocitário é indicada em situações de anemia fetal, cuja causa mais frequente é a doença hemolítica perinatal. Os anticorpos mais frequentemente envolvidos são o anti-D, -c ou –Kell.
Com a TIU, o objectivo é atingir valores de hematócrito de 45%. Em situações graves, poderá ser necessário proceder a TIU recorrentes, a cada 2-3 semanas.
O volume a transfundir é calculado de acordo com a seguinte fórmula:
Ht desejado – Ht fetal x volémia da unidade feto-placentária (150 mL/kg) |
A transfusão deverá ser administrada a um ritmo lento (cerca de 5 mL/minuto), ainda mais reduzido na presença de hidropisia fetal (2-3 mL/minuto).
Para garantir a disponibilidade de componentes adequados, o serviço de imuno-hemoterapia deve ser contactado, pelo menos 24 horas antes da realização da TIU. As unidades de CE para TIU devem cumprir os seguintes requisitos:
- Colheita recente, menos de 5 dias;
- Grupo 0 ou AB0 -idêntico ao do feto;
- Fenótipo RhD e Kell negativo, e negativo para outros antigénios em causa;
- Compatível com o soro materno;
- Hemoglobina S negativo;
- Desleucocitado;
- Irradiado nas 24 horas anteriores à administração.
Antes do parto, é igualmente importante garantir a existência de concentrados eritrocitários antigénio-negativos, caso a transfusão neonatal seja necessária.
A anemia pode persistir nas primeiras semanas de vida, devido à permanência de anticorpos maternos em circulação conduzindo a hemólise.
Por outro lado, a própria TIU pode inibir transitoriamente a hematopoiese neonatal, sobretudo nos casos em que foram administradas várias transfusões. Nesta situação, a anemia hipoproliferativa poderá prolongar-se até às 8-12 semanas de vida.
A TIU de plaquetas está indicada em algumas situações de trombocitopénia aloimune fetal/neonatal em que o risco de hemorragia é elevado.
Tal como na aloimunização eritrocitária, na mãe desenvolvem-se anticorpos contra antigénios presentes nas plaquetas do feto. O antigénio mais frequentemente envolvido é o HPA-1A, responsável por cerca de 90% dos casos.
A decisão terapêutica depende da evolução das gravidezes anteriores e, nomeadamente, do valor da contagem plaquetária do feto ou RN, e da ocorrência de hemorragia fetal/neonatal.
Nalgumas situações, a terapêutica materna com corticoesteróides e/ou imunoglobulina endovenosa pode ser suficiente para evitar a necessidade de TIU.
As plaquetas para TIU devem ser:
- HPA-compatíveis com o soro materno, logo, negativas para o antigénio em causa;
- Irradiadas nas 24 horas anteriores à administração.
Mais uma vez, o serviço de imuno-hemoterapia deve ser contactado pelo menos 24 horas antes da realização da TIU para obtenção dos componentes necessários.
Perante um recém-nascido com diagnóstico suspeito ou comprovado de trombocitopénia aloimune fetal/neonatal/FNAIT, deve proceder-se a exames necessários para estabelecer o diagnóstico e iniciar a terapêutica logo que possível: imunoglobulina endovenosa e transfusão de concentrado plaquetário nas seguintes situações:
- Hemorragia activa;
- Contagem plaquetária < 30 x 109/L em RN de termo sem sinais de hemorragia ou outros factores de risco;
- Contagem plaquetária < 50 x 109/L, em RN pré-termo ou com outros factores de risco.
O objectivo das transfusões é manter um número plaquetário estável nas primeiras 72-96 horas de vida, uma vez que é neste período que há maior risco de hemorragia intracraniana.
As plaquetas devem ser HPA-compatíveis com o RN; contudo, se não estiverem disponíveis em tempo útil, poderão ser utilizados os concentrados plaquetários existentes no banco de sangue.
Na maioria dos casos, o número plaquetário retorna a valores normais entre a primeira e a sexta semanas de vida.
Exsanguinotransfusão
A exsanguinotransfusão (ET) é um procedimento através do qual o volume sanguíneo circulante é removido e substituído por igual volume de sangue de um dador.
A sua principal indicação em neonatalogia é o tratamento de situações de hiperbilirrubinémia grave, não respondentes à fototerapia.
Tal procedimento permite diminuir os níveis excessivos de bilirrubina não conjugada susceptível de atravessar a barreira hemato-encefálica e provocar lesões no SNC. Remove também eventuais anticorpos maternos ainda em circulação e os eritrócitos aos quais esses anticorpos se podem ligar, travando assim o processo hemolítico.
Habitualmente, são processadas duas volémias sanguíneas (160 a 200 mL/kg, de acordo com a idade gestacional), o que permite remover até 90% dos eritrócitos neonatais e 50% da bilirrubina circulante.
Este procedimento deve ser realizado em unidades de cuidados intensivos dotadas de meios técnicos adequados e duma equipa multidisciplinar com experiência na sua execução.
O serviço de imuno-hemoterapia deve ser contactado o mais precocemente possível antes da realização da ET para garantir a disponibilidade de componentes adequados.
Os CE para ET devem obedecer aos seguintes critérios:
- Colheita com menos de 5 dias;
- Grupo 0 ou AB0-idêntico ao do RN;
- Fenótipo negativo para os antigénios em causa;
- Compatível com o soro materno;
- Hemoglobina S negativo;
- Desleucocitado;
- Irradiado nas 24 horas anteriores à administração.
O CE deve ser espoliado da solução aditiva e reconstituído com plasma fresco congelado (de quarentena ou inactivado), do grupo AB, de forma a que o produto final atinja um hematócrito entre 45-60%. Deve ser administrado nas 24 horas após a reconstituição.
Terapêutica transfusional na doença de células falciformes (DCF)
A terapêutica transfusional poderá ser necessária numa situação de urgência/emergência, ou para prevenção de complicações a curto e a longo prazo, de forma intermitente ou crónica.
Podem ser utilizadas duas modalidades transfusionais:
- Transfusão simples de CE;
- Eritrocitaferese (ET)/transfusão-permuta manual (TPM).
A ET, efectuada por métodos automáticos, requer que grandes volumes de CE (1 ou 1,5 volémia do doente) sejam administrados; o objectivo do procedimento é remover os eritrócitos do doente, permitindo uma redução rápida da Hb S.
Em serviços que não disponham de separadores celulares, poderá ser efectuada a TPM. Este método envolve a flebotomia de 5-10 mL/Kg (dependendo da Hb de base do doente e da sua tolerância à anemia) imediatamente antes da transfusão de CE.
Antes de iniciar a terapêutica transfusional, deverá proceder-se aos seguintes estudos:
- Fenotipagem eritrocitária detalhada;
- Marcadores víricos: VHB, VHC, VIH 1 e 2;
- Calendário de vacinação segundo o PNV;
- Confirmar administração de vacina anti-hepatite B.
O CE a administrar deve cumprir os seguintes critérios:
- Colheita há menos de 7 dias;
- Compatíveis nos sistemas AB0, Rh (C c CW D E e), Kell e Fyª;
- Na presença de aloanticorpos, administrar CE sem os respectivos antigénios;
- Hemoglobina S negativo;
A terapêutica com CE, um dos pilares do tratamento desta patologia, tem contribuído largamente para aumentar a longevidade dos doentes. Contudo, as suas indicações devem ser criteriosas dado o risco considerável de iatrogenia (Quadro 6). A anemia basal não é geralmente indicação para transfusão, a não ser que se verifique Hb de 5 g/dL ou < 5 g/dL.
QUADRO 6 – Indicações para transfusão de CE em doentes com DCF
| A. Indicações para transfusão | Método transfusional |
| Acidente vascular isquémico agudo Prevenção primária de trombose Prevenção secundária de trombose Síndroma torácica aguda Sequestração esplénica Sequestração esplénica, recorrência Pré-operatório (se necessário anestesia geral) Crise aplásica transitória Falência orgânica aguda multissistémica Sequestração hepática aguda Colestase intra-hepática aguda Complicações drepanocíticas ou obstétricas na gravidez | ET, se possível Transfusão crónica simples ou ETa Transfusão crónica simples ou ETa Transfusão simples ou ETa Transfusão simples Transfusão simples crónica (antes da esplenectomia)b Transfusão simples Transfusão simples Transfusão simples ou ETc Transfusão simples ou ETc Transfusão simples ou ETc Transfusão simples ou ETc |
| B. Indicações controversas para transfusão | |
| Síndroma torácica aguda, recorrente Episódios vasoclusivos recorrentes Hipertensão pulmonar | Transfusão crónica simples ou ETc Transfusão crónica simples ou ETc Transfusão crónica simples ou ETc |
| C. Transfusão habitualmente não indicada | |
| Episódio vasoclusivo não complicado Priapismo Gravidez não complicada Úlceras dos membros inferiores Necrose avascular sem necessidade de intervenção cirúrgica | Não aplicável (NA) NA NA NA NA |
| |
Na síndroma vasoclusiva/SVO não complicada as transfusões não estão indicadas, excepto se se verificar anemia sintomática, baixo número de reticulócitos (<100 x 109/L) ou descida de Hb ultrapassando -2 g/dL em relação ao valor habitual.
Na síndroma torácica aguda/STA, a segunda causa mais frequente de hospitalização destes doentes, a terapêutica transfusional é sempre necessária. As transfusões simples devem ser consideradas em doentes com STA, hipoxemia e exacerbação da anemia. A ET poderá ficar reservada para doentes que não estejam gravemente anémicos, mas que apresentem declínio progressivo da função respiratória.
Na crise aplástica, cuja etiologia mais comum é a infecção por parvovírus B19, ocorre supressão temporária da actividade medular. A necessidade de transfusões depende da gravidade da anemia, reticulocitopénia e do estado clínico do doente. Deverão ser administradas transfusões simples de CE, em pequenos volumes, para prevenir a insuficiência cardíaca congestiva.
Na sequestração esplénica aguda, a transfusão de CE constitui uma emergência para corrigir a anemia grave. Deverão ser administrados pequenos volumes, com monitorização do tamanho do baço e do sistema cardiovascular, para prevenir a hiperviscosidade depois de a sequestração esplénica regredir.
A sequestração hepática aguda manifesta-se como um incremento das dimensões do fígado, anemia, hiperbilirrubinémia e elevação das transaminases. Trata-se dum quadro clínico muito grave em que as transfuões simples ou a ET são contributos indispensáveis na sua resolução.
A terapêutica transfusional no período perioperatório reduz a ocorrência de complicações. Estudos recentes têm demonstrado que a transfusão simples de CE, para obter uma Hb pré-operatória de 10 g/dL, é equivalente à realização de ET para obter uma HbS ≤ 30%.
As complicações neurológicas, nomeadamente AVC, continuam a ser a principal causa de morbilidade a longo prazo, sendo a terapêutica transfusional procedimento considerado obrigatório. A ET na apresentação aguda é o método transfusional de eleição.
Em 60-90% dos casos há eventos recorrentes, pelo que se deverá iniciar regime de transfusões crónicas, para manter a percentagem de HbS ≤ 30%. Esta terapêutica muitas vezes deve ser mantida indefinidamente porque a sua interrupção tem levado a recorrências do AVC. Assim, este regime parece ser a melhor opção terapêutica na prevenção do AVC recorrente. Os doentes politransfundidos devem ser submetidos a terapêutica quelante para reduzir a sobrecarga secundária de ferro.
O priapismo pode afectar jovens e adultos. O benefício da terapêutica transfusional, quer no priapismo agudo, quer na prevenção da recorrência, é controverso, não estando provada a sua eficácia.
As doentes com DCF apresentam maior risco de complicações obstétricas, nomeadamente morte fetal e materna. Após as 28 semanas de gestação, podem efectuar-se transfusões profilácticas, para obter níveis de Hb de 10-11 g/dL e Hb S ≤ 35%. A terapêutica transfusional está também indicada na grávida com complicações médicas agudas.
Terapêutica transfusional na β-talassémia major
As talassémias são um grupo heterogéneo de doenças caracterizadas pela ausência ou redução de síntese de uma ou mais cadeias de globina.
As talassémias que necessitam de suporte transfusional regular são as β-talassémias major, em que há ausência total ou síntese reduzida de cadeias β.
Antes do início da terapêutica transfusional dever-se-á proceder, como foi descrito anteriormente a propósito da doença de células falciformes, sem que no entanto, a avaliação da compatibilidade no sistema Duffy (Fy) não seja exigida. O CE a administrar deve também obedecer aos critérios aí referidos.
Na situação em epígrafe preconiza-se que os doentes sejam transfundidos regularmente, mantendo uma Hb pré-transfusional média de 9-10 g/dL, não devendo a Hb pós-transfusional ser superior a 15 g/dL pelo risco de hiperviscosidade e acidentes vasculares cerebrais; quanto à Hb média, o valor recomendado situa-se em torno de 12 g/dL.
Este suporte transfusional permite um crescimento e desenvolvimento dentro da normalidade, mantendo uma adequada supressão da actividade medular e minorando a acumulação de ferro. Semestralmente, deve ser avaliada a eficácia transfusional.
Nos doentes sem patologia cardíaca, o volume a administrar deve ser de 10-15 mL/kg, em cerca de 2 horas (4-5 mL/kg/hora).
Em doentes cardíacos, dever-se-á transfundir 5 mL/Kg, não excedendo 2 ml/kg/hora; pode, se necessário, reduzir-se o intervalo transfusional.
Se houver necessidade de maiores volumes, até 20 mL/kg, a administração deve ser mais lenta, não utrapassando as 4 horas.
A hemossiderose é a complicação mais temível nesta patologia, sendo que o seu controlo é tão importante quanto o da anemia. Para cada doente, deve ser registado o número e volume das unidades transfundidas, bem como o Ht das mesmas, de forma a que seja possível calcular o volume total de CE e a quantidade de ferro administrado. Estes são parâmetros muito importantes no controlo da terapêutica quelante do ferro, a que todos estes doentes têm de ser submetidos de forma regular.
Irradiação de componentes sanguíneos
A irradiação dos componentes sanguíneos é a metodologia mais adequada para inactivar os linfócitos residuais, e para a prevenção da doença de enxerto contra hospedeiro associada à transfusão. Embora os primeiros casos tenham sido descritos em doentes imunossuprimidos, sabe-se actualmente que doentes imunocompetentes podem também desenvolver tal doença, particularmente se receberem sangue de dadores HLA haploidênticos não relacionados ou de familiares.
A irradiação gama é a metodologia mais comummente utilizada, embora a irradiação X também possa ser aceite. Actualmente, estão disponíveis novos métodos de inactivação patogénica que reduzem a viabilidade dos linfócitos T e têm sido usados na substituição da irradiação, particularmente, em concentrados plaquetários.
As indicações sucintas para a irradiação de componentes sanguíneos são:
- Doentes submetidos a transplantes de células progenitoras hematopoiéticas, autólogos ou homólogos;
- Anemia aplástica;
- Doença de Hodgkin;
- Doentes tratados com análogos das purinas (fludarabina, cladribina e deoxucoforuycina), globulina anti-timocítica ou alentuzumab (anti-CD 52);
- Síndromas de imunodeficiência congénita nomeadamente nas síndromas de Di George, Wiskott-Aldrich e Ataxia- telangiectasia, e em todas as crianças com o diagnóstico ou suspeita de imunodeficiência celular ou combinada;
- RN com menos de 30 semanas de gestação ou menos de 1200 g;
- Transfusões intra-uterinas e RN submetidos a transfusões intrauterinas;
- Transfusões provenientes de familiares de 1º e 2º grau, mesmo que o doente seja imunocompetente;
- Transfusões HLA-idênticas;
- Utilização de ECMO (técnica de oxigenação extracorporal por membrana).
Efeitos adversos da transfusão e procedimentos
- A transfusão de componentes e derivados sanguíneos não é um acto inócuo. Antes da prescrição deste tipo de terapêutica é sempre necessário ponderar os benefícios e os possíveis riscos imediatos e tardios.
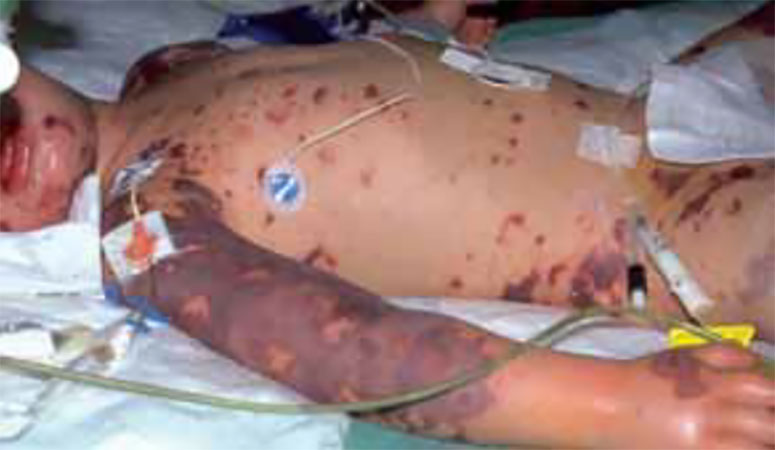
As reacções transfusionais podem ser classificadas em quatro categorias:
- Imunológicas Agudas;
- Não Imunológicas Agudas;
- Imunológicas Tardias;
- Não Imunológicas Tardias.
As reacções agudas são as que ocorrem desde os primeiros minutos após o iníco da administração até 24 horas após o final da transfusão. As tardias são as que ocorrem após este período.
As reacções imunológicas são devidas à resposta imune do organismo contra os antigénios das células sanguíneas.
Os Quadros 7, 8, 9 e 10 descrevem de modo sucinto exemplos concretos de cada tipo de reacção, incluindo manifestações clínicas mais frequentes e medidas terapêuticas indicadas.
QUADRO 7 – Reacções transfusionais agudas – (imunológicas)
Tipo | Etiologia | Manifestações | Medidas terapêuticas |
Hemolítica Aguda | Incompatibilidade entre antigénios eritrocitários do dador e receptor | Dor no local de infusão, agitação, dispneia, dor lombar, febre, calafrios, hemoglobinúria, insuficiência renal, CID, etc. | Manter acessos venosos com soro fisiológico, manter débito urinário ~1-2 ml/Kg/h, analgésicos, vasopressores |
Febril não hemolítica | Anticorpos antileucocitários, citocinas | Febre, calafrios, cefaleias, vómitos | Antipiréticos, desleucocitação de componentes sanguíneos |
Urticariforme | Anticorpos contra as proteínas plasmáticas do dador | Urticária, prurido | Anti-histamínicos |
Anafiláctica | Anticorpos antiproteína de dador: anti-IGA, C4, haptoglobina | Hipotensão, taquicárdia broncospasmo, ansiedade, edema da glote | Posição de Trendlenburgo, anti-histamínicos, corticosteróides, epinefrina |
Edema pulmonar agudo não cardiogénico | Anticorpos antileucocitários no dador | Hipoxémia, insuficiência respiratória, edema pulmonar agudo sem compromisso da função cardíaca | Oxigenoterapia, assistência respiratória de acordo com a gravidade do quadro clínico |
QUADRO 8 – Reacções transfusionais agudas – (não imunológicas)
Tipo | Etiologia | Manifestações | Medidas terapêuticas |
(*) Um método simples e prático que pode ser utilizado quando se trata de transfundir pequenos volumes de sangue é colocar a bolsa de sangue, antes da transfusão, durante alguns minutos numa incubadora com sistema de aquecimento servocontrolado (isto é, equipada com sensor que monitorize a temperatura, colocando o referido sensor sobre o referido saco) evitando temperaturas superiores a 37ºC. | |||
Quadro de sépsis | Contaminação bacteriana | Febre, calafrios, hipotensão | Antibioticoterapia |
Sobrecarga circulatória | Sobrecarga de volume | Dispneia, ortopneia, tosse, hipertensão, cefaleias | Oxigenoterapia, diuréticos |
Hipocalcémia | Rápida infusão de citrato | Parestesias, tetania, arritmia | Infusão lenta de cálcio |
Hipotermia | Transfusão rápida de componentes sanguíneos frios | Arritmia | Utilizar sistemas de aquecimento de componentes sanguíneos, particularmente quando são transfundidos grandes volumes (*) |
QUADRO 9 – Reacções transfusionais tardias – (imunológicas)
(#) As principais indicações absolutas para irradiação de componentes celulares sanguíneos são: | |||
| Tipo | Etiologia | Manifestações | Medidas terapêuticas |
| Alo-imunização | Resposta imune aos antigénios estranhos do eritrócito, leucócito ou plaquetas | Aparente ineficácia transfusional; não resposta à transfusão de plaquetas, febre, icterícia | Identificar anticorpos e transfundir sangue compatível; desleucocitar os componentes |
Reacção de tipo enxerto contra hospedeiro | Os linfócitos do dador opõem-se aos do receptor imunodeprimido | Exantema máculo-papular, anorexia, náuseas, vómitos, diarreia, hepatite, pancitopénia (rara) | Corticosteróides, citotóxicos |
Púrpura Pós-transfusional | Anticorpos antiplaquetários no receptor | Púrpura trombocitopénica, 8-10 dias após a transfusão | Imunoglobulina intravenosa, plaquetas negativas para HPA1 |
QUADRO 10 – Reacções transfusionais tardias – (não imunológicas)
| Tipo | Etiologia | Manifestações | Medidas terapêuticas |
| Hemossiderose | Excesso de ferro devido a múltiplas transfusões de concentrado eritrocitário (> 100 unidades) | Diabetes, cirrose, cardiomiopatia | Quelantes de ferro |
Todos os profissionais envolvidos na terapêutica transfusional devem estar habilitados a reconhecer um incidente transfusional e a tomar prontamente as medidas adequadas e consideradas prioritárias no âmbito do seu tratamento inicial.
Os serviços clínicos devem dispor de fichas de registo de incidentes transfusionais (FIT), e perante a sua ocorrência, devem preenchê-las, enviá-las ao serviço de imuno-hemoterapia (SIH) acompanhadas de uma amostra pós-transfusional. Uma vez identificada a causa, esta deverá ser devidamente analisada, remetendo-se em seguida o registo e participação do incidente ao sistema de hemovigilância nacional, o qual, que por sua vez, o deverá comunicar ao sistema de hemovigilância internacional.
Os incidentes relacionados com a transmissão de doenças infecciosas, nomeadamente a transmissão de VIH e hepatite, têm vindo a reduzir-se significativamente nos últimos anos. Contudo, subsistem os não infecciosos, muitas vezes letais e difíceis de prevenir e de tratar.
- Perante uma reacção transfusional, as medidas imediatas a tomar são:
- Suspender imediatamente a transfusão; manter os acessos venosos, com soro fisiológico;
- Verificar a identificação do doente e da unidade transfundida;
- Contactar o médico de serviço do doente e o do SIH, para que a causa do incidente seja devidamente estudada e analisada;
- Devolver os componentes envolvidos na reacção ao SIH, a FIT devidamente preenchida, juntamente com uma amostra pós-transfusional do doente colhida em tubo de EDTA.
GLOSSÁRIO
Aférese > Separação dos elementos constituintes do sangue.
Concentrado eritrocitário > É o componente obtido por remoção parcial do plasma de uma unidade de sangue total. Consoante o tipo de processamento efectuado é possível obter concentrados eritrocitários com maior ou menor contaminação de glóbulos brancos, plaquetas e plasma.
Concentrado eritrocitário sem “buffy coat”, em solução aditiva, e desleucocitado > Este tipo de concentrado eritrocitário apresenta menor contaminação de glóbulos brancos, plaquetas e plasma do que o anteriormente referido, porque no método de produção, além de ser removido o plasma, é também retirada a camada leucoplaquetária, sendo subsequentemente adicionada às células uma solução nutritiva apropriada. Em seguida é desleucocitado, antes do armazenamento. Em média este componente tem um volume de 250 mL ± 10%. Tem um hematócrito que oscila entre 50-70% e um mínimo de 45 g de hemoglobina por unidade.
Concentrado plaquetário > É um componente obtido a partir de uma unidade de sangue total, devendo conter a maioria das plaquetas da unidade original. Dependendo do método de preparação, o número médio de plaquetas numa unidade deve ser 70 x 109 suspensa num volume de 40-70 mL de plasma. Só podem ser conservadas durante cinco dias.
Concentrado unitário de plaquetas > É obtido de um único dador utilizando um separador automático de células. Dependendo do tipo de processamento e do equipamento utilizado, pode obter-se um número de plaquetas que oscila entre 200-800 x 109/L.
Crioprecipitado > É um preparado que contém a fracção crioglobulínica do plasma, obtido através da descongelação do PFC a 4ºC e removendo o sobrenadante. É rico em fibrinogénio, factor VIII, vários multímeros de factor de Von Willebrand, fibronectina e factor XIII. Segundo recomendações internacionais deve ter um volume entre 30-40 mL.
Plasma fresco congelado > É a porção aquosa e acelular do sangue total, contendo proteínas, colóides, nutrientes, cristalóides, hormonas e vitaminas. A albumina é a proteína mais abundante, mas também contém outras como: fracções do complemento, enzimas, imunoglobulinas e factores da coagulação, nomeadamente, fibrinogénio, factor II, VII, IX, X, XIII, VIII. O plasma pode ser obtido a partir do sangue total ou por aférese. Deve ser congelado num período de tempo e a uma temperatura que permita manter adequadamente, em estado funcional, os factores da coagulação. Contém um volume aproximado de 180-300 mL.
Transfusão > Injecção endovascular de sangue compatível, fresco ou conservado; este conceito engloba também um constituinte do sangue separadamente (leucócitos ou eritrócitos ou plaquetas) ou de um seu sucedâneo.
Unidade de sangue total > É a quantidade de sangue colhida a um dador previamente seleccionado, utilizando material estéril e de uso único, contendo uma solução anticoagulante/preservador. O volume da unidade deve ser 450 mL ± 10%, excluindo o anticoagulante. Tem um período de conservação limitado. Com o armazenamento observa-se uma rápida deterioração do factor VIII, leucócitos e plaquetas, o que o torna um produto inviável para tratar alterações da coagulação após 24 horas de conservação. A sua maior aplicação diz respeito à preparação de outros componentes sanguíneos.
BIBLIOGRAFIA
Becheura M, Bouslamab B, Slamab H, et al. Anémie hémolytique auto-immune de l’enfant. Transfus Clin Biolog 2015; 22: 291-298
Carson JL, Grossman BJ, Kleinman S, et al. Red blood cell transfusion. A clinical practice guideline from the American Association of Blood Banks. Ann Intern Med 2012; 157: 49-58
Chou ST, Fasano RM. Management of patients with sickle cell disease using transfusion therapy. Guidelines and Complications. Hematol Oncol Clin N Am 2016; 30; 591-608
Davis BA, Allard S, Qureshi A, et al. Guidelines on red cell transfusion in sickle cell disease. Part I: principles and laboratory. Br J Haematol 2017; 176: 179-191
Deng X, Wang Y, Huang P, et al. Red blood cell transfusion threshold after pediatric cardiac surgery. Medicine 2019; 98- p e14884. doi: 10.1097/MD.0000000000014884
Favrais G, Wibaut B, Pladys P, Saliba E. Blood transfusion to pre-term neonates: What is new in the French guidelines since 2002? Arch Pédiatrie 2017; 24: 894-901
Forest SK, Hod EA. Management of the platelet refractory patient. Hematol Oncol Clin Am 2016; 30: 665-677
Gehrie EA, Dunbar NM. Modifications to blood components. When to use them and what is the evidence? Hematol Oncol Clin N Am 2016; 30: 653-663
Girelli G, Antoncecchi S, Casadei AM, et al. Recommendations for transfusion therapy in neonatology. Blood Transfus 2015;13: 484-497
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Hoffman R, Benz EJ, Abutalib SA (eds). Hematology. Philadelphia: Elsevier, 2018
Ibonia KT, Bada HS, Westgate PM, et al. Blood transfusions in preterm infants: changes on perfusion index and intermittent hypoxemia. Transfusion 2018;58: 2538-2544. doi: 10.1111/trf.14808
Kliegman RM, Stanton BF, StGeme JW, Schor NF (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2015
Moro M, Málaga S, Madero L. Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nellis ME, Goel R, Feinstein S, et al. Association between transfusion of RBCs and subsequent development of delirium in critically ill children. Pediatr Crit Care Med 2018;19: 925-929. doi: 10.1097/PCC.0000000000001675
Roubinian N, Carson JL. Red blood cell transfusion strategies in dult and pediatric patients with malignancy. Hematol Oncol Clin N Am 2016; 30: 529-540
Shah N, Andrews J, Goodnough LT. Transfusions for anemia in adult and pediatric patients with malignancies. Blood Rev 2015; 29: 291-299
Shander A. Preoperative anemia and its management. Transfus Apheresis Sci 2014; 50: 13-15
Tinmouth A. Assessing the rationale and effectiveness of frozen plasma transfusions. An evidence – based review. Hematol Oncol Clin N Am 2016; 30: 561-572