Definição e importância do problema
A coagulação intravascular disseminada (CIVD) é uma síndroma caracterizada pela activação difusa da coagulação com formação e depósito de fibrina nos pequenos vasos, levando a diátese hemorrágica, uma das principais manifestações clínicas. Este estado de hipercoagulabilidade pode levar à oclusão dos vasos com compromisso da irrigação sanguínea de diversos órgãos e consequente isquémia. A fibrinólise, que também está comprometida, exacerba este desequilíbrio entre coagulação e capacidade de lise dos trombos o que, somado ao estado crítico do doente, instabilidade hemodinâmica e défice de perfusão, contribui para a falência de vários órgãos e para a gravidade do quadro. Sintetizando, o consumo e a deplecção de factores de coagulação e plaquetas, neste processo contínuo de coagulação, acaba por levar a hemorragia.
Estima-se uma incidência de cerca de 1% dos doentes hospitalizados, com uma taxa de mortalidade entre os 50-75%, dependendo em muito da doença subjacente.
QUADRO 1 – Principais factores etiológicos de CIVD
| Abreviaturas: LPA – leucemia pró-mielocítica aguda; LLA – leucemia linfocítica aguda; HELLP – síndroma de hemólise, aumento das enzimas hepáticas e baixo número de plaquetas |
| CIVD aguda |
Sépsis grave Patologia obstétrica Reacções imunitárias Neoplasias Toxinas/Fármacos |
| CIVD subaguda/crónica |
| – Doenças cardiovasculares – Doenças vasculares renais – Doenças hematológicas – Doenças inflamatórias – Doenças autoimunes (rejeição de transplante) – Doenças neoplásicas |
Etiopatogénese
A CIVD não é uma doença, mas uma síndroma resultando de diversos problemas clínicos subjacentes os quais constituem, assim, factores etiológicos.
O Quadro 1 enumera as situações clínicas que mais frequentemente desencadeiam CIVD.
A sépsis é a causa mais comum de CIVD, podendo ocorrer em 30-50% dos casos. Os componentes da membrana celular das bactérias (lipopolissacárido ou endotoxina) ou as exotoxinas bacterianas (por ex. toxina α dos estafilococos), induzindo a libertação de factores plaquetários e lesão endotelial, activam factores de coagulação.
Os vírus da varicela e hepatite, e o citomegalovírus são os mais habitualmente associados a CIVD. Os mecanismos desencadeantes estão menos esclarecidos do que nas infecções bacterianas, mas podem envolver a activação de factor XII por complexo antigénio-anticorpo, reacções de libertação de plaquetas, ou lesão endotelial com exposição do colagénio subendotelial.
A hepatite vírica fulminante e a insuficiência hepática aguda de qualquer causa podem levar a CIVD, salientando-se a dificuldade que por vezes existe em distinguir esta doutras alterações da coagulação resultantes de disfunção hepática grave.
A incidência de CIVD em doentes com traumatismo grave é da ordem de 50 a 70%.
A libertação de fragmentos de tecidos lesados (designadamente fosfolípidos a partir do tecido adiposo) na circulação sistémica, hemólise e lesão endotelial causam activação da coagulação mediada por factor tecidual. O aumento das citocinas circulantes (TNF-α e IL-1) levam a deposição generalizada de fibrina nos microvasos, do que resulta resposta inflamatória sistémica mantida e síndroma de disfunção multiorgânica (SDMO).
Verifica-se CIVD em 10 a 15% dos doentes com leucemia aguda e em cerca de 15% dos doentes com neoplasias sólidas. Com efeito, em tais circunstâncias verifica-se libertação de moléculas procoagulantes (factor tecidual e cisteína protéase que activam o factor X). A CIVD associada a neoplasia é habitualmente crónica e compensada.
A transfusão de eritrócitos AB0 incompatíveis pode causar CIVD aguda. Os anticorpos IgM naturais ligam-se a antigénio A ou B na superfície das células transfundidas e formam imunocomplexos que activam a cascata do complemento. Estes imunocomplexos, por sua vez, causam lesão endotelial desencadeando a activação da coagulação.
A CIVD aguda é uma complicação grave de várias entidades obstétricas, como embolia por líquido amniótico, placenta prévia e eclampsia. Tal é explicável pelo facto de o líquido amniótico conter uma substância com afinidades para a tromboplastina, altamente potente, e igualmente com propriedades antifibrinolíticas. Esta actividade procoagulante aumenta com o tempo de gestação. A entrada de líquido amniótico na circulação materna activa o sistema de procoagulação, levando de modo agudo a CIVD.
Assim, globalmente, a síndroma de CIVD é desencadeada pela activação sistémica da coagulação sanguínea, a qual é mediada por vários mecanismos em simultâneo. A deposição sistémica de fibrina resulta da produção de trombina mediada pelo factor tecidual, com supressão simultânea dos mecanismos fisiológicos de anticoagulação e alteração da fibrinólise (causada pelo inibidor do activador do plasminogénio, tipo I).
As alterações da coagulação e fibrinólise resultam de diversas citocinas pró-inflamatórias. A interleucina-6 (IL-6) é o principal mediador da activação da coagulação, sendo que o factor de necrose tumoral (TNF-alfa) inibe as vias fisiológicas de anticoagulação e da fibrinólise (Figura 1). São descritos a seguir os principais eventos fisiopatológigos.
Abreviaturas: IL – interleucina; AT III – antitrombina III; FNT – factor de necrose tumoral; VIIa – factor VII activado; IAP-1 – inibidor do activador do plasminogénio, tipo I libertado pelas células endoteliais e plaquetas activadas; IVFT – inibidor da via do factor tecidual
FIGURA 1 – Fisiopatologia da coagulação intravascular disseminada
Produção de trombina
A produção de trombina mediada por factor tecidual (FT) desempenha um papel central na fisiopatologia da CIVD. A produção de trombina na CIVD é exclusivamente iniciada pela activação do FT/complexo VII activado. Nem sempre é clara a fonte exacta do FT. Monócitos, células polimorfonucleares, e células endoteliais expressam FT em resposta a citocinas pró-inflamatórias. O FT e factor VII activado catalizam a conversão dos factores IX e X. Os factores IXa e Xa aumentam a activação de factor X e pró-trombina, levando à formação de trombina. A trombina converte fibrinogénio em fibrina e é um activador potente das plaquetas. As plaquetas formam “uma superfície de fosfolípidos” sobre a qual se depositam complexos de factores de coagulação activados, ampliando a activação da coagulação.
Disfunção das vias fisiológicas da anticoagulação
A produção de trombina é normalmente limitada pela antitrombina III (AT III), proteína C e inibidor da via do factor tecidual (IVFT). Na CIVD estes sistemas de regulação são defeituosos como resultado da disfunção endotelial. Ocorre produção generalizada de trombina, levando à deposição de fibrina. A AT-III é o inibidor mais importante da trombina e factor Xa. Na CIVD os níveis de ATIII são muito baixos como resultado do consumo, activados, diminuição da síntese hepática e extravasamento através de capilares permeáveis. Os baixos níveis de AT-III na CIVD estão associados a um aumento da mortalidade em doentes com sépsis.
Disfunção da fibrinólise
Na CIVD as células endoteliais e as plaquetas activadas libertam inibidor tipo I do activador do plasminogénio (IAP-1). Em estudos clínicos, os elevados níveis de IAP-1 e os níveis baixos do complexo alfa 2 antiplasmina-plasmina constituem marcadores de mau prognóstico.
Interacção entre coagulação e inflamação
A activação da coagulação produz proteases, as quais induzem mediadores pró-inflamatórios com efeitos pró-coagulantes e amplificam a cascata que leva a CIVD.
Manifestações clínicas
Dum modo geral, as manifestações clínicas traduzindo situação de aparência geral grave relacionável com as da entidade subjacente (por exemplo, infecção, neoplasia, traumatismo grave, diversas entidades obstétricas, transfusão de sangue incompatível, golpe de calor, afogamento em água doce, etc.), somam-se às devidas a trombose e hemorragia. De salientar que a CIVD duplica aproximadamente o risco de morte em doentes com sépsis ou lesão traumática grave.
A hemorragia é a manifestação clínica mais dramática da CIVD aguda, associada a uma formação excessiva de plasmina: equimoses em locais de venopunção e feridas, hematomas, hematúria, assim como petéquias no palato mole e pele (Figura 2).
Nas formas graves podem surgir hemorragias maciças com localizações diversas: génito-urinária, pulmonar, gastrintestinal, sistema nervoso central, etc..
Ocorre febre e hipotensão e choque em 50% dos casos, e anemia hemolítica microangiopática em cerca de 15%.
A CIVD subaguda ou crónica associada a neoplasias, doenças do tecido conjuntivo ou doença renal crónica, manifesta-se habitualmente como entidade pró-trombótica e não como doença hemorrágica. Menos óbvia clinicamente é a microtrombose vascular causada pela deposição de fibrina em diversos territórios, levando à falência de órgãos.
As manifestações trombóticas habitualmente observadas são: insuficiência renal aguda (necrose cortical bilateral, necrose tubular aguda), acidente vascular cerebral, isquémia do miocárdio (enfarte, arritmia), insuficiência suprarrenal aguda (necrose suprarrenal), púrpura fulminante e trombose venosa hepática.
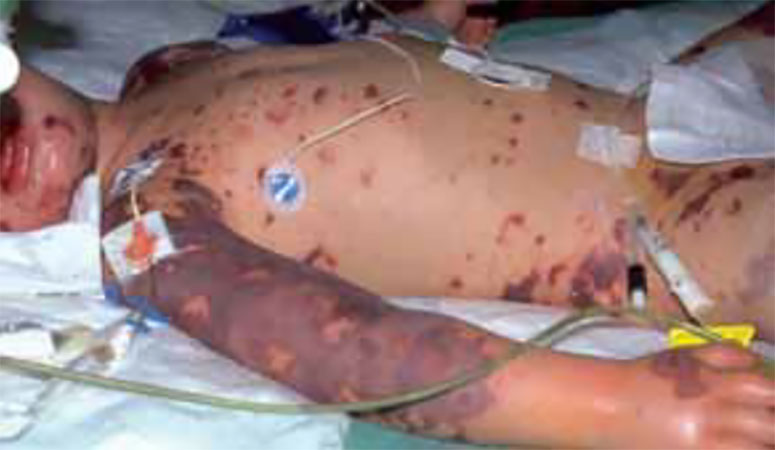
FIGURA 2 – Quadro de CIVD aguda/diátese hemorrágica grave. (doente da Unidade de Cuidados Intensivos Pediátricos do Hospital Dona Estefânia, Lisboa)
Os achados na autópsia em doentes com CIVD crónica ou subaguda mostram sinais de hemorragia difusa em diversos locais, de necrose hemorrágica dos tecidos, e de trombose em pequenos e grandes vasos.
Exames complementares
A anamnese e o exame objectivo, conduzindo à suspeita de CIVD, obrigam à realização de exames complementares, sendo de referir que nenhum exame laboratorial isoladamente permite diagnosticar ou excluir CIVD.
Aspectos gerais
As anomalias observadas nos resultados de diversos exames biológicos podem variar em função da fase em que se encontra o doente, gravidade e tipo de doença subjacente, e eventual suporte hemoterapêutico já levado a cabo anteriormente.
Na prática, em caso de CIVD observa-se:
- Diminuição rápida do número de plaquetas ou número < 100.000 por mmc;
- Aumento dos tempos de coagulação, tempo de protrombina (TP), tempo de tromboplastina parcial activada (TTPa);
- Verificação e aumento de produtos de degradação da fibrina no plasma (PDF) e de dímeros D, estes últimos o indicador biológico mais sensível;
- Baixos níveis de inibidores da coagulação (como antitrombina III).
De acordo com o que anteriormente foi referido, a síndroma de CIVD não pode ser excluída se os resultados dos exames referidos estiverem dentro do intervalo de normalidade; com efeito, a resposta de fase aguda leva à diminuição do tempo de tromboplastina parcial activada e ao aumento da concentração de fibrinogénio. Segundo as normas da Sociedade de Trombose e Hemostase, o Quadro 2 sintetiza os achados principais como critérios auxiliares de diagnóstico.
QUADRO 2 – Exames laboratoriais para confirmação de CIVD
| CIVD aguda | CIVD crónica ou compensada | |
| Tempo de protrombina (TP) | ⇑ | N ou ⇓ |
| Tempo de tromboplastina parcial activada (TTPa) | ⇑ | N ou ⇓ |
| Número de plaquetas | ⇓ | N ou ⇓ |
| Concentração de fibrinogénio | ⇓ | N, ⇓ ou ⇑ |
| D-dímeros | ⇑ | N ou ⇑ |
| Produtos de degradação da fibrina (PDF) | ⇑ | N ou ⇑ |
| Monómeros de fibrina | ⇑ | N ou ⇑ |
| Esfregaço de sangue | Esquizócitos | |
| Complexo trombina antitrombina | ⇑ | |
| Fragmentos de activação da protrombina tipo 1 e 2 | ⇑ | |
| Complexo plasmina antiplasmina (PAP) | ⇑ | |
| Abreviaturas: N – normal; ⇑ – aumentado; ⇓ – diminuído | ||
Aspectos específicos
Tendo como base os conceitos da fisiopatologia antes descritos, são referidos mais em pormenor os seguintes exames:
- Provas para detectar a formação intravascular de fibrina e produtos de degradação da fibrina/fibrinogénio.
Uma vez que o principal factor desencadeante da fisiopatologia da CIVD é um aumento da formação de fibrina, a comprovação da existência de fibrina no plasma seria essencial no diagnóstico de CIVD. O aumento do nível de fibrina solúvel tem uma elevada sensibilidade (90-100%), como prova diagnóstica. Contudo, este exame não está disponível nos laboratórios de rotina. Os produtos de degradação da fibrina (PDF) formam-se quando há degradação de fibrina e/ou de fibrinogénio. Os níveis de PDF estão aumentados em 80-100% dos doentes com CIVD e podem ser detectados através de métodos ELISA ou de aglutinação de látex. Contudo, trata-se dum exame relativamente inespecífico, uma vez que várias outras entidades (por ex. lesão traumática, inflamação ou tromboembolismo venoso) podem aumentar os níveis de PDF. Provas mais específicas que detectam os produtos resultantes da degradação de fibrina pela plasmina (os dímeros-D) são mais úteis, uma vez que indicam que ocorreu coagulação e fibrinólise. Os dímeros-D estão aumentados em 95% dos doentes. - Marcadores de formação de trombina.
Níveis plasmáticos elevados de trombina podem reflectir-se em aumento dos níveis de: fragmento F1 (F1+2) de activação da protrombina, complexo trombina-antitrombina (TAT) e fibrinopéptido A. A conversão de protrombina em trombina leva a libertação de fragmento inactivo F1+2 e de um elemento intermédio, pré-trombina 2, que mais tarde forma trombina. A trombina pode degradar o fibrinogénio por proteólise e libertar fibrinopéptido A. Em alternativa, pode formar-se um complexo estável, inactivo com antitrombina, o complexo TAT. Níveis aumentados de F 1+2, TAT e fibrinopéptido A são indicadores sensíveis de CIVD quando as manifestações são subclínicas. Contudo, a sua utilidade é limitada pela necessidade de manuseamento cuidadoso da amostra e pela falta de especificidade. Estes exames não estão disponíveis na maioria dos laboratórios comuns. - Contagem de plaquetas.
A agregação de plaquetas induzida por trombina contribui significativamente para o consumo de plaquetas na CIVD. Contudo, podem ocorrer alterações na produção de plaquetas em doentes gravemente doentes. A repetição da contagem de plaquetas com intervalos de 1 a 4 horas reflecte a extensão da formação de trombina em curso. - Factores de coagulação e inibidores.
O consumo de factores de coagulação resulta no aumento de parâmetros globais de coagulação como o tempo de protrombina (TP) e tempo de tromboplastina parcial activada (TTPa) em apenas 50 a 70% dos doentes. Assim, valores normais destes parâmetros não excluem o diagnóstico de CIVD. As concentrações plasmáticas de factores de coagulação específicos, como os factores V e VII, são habitualmente baixas. Contudo, os níveis de factor VIII e de fibrinogénio podem manter-se normais, apesar do consumo, pois são reagentes de fase aguda. Nos casos graves observam-se baixos níveis de fibrinogénio; no entanto, esta prova evidencia uma baixa sensibilidade (28%). Os níveis plasmáticos de inibidores fisiológicos da coagulação, como antitrombina III e proteína C, são indicadores indirectos da activação da coagulação. Uma baixa concentração plasmática correlaciona-se com mau prognóstico. - Marcadores de fibrinólise aumentada.
Várias provas comprovam o aumento de fibrinólise que se observa na CIVD. A medição directa dos níveis plasmáticos de plasmina é difícil porque esta forma rapidamente um complexo com a alfa-2 antiplasmina. O aumento dos níveis de complexos alfa-2 antiplasmina-plasmina (PAP) pode ser detectado pelo método ELISA, imunoelectroforese e radioimunoensaio. Os níveis plasmáticos de plasminogénio e alfa-2 antiplasmina são baixos em doentes com CIVD indicando o consumo destas proteínas. Identificam-se concentrações elevadas de inibidor tipo I do activador do plasminogénio (IAP-1), o que comporta mau prognóstico.
Escala de avaliação
A Sociedade Internacional de Trombose e Hemostase propôs recentemente um algoritmo de diagnóstico em 5 passos para o diagnóstico de CIVD orientando igualmente na actuação a seguir (Quadro 3). Com esta estratégia são utilizadas provas laboratoriais simples disponíveis na maior parte dos laboratórios hospitalares.
QUADRO 3 – Escala de avaliação diagnóstica de CIVD e actuação
| 1. Avaliação de risco | |
| O doente tem alguma doença subjacente associada a manifestações de CIVD? | Continuar o algoritmo unicamente se sim, caso contrário não usar este algoritmo |
| 2. Proceder à realização de exames complementares | |
| Contagem de plaquetas | Esfregaço de sangue |
| TP, aPTT | Outros exames dirigidos à doença subjacente |
| Fibrinogénio | Outros exames dirigidos a função de órgão (rim, fígado, coração) |
| PDF, D-Dímeros | |
| 3. Atribuir um valor (pontuação) aos resultados das provas de coagulação | |||
| Plaquetas (/mm3) | PDF, D-dímeros | Prolongamento TP (limite superior) | Fibrinogénio |
| > 100 000 = 0 pontos | Normal = 0 pontos | < 3´= 0 pontos | > 1 g/dl = 0 pontos |
| < 100 000 = 1 ponto | Aumentado = 1 ponto | 3-6´= 1 ponto | < 1 g/dl = 1 ponto |
| <50 000 = 2 pontos | Muito aumentado = 3 pontos | >6´= 2 pontos | |
| 4. Calcular pontuação |
| 5. Avaliação de resultados | |
| Resultado > ou = 5 | Resultado < 5 |
| CIVD com manifestações (fase III) | CIVD sem manifestações, reavaliar posteriormente |
Novas perspectivas
Actualmente está a ser desenvolvido um processo que consiste na análise de ondas de transmissão em provas de coagulação de rotina. A onda de “transmissão” é o perfil óptico gerado em testes de coagulação padrão como TP e TTPa, documentando alterações na transmissão da luz durante o processo de formação e manutenção do coágulo. A onda normal do TTPa é uma curva sigmóide. Em doentes com CIVD, observa-se uma onda bifásica. A sensibilidade e a especificidade da onda bifásica do TTPa é, respectivamente, 97,6 e 98%. A análise das ondas de transmissão pode também ser utilizada para detectar CIVD subclínica. A forma crónica ou compensada de CIVD precede frequentemente a forma de descompensação aguda. Do ponto de vista terapêutico, seria melhor interromper o processo antes de ocorrer a descompensação. Infelizmente, a CIVD compensada não é clinicamente evidente e as provas de diagnóstico habituais podem ser normais. Embora se trate duma nova técnica de grandes potencialidades diagnósticas, a mesma exige equipamento especializado que ainda não está disponível na generalidade dos centros.
Tratamento
O princípio fundamental do tratamento da CIVD diz respeito ao tratamento rápido e agressivo da doença subjacente. Contudo, nas situações de resposta inflamatória sistémica (como na sépsis, traumatismo grave, ou queimaduras extensas), a CIVD poderá não ter resolução espontânea apesar do tratamento adequado e dirigido à doença de base. Nestes casos poderá ser necessário tomar medidas de suporte e estratégias específicas incidindo sobre os vários processos envolvidos na fisiopatologia da CIVD.
Tratamento transfusional
Pretende corrigir os diferentes défices de coagulação com factores contidos no plasma e outros hemoderivados. De salientar que não se deve proceder a administração de transfusões “profilácticas” em doentes com CIVD; as indicações surgem apenas quando existem manifestações clínicas da doença e/ou necessidade de realizar procedimentos invasivos.
*Plasma fresco congelado
Dose: 10 a 20 ml/Kg/dia
Indicações:
- doentes com hemorragia activa;
- procedimento ou cirurgia invasivos.
Não está indicado nas alterações laboratoriais sem evidência de hemorragia.
*Concentrado de plaquetas
Dose: 1U para cada 10 Kg de peso
Indicações:
- hemorragia e número de plaquetas inferior a 50 x 109/L;
- hemorragia e suspeita de disfunção plaquetária (qualquer valor de plaquetas).
*Crioprecipitado
Dose: uma Unidade contém 250 mg de fibrinogénio e uma pequena quantidade de plasma. O número de unidades é calculado tendo em conta o peso do doente, o nível de fibrinogénio e o volume plasmático. A regra geral é: 1U para cada 10 Kg de peso.
Objectivo:
- manter níveis de fibrinogénio superiores a 100-150 mg/dL.
Anticoagulantes
A utilização da heparina no tratamento da CIVD continua a ser controversa. Admite-se que a diminuição dos níveis plasmáticos de antitrombina associada a CIVD pode diminuir a eficácia da heparina uma vez que, para se garantir a acção anticoagulante da heparina, é necessária uma concentração plasmática adequada de antitrombina III. Contudo, a heparina em doses terapêuticas está indicada em doentes com tromboembolismo e manifestações clínicas ou evidência de deposição extensa de fibrina, como isquémia das extremidades.
Inibidores da coagulação
A antitrombina constitui, não só um importante inibidor fisiológico da coagulação, como possui propriedades anti-inflamatórias (através da libertação de prostaglandina I2 das células endoteliais). Embora se tenham demonstrado efeitos benéficos (sobre os parâmetros laboratoriais, o encurtamento da evolução da CIVD e a função dos órgãos) em doentes com sépsis ou choque séptico tratados com concentrados de antitrombina III, não se tem verificado redução significativa na mortalidade.
A proteína C, uma serina-protease dependente da vitamina K, inibe os factores activados V e VII prevenindo, assim, a produção de trombina. A proteína C humana recombinante activada (PCAhc) na dose de 24 mg/kg/h em infusão contínua ao longo de 96 horas reduz a mortalidade, melhora o perfil de coagulação, evidenciando também propriedades anti-inflamatórias mediadas pela modulação do factor kappa-B.
Contudo, devem ser tomadas precauções quando se administra PCArh em doentes com trombocitopénia (número plaquetário < 50 x 109/L) dada a maior probabilidade de hemorragia intracraniana, o que implica, em tal circunstância, proceder a transfusão de plaquetas previamente.
ABREVIATURAS
ADP > Adenosina difosfato.
TTPa > Tempo de tromboplastina parcial activada.
AT III > Antitrombina III.
CID > Coagulação intravascular disseminada.
ELISA > Imunoensaio enzimático.
F 1+2 > Fragmentos 1 e 2 de activação de protrombina.
HELLP > Síndroma de hemólise, aumento das enzimas hepáticas e diminuição das plaquetas.
IL > Interleucina.
IAP-1 > Inibidor do activador do plasminogénio tipo 1.
PAP > Complexo plasmina antiplasmina.
RAP > Receptor activado da protease.
TAT > Complexo trombina antitrombina.
IFVT > Inibidor do factor da via tecidual.
FNT/TNF > Factor de necrose tumoral.
BIBLIOGRAFIA
Bakhtiari K, Meijers JC, de Jonge E, Levi M. Prospective validation of the International Society of Thrombosis and Haemostasis scoring system for disseminated intravascular coagulation. Crit Care Med 2004; 32: 2416–2421
Bernard GR, Vincent JL, Laterre PF, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med 2001; 344: 699–709
Bick RL. Disseminated intravascular coagulation. Current concepts of etiology, pathophysiology, diagnosis, and treatment. Hematol Oncol Clin North Am 2003; 17: 149–176
Choudhry A, DeLoughery TG. Bleeding and thrombosis in acute promyelocytic leukemia. Am J Hematol 2012; 87: 596–603
Gando S. Disseminated intravascular coagulation in trauma patients. Sem Thromb Hemost 2001; 27: 585–592
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Hardaway RM, Williams CH, Vasquez Y. Disseminated intravascular coagulation in sepsis. Sem Thromb Hemost 2001; 27: 577–583
Helfaer MA, Nichols DG (eds). Roger’s Handbook of Pediatric Intensive Care. Philadelphia: Lippincott Williams & Wilkins, 2009
Hoffman R, Benz EJ, et al (eds). Hematology: Basic Principles and Practice. Philadelphia: Elsevier, 2018
Kamal AH, Tefferi A, Pruthi RK. How to interpret and pursue an abnormal prothrombin time, activated partial thromboplastin time, and bleeding time in adults. Mayo Clin Proc 2007; 82: 864–873
Kliegman RM, Stanton BF, StGeme JW, Schor NF (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier Saunders, 2015
Levi M, Schultz M. Coagulopathy and platelet disorders in critically ill patients. Minerva Anestesiol 2010; 76:851-859
Levi M, Toh CH, Thachil J, Watson HG. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br J Haematol 2009; 145: 24–33
Morley SL. Management of acquired coagulopathy in acute paediatrics. Arch Dis Child Educ Pract Ed 2011; 96:49-60
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Rudolph CD, Rudolph AM, Lister GE, First LR, Gershon AA (eds). Rudolph’s Pediatrics. New York: McGraw-Hill Medical, 2011
Thachil J, Falanga A, Levi M, Liebman H, Di Nisio M. Recommendations and guidelines: management of cancer associated disseminated intravascular coagulation: guidance from the SSC of the ISTH. International Society on Thrombosis and Haemostasis 2015; 13: 671-675
Wada H, Thachil J, Di Nisio M, et al. The Scientific Standardization Committee on DIC of the International Society on Thrombosis Haemostasis. Guidance for 2015 International Society on Thrombosis and Haemostasis. J Thromb Haemost 2013; 11: 761–767
Wada H, Matsumoto T, Yamashita Y, Hatada T, Disseminated intravascular coagulation: Testing and diagnosis. Clin Chimica Acta 2014; 436:130-134