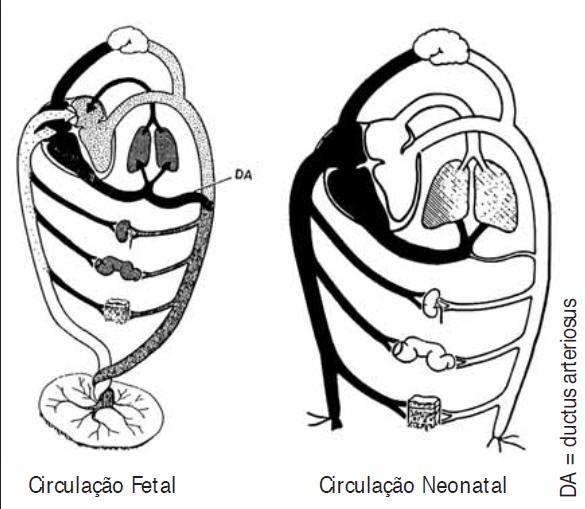
Definição e importância do problema
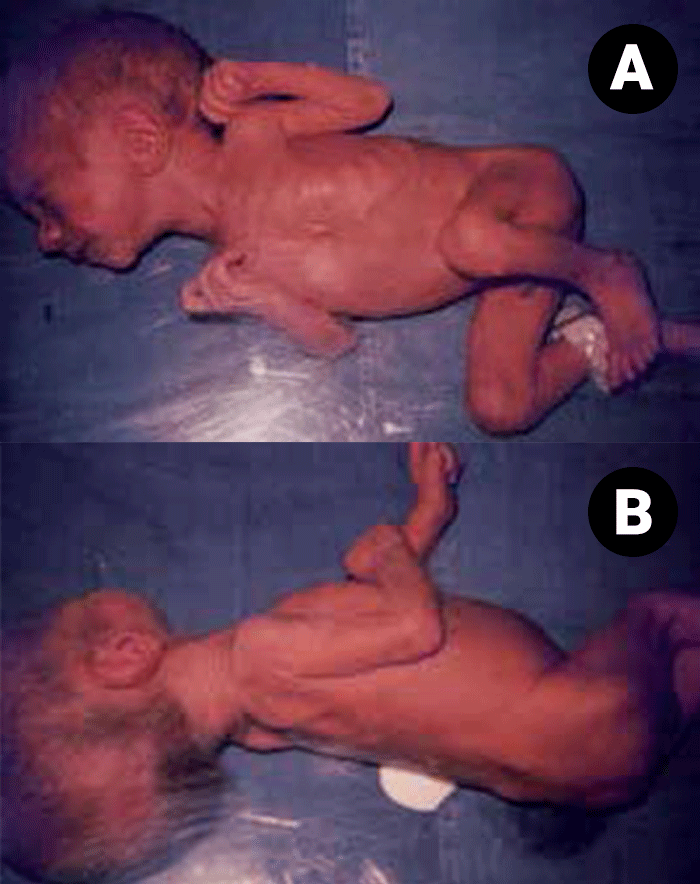
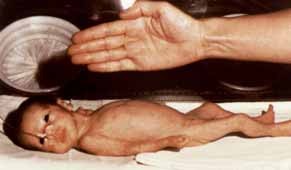
Mesmo que as estratégias ventilatória e antimicrobiana praticadas numa unidade de cuidados intensivos neonatais sejam de excelência, a qualidade assistencial praticada nestas pode considerar-se deficitária se não for dada a devida atenção ao suporte nutricional.
Os recém-nascidos total ou parcialmente impossibilitados de utilizar a via entérica, requerem nutrição parentérica (NP), método em que os nutrientes são administrados por via intravenosa.
Apesar de haver, desde há muito, programas informatizados que auxiliam a prescrição de NP neonatal, as premissas em que assentam os critérios não são muitas vezes consensuais e estão em contínua mudança.
Este capítulo baseia-se nas actuais Recomendações da Sociedade Portuguesa de Neonatologia de 2019, publicadas em Port J Pediatr 2019;50:209-219 (parte I) e Port J Pediatr 2019;50:220-231 (parte II), por sua vez orientadas por recomendações conjuntas de quatro sociedades científicas, publicadas em 2018: European Society of Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN), European Society for Parenteral and Enteral Nutrition (ESPEN), European Society of Pediatric Research (ESPR) e Chinese Society of Parenteral and Enteral Nutrition (CSPEN). No final do mesmo é incluído um Anexo para consulta rápida de doses de nutrientes recomendadas por nutrição parentérica em recém-nascidos pré-termo. |
GENERALIDADES
Normas de orientação e recomendações
As recomendações nacionais sobre NP neonatal revistas em 2008 (Acta Pediatr Port. 2008; 39: 125-34), reflectiram-se em assinalável adesão dos neonatologistas e melhoria da prática clínica. Um inquérito sobre as práticas de prescrição, respondido por 72% dos coordenadores de unidades neonatais portuguesas, revelou que 83% das unidades seguiam tais recomendações, 87% iniciavam aminoácidos no primeiro dia pós-natal e 95% iniciavam lípidos nos primeiros três dias pós-natais. Talvez por não haver recomendação nacional similar sobre a preparação de NP neonatal, foram detectados pontos débeis (por ex. controlo de qualidade) noutro inquérito nacional contemporâneo feito aos responsáveis pela sua preparação.
Particularmente para recém-nascidos muito e extremo pré-termo, são revistos aspectos fundamentais relacionados com os critérios de prescrição dos macro e micronutrientes, quer usando a prescrição individualizada com preparação em farmácia hospitalar, quer bolsas comerciais de composição fixa prontas a usar.
Indicações
A NP está indicada sempre que não é possível estabelecer uma nutrição entérica suficiente por período prolongado, nomeadamente nas seguintes situações:
- Prematuridade, sobretudo < 33 semanas de gestação;
- Anomalias congénitas principais do aparelho gastrintestinal ou que se reflictam no seu funcionamento, por ex., atrésia do esófago, atrésia intestinal, gastrosquise e hérnia diafragmática;
- Doenças que atinjam gravemente o tubo digestivo, por ex., enterocolite necrosante e síndroma do intestino curto;
- Restrição de crescimento intrauterino especialmente associado a prematuridade e a alterações nos achados Doppler;
- Asfixia perinatal grave;
- Cardiopatia congénita com compromisso da perfusão visceral e no pós-operatório precoce de cirurgia cardíaca.
Contraindicações e limitações
A NP não deve ser utilizada se houver: desidratação aguda, acidose metabólica mantida, desequilíbrios hidroeletrolíticos e metabólicos persistentes (acidose metabólica e alterações da natrémia, caliémia, glicémia e calcémia), insuficiências renal ou hepática agudas.
Em grande parte das situações associadas a estresse (por ex., cirurgia, sépsis), não está preconizado interromper a NP, mas sim proceder a ajustes individuais.
Formulação das misturas
Geralmente, são usadas misturas binárias de NP, isto é, duas misturas separadas, respectivamente:
- Uma solução hidroeletrolítica contendo glicose, aminoácidos, eletrólitos e oligoelementos e, outra;
- Uma emulsão de lípidos e vitaminas.
Por motivos económicos e de conveniência, há autores que propõem que as misturas preparadas em farmácia hospitalar sejam incluídas numa só bolsa (designada por mistura ternária ou “três-em-um”); contudo, tal estratégia está condicionada por alterações na estabilidade e compatibilidade físico-química de vários componentes.
Notas importantes:
|
Preparação individualizada e bolsas de composição fixa
Actualmente, na maioria das unidades neonatais portuguesas é usada a prescrição de NP individualizada e preparação em farmácia hospitalar (compounding). A prescrição é geralmente feita com auxílio de suporte informático, procedimento que comprovadamente melhora a eficiência da prescrição, reduz erros de prescrição e poupa muitos cálculos aos prescritores e preparadores. Tal preparação individualizada deve ser centralizada em farmácia hospitalar e preferida em recém-nascidos muito pré-termo com risco acrescido de desequilíbrios metabólicos, como hipo- e hiperglicémia, hipo- e hipernatrémia e hipo- e hipercaliémia.
Recentemente, passaram a ser comercializadas bolsas de NP neonatal de composição fixa, com as vantagens de estarem prontas a usar, serem de fácil armazenamento e terem garantida a estabilidade dos nutrientes.
Estimativa da osmolalidade
A osmolalidade é expressa em mOsm/Kg de água (solvente) e a osmolaridade em mOsm/L de solução (soluto + solvente).
Sendo a osmolalidade obtida por medição e a osmolaridade por cálculo, foi validada por osmometria uma equação simples para estimativa da osmolalidade de soluções de NP neonatal, baseada nas concentrações dos quatro componentes mais influentes: glicose, aminoácidos, fósforo e sódio; as concentrações de glicose e aminoácidos são expressas em g/L, a de fósforo em mg/L e a de sódio em mEq/L: Osmolaridade (mOsm/L) = (aminoácidos x 8) + (glicose x 7) + (sódio x 2) + (fósforo x 0,2) – 50; equação equivalente foi disponibilizada com as concentrações molares de azoto, glicose, sódio e fósforo. A referida equação, que pode ser incorporada em folha de cálculo e em programas informáticos, tem sido sugerida por vários autores, verificando-se boa correlação com as equações propostas pela American Society for Parenteral and Enteral Nutrition (ASPEN).
Vias de administração
Na NP binária, a solução aquosa com glicose e aminoácidos é geralmente perfundida utilizando linha individual, à qual se liga a perfusão lipídica por conexão em Y, o mais próximo do local de venopunção ou da inserção de cateter. A opção de administrar NP por via periférica ou por via central depende de vários factores, como a duração prevista da NP, a osmolalidade da solução e a facilidade de acesso de uma via central.
Via periférica
Está indicada quando é prevista NP por período inferior a 2 semanas, existem bons acessos periféricos e bom estado nutricional. São limitações as venopunções frequentes e o suprimento insuficiente de energia e nutrientes, dado que soluções com teor adequado de nutrientes facilmente excedem 900 mOsm/Kg.
Via central
Está indicada quando é prevista NP por período prolongado, utilizando osmolalidade dos componentes em mOsm/Kg: > 900, ou concentração de glicose > 12,5 g/dL na solução final. Mesmo por via central, a osmolalidade não deve ser > 1.700 mOsm/Kg, ou a concentração de glicose não ser > 15 g/dL.
Tipos de cateter mais usados:
- venoso central, de inserção percutânea periférica (epicutâneo-cava); ou venoso de inserção percutânea central (por ex., na veia subclávia, tipo Arrow®) – se previsão de NP inferior a 2-3 semanas;
- venoso central, com túnel (eg, tipo Broviac®) – se previsão de NP superior a 2-3 semanas.
Utilizando os vasos umbilicais:
- veia umbilical, se via periférica não disponível, especialmente em recém-nascidos < 1.000 g e utilização por menos de 5 dias;
- artéria umbilical, apenas se não houver outra alternativa e se a utilização for inferior a 48 horas.
Heparinização de cateteres
Existe controvérsia sobre a vantagem do uso de heparina para evitar a oclusão de cateteres centrais destinados à administração de NP neonatal. Actualmente, os peritos no âmbito da ESPGHAN/ESPEN/ESPR/CSPEN não recomendam o seu uso profiláctico por rotina. No entanto, de acordo com uma revisão sistemática concluiu-se que havia vantagem da adição de heparina à solução hidroelectrolítica, na dose de 10-15 UI/kg/d.
Um procedimento preventivo alternativo ao uso de heparina por rotina, para promover a permeabilidade de cateteres aplicados intermitentemente, é a sua lavagem (flushing) semanal, com pequenos volumes de soro fisiológico heparinizado (5-10 UI/ml).
De salientar que a heparina não deve ser adicionada às emulsões lipídicas por poder alterar a sua estabilidade.
Armazenamento e filtros
Os dois principais factores que determinam a estabilidade de soluções de NP durante o armazenamento são a temperatura e a exposição à luz.
Segundo um estudo sobre a estabilidade físico-química de soluções binárias de NP neonatal comprovou-se que estas se mantêm estáveis por 4 meses à temperatura de 4-8 ºC.
Todas as soluções de NP devem ser protegidas da luz natural e artificial (incluindo fototerapia), durante o armazenamento e a administração, para reduzir a probabilidade de degradação de algumas vitaminas e a formação de peróxidos de hidrogénio e lipídicos.
Durante a administração é recomendado o uso de filtros de 1,2 micras na administração de misturas ternárias e de 0,22 micras para misturas binárias, a fim de reter micropartículas ou precipitados.
Complicações
As complicações mais frequentemente associadas à NP neonatal incluem: sépsis relacionada com cateter central, oclusão trombótica do cateter central, assim como extravasamento, fractura do cateter central e migração deste.
A doença metabólica óssea e a colestase associada à NP são consequência de pausa alimentar prolongada com dependência de NP exclusiva.
Vigilância clínica e laboratorial
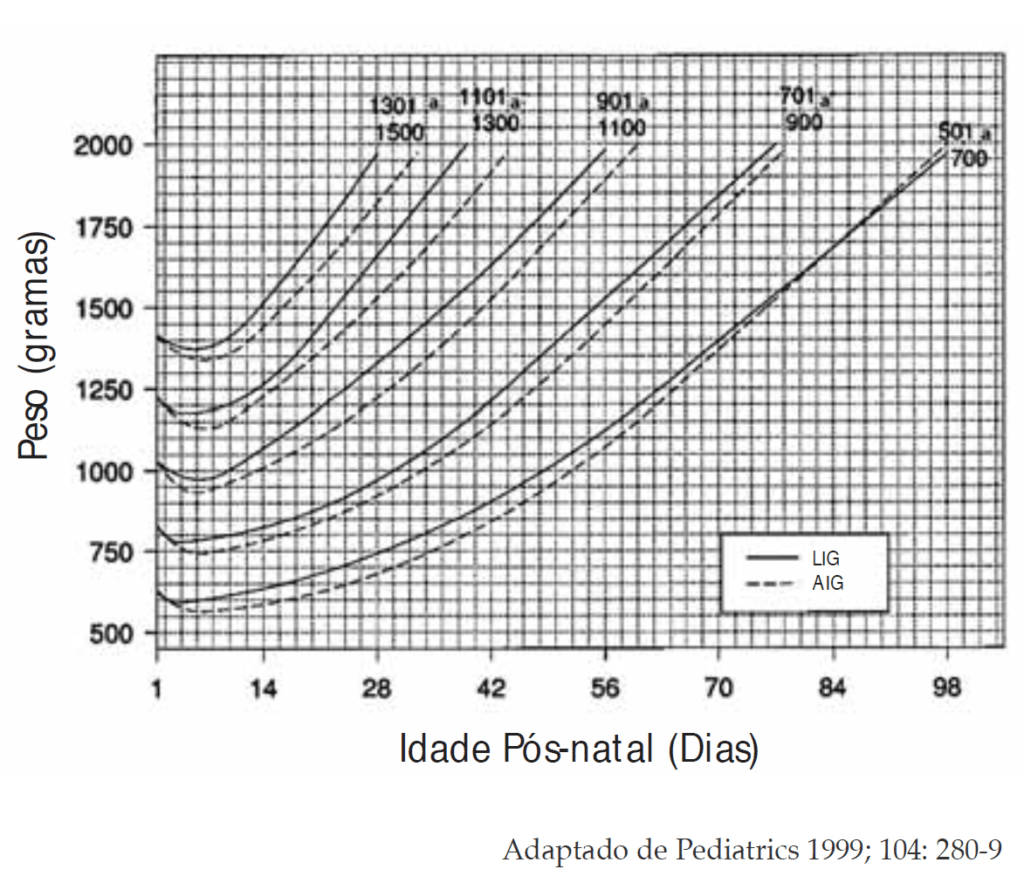
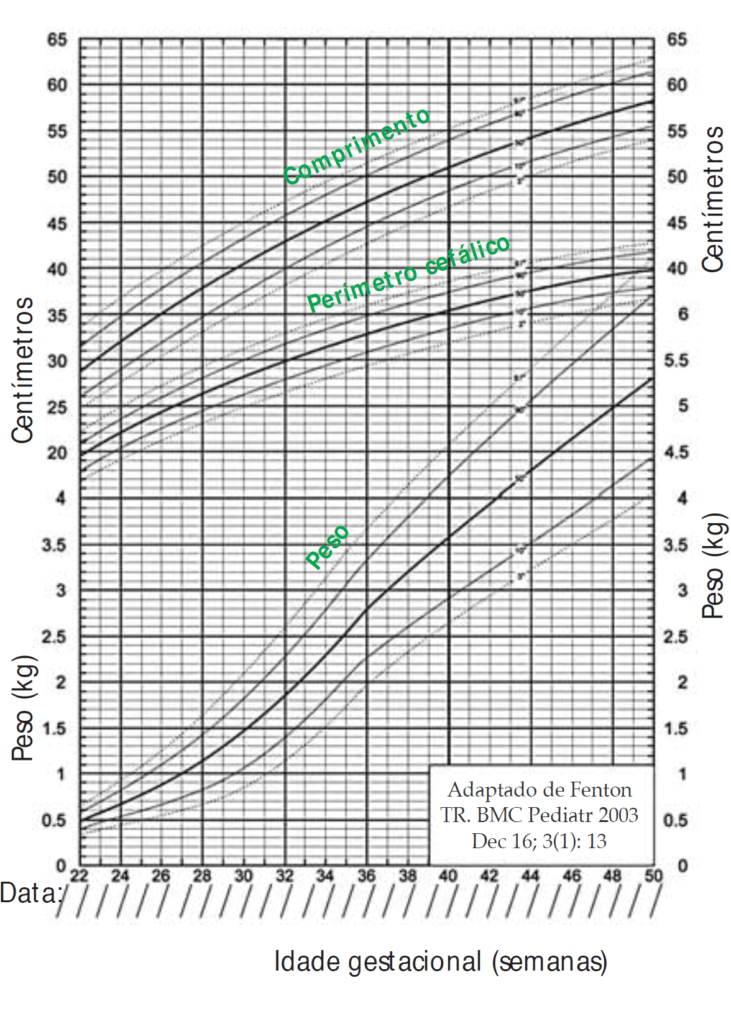
Antropometria: peso (diariamente), comprimento e perímetro cefálico (semanalmente).
Avaliação laboratorial:
- Na primeira semana pós-natal, diariamente – glicemia, densidade urinária, glicosúria, gasometria no sangue, ionograma sérico e calcémia; e duas a três vezes por semana – hemograma, urémia (BUN) e creatininémia.
- Após a primeira semana, para além das análises referidas, devem ser avaliadas semanalmente as transaminases, fosfatase alcalina, bilirrubinas total e conjugada, γ-glutamil transpeptidase, albuminémia e trigliceridémia.
Para evitar a espoliação excessiva em recém-nascidos muito pré-termo estáveis, a periodicidade do controlo analítico pode ser menos frequente.
PRESCRIÇÃO INDIVIDUALIZADA
Líquidos
QUADRO 1 – Suprimento diário de líquidos (mL/kg), desde a primeira semana pós-natal.
| Dia pós-natal | D1 | D2 | D3 | D4 | D5 | ≥ D6 |
| Termo | 40-60 | 50-70 | 60-80 | 60-100 | 100-140 | 140-170 |
| Pré-termo ≥ 1.500 g | 60-80 | 80-100 | 100-120 | 120-140 | 140-160 | 140-160 |
| Pré-termo < 1.500 g | 80-100 | 100-120 | 120 -140 | 140-160 | 160-180 | 140-160 |
Considerações:
- Nos primeiros dias pós-natais, os principais determinantes do balanço hídrico no recém-nascido muito pré-termo são a oligúria relativa e a perda transepidérmica de água. Para não exceder o suprimento hídrico recomendado, é necessário contrariar a perda transepidérmica providenciando humidade ambiente de 80-90% e ambiente de termoneutralidade, preferencialmente em incubadora de dupla parede.
- A humidade deve ser diminuída rapidamente a partir dos 5 dias pós-natais, para evitar o risco de infecção. Uma estratégia complementar é utilizar cobertor de plástico. A seguir à fase de oligúria relativa, segue-se outra de diurese e natriurese, sendo desejável que o recém-nascido muito e extremo pré-termo perca 7-10% do peso de nascimento.
- Embora seja controverso, poderá ser necessário aumentar o suprimento de líquidos (não mais do que 10% das necessidades basais) se for usada incubadora aberta ou fototerapia.
- Parâmetros orientadores da prescrição:
- Densidade urinária – é desejável que se situe entre 1005-1010;
- Natrémia – na primeira semana pós-natal reflecte essencialmente o estado de hidratação (a hiponatrémia indica hiperidratação, e a hipernatrémia desidratação);
- Diurese – é desejável que se situe entre 1-3 mL/kg/h, considerando oligúria o valor < 0,5-1 mL/kg/h e poliúria > 6-7 mL/kg/h;
- Evolução ponderal – nos primeiros dias pós-natais, reflete o estado de hidratação.
Energia
QUADRO 2 – Suprimento diário (kcal/kg) de energia recomendado.
D <> Dia vida | |||
| Dias pós-natais | D 1 | D 2-6 | ≥ D 7 |
| Termo | 40 | 60-80 | 90-100 |
| Pré-termo | 45-55 | 60-80 | 90-120 |
Considerações:
- O suprimento energético excessivo aumenta o risco de acumulação exagerada de massa gorda; o suprimento insuficiente predispõe à restrição de crescimento, compromisso do neurodesenvolvimento e alteração da imunidade.
- Idealmente, a glicose deve contribuir com 45-55% da energia total, os lípidos com 30-40% e os aminoácidos com 10-15%; os lípidos não devem exceder 40-60% da energia não-proteica.
- Um grama (1 g) de glicose fornece 4 kcal; um grama (1 g) de aminoácidos fornece igualmente 4 kcal; e um grama (1 g) de lípidos fornece 9 kcal.
Glicose
QUADRO 3 – Suprimento diário (mg/kg/min) de glicose recomendado
|
Considerações:
- A dose máxima recomendada de glicose é de 12 mg/kg/min (17,3 g/Kg/d). Um suprimento exagerado de glicose pode promover a lipogénese e excessivo armazenamento de gordura, aumento da susceptibilidade a infecções e retinopatia da prematuridade.
- Situações como estresse, infecção e medicação com metilxantinas podem predispor a hiperglicemia. Na fase aguda de doença (por ex, sépsis), o suprimento de glicose não deve exceder 5-7 mg/kg/min no primeiro dia de doença.
- Em caso de hiperglicemia (>145 mg/ dL), a dose de glicose deve ser diminuída; poderá também ser necessário diminuir a de lípidos pelo seu efeito hiperglicemiante mediado pela neoglicogénese.
- O uso de insulina deve ser apenas considerado se a hiperglicemia persistir apesar de de o suprimento de glicose ser reduzido para 4 mg/kg/min, e/ou se a glicemia se mantiver >180 mg/dL.
Parâmetros orientadores da prescrição:
- Glicemia venosa ou capilar: hiperglicemia se >145 mg/dL e hipoglicemia se <40 mg/dL.
- Pesquisa de glicosúria (fitas reagentes).
Aminoácidos
QUADRO 4 – Suprimento diário (g/kg) de aminoácidos recomendado.
| Dias pós-natais | D 1 | ≥ D 2 | Máximo |
| Termo | > 1,5 | 2,5-3,0 | 3,0 |
| Pré-termo | > 1,5 | 2,5-3,5 | 3,5 |
Considerações:
- A administração parentérica de aminoácidos é considerada menos fisiológica que a entérica, por ser feita directamente para a circulação sistémica, sem passar pelo metabolismo hepático e esplâncnico.
- O suprimento de energia não-proteica > 65 kcal/kg/d promove a retenção azotada; contudo, se tal suprimento for inferior não se deve limitar a dose de aminoácidos, uma vez que a quantidade que não é utilizada para a retenção azotada é oxidada para produção de energia.
- Em recém-nascidos pré-termo, o início precoce de aminoácidos, estimulando a secreção endógena de insulina, poderá contribuir para prevenir a hiperglicé
Parâmetros orientadores da prescrição:
- Urémia e azoto ureico (BUN): valores de referência 5,5-22 mg/dL. O valor da urémia equivale a 2,14 do valor de BUN (por ex., 20 mg/dL de urémia equivalem a 9,3 mg/dL de BUN). O azoto ureico constitui um bom indicador do suprimento proteico, exceptuando nos primeiros dias pós-natais, muito influenciados pelo estado de hidratação e função renal. Um valor baixo de BUN indica suprimento insuficiente; todavia, um valor no limiar superior poderá apenas reflectir uma eficiente oxidação dos aminoácidos e não sua intolerância.
Lípidos
QUADRO 5 – Suprimento diário (g/kg) de lípidos recomendado.
|
Considerações:
- As emulsões lipídicas são uma boa fonte de energia, de ácidos gordos essenciais e de substracto para acréscimo de gordura em recém-nascidos muito pré-termo com escassa reserva adiposa fetal.
- É necessária a dose mínima de 1 g/kg/d para evitar o défice de ácidos gordos essenciais que ocorre ao fim de 72 h sem suprimento exógeno, usando as actuais emulsões lipídicas. Idealmente, a emulsão lipídica deve conter ácidos gordos n-6 e n-3 (óleo de peixe), substâncias com boa capacidade antioxidante (por ex., α–tocoferol e ácidos gordos monoinsaturados) e, porventura, ácidos gordos de cadeia média (menos dependentes da carnitina).
- Embora os recém-nascidos pré-termo sejam deficitários em carnitina (que facilita o transporte dos ácidos gordos para o interior da mitocôndria onde são oxidados), com a sua suplementação não foram verificadas vantagens.
- Uma vez que as emulsões lipídicas são iso-osmolares, podem ser administradas por via periférica.
- Especialmente em recém-nascidos pré-termo, todo o sistema de perfusão (seringa, tubos) da emulsão lipídica deve estar protegido da luz, em especial da fototerapia, para evitar a formação de peróxidos de lípidos e de hidrogénio e consequente lesão celular.
- Receios não comprovados do uso parentérico de lípidos, não se aconselhando a limitação da sua administração: 1) Não está comprovado que predisponha à doença pulmonar crónica ou à retinopatia da prematuridade; 2) Na trombocitopénia, admite-se que outros cofactores são responsáveis pelos efeitos adversos atribuídos aos lípidos, como o défice de vitamina E (responsável pela redução do número de plaquetas) e a administração de heparina (interferindo com a função plaquetar); 3) Estudos in vitro e in vivo não demonstraram claramente que os lípidos endovenosos interferem negativamente no sistema imune, nomeadamente na actividade dos monócitos; e 4) A utilização de lípidos endovenosos pode predispor à sépsis por Staphylococcus coagulase negativo e Candida; contudo, as vantagens nutricionais da sua utilização são francamente superiores aos riscos.
- Na hiperbilirrubinémia não conjugada, na fase aguda de sépsis, na hipertensão pulmonar e na trombocitopénia grave e não explicada, poderá ser necessário reduzir a dose dos lípidos, porventura para 1 g/Kg/d para evitar o défice de ácidos gordos essenciais.
Parâmetro orientador da prescrição:
- Trigliceridémia: não deve exceder 265 mg/dL.
Sódio
QUADRO 6 – Suprimento diário de sódio (mEq/kg) recomendado.
| Pode vir a necessitar: a 3 mEq/kg/d; b 7 mEq/kg/d | |||
| Dias pós-natais | D 1-3 | D 4 e 5 | D ≥6 |
| Termo | 0-2 | 1-3 | 2-3 |
| Pré-termo ≥ 1.500 g | 0-2 a | 2-5 | 3-5 |
| Pré-termo < 1.500 g | 0-2 a,b | 2-5 b | 3-5 b |
Considerações:
- Sódio (Na): 1 mmol = 1 mEq = 23 mg.
- Em recém-nascidos pré-termo, nos primeiros dias pós-natais deve permitir-se o balanço negativo fisiológico de sódio, sob pena de predispor à morbilidade, nomeadamente persistência do canal arterial e displasia broncopulmonar. Embora alguns autores tenham descrito que a administração de sódio por NP desde o primeiro dia pós-natal não se associa a hipernatrémia, a maioria das sociedades científicas recomenda que se protele a sua administração ou não se exceda 2 mEq/Kg/d até que ocorra perda de > 6% do peso ao nascer, que indica o estabelecimento de natriurese suficiente. Tal interpretação pode ser enviesada se a diminuição de peso resultar da perda transepidérmica de água (e não da natriurese), por não ter sido providenciada a adequada de humidade ambiente.
- Durante a primeira semana pós-natal, a natrémia reflecte o estado de hidratação; posteriormente, indica também a reserva de sódio. A hipernatrémia nos primeiros dias pós-natais pode resultar de desidratação por exagerada perda transepidérmica de água ou de inadequado suprimento de sódio. A hiponatrémia pode resultar de hemodiluição por oligúria, perda renal no caso de recém-nascidos muito pré-termo, ou do uso de diuréticos e cafeína.
- Se as necessidades de sódio forem superiores às recomendadas, o suprimento basal deve ser fornecido por NP e o suplementar por perfusão independente em Y de solução com sódio, usando por exemplo NaCl 20% (1 ml = 3,4 mEq); este método permite ajustar de forma conveniente a dose em função da natrémia.
Parâmetro orientador da prescrição:
- Natrémia: valores de referência 135-145 mEq/L.
- Sódio urinário: uma amostra de urina com Na < 20 mEq/L associada a hiponatrémia ou uma excreção fraccionada de sódio (FENa) < 3% em recém-nascidos de termo ou < 4% em recém-nascidos pré-termo, indica depleção da volémia.
Cloro
QUADRO 7 – Suprimento diário de cloro (mEq/Kg) recomendado.
| Dias pós-natais | D 1-3 | D 4-5 | D ≥ 6 |
| Termo e Pré-termo | 0-3 | 2-5 | 2-5 |
Considerações:
- Cloro (Cl): 1 mmol = 1 mEq = 35,5 mg.
- O suprimento de cloro geralmente acompanha o de sódio e a dose não deve exceder a de sódio e de potássio para evitar a acidose metabólica hiperclorémica.
- Em recém-nascidos muito e extremos pré-termo, o suprimento excessivo de cloro associa-se à acidose metabólica hiperclorémica (> 114 mEq/L). Isto pode ser prevenido ou resolvido substituindo parcialmente o cloro por acetato.
Parâmetros orientadores da prescrição:
- Cloremia: valores de referência 96-106 mEq/L.
- Gases no sangue: para vigilância de acidose.
Potássio
QUADRO 8 – Suprimento diário de potássio (mEq/Kg) recomendado.
Iniciar ≥ D2 se diurese ≥ 1 ml/kg/h
|
Considerações:
- Potássio (K): 1 mmol = 1 mEq = 39 mg.
- Embora alguns autores refiram que a administração de potássio por rotina desde o primeiro dia pós-natal não se associa hipercaliémia, as sociedades científicas recomendam que seja iniciada a sua administração apenas quando se verificar diurese ≥ 1 ml/kg/h, na ausência de hipercaliémia.
- Em recém-nascidos ventilados, as alterações súbitas da caliémia podem resultar de variações do equilíbrio ácido-base: a acidose metabólica com acidémia associa-se à hipercaliémia e a alcalose metabólica à hipocaliémia.
- A hipercaliémia em particular pode ocorrer associada ou não a oligúria. A hipercaliémia não-oligúrica pode ocorrer na presença de hematoma, hemólise e falta de administração de corticóides pré-natais em recém-nascidos muito pré-termo. Nestes, a hipocaliémia pode resultar de suprimento insuficiente face à elevada demanda, perda renal ou uso de diuréticos e cafeína.
- Se as necessidades de potássio forem superiores às recomendadas, o suprimento basal deve ser fornecido por NP e o suplementar por perfusão independente em Y de solução com potássio, usando por exemplo KCl 7,5% (1ml = 1 mEq); este método permite ajustar de forma conveniente a dose em função da caliémia.
Parâmetros orientadores da prescrição:
- Caliémia: valores de referência 3,5-4,5 mEq/L.
- Diurese.
Cálcio e Fósforo
Quadro 9 – Suprimento diário (mg/Kg) de cálcio e fósforo recomendado.
| Termo | Pré-termo 1ª semana pós-natal | Pré-termo > 1ª semana pós-natal | |
| Cálcio | |||
| mg/kg | 30 – 60 | 32 – 80 | 100 – 140 |
| mmol/kg | 0,8 – 1,5 | 0,8 – 2,0 | 2,5 – 3,5 |
| Fósforo | |||
| mg/kg | 20 – 40 | 31 – 62 | 77 – 108 |
| mmol/kg | 0,7 – 1,3 | 1,0 – 2,0 | 2,5 – 3,5 |
| Ratio Ca:P | |||
| mg:mg | 1,3 – 1,7 | 1,3 | 1,3 – 1,7 |
| molar | 1,0 – 1,3 | 1,0 | 1,0 – 1,3 |
Considerações:
- Cálcio (Ca): 1 mmol = 2 mEq = 40 mg; Fósforo (P): 1 mmol = 31 mg; a valência do fósforo varia conforme esteja na forma de fosfato monobásico ou dibásico.
- Utilizando a ratio Ca:P de mg:mg 1,7:1 (molar 1,3:1) antes recomendada em recém-nascidos muito pré-termo, era frequente ocorrer hipercalcémia, hipofosforémia e hipocaliémia em presença de doses recomendadas de aminoácidos (> 2,5 g/kg/d). Isto era devido ao crescimento celular induzido pelo adequado suprimento de aminoácidos, o que originava a mobilização intracelular de potássio e fósforo, consequente hipocaliémia e hipofosforémia, com mobilização óssea de cálcio em resposta à hipofosforé Mulla et al (2017) demonstraram que, em recém-nascidos muito pré-termo, a utilização da ratio Ca:P mg:mg de 1,3:1 (ou equimolar de 1:1), à custa do aumento da dose de fósforo, obvia o problema.
- Na actual recomendação da ESPGHAN/ESPEN/ESPR/CSPEM são propostas doses muito elevadas de cálcio e fósforo em recém-nascidos pré-termo (Quadro 9), o que levanta preocupações quanto à sua compatibilidade, estabilidade e risco de precipitação. Para que a segurança esteja garantida, será necessário testar tais doses associadas a diferentes tipos e concentrações de soluções de aminoácidos, diferentes sais de fosfato e diferentes pH das soluções finais, o que parece não ter sido ainda totalmente analisado. São factores determinantes da boa compatibilidade de cálcio e fósforo nas soluções de NP a utilização de sais orgânicos de cálcio e fósforo e pH < 7,1 na solução final, que promove a formação de fosfato de cálcio dibásico (60 vezes mais compatível que o monobásico). Não estando provada cientificamente a garantia de compatibilidade e estabilidade mineral usando as tais doses elevadas (Quadro 9), será preferível adoptar, pelo menos de início, os valores descritos por Mulla et al (2017): cálcio 88-90 mg/kg/d, fósforo 68-70 mg/kg/d e ratio Ca:P molar de 1 (ou de 1,3:1 em mg).
- Ao optar-se por administrar fósforo nos primeiros dias pós-natais, importa contabilizar a quantidade apreciável de sódio contida na maioria dos sais de fósforo, por ex. 2 mEq de sódio por 1 ml de glicerofosfato de sódio.
- Soluções com elevada concentração de cálcio devem ser administradas por cateter central, pelo risco de necrose tecidual quando há extravasamento ao ser usada a via periférica.
Parâmetros orientadores da prescrição:
- Fosforémia e fosfatase alcalina: não há marcadores bioquímicos precoces confiáveis de doença metabólica óssea da prematuridade. No entanto, de entre os marcadores bioquímicos mais usados, a hipofosforémia (< 5,5 mg/dL ou < 1,8 mmol/L) e a elevação da fosfatase alcalina (> 900 UI/L), particularmente a combinação de ambos, são os marcadores com maior sensibilidade e especificidade, sendo a calcémia um mau marcador.
Magnésio
QUADRO 10 – Suprimento diário de magnésio recomendado.
| Termo | Pré-termo 1ª semana pós-natal | Pré-termo > 1ª semana pós-natal | |
| Magnésio | |||
| mg/kg | 2,4 – 5,0 | 2,0 – 5,0 | 5,0 – 7,5 |
| mmol/kg | 0,1 – 0,2 | 0,1 – 0,2 | 0,2 – 0,3 |
| mEq/kg | 0,2 – 0,4 | 0,2 – 0,4 | 0,4 – 0,6 |
Considerações:
- Magnésio (Mg): 1 mmol = 2 mEq = 24 mg.
- A suplementação parentérica de magnésio só deve ser iniciada se a magnesiémia estiver dentro dos limites normais, especialmente em recém-nascidos pré-termo nos primeiros dias pós-natais, quer pela baixa taxa de filtração glomerular e limitada capacidade da sua excreção renal, quer por possível exposição pré-natal a sulfato de magnésio usado como tocolítico.
Parâmetro orientador da prescrição:
- Magnesiémia – valores de referência para recém-nascidos de termo e pré-termo 0,7-1,5 mEq/L.
Vitaminas hidrossolúveis
QUADRO 11 – Suprimento diário de vitaminas hidrossolúveis recomendado para recém-nascidos de termo e pré-termo.
| Vitamina | Dose/kg |
| Vitamina C (ácido ascórbico), mg | 15 – 25 |
| Tiamina (vitamina B1), mg | 0,35 – 0,5 |
| Riboflavina (vitamina B2), mg | 0,15 – 0,2 |
| Piridoxina (vitamina B6), mg | 0,15 – 0,2 |
| Niacina (nicotinamida ou vitamina B3), mg | 4,0 – 6,8 |
| Vitamina B12 (cobalamina), μg | 0,3 |
| Ácido pantoténico (vitamina B5), mg | 2,5 |
| Biotina (vitamina B7), μg | 5,0 – 8,0 |
| Ácido fólico, μg | 56 |
Considerações:
- Embora a dose parentérica ideal da maioria das vitaminas hidrossolúveis não tenha sido determinada em recém-nascidos, o Quadro 11 indica as doses recomendadas.
- As vitaminas hidrossolúveis devem ser administradas diariamente e adicionadas à emulsão lipídica para aumentar a sua estabilidade.
- Sugerido o produto Soluvit N® (Fresenius Kabi) na dose diária de 1 ml/kg, contendo cada 1 ml: vitamina C 10,0 mg, tiamina 0,25 mg, riboflavina 0,36 mg, niacina 4,0 mg, piridoxina 0,40 mg, vitamina B12 0,5 μg, ácido pantoténico 1,50 mg, biotina 6,0 μg e ácido fólico 40 μ
Vitaminas lipossolúveis
QUADRO 12 – Suprimento diário de vitaminas lipossolúveis recomendado em recém-nascidos de termo e pré-termo.
| a máximo 11 mg/dia; b as soluções multivitamínicas actuais fornecem dose superior | ||
| Vitamina | Termo | Pré-termo |
| Vitamina A (retinol) | ||
| UI | 150-300/kg ou 697/dia | 227-455 ou 700-1.500/kg/dia |
| μg | 2.300/dia | 227-455/kg |
| Vitamina D (calciferol) | ||
| UI | 40-150/kg ou 400/dia | 80-400/kg ou 200-1.000/dia |
| Vitamina E (a-tocoferol) | ||
| UI | 2,8-3,5/kg/dia | 2,8-3,5/kg/dia |
| mg | 2,8-3,5/kg/dia a | 2,8-3,5/kg/dia a |
| Vitamina K, (fitomenadiona) | ||
| μg | 10/kg/dia b | 10/kg/dia b |
Considerações:
- Vitamina A 1 μg = 3,33 UI; Vitamina D 1 μg = 40 UI; Vitamina E 1 mg = 1 UI.
- As vitaminas lipossolúveis devem ser administradas diariamente e adicionadas à emulsão lipídica para aumentar a sua estabilidade.
- A dose de vitamina K1 fornecida pela solução de vitaminas lipossolúveis pressupõe que esta tenha sido administrada no primeiro dia pós-natal para prevenção da doença hemorrágica do recém-nascido.
- Sugerido o produto: Vitalipid N Infantil® (Fresenius Kabi): se peso < 2,5 kg, a dose diária é de 4 ml/kg; se peso ≥ 2,5 kg, a dose diária máxima é de 10 ml. Cada 1 ml de Vitalipid N Infantil® (Fresenius Kabi), contém: vitamina A 69 μg (230 UI), vitamina D2 1 μg (40 UI), vitamina E 0,64 mg (0,70 UI) e vitamina K1 20 μ
Oligoelementos
QUADRO 13 – Suprimento diário (μg/kg) de oligoelementos recomendado.
| Oligoelemento | Termo | Pré-termo |
| Zinco | 250 | 400 – 450 |
| Cobre | 20 | 40 |
| Selénio | 2 – 3 | 7 |
| Crómio | 0 | 0 |
| Manganês | 1 | 1 |
| Molibdénio | 0,25 | 1 |
| Iodo | 1 – 10 | 1 |
| Ferro | 50 – 100 | 200 |
Considerações:
- A transferência mãe-feto quantitativamente mais elevada dos oligoelementos ocorre no terceiro trimestre. Embora a dose parentérica da maioria dos oligoelementos não tenha sido determinada em recém-nascidos pré-termo, o Quadro 13 indica as doses recomendadas.
- O zinco deve ser administrado desde o início da NP exclusiva. As soluções correntes de oligoelementos incluem manganês e molibdénio, cuja suplementação parentérica só está recomendada se a NP for superior a duas semanas. As soluções de NP estão geralmente contaminadas com alumínio e crómio, o que perfaz as necessidades, não sendo necessária a sua suplementação parentérica.
- Para evitar a toxicidade, na colestase e na insuficiência hepática, as doses de cobre e manganês devem ser reduzidas. Na insuficiência renal aguda, deve ser reduzida a dose de selénio.
- Sugerido suplementar com gluconato de zinco 0,1% (1 ml = 1000 µg de zinco) desde o início da NP. A partir das 2 semanas de NP, pode usar-se a solução completa de oligoelementos, por ex., Peditrace® (Fresenius Kabi) 1 ml/kg, contendo cada 1 ml (μg): Zn 250, cobre 20, manganês 1, selénio 2, iodo 1 e flúor 57. Em recém-nascidos pré-termo, torna-se necessário adicionar gluconato de zinco 0,1% para perfazer a dose recomendada de zinco.
BOLSAS COMERCIAIS PRONTAS A USAR
Como alternativa à prescrição individualizada de NP com preparação em farmácia hospitalar (em condições de assepsia, aquando da mistura dos componentes, sob câmara de fluxo laminar), passaram a estar disponíveis bolsas comerciais de NP neonatal de composição fixa e prontas a usar. Entre as suas potenciais vantagens, incluem-se: – melhoria da estabilidade físico-química das soluções, – maior garantia quanto à mistura e suprimento de macro e micronutrientes, – melhor custo-efectividade, – redução dos erros de prescrição e da contaminação bacteriana, – e disponibilidade dum produto durante 24 horas, em qualquer dia da semana, sem a dependência dos serviços farmacêuticos.
Por estes motivos, as ESPGHAN/ESPEN/ESPR/CSPEM recomendam a utilização destas bolsas, preferindo-as relativamente à prescrição e preparação individualizada em farmácia hospitalar, inclusive para recém-nascidos pré-termo, desde que estes estejam em condições de estabilidade, e as referidas bolsas sejam usadas por períodos inferiores a 2-3 semanas, com a devida monitorização laboratorial.
Contudo, tal modalidade não deve ser usada em recém-nascidos muito e extremo pré-termo com risco de desequilíbrio metabólico, como hipo- e hiperglicémia, hipo- e hipernatrémia e hipo- e hipercaliémia, tendo em consideração, em tal contexto, a necessidade de serem ajustados, para correcção, os suprimentos de macro e micronutrientes até à estabilização metabólica.
Em Portugal, encontram-se comercializadas as bolsas de NP neonatal prontas a usar Numeta® (Baxter), tendo as Pediaven NN® (Fresenius Kabi) a autorização de introdução no mercado, cedida pelo INFARMED.
Bolsas Numeta® (Baxter)
Segundo o fabricante, a Numeta G13%E® (Baxter), está indicada em recém-nascidos pré-termo e a Numeta G16%E® (Baxter) nos de termo.
Trata-se de bolsas tricompartimentadas, contendo respectivamente solução de glicose, solução de aminoácidos com eletrólitos e emulsão de lípidos. No momento da administração, activa-se a remoção do selo entre os compartimentos de glicose e de aminoácidos/eletrólitos e, ao pretender administrar-se também lípidos, activa-se a remoção do selo do respectivo compartimento.
As soluções Numeta® (Baxter) não contêm vitaminas nem oligoelementos, os quais devem ser adicionados quando se decide a sua administração.
SITUAÇÕES PARTICULARES
Sépsis
Na fase aguda da sépsis pode ocorrer hiperglicémia por aumento da resistência à insulina e hipertrigliceridémia por elevação das catecolaminas e cortisol e diminuição da actividade da lipoproteína lípase.
Ao complicar-se com trombocitopénia, não há comprovação de que os lípidos endovenosos diminuam o número ou função das plaquetas; admite-se que tais factos sejam devidos respectivamente a défice de vitamina E e à perfusão de heparina.
Na fase aguda da sépsis, não está demonstrado que haja maior necessidade de aminoácidos, anotando-se que o excesso de nutrientes na fase catabólica pode ser contraproducente.
Actuação prática
- A glicose deve ser a fonte energética preferencial; se ocorrer hiperglicémia (> 145 mg/dL), o suprimento de glicose deve ser reduzido, se necessário até 2,5 mg/kg/min no recém-nascido de termo e 4 mg/kg/min no pré-termo.
- Se ocorrer hipertrigliceridémia (> 265 mg/dL), o suprimento de lípidos deve ser reduzido, se necessário para 1 g/kg/d para evitar o défice de ácidos gordos essenciais.
- Na fase aguda da sépsis deve ser garantido o suprimento de, pelo menos, 60 kcal/kg/d e 2,5 g/kg/d de aminoácidos.
Colestase
No recém-nascido, a colestase associada à NP é multifactorial, sendo factores independentes a duração da NP e a dose elevada de glicose, e não a dose de lípidos ou de aminoácidos.
Quanto aos componentes das emulsões lipídicas, admite-se que o elevado teor em fitoesteróis e ácidos gordos n-6 e o baixo teor em a-tocoferol predispõem à colestase associada à NP, enquanto o elevado teor em óleo de peixe tem efeito de protecção.
Por outro lado, deve ter-se em conta a potencial toxicidade do cobre e manganês na colestase, pela dificuldade da sua excreção pela bílis.
Como forma de prevenir ou mitigar a colestase associada à NP (bilirrubina conjugada > 2 mg/dl), descreve-se a seguir a:
Actuação prática
- Reduzir a dose de glicose, porventura para níveis que não excedam a sua capacidade oxidativa (8,3 mg/kg/min).
- Aumentar a nutrição entérica e reduzir/suspender a NP logo que possível.
- Preferir emulsões lipídicas que contenham óleo de peixe e a-tocoferol.
- Conforme a gravidade da colestase, suspender ou reduzir a solução de oligoelementos por conterem cobre e manganês.
Hiperbilirrubinémia não conjugada
Em recém-nascidos pré-termo, há controvérsia sobre a possibilidade de os ácidos gordos livres resultantes da hidrólise dos triglicéridos deslocarem a bilirrubina ligada à albumina, elevando a fracção livre de bilirrubina para níveis neurotóxicos. Tal parece não ocorrer se a ratio molar ácidos gordos livres:albuminénia for < 6; ou seja, será menos provável se os níveis de albuminénia estiverem dentro dos limites de referência.
A actuação prática consiste em recém-nascidos pré-termo, reduzir a dose de lípidos se bilirrubinémia não-conjugada for > 10 mg/dL
Hipertensão pulmonar
Em recém-nascidos de termo e pré-termo, a perfusão endovenosa de lípidos pode agravar a hipertensão pulmonar, com efeito dependente da dose e do tempo.
A actuação prática consiste, dependendo da gravidade da hipertensão pulmonar, em suspender temporariamente os lípidos, ou diminuir o respectivo suprimento até 1 g/kg/d.
Grande cirurgia
Nos recém-nascidos submetidos a grande cirurgia, devidamente anestesiados e analgesiados, há necessidade de ligeiro acréscimo do suprimento energético (cerca de 15%) no pós-operatório imediato (cerca de 4 h após a cirurgia). Durante este período, também está comprovado que o turnover proteico não aumenta significativamente.
Como actuação prática refere-se que no pós-operatório, inclusive imediato, não há necessidade de aumentar o suprimento energético-proteico se a analgesia for adequada.
ANEXO: Consulta rápida – Doses diárias em recém-nascidos pré-termo.
| 1º dia pós-natal | Incremento diário | Máximo | |
| * Enquanto não houver estudos suficientes que garantam a compatibilidade e estabilidade mineral usando doses superiores. | |||
| Líquidos (ml/kg/d) | 60 – 100 humidade 80-90% | 10 – 15 | 160 – 180 |
| Energia (kcal/kg/d) | 45 – 55 | – | 90 – 120 |
| Glicose (mg/kg/min) | 4 – 8 | q.b. para glicémia 45-120 mg/dL | 12 |
| Aminoácidos (g/kg/d) | > 1,5 | 0,5 – 1 | 3,5 |
| Lípidos (g/kg/d) | 1 – 2 | 0,5 – 1 | 4 |
| Na (mEq/ kg/d) | 0 – 2 após perda > 6% peso nascimento | – | 3 – 5 (até 7) |
| Cl (mEq/kg/d) | Idêntica ao Na | – | Idêntica ao Na |
| K (mEq/kg/d) | 1 – 3 após diurese > 1 mL/Kg/h | – | 1 – 3 |
| Ca (mg/kg/d) | 32 – 80 | – | 100 – 140 (*ou 88 – 90 mg/kg/d, máximo 68 mg/dL) |
| P (mg/kg/d) | Dividir dose Ca por 1,3 | Dividir dose Ca por 1,3 | Dividir dose Ca por 1,3 |
| Mg (mEq/kg/d) | 0,2 – 0,4 | – | 0,4 – 0,6 |
| Vitaminas hidrossolúveis (ml/kg/d) (Soluvit N Infantil ®) | 1 | – | 1 |
| Vitaminas lipossolúveis (ml/kg/d) (Vitalipid N Infantil®) | 1 – 2 | 1 | 4 |
| Oligoelementos < 2 semanas NP ≥ 2 semanas NP |
|
| Zn 400 – 450 µg/kg/d Peditrace® 1 ml/kg/d + Zn (para perfazer 400-450 µg/kg/d) |
BIBLIOGRAFIA
Bolisetty S, Osborn D, Sinn J, Lui K, and the Australasian Neonatal Parenteral Nutrition Consensus Group. Standardised neonatal parenteral nutrition formulations – an Australasian group consensus 2012. BMC Pediatr 2014; 14: 48
Bonsante F, Iacobelli S, Latorre G, et al. Initial amino acid intake influences phosphorus and calcium homeostasis in preterm infants – It is time to change the composition of the early parenteral nutrition. PLoS One 2013; 8:1-9
Bronsky J, Campoy C, Braegger C; the ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR guidelines on pediatric parenteral nutrition: Vitamins. Clin Nutr 2018; 37: 2366-2378
Darmaun D, Lapillonne A, Simeoni U, et al.; Committee on Nutrition of the French Society of Pediatrics (CNSFP), and French Society of Neonatology (SFN). Parenteral nutrition for preterm infants: Issues and strategy. Arch Pediatr 2018; 25: 286-294
Domellöf M, Szitanyi P, Simchowitz V, et al.; the ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Iron and trace minerals. Clin Nutr 2018; 37: 2354-2359
Duesing LA, Fawley JA, Wagner AJ. Central venous access in the pediatric population with emphasis on complications and prevention strategies. Nutr Clin Pract 2016; 31: 490-501
ElHassan NO, Kaiser JR. Parenteral nutrition in the neonatal intensive care unit. NeoRev 2011; 12; e130-e140
Fu R-H. Selection of lipid emulsions for protection against parenteral nutrition-associated liver disease. Pediatrics & Neonatol 2019; 60: 355-356
Hartman C, Shamir R, Simchowitz V, et al. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Complications. Clin Nutr 2018; 37: 2418-2429
Jochum F, Moltu SJ, Senterre T, et al.; the ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Fluid and electrolytes. Clin Nutr 2018; 37: 2344-2353
Johnson PJ. Review of macronutrients in parenteral nutrition for neonatal intensive care population. Neonatal Netw 2014; 33: 29-34
Johnson PJ. Review of micronutrients in parenteral nutrition for the NICU population. Neonatal Netw 2014; 33: 155-161
Jolin-Dahel K, Ferretti E, Montiveros C, et al. Parenteral nutrition-induced cholestasis in neonates: where does the problem lie? Gastroenterol Res Pract 2013; 2013:163632
Joosten K, Embleton N, Yan W, et al. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Energy. Clin Nutr 2018; 37: 2309-2314
Kim SM, Lee EY, Chen J, et al. Improved care and growth outcomes by using hybrid humidified incubators in very preterm infants. Pediatrics 2010; 125: e137-45
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Kolaček S, Puntis JWL, Hojsak I, et al. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Venous access. Clin Nutr 2018; 37: 2379-2391
Lapillonne A, Fidler Mis N, Goulet O, et al. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Lipids. Clin Nutr 2018; 37: 2324-2336
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
MacKay M, Jackson D, Eggert L, et al. Practice-based validation of calcium and phosphorus solubility limits for pediatric parenteral nutrition solutions. Nutr Clin Pract 2011; 26: 708-713
Maruyama H, Saito J, Nagai M, et al. Maximization of calcium and phosphate in neonatal total parenteral nutrition. Pediatr Int 2018; 60: 634-638
Mesotten D, Joosten K, van Kempen AVS. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR guidelines on pediatric parenteral nutrition: Carbohydrates. Clin Nutr 2018; 37: 2337-2343
Mihatsch W, Fewtrell M, Goulet O, et al. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Calcium, phosphorus and magnesium. Clin Nutr 2018; 37: 2360-2365
Mihatsch W, Shamir R, van Goudoever JB, et al. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Guideline development process for the updated guidelines. Clin Nutr 2018; 37: 2306-2308
Mulla S, Stirling S, Cowey S, et al. Severe hypercalcaemia and hypophosphataemia with an optimised preterm parenteral nutrition formulation in two epochs of differing phosphate supplementation. Arch Dis Child Fetal Neonatal Ed 2017;102: F451-F455
Neves A, Pereira-da-Silva L, Fernandez-llimos F. Prácticas de prescripción de nutrición parenteral neonatal en Portugal. An Pediatr 2014; 80: 98-105
Neves A, Pereira-da-Silva L, Fernandez-Llimos F. Prácticas de preparación de nutrición parenteral neonatal en Portugal; comparación con las recomendaciones españolas. Nutr Hosp 2014; 29: 1372-1379
Patel P, Bhatia J. Total parenteral nutrition for the very low birth weight infant. Semin Fetal Neonatal Med 2017; 22: 2-7
Pedrón Giner C, Cuervas-Mons Vendrell M, Galera Martínez R, et al. Grupo de Estandarización de la SENPE. Guía de práctica clínica SENPE/SEGHNP/SEFH sobre nutrición parenteral pediátrica. Nutr Hosp 2017; 34: 745-758
Pereira-da-Silva L, Castela J, Malheiro L, et al.; em representação da Secção de Neonatologia da SPP. Nutrição parentérica no recém-nascido: 1ª revisão do consenso nacional, 2008. Acta Pediatr Port 2008; 39: 125-134
Pereira-da-Silva L, Costa A, Pereira L, et al. Early high calcium and phosphorus intake by parenteral nutrition prevents short-term bone strength decline in preterm infants. J Pediatr Gastroenterol Nutr 2011; 52: 203-209
Pereira-da-Silva L, Henriques G, Amaral JMV, et al. Osmolality of solutions, emulsions and drugs that may have a high osmolality. Aspects of their use in neonatal care. J Matern Fetal Neonatal Med 2002; 11: 333-338
Pereira-da-Silva L, Macedo I, Rosa ML, et al.. Calcium and phosphorus intake by parenteral nutrition in preterm infants. In: Rajendran R, Preedy VR, Patel VB (eds). Diet and Nutrition in Critical Care. New York: Springer Science+Business Media, 2015; 1817-1829
Pereira-da-Silva L, Nóbrega S, Rosa ML, et al. Parenteral nutrition-associated cholestasis and triglyceridemia in surgical term and near-term neonates: A pilot randomized controlled trial of two mixed intravenous lipid emulsions. Clin Nutr ESPEN 2017; 22: 7-12
Pereira-da-Silva L, Nurmamodo A, Amaral JMV, et al. Compatibility of calcium and phosphate in four parenteral nutrition solutions for preterm neonates. Am J Health Syst Pharm 2003; 60: 1041-1044
Pereira-da-Silva L, Pissarra S, Alexandrino AM, et al. On behalf of the Portuguese Neonatal Society. Guidelines for neonatal parenteral nutrition: 2019 Update by the Portuguese Neonatal Society. Part I. General aspects, energy, and macronutrients. Port J Pediatr 2019; 50: 209-219
Pereira-da-Silva L, Pissarra S, Alexandrino AM, et al.; on behalf of the Portuguese Neonatal Society. Guidelines for neonatal parenteral nutrition: 2019 Update by the Portuguese Neonatal Society. Part II. Micronutrients, ready-to-use solutions, and particular conditions. Port J Pediatr 2019; 50: 220-231
Pereira-da-Silva L, Virella D, Henriques G, et al. A simple equation to estimate the osmolarity of neonatal parenteral nutrition solutions. J Parenter Enteral Nutr 2004; 28: 34-37
Puntis J, Hojsak I, Ksiazyk J, et al. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Organisational aspects. Clin Nutr 2018; 37: 2392-2400
Ramel SE, Brown LD, Georgieff MK. The impact of neonatal illness on nutritional requirements – one size does not fit all. Curr Pediatr Rep 2014; 2: 248-254
Riskin A, Picaud J-C, Shamir R. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Standard versus individualized parenteral nutrition. Clin Nutr 2018; 37: 2409-2417
Salama GS, Kaabneh MA, Almasaeed MN, et al. Intravenous lipids for preterm infants: a review. Clin Med Insights Pediatr 2015; 9: 25-36
Van Aerde JE. In preterm infants, does the supplementation of carnitine to parenteral nutrition improve the following clinical outcomes: Growth, lipid metabolism and apneic spells? Part B: Clinical commentary. Paediatr Child Health 2004; 9: 573
van Goudoever JB, Carnielli V, Darmaun D, et al. The ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Amino acids. Clin Nutr 2018; 37: 2315-2323
Wong JC, McDougal AR, Tofan M, et al. Doubling calcium and phosphate concentrations in neonatal parenteral nutrition solutions using monobasic potassium phosphate. J Am Coll Nutr 2006; 25: 70-77
Working Group of Pediatrics Chinese Society of Parenteral and Enteral Nutrition, Working Group of Neonatology Chinese Society of Pediatrics, Working Group of Neonatal Surgery Chinese Society of Pediatric Surgery. CSPEN guidelines for nutrition support in neonates. Asia Pac J Clin Nutr 2013; 22: 655-663
Yailian AL, Serre C, Fayard J, et al. Production and stability study of a hospital parenteral nutrition solution for neonates. J Pharm Anal 2019; 9: 83-90
Yildizdas HY, Poyraz B, Atli G, et al. Effects of two different lipid emulsions on antioxidant status, lipid peroxidation and parenteral nutrition- related cholestasis in premature babies, a randomized-controlled study. Pediatrics & Neonatol 2019; 60: 359-36
Zanuy MAV, Bravo SP, Cebas AL, et al. Agreement between different equations to estimate osmolarity of parenteral nutrition solutions. Nutr Hosp 2015; 32: 2757-2762