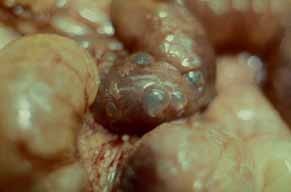
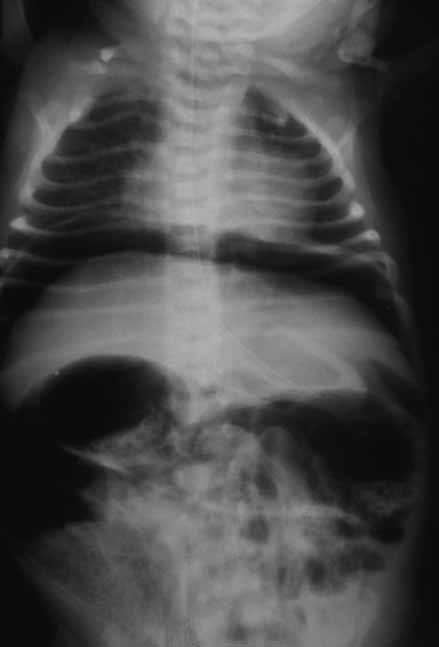
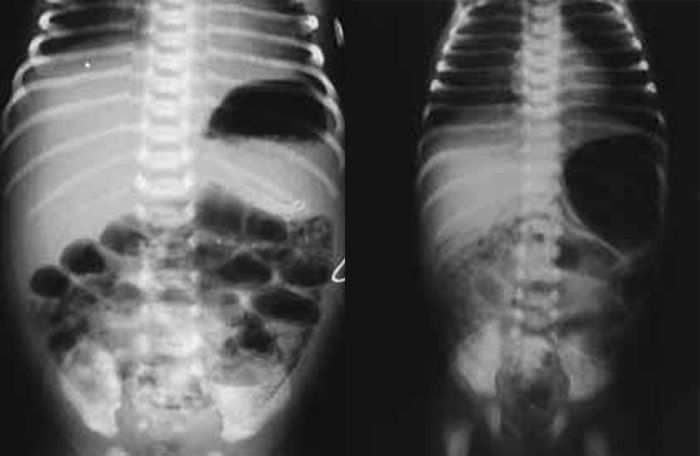
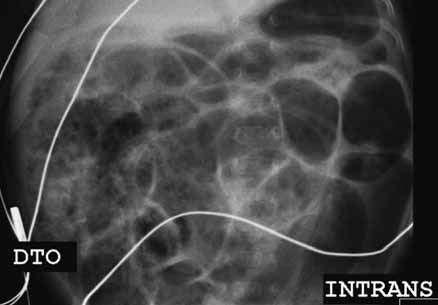
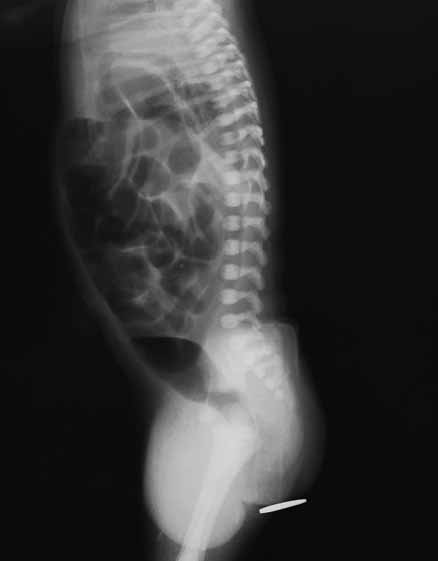
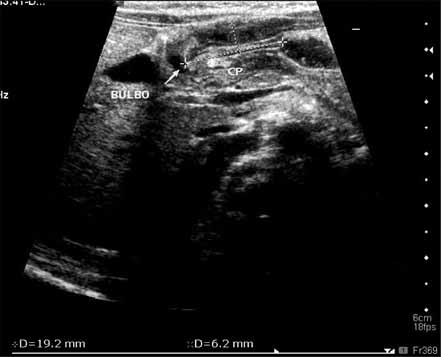
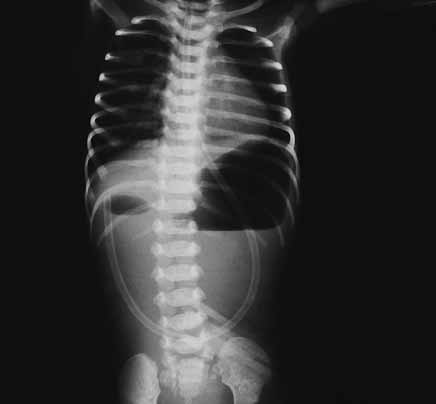
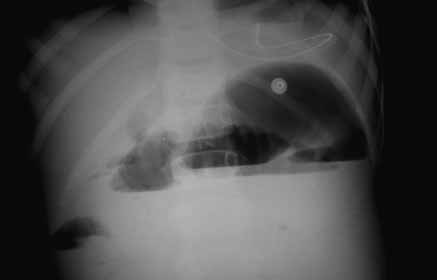
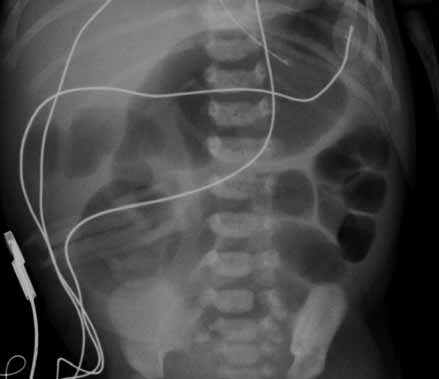
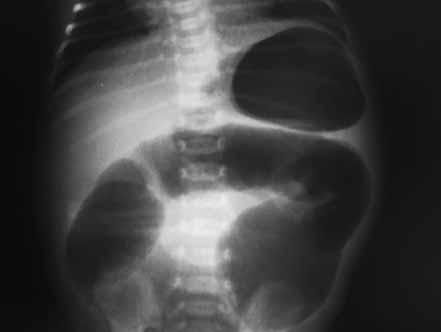
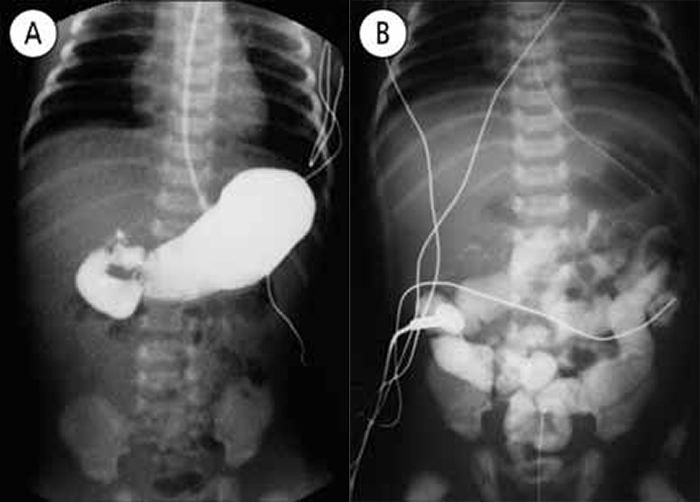
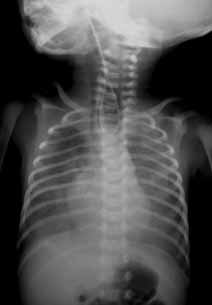
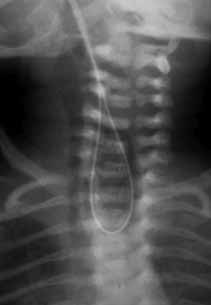
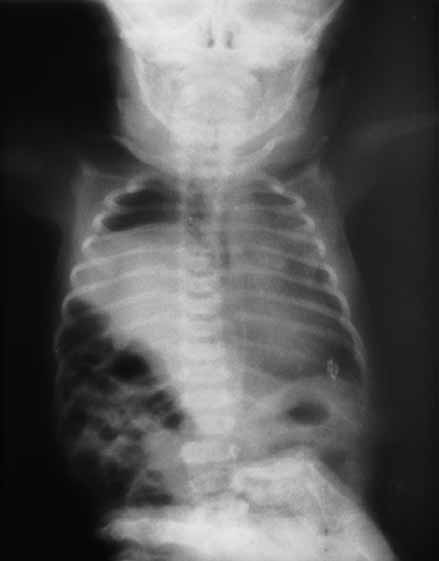
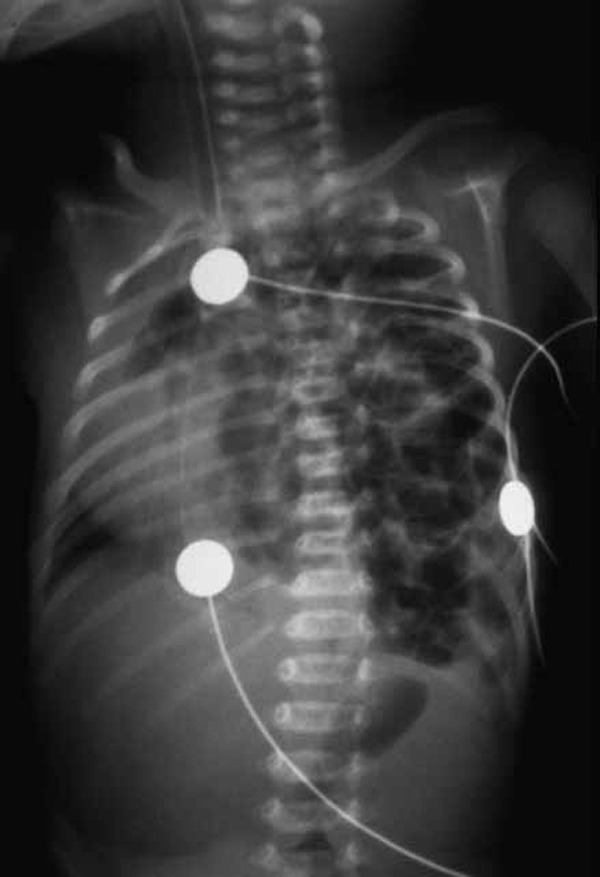
Para avaliação do grau de oxigenação ao nível dos órgãos (designadamente SNC, intestino, e outros), com valor prognóstico, presentemente (2020), alguns centros dispõem de tecnologia aplicando espectroscopia próxima dos infra-vermelhos.
Prevenção
Ao delinear estratégias de prevenção torna-se fundamental entrar em conta com os mecanismos potencialmente envolvidos na etiopatogénese.
Ao longo do tempo têm sido preconizadas diversas estratégias, algumas das quais têm evoluído em função dos resultados da investigação científica, designadamente de meta-análises de uma multiplicidade de estudos.
Seguidamente são descritas diversas medidas, as quais foram estratificadas em função de critérios de segurança e eficácia, com base em estudos da Cochrane Library.
1 – Leite materno
O leite humano contém múltiplos factores tais como imunoglobulinas, interleucina-10, FCE, acetil-hidrolase, entre outros; por outro lado, o factor de activação plaquetária (PAF) que comparticipa a etiopatogénese da ECN evidencia concentrações elevadas em casos de ECN, enquanto os níveis da enzima que promove a sua hidrólise (acetil-hidrolase) estão diminuídos.
Ora, o leite humano contém níveis elevados de FCE e de acetil-hidrolase, factores que são protectores em relação à ECN. Daí a incidência cerca de 6 a 10 vezes menor de ECN em RN pré-termo alimentados com leite materno, em comparação com a verificada nos alimentados com fórmula, o que tem sido provado em estudos de meta-análise.
Trata-se duma medida segura, de eficácia comprovada. Deve ser iniciada nos primeiros 2-5 dias (a pausa alimentar > 5-7 dias, inicialmente recomendada é actualmente desaconselhada), recomendando-se nos primeiros dias alimentação entérica trófica com leite materno, não nutricional, com incrementos diários modestos e prudentes ~15 mL/kg/dia, em função da avaliação clínica caso a caso. (ver Parte sobre Neonatologia)
2 – Corticoterapia pré-natal
Uma vez que o nascimento antes do termo da gravidez constitui o factor de risco mais relevante de ECN, a possibilidade de indução medicamentosa da maturidade intestinal com a utilização de corticosteróide pré-natal tem sido estudada. A este propósito cabe referir que os resultados de estudos aleatórios multicêntricos não têm sido concordantes: nalguns demonstrou-se diminuição de incidência de ECN, enquanto noutros, precisamente o contrário.
Apesar destes achados aparentemente contraditórios, a utilização de corticóides pré-natais (betametasona) está hoje consagrada como uma importante medida para a redução da mortalidade e morbilidade relacionáveis com a imaturidade pulmonar e com a prematuridade em geral.
Esta medida é considerada de eficácia comprovada, embora de segurança questionável.
3 – Encerramento precoce do ductus arteriosus
A presença de canal arterial patente promove um desvio do volume sanguíneo para as artérias pulmonares na fase diastólica, o que tem como consequência a diminuição da perfusão do territórios esplâncnico, aumentando a probabilidade de ECN. Este dado fisiopatológico tem confirmação na prática clínica na sequência de estudos controlados e aleatórios em recém-nascidos pré-termo de peso inferior a 1.000 gramas submetidos a laqueação cirúrgica precoce do canal arterial.
A partir do início dos anos 80, a indometacina (inibidor das prostaglandinas) passou a ser usada profilacticamente, com eficácia demonstrada, para o encerramento do canal arterial e prevenção da hemorragia intracraniana. No entanto, estudos ulteriores identificaram efeitos colaterias, tais como diminuição do fluxo sanguíneo esplâncnico, aumento da incidência de ECN e perfuração intestinal, comprometendo a recomendação universal para o seu uso.
Noutros estudos demonstrou-se diminuição do fluxo sanguíneo esplâncnico menos marcada empregando outro fármaco, também inibidor das prostaglandinas – o ibuprofeno. Recentemente, dados da Cochrane Library provaram que o uso de indometacina não está associado a aumento de risco de ECN.
Esta medida é considerada de eficácia comprovada, embora de segurança questionável.
4 – Antibioticoterapia por via enteral
A análise de estudos da Cochrane Library empregando antibióticos por via enteral (aminoglicosídeos) sugere, de facto, que tal procedimento contribui para reduzir tanto a incidência, como a mortalidade por ECN. No entanto, face ao risco acrescido de selecção de estirpes com tal estratégia, tal procedimento não deve ser posto em prática.
Esta medida é considerada de eficácia comprovada, embora de segurança questionável.
5 – Probióticos
Na sequência do que foi referido no capítulo respeitante a esta área, importa acentuar que, em modelos experimentais e em estudos meta-analíticos na espécie humana, se comprovou a eficácia na prevenção no RN pré-termo, com redução da incidência e da mortalidade, recomendando-se o uso de duas ou mais espécies, incluindo designadamente Lactobacillus acidophilus e Bifidusbacterium spp. Contudo, os investigadores alertaram para o risco de sépsis em RN pré-termo com peso < 750 gramas.
Tendo em consideração que os estudos analisados adoptaram metodologias diversas, considera-se que esta medida é considerada de eficaz, embora de segurança questionável.
6 – Suplemento de arginina
Com base no achado anátomo-patológico de necrose de coagulação, resultante de eventos isquémicos locais ou sistémicos, o papel do óxido nítrico tem adquirido importância especial. Com efeito, o óxido nítrico é produzido durante a conversão enzimática da L-arginina em L-citrulina sob a acção da sintetase de NO. Embora os investigadores considerem o suplemento exógeno de arginina uma arma promissora na prevenção da ECN, esta medida é considerada de eficácia comprovada, embora de segurança questionável.
7 – Novos fármacos (anticitocinas e factores de crescimento)
Com estes fármacos, em fase de investigação, foi demonstrada eficácia em modelos animais, mas não na espécie humana.
8 – Pré-bióticos (derivados do leite humano e de plantas), glutamina, ácidos gordos ómega-3, receptores agonistas funcionando como barreira a compostos microbianos
Com estes compostos, também em fase de investigação, não foi demonstrada eficácia, razão pela qual são desaconselhados.
9 – Imunoglobulinas e bloqueadores H2 por via oral
Sabendo-se que no recém-nascido pré-termo são baixos os níveis séricos de imunoglobulinas, nomeadamente IgA secretória, diversos estudos aleatórios avaliaram o papel da utilização profiláctica de preparados de imunoglobulinas e de bloqueadores H2 por via oral na prevenção da ECN.
Embora alguns autores tivessem comprovado redução significativa da doença nos grupos tratados com os referidos compostos, de acordo com a meta-análise da Cochrane Library concluiu-se que são desaconselhados.
Tratamento
1 – Medidas gerais
Perante a suspeita de ECN há que pôr em execução um conjunto de medidas gerais prioritárias de carácter conservador, no pressuposto de que a avaliação, em centro especializado e em unidade de cuidados intensivos, deverá ser feita por equipa multidisciplinar: interrupção imediata de alimentação por via entérica, descompressão gástrica com introdução de sonda naso ou orogástrica, manutenção, após correcção, dos equilíbrios hidroelectrolítico, ácido-base, hemodinâmico, início de nutrição parentérica, início de antibioticoterapia de largo espectro para cobertura de germes gram-positivos, gram-negativos e anaeróbios (esquema empírico a modificar em função do contexto clínico-microbiológico: ampicilina + aminoglicosídeo ou cefalosporina de terceira geração + clindamicina ou metronidazol). No âmbito da avaliação de parâmetros hematológicos, haverá que manter hematócrito em torno de 40-45% e número de plaquetas acima de 40.000/mmc.
Nos casos com boa resposta às medidas gerais acima discriminadas, isto é, com diminuição da distensão abdominal, desaparecimento das imagens radiológicas de pneumatose, desaparecimento do resíduo gástrico e da perda de sangue nas fezes, mantém-se pausa alimentar total até ao 12º ou 14º dia de evolução, e reintroduzindo-se de modo muito cauteloso e progressivo, por fases, o suprimento entérico utilizando leite materno ou fórmula de aminoácidos hiposmolar.
Estas medidas, dum modo geral, aplicam-se aos estádios, de I A a II B (classificação de estádios evolutivos de Bell atrás descrita).
2 – Medidas específicas
Pelo contrário, nos casos em que se verifica progressão rápida do quadro clínico de ECN e agravamento global (correspondendo, em geral aos estádios III A e III B), para além de medidas gerais (mais agressivas, incluindo a administração de inotrópicos e a assistência ventilatória), devem ser ponderados dois procedimentos invasivos: paracentese abdominal para drenagem peritoneal simples e/ou laparotomia.
De referir que a decisão da necessidade e do momento adequado da laparotomia deve ser individualizada com base na análise evolutiva dos achados clínicos e imagiológicos. Uma vez que os doentes em causa evidenciam, na maior parte das vezes, estado crítico, a decisão deve ser tomada de preferência, por equipa multidisciplinar: cirurgião, anestesista e pediatra-neonatologista.
Reportando-nos aos estádios de Bell, a detecção de sinais de ascite (estádio II A), implicará, em princípio, drenagem peritoneal, enquanto a detecção de sinais de pneumoperitoneu – indicativo de perfuração de ansa – (estádio III B) implicará laparotomia exploradora com eventual ressecção do segmento afectado, seguida de anastomose primária ou enterostomias.
Nalguns centros cirúrgicos é realizada já laparotomia em presença do estádio III A (ascite sem evidência de pneumoperitoneu) sendo que a tendência actual, no estádio III A, segundo dados da literatura, seja reservar a drenagem peritoneal simples para os casos de idades gestacionais muito baixas e menor peso.
Para além do pneumoperitoneu, outros sinais mais frequentemente associados a perfuração, estabelecendo a indicação de laparotomia são: massa abdominal (indicativa de perfuração coberta ou de abcesso intraperitoneal), alterações inflamatórias da parede abdominal (indicativas de peritonite e de necrose intestinal subjacente), ansa intestinal em posição fixa nas radiografias simples seriadas e presença de ar no sistema porta.
As alterações laboratoriais indicativas de processo clínico em progressão que poderão estabelecer indicação de laparotomia são: alterações da coagulação, trombocitopénia, hiponatrémia e acidose metabólica persistente.
Igualmente, a detecção de germes na coloração pelo Gram no material obtido por paracentese abdominal previamente realizada, poderá constituir indicação para laparotomia.
Uma vez concretizada a ressecção intestinal, deve restabelecer-se, logo que possível, o trânsito intestinal, nomeadamente se em presença de estabilidade hemodinâmica, e na ausência de peritonite ou de ressecção jejunal muito proximal. Nalguns casos há que proceder a duas ou mais enterostomias descompressivas, utilizando os segmentos intestinais viáveis e funcionantes para o restabelecimento ulterior do trânsito intestinal.
No período pós-operatório, o doente deve ser submetido a programa de nutrição parentérica total, pelo que se torna necessário colocar uma via central de longa duração (cateter do tipo Hickman-Broviac).
Prognóstico
As complicações letais da ECN prendem-se com a progressão do processo patológico desencadeante, que pode culminar com o desenvolvimento da chamada síndroma de reacção inflamatória sistémica (SRIS) num contexto de sépsis e acidose metabólica irreversível.
Em cerca de 20 a 25% dos casos poderão desenvolver-se quadros de estenose (fibrose estenosante pós-inflamatória), mais frequente no território ileal distal e cólico; em tais circunstâncias há indicação para ressecção.
A síndroma de intestino curto constitui outra complicação não imediata surgindo como consequência de ressecções intestinais muito alargadas por necrose intestinal extensa.
A sépsis de cateter central, nomeadamente a sépsis por fungos, tem sido apontada como uma complicação relevante pela mortalidade significativa que comporta.
Em suma, os progressos da terapia intensiva e das técnicas operatórias permitem actualmente obter nos casos de ECN uma sobrevivência global > 85%.
Agradecimentos
Os autores e editor agradecem aos Drs. Micaela Serelha, Daniel Virella e Sérgio Pinto a cedência de dados estatísticos e imagiológicos referentes à UCIN-HDE.