Definição e importância do problema
A atrésia do esófago (AE) é uma anomalia congénita que consiste na interrupção da continuidade do esófago; na maioria dos casos (cerca de 85%-90% conforme as estatísticas) existe trajecto permeável entre a traqueia e o coto esofágico distal, estabelecendo-se, por isso, uma comunicação entre o aparelho digestivo e o aparelho respiratório.
A incidência da AE oscila entre 1/3.000 e 1/8.000 nascimentos com uma relação de 1,5/1 entre sexo masculino e sexo feminino. Trata-se da anomalia congénita do esófago mais frequente.
Etiopatogénese
Durante a embriogénese (por volta da 5ª semana de gestação), a partir do chamado tubo intestinal faríngeo (intestino primitivo), forma-se um divertículo ventral em “dedo de luva”, o qual origina a traqueia. Ulteriormente forma-se um septo que divide o tubo intestinal primitivo numa porção ventral – o tubo laringotraqueal – e, numa porção dorsal – o esófago.
A atrésia do esófago é precisamente a consequência de um desvio posterior do septo tráqueo-esofágico, sendo que o referido desvio provoca uma separação incompleta entre o esófago e o tubo laringotraqueal, surgindo, na maioria das vezes, uma comunicação (fístula) entre o esófago e a traqueia. A ocorrência de AE sem fístula é rara, sendo atribuída esta situação a não recanalização do esófago por volta da 8ª semana de gestação.
Classificação e aspectos epidemiológicos
Entre 1984 e 1993 (9 anos) foram hospitalizados na UCIN do Hospital Dona Estefânia-Lisboa, 2645 RN; esta amostra inclui 59 crianças com o diagnóstico de atrésia do esófago (AE) – (2,2% dos doentes).
A classificação dos diversos tipos de AE decorre da verificação ou não de fístula e da respectiva localização.
Na referida amostra foram obtidos os seguintes dados: o tipo mais frequente (76,1% dos casos) é o que evidencia um coto proximal em fundo cego associado a fístula tráqueo-esofágica (FTE) distal; em geral a fístula comunica com a traqueia junto à carina; o segundo tipo mais frequente (13,1%) corresponde à forma de AE sem fístula; a seguir, surgem a fístula tráqueo-esofágica sem atrésia ou fístula em H (4,3%), a AE com fístula tráqueo-esofágica proximal (4,3%) e AE com dupla fístula (2%). (Figura 1)
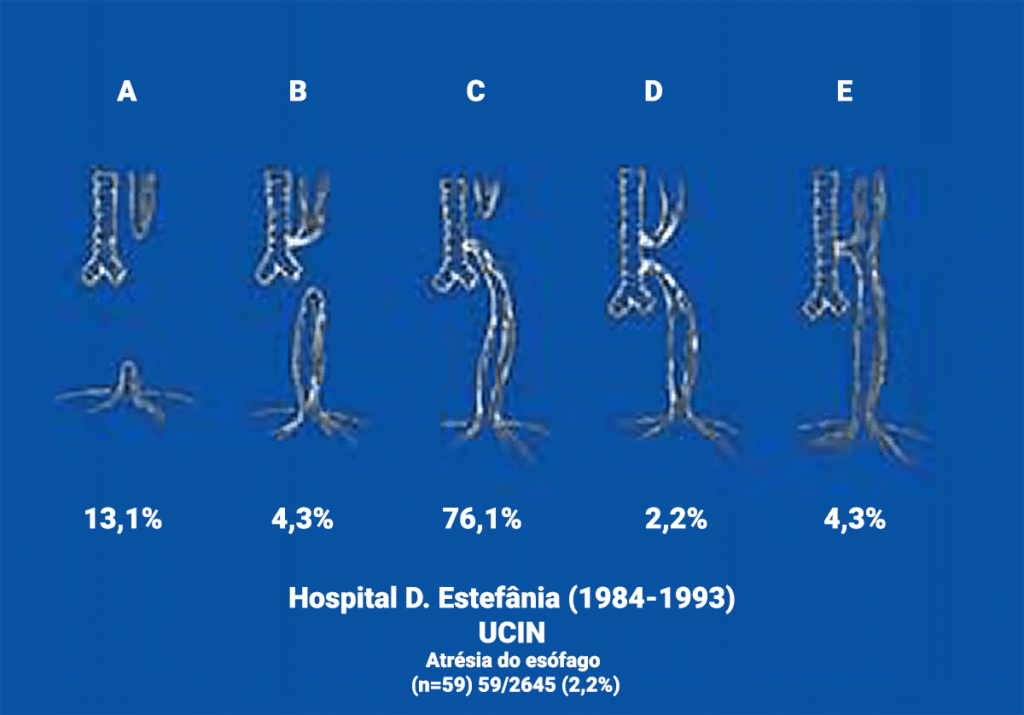
FIGURA 1. Representação esquemática e prevalência da atrésia do esófago e defeitos tráqueo-esofágicos.
Anomalias associadas
Em cerca de 50% dos casos de AE existem outras anomalias associadas, em geral da linha média. Os defeitos cardíacos são os mais frequentemente encontrados; outros incluem: defeitos músculo-esqueléticos, do tracto urinário, digestivo, etc..
Cabe salientar, a propósito, a entidade clínica conhecida por associação VATER/VACTERL (sigla da língua inglesa que traduz a ocorrência associada das seguintes anomalias: V (vertebral), A (ano-rectal), C (cardíaca), TE (tráqueo-esofágica), R (renal), L (limb ou membro). Refira-se que a forma de AE sem fístula é a que mais frequentemente surge com anomalias associadas; situação contrária se verifica em relação à forma com fístula em H isolada.
Apesar da baixa incidência de casos familiares, está provado que os factores genéticos (mutações em genes, <> →) poderão desempenhar papel significante em determinadas síndromas integrando AE; é o que acontece com a síndroma de Feingold (→ N-MYC), a associação CHARGE (→ CHD7), e a síndroma anoftalmia-esófago-genital (→ SOX2).
Manifestações clínicas e diagnóstico
O diagnóstico provável de AE pode ser eventualmente realizado, já no período pré-natal, por meio de ecografia morfológica obstétrica evidenciando sinais de poli-hidrâmnio, de ausência de “bolha” gástrica e de distensão do topo esofágico superior (bolsão esofágico cervical).
No período pós-natal, a suspeita de AE é fundamentada pela verificação de um conjunto de sinais, mais valorizáveis se existirem os antecedentes pré-natais aludidos: sialorreia abundante com secreções “com bolhas de ar”, impossibilidade de deglutição, com ou sem dificuldade respiratória (cianose, retracção costal, cianose, etc.); de salientar que os sinais poderão regredir parcialmente após aspiração de secreções, recorrendo depois, por acumulação de saliva não deglutida, a qual provoca obstrução das vias respiratórias superiores.
Se existir fístula pode verificar-se aumento de volume abdominal nos quadrantes superiores explicável pela dilatação gástrica por acumulação de ar proveniente da via respiratória; nas situações não acompanhadas de fístula, pelo contrário, pode observar-se certo grau de depressão epigástrica.
Nos casos em que o diagnóstico não é realizado no período pós-parto imediato (hoje em dia, situação rara uma vez que a pesquisa de permeabilidade esofágica faz parte dos procedimentos sistemáticos do primeiro exame físico do recém-nascido em muitas maternidades), o quadro clínico de apresentação pode ser o de infecção respiratória relacionável com aspiração para a via aérea de saliva colectada no coto proximal e com refluxo gastresofágico provocado pelo volume gástrico, favorecido pela fístula tráqueo-esofágica.
Nos casos de fístula em H isolada (fístula tráqueo-esofágica sem atrésia do esófago), o diagnóstico poderá ser feito mais tardiamente, sobretudo quando aquela é longa e tem posição oblíqua.
O procedimento a realizar em casos de suspeita de atrésia do esófago (ou como atitude sistemática no âmbito do primeiro exame físico do recém-nascido) consiste em introduzir sonda oro ou nasogástrica nº 8 ou 10. Se a sonda chegar ao estômago em situação de esófago permeável, o líquido aspirado (gástrico, com pH ácido), em contacto com papel azul de tornesol, promove a viragem de cor deste para azul.
Nos casos em que se verifica resistência na progressão da sonda, existindo atrésia, a mesma dobra-se ou enrola-se em U, formando uma ansa que poderá ser evidenciada em radiografia tóraco-abdominal simples se for radiopaca (Figuras 2 e 3). Na radiografia, caso não exista FTE, não se verifica sinal de ar abdominal (em negativo, aspecto de abdómen “branco”).
Persistindo a suspeita diagnóstica deve proceder-se a radiografia simples do tórax e abdómen em posição póstero-anterior e em perfil com o doente em posição vertical, tanto quanto possível; a verificação de sinais de ar infradiafragmático leva à conclusão de que existe fístula tráqueo-esofágica, podendo ser igualmente conclusiva quanto à eventualidade de existirem anomalias do tracto digestivo associadas (tais como atrésia duodenal com o sinal da “dupla bolha”), cardíacas (por exemplo arco aórtico à direita), vertebrais, das costelas, sinais de pneumonia, etc.).
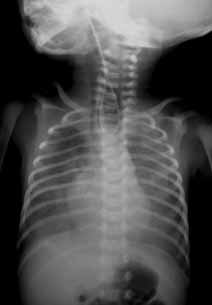
FIGURA 2. Imagem radiográfica tóraco-abdominal com visualização de sinais de ar infradiafragmático testemunhando comunicação tracto respiratório-digestivo.
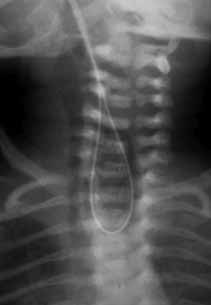
FIGURA 3. Imagem radiográfica de sonda em U.
Nesta mesma radiografia tóraco-abdominal simples poderá comprovar-se a posição da sonda radiopaca enrolada em U atrás referida, (em geral entre as vértebras C7 e D3), o que tem implicações práticas para o cirurgião.
Até há cerca de 3 décadas, procedia-se à introdução, pela sonda, de meio de contraste radiopaco (hoje abandonado pelo risco de aspiração para a via respiratória); este procedimento permitia visualizar com precisão o fundo de saco cego do coto proximal do esófago.
Tratamento
Medidas gerais
A AE, é uma situação que deverá ser assistida em centro especializado do nível mais elevado de diferenciação, com possibilidade de terapia intensiva.
Tratando-se duma anomalia incompatível com a vida se não for corrigida, tem sempre indicação operatória. Porém, o procedimento operatório não constitui uma emergência cirúrgica; com efeito, para além de ser indispensável que o doente chegue ao bloco operatório em situação de estabilização hemodinâmica, a probabilidade de anomalias associadas implica a realização prévia de um conjunto de estudos diagnósticos complementares (por exemplo estudo ecográfico cardíaco, nefro-urológico) para detecção da patologia de que se suspeita; entretanto, poderá ser submetido a ventilação mecânica e nutrição parentérica.
Exemplificando, se concomitantemente ocorrerem outros problemas clínicos que exijam solução prioritária como problemas respiratórios graves, anomalias cardíacas ou do tracto urinário, a intervenção cirúrgica esófagica será diferida de modo electivo e controlado.
As medidas gerais dizem respeito, essencialmente, à aspiração de secreções, fluidoterapia endovenosa para garantia de equilíbrio hídro-electrolítico e ácido-base, nutrição parentérica, manutenção de oxigenação adequada e eventual assistência ventilatória. A antibioticoterapia empírica inicial constitui outro aspecto das medidas gerais cujo esquema depende do contexto clínico individualizado.
Nalguns casos poderá estar indicada gastrostomia prévia para evitar refluxo e garantia de melhores condições operatórias.
Tratamento cirúrgico
A correcção cirúrgica da AE consiste fundamentalmente numa abordagem por toracotomia lateral pelo 4º ou 5º espaço intercostal direito (esquerdo se existir arco aórtico à direita), acesso ao mediastino posterior por via extrapleural, laqueação da crossa da veia de ázigos, laqueação selectiva da fístula tráqueo-esofágica e esófago-esofagostomia término-terminal.
Actualmente, nalguns centros (designadamente no Hospital de Braga/ por um de nós – JCP) está a ser utilizada a técnica por via toracoscópica, com bons resultados a curto e longo prazo.
Complicações pós-operatórias
As complicações associadas a esta técnica cirúrgica prendem-se com a segurança da laqueação da fístula tráqueo-esofágica e a possibilidade de realização de esófago-esofagostomia término-terminal sem tensão.
A deiscência parcial da anastomose esofágica e a estenose no local da anastomose são complicações que podem ocorrer entre 5% e 15% dos casos, sendo que, na maior parte destes, a respectiva resolução é possível com terapêutica conservadora.
Nos casos em que existe deiscência total da anastomose esofágica ou refistulização tráqueo-esofágica, é necessário realizar uma revisão cirúrgica da complicação, com correcção da refistulização tráqueo-esofágica e reanastomose esofágica directa ou, optar por construir uma derivação esofágica cervical com gastrostomia descompressiva temporária. Posteriormente, será necessário reconstruir o segmento esofágico por meio de reanastomose directa ou por cirurgia substitutiva esofágica com estômago ou segmento intestinal ileal ou cólico.
Seguimento
O seguimento pós-operatório destes doentes é de extrema importância devido à prevalência de traqueomalácia e de refluxo gastresofágico (RGE) acompanhantes.
A traqueomalácia deve-se à própria natureza embrionária da lesão como já foi referido anteriormente. O RGE é originado pelo invariável encurtamento esofágico obtido após a anastomose, e também pelos mecanismos anti-refluxo deficitários tais como o alargamento do ângulo de His, incompetência do cárdia e peristaltismo pós-anastomótico ineficaz.
O seguimento relacionado com o impacte no sistema respiratório deverá incluir uma vigilância rigorosa de episódios de estridor laríngeo e traqueal (devido, sobretudo à traqueomalácia) e de dificuldade respiratória (devido essencialmente a RGE grave com risco de aspiração com desencadeamento de quadros de pneumonite de repetição e de hipoxémia). Uma das complicações é a doença do refluxo gastresofágico.
Quanto ao sistema digestivo, está indicada a endoscopia digestiva alta, a realizar depois da terceira semana pós-operatória, para detecção de esofagite e de estenose anastomótica com eventual necessidade de dilatação. Para além do RGE, é habitual o atraso do esvaziamento gástrico.
Importa igualmente especial atenção para a possibilidade de deformidades da grelha costal e da coluna tóraco-lombar associadas aos antecedentes de toracotomia para correcção cirúrgica.
Prognóstico
O prognóstico da AE pode ser classicamente definido em três patamares ou classes, segundo os Critérios de Spitz. De acordo com este autor, as classes prognósticas valorizam o peso de nascimento e a presença de anomalia cardíaca como os factores preponderantes para o prognóstico final dos RN portadores de AE.
Assim, os RN com peso < 1.500 gramas e anomalia cardíaca têm o pior prognóstico, com 22% de sobrevivência. Pelo contrário, os RN com peso de nascimento > 1.500 gramas e sem anomalia cardíaca têm o melhor prognóstico, com cerca de 97% de sobrevivência. Actualmente, na unidade de cuidados intensivos neonatais do Hospital Dona Estefânia a sobrevivência global é > 90%, dado comparável ao divulgado por outros centros europeus e americanos.
BIBLIOGRAFIA
Adzick NS, Nance ML. Pediatric surgery. NEJM 2000;342:1651-1657
Chahine A, Ricketts R. Esophageal atresia in infants with very low birth weight. Semin Pediatr Surg 2000;9:73-77
Chittmittrapap S, Spitz L, Kiely E. Esophageal atresia, and associated anomalies. Arch Dis Child 1989;64:364-368
Cloherty JP, Eichenwald EC, Strak AR. Manual of Neonatal Care. Philadelphia; Lippincott Williams & Wilkins, 2008
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamaericana, 2015
Oldham KT, Colombani PM, Foglia RP (eds). Principles and Practice of Pediatric Surgery. Philadelphia: Lippincott Williams & Wilkins, 2005
O’Neill Jr JA, Rowe MI, Grosfeld JL, et al (eds). Pediatric Surgery. Philadelphia: Elsevier, 2017
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Polin RA, Lorenz JM. Neonatology. New York: Cambridge University Press, 2008
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier, 2015
Sharma AK, Shekhawat NS, Agraval LD, et al. Esophageal atresia and tracheoesophageal fistula: a review of 25 years´experience. Pediatr Surg Int 2000;16:478-482
Shaw-Smith C. Oesophageal atresia, tracheo-oesophageal fistula and the VACTERL association: review of genetics and epidemiology. J Med Genet 2006;43:545-554
Spitz L, Kiely E, Brereton R, Drake D. Esophasgeal atresia: At-risk groups for the 1990´s. Pediatr Surg 1994;29:723-727
Spitz L. Esophageal atresia: past, present, and future. J Pediatr Surg 1996;31:19-24
Tanny SPT, Fearon E, Hawley A, et al. Predictors of mortality after primary discharge from hospital in patients with esophageal atresia. J Pediatr 2020;219:70-74.
Tanny SPT, Fearon E, Hawley A, et al. Predictors of mortality after primary discharge from hospital in patients with esophageal atresia. J Pediatr 2020;219:140-144.