Introdução
A displasia broncopulmonar (DBP), também conhecida por doença pulmonar crónica (DPC) da prematuridade, é uma síndroma que se desenvolve na maioria dos recém-nascidos (~60%) com prematuridade extrema (22-27 semanas) em que se verifica necessidade prolongada de suporte respiratório e oxigenoterapia suplementar; de referir que tal proporção aumenta: 100% entre 22 e 24 semanas.
Trata-se, pois, da doença pulmonar crónica mais frequente na primeira infância, multifactorial, resultando da interacção complexa entre o pulmão imaturo em desenvolvimento e a acção de múltiplos factores perinatais e pós-natais.
A epidemiologia e a fisiopatologia da displasia broncopulmonar (DBP) evoluíram muito desde a sua primeira descrição por Northway em 1967, numa época em que não eram ainda utilizados corticóides pré-natais nem surfactante exógeno, assim como assistência respiratória menos invasiva, aplicando pressão positiva contínua (CPAP–continuous positive airway pressure).
Assim, em tal época (na era pré-surfactante), a DBP foi definida tendo como base os seguintes critérios:
- Dependência de oxigénio em RN e lactentes com antecedentes de prematuridade e de doença da membrana hialina grave;
- Ventilação prévia por longos períodos com concentrações elevadas de oxigénio;
- Presença de alterações radiológicas/ pulmonares do tórax (padrão reticular grosseiro, opacidades alternando com áreas de arejamento irregular, etc.), e
- Presença de alterações histopatológicas (de cujo padrão de “displasia” resultou o nome dado à doença).
Tal patologia é actualmente pouco frequente em crianças nascidas com peso >1.500 gramas e idade gestacional >32 semanas.
Na era pré-surfactante, as alterações histológicas mais frequentemente encontradas na via aérea eram hipertrofia da musculatura lisa, metaplasia epitelial e, no parênquima, zonas de enfisema alternando com zonas de fibrose. A este padrão fenotípico de doença é dado muitas vezes o nome de “velha ou clássica” DBP.
Na actualidade, a que corresponde a era moderna de cuidados neonatais, o padrão histológico mais frequentemente encontrado é o de doença homogénea marcada por reduzido número de alvéolos e capilares, mínimas áreas de hiperinsuflação e colapso focal, menos áreas de enfisema e fibrose, ao qual corresponde a chamada “nova” DBP, característica de RN com estádio de desenvolvimento pulmonar mais imaturo, com <1.000 gramas e <28 semanas de gestação.
Critérios de diagnóstico de DBP actuais
Antecedentes históricos Bancalari em 1979 propôs a definição de DBP considerando como critérios: dificuldade respiratória com necessidade de oxigenoterapia aos 28 dias de vida, associada a alterações radiológicas compatíveis. Verificou-se, entretanto, que um contingente significativo de RN, sobretudo com peso <1.000 granas e imaturidade extrema, estava dependente de oxigénio aos 28 dias de vida não se verificando antecedentes de patologia pulmonar significativa. Em 1988 Shennan modificou os critérios propostos por Bancalari introduzindo o termo de DPC do pré-termo assim definida: dificuldade respiratória e dependência de oxigénio às 36 semanas de idade gestacional, associadas a alterações radiológicas compatíveis com a doença. Concluindo-se que tanto a definição de Bancalari como a de Shennan não permitiam determinar a gravidade da doença pulmonar, chegou-se à definição actual, sintetizada a seguir. |
Actualmente, de acordo com os peritos dos National Institutes of Health and Human Development (NICHD) e da Neonatal Research Network (NRN) dos EUA, foram estabelecidos os seguintes critérios sobre terminologia a aplicar nos casos de doença pulmonar crónica com início no período neonatal, considerando dois grupos de RN com as seguintes idades gestacionais: respectivamente, <32 semanas e ≥32 semanas:
I- RN com <32 semanas de idade gestacional: avaliação às 36 semanas de idade pós-menstrual (IPM) ou na data da alta (considerando a que ocorrer primeiro) nos casos de RN necessitando de FIO2 >21% durante, pelo menos, 28 dias:
- DBP ligeira <> Respirando ar às 36 semanas de idade pós-menstrual ou na data da alta (considerando a que ocorrer primeiro);
- DBP moderada <> Necessidade de FiO2 <30% às 36 semanas de IPM, ou na data da alta;
- DBP grave <> Necessidade de FIO2 >30%, com ou sem ventilação IPPV ou CPAP às 36 semanas de IPM, ou na data da alta.
II- RN com ≥32 semanas de idade gestacional: avaliação com idade >28 dias, e <56 dias de idade pós-natal ou na data da alta, idem, necessitando de Fi O2 >21% durante pelo menos 28 dias:
- DBP ligeira <> Respirando ar pelos 56 dias de idade pós-natal ou na data da alta;
- DBP moderada <> Necessidade de FiO2 <30% até aos 56 dias de idade pós-natal ou na data da alta;
- DBP grave <> Necessidade de FiO2 >30% com ou sem ventilação IPPV ou CPAP aos 56 dias de idade pós-natal, ou na data da alta.
O grupo II inclui recém-nascidos pré-termo e de termo com antecedentes de patologia cardiopulmonar diversa como síndroma de aspiração meconial, pneumonia, e cardiopatias congénitas requerendo suporte ventilatório prolongado.
Depreende-se que, de acordo com a definição adoptada na actualidade, são considerados como critérios sine qua non a oxigenoterapia e a idade gestacional, sem considerar eventuais alterações radiológicas pulmonares. |
Aspectos epidemiológicos
De acordo com estudos epidemiológicos, nos EUA calcula-se uma incidência anual de 10.000 a 15.000 (novos casos) de DBP.
Como regra geral pode afirmar-se que a incidência de DBP é tanto mais elevada quanto menores a idade gestacional e o peso de nascimento, sendo que é pouco frequente em RN com idade gestacional >34 semanas.
Com a prática de indução da maturação pulmonar com corticóides pré-natais, as estratégias de ventilação mecânica, cada vez menos agressivas, e o desenvolvimento da terapêutica substitutiva com surfactante exógeno, a incidência da forma clássica de DBP tem diminuído consideravelmente, em paralelo com a modificação de critérios de definição ao longo do tempo, o que tem gerado, por vezes, alguma confusão na literatura científica.
Estudos epidemiológicos do grupo de Bancalari em RN imaturos (<1.000 gramas) evidenciaram, na era pré-surfactante, a proporção de cerca de 46%; e na era pós-surfactante, cerca de 39%.
Num estudo do grupo de Hack (década de 90 passada – englobando sete UCIN) foram obtidos os seguintes resultados quanto a dependência de oxigénio aos 28 dias de vida; grupo ponderal 1.001-1.500 gramas: 13%; no de 751-1.000 gramas: 42%; e no de 501-750 gramas: 9%.
Noutro estudo de Darlow & Horwood (1992), considerando a dependência de oxigénio pelas 36 semanas de idade pós-concepcional, obteve-se a frequência de 23% em RN com idade gestacional <32 semanas e peso oscilando entre 500-1.499 gramas.
Em Portugal, de acordo com os dados publicados pelo Grupo do Registo Nacional do Recém-nascido de Muito Baixo Peso (RNMBP)/ Estudo Multicêntrico 1996-2000 (5 anos), no contingente de RNMBP com <34 semanas de gestação e peso igual ou >500 gramas, sobreviventes às 36 semanas de idade pós-concepcional e dependentes de O2 nesta referida idade, a proporção média de DPC no quinquénio foi 20,8% (643/3094) especificando-se os limites: 12,5-26,3%.
Etiopatogénese
Na era pré-surfactante, a DBP (clássica ou “velha”) era considerada doença pulmonar crónica, fibroproliferativa, relacionada predominantemente com lesões provocadas por ventilação mecânica e oxigenoterapia prolongadas. Identificava-se o papel importante do colapso alveolar (atelectrauma) como consequência do défice de surfactante, juntamente com a hiperdistensão pulmonar pela ventilação artificial (volutrauma) como indutores de inflamação e lesão pulmonares. Acrescentavam-se as lesões por toxicidade do oxigénio suplementar produzindo radicais livres não susceptíveis de metabolização pela imaturidade antioxidante do pulmão. Como foi referido antes, a lesão pulmonar produzida evidenciava sobretudo hipertrofia do músculo liso e áreas de fibrose alternando com áreas enfisematosas.
Na era actual, em que o limite de viabilidade diminuiu consideravelmente (DBP nova), considera-se que a etiopatogénese da DBP é predominantemente multifactorial como foi referido antes, salientando-se que a lesão pulmonar é acompanhada de inflamação.
Entre os múltiplos factores perinatais e neonatais, considerados factores de risco, sobressaem infecção, hiperóxia, volutrauma, barotrauma e atelectrauma, os quais contribuem para o desenvolvimento da DBP através de mecanismo de lesão inflamatória pulmonar e apoptose celular. Segundo alguns investigadores, trata-se dum processo de regulação aberrante da inflamação pulmonar.
Tais factores, originando anomalias no processo de renovação da matriz extracelular e da remodelação estrutural, contribuem por sua vez para deposição desordenada da elastina, fibrose da parede sacular e alteração no desenvolvimento da formação dos alvéolos, o que corresponde a patologia fibroproliferativa.
Tendo em consideração que pelas 24 semanas de gestação é atingida a fase canalicular do desenvolvimento, a qual progride até ser atingida a fase sacular pelas 30 semanas, na nova DBP, quanto à característica das lesões, verifica-se, fundamentalmente: ruptura e interrupção do desenvolvimento das estruturas em geral, reparação tecidual anómala e alvéolos incompletamente desenvolvidos com septação insuficiente ou inexistentes, o que compromete a funcionalidade da barreira alveolocapilar.
Existem, pois, características estruturais que tornam o pulmão imaturo mais susceptível à lesão aguda provocada pela intervenção terapêutica, designadamente ventilatória.
Na DBP, considerada globalmente, importa uma referência aos seguintes factos biológicos:
- Zonas de diferente distensibilidade ou compliance, do que resulta correspondente heterogeneidade de dimensões dos alvéolos, ou seja, a par de zonas do parênquima evidenciando colapso alveolar, existem outras hiperventiladas em grau variável;
- Passagem de fluidos e proteínas para o espaço alveolar, o que inactiva o surfactante pulmonar, comprometendo ainda mais a compliance pulmonar;
- O oxigénio produz radicais livres que não são metabolizados no RN de muito baixo peso imaturo, o que se explica pela imaturidade do sistema imune (ver adiante).
Notas importantes:
|
Factores de risco
Reiterando que a DBP resulta do efeito combinado duma multiplicidade de factores perinatais e pós-natais com impacte no pulmão imaturo em desenvolvimento, descrevem-se a seguir alguns dos referidos factores:
Prematuridade
A prematuridade constitui o mais importante factor de risco de DBP. Em valor numérico, são apontadas as seguintes proporções: <5% de crianças nascidas a partir das 30 semanas, em comparação com >50% com 24-25 semanas ou menos.
Importa salientar que a verificação de restrição do crescimento fetal aumenta o risco.
Quanto ao sexo, a realidade é a seguinte: para igual peso e idade gestacional, a proporção de RN pré-termo do sexo masculino é duas vezes superior à do sexo feminino.
Inflamação e infecção
A inflamação e o oxigénio, constituem factores major na etiopatogénese da DBP; ou seja, na maioria dos casos, os factores implicados na doença estão interligados.
Com efeito, a resposta inflamatória pode ser desencadeada por factores não infecciosos (a que já se aludiu atrás), e a factores infecciosos pré-natais, ou pós-natais, actuando estes últimos no pós-parto imediato.
Infecção pós-natal – A sépsis neonatal está associada a risco elevado de DBP no RN pré-termo. O risco de DBP é significativamente superior se coexistirem sépsis e canal arterial hemodinamicamente significativo.
Corioamnionite – A infecção pré-natal tem sido apontada como factor de risco de desenvolvimento de DBP. Esta hipótese baseia-se na verificação de níveis elevados de citocinas inflamatórias no sangue do cordão fetal, no líquido amniótico e ulterior desenvolvimento de DBP.
A resposta inflamatória traduz-se:
- Pelo afluxo ou recrutamento de neutrófilos, macrófagos, leucotrienos, factor de activação das plaquetas (PAF), IL-6, IL-8, factor de necrose tumoral (TNF), etc. às vias aéreas e tecido intersticial, sendo que tal recrutamento se verifica por acção do quimiotactismo positivo de citocinas;
- Lesão oxidativa;
- Aumento da permeabilidade da membrana alveolocapilar;
- Desequilíbrio entre o sistema protease e antiprotease. Em RN pré-termo com DBP demonstrou-se a e alevação sérica de quimiocinas Th2.
Recorda-se que as proteases são enzimas sintetizadas pelos neutrófilos; têm acção proteolítica e, em condições de normalidade, são inactivadas pelas antiproteases. Sendo as antiproteases degradadas ou bloqueadas pelos radicais livres de oxigénio, passam a predominar as proteases (com papel relevante a elastase) cuja concentração aumenta; desfaz-se assim o equilíbrio existente em condições normais entre protease e antiprotease. As consequências são a destruição da matriz proteica, colagénio, elastina, etc..
Em particular, a infecção por Ureaplasma urealyticum tem sido referida como causa de resposta inflamatória anormal com consequente alteração do desenvolvimento pulmonar e ulterior DBP. No entanto, são necessários mais estudos comprovando que a erradicação da colonização respiratória por Ureaplasma adquirida in utero reduz a incidência de DBP.
Ventilação mecânica
Sendo a expansibilidade torácica inversamente proporcional à idade gestacional, o risco de volutrauma é tanto maior quanto menor a idade gestacional, chamando-se a atenção para:
- A possibilidade de pressões inspiratórias, consideradas moderadas ou não excessivas, poderem originar volumes correntes excessivos e hipocapnia;
- A possibilidade de mais acentuado volutrauma quando alvéolos colapsados são hiperdistendidos por ventilação com pressão positiva intermitente; e menos acentuado volutrauma nos casos em que se mantém distensão contínua moderada dos alvéolos ao ser aplicada uma pressão positiva contínua nas vias aéreas (CPAP).
Uma vez que na maioria dos RN pré-termo em que surge DBP há antecedentes de ventilação mecânica, e havendo associação frequente entre enfisema intersticial e DBP, é provável que surjam diversos tipos de lesão traumática ao nível do parênquima pulmonar em relação, quer com as alterações anatomofisiológicas das vias terminais e parenquimatosas, quer com as características do ventilador e as estratégias ventilatórias adoptadas.
Assim, poderá surgir volutrauma e barotrauma, respectivamente:
- Volutrauma por volume corrente e pressão inspiratória elevados provocando hiperdistensão alveolar e;
- Barotrauma (colapso alveolar) devido a insuficiente pressão positiva no final da expiração (PEEP) ou por défice de “recrutamento” alveolar.
Admite-se também o possível papel do tubo endotraqueal (TET) que, por um lado, pode lesar a mucosa e, por outro, levar a infecção relacionada com a dificuldade na drenagem de secreções.
Estudos experimentais em animais pré-termo concluíram que existe associação entre pressão inspiratória elevada, volume corrente elevado e défice de surfactante.
Demonstrou-se também que volume corrente excessivo pode lesar o pulmão e iniciar a cascata inflamatória.
Oxigénio
Admite-se que a toxicidade do O2 resulta do aumento de produção de radicais livres de oxigénio citotóxicos por défice de defesas antioxidantes ao nível das células endoteliais (dos capilares e alveolares).
Recordam-se, a propósito, os principais sistemas antioxidantes: dismutase do superóxido, peroxidase da glutationa, catalase, redutase, sintetase (enzimáticos), vitaminas C, A, e E, determinados oligoelementos como o selénio, cobre, ferro, zinco, etc. (não enzimáticos).
Acontece que a actividade dos sistemas enzimáticos antioxidantes é tanto mais deficitária quanto menor a idade gestacional, o que confere, em tal circunstância, maior vulnerabilidade das células à acção dos radicais livres de oxigénio (radical superóxido, peróxido de hidrogénio, hidroxilo, etc.), os quais, reagindo com constituintes celulares proteicos (ADN) e lipídicos (designadamente, a membrana lipídica) provocam destruição celular e lesões estruturais por alteração do mecanismo de reparação celular.
Outro efeito dos radicais livres de oxigénio é o recrutamento celular (sobretudo de leucócitos polimorfonucleares), o qual estimula a activação do ácido araquidónico, a inactivação da alfa-1-antitripsina (esta última antioxidante), e o processo inflamatório em cascata. Embora todas as células do organismo possam ser afectadas pelo efeito dos radicais livres de oxigénio face a concentrações elevadas de oxigénio, o pulmão é mais vulnerável tendo em conta, não propriamente a sensibilidade inerente ao tecido pulmonar, mas a maior superfície de exposição dos pneumócitos I e II, em contacto directo com o gás inspirado.
Canal arterial funcionante
Diversos estudos demonstraram que nos RN com doença respiratória por imaturidade pulmonar, submetidos a fluidoterapia com suprimento de volume excessivo, e não evidenciando fase diurética precoce nas primeiras 48-72 horas, a incidência de DBP é mais elevada.
Admite-se que, em tal circunstância, o suprimento excessivo de fluidos aumenta a incidência do quadro clínico decorrente de manutenção da permeabilidade do canal arterial (PDA ou persistência do ductus arteriosus) determinando:
- Aumento do débito sanguíneo pulmonar e do líquido intersticial (edema pulmonar) com aumento da resistência da via aérea ao fluxo de gases e estímulo da cascata inflamatória;
- Diminuição da compliance pulmonar, com tendência ao colapso alveolar.
Gera-se, assim, um círculo vicioso do qual resulta a necessidade de assistência ventilatória com pressão inspiratória mais elevada e a necessidade de FiO2 também mais elevada.
Contudo, com a aplicação de diferentes estratégias para prevenir ou tratar situações de canal arterial hemodinamicamente significativo, não se demonstrou haver consequente redução na incidência da DBP. Numa revisão da Cochrane (Bell & Acarregui, 2008) demonstrou-se que, embora a incidência de PDA diminua com a restrição de fluidos, a incidência de DBP não se altera. Também se provou que a utilização de diuréticos na DBP se associa a melhoria a curto-prazo na função pulmonar, e a diminuição das necessidades de oxigénio, embora sem qualquer efeito significativo na incidência da doença.
Nutrição
Os nutrientes têm papel importante no crescimento e desenvolvimento celulares, sendo de salientar que a desnutrição (carência de nutrientes) torna as células mais vulneráveis à lesão induzida pela acção dos radicais livres de oxigénio.
Sabendo-se que a transferência dos nutrientes da mãe para o feto se verifica sobretudo no terceiro trimestre, torna-se fácil compreender que a carência nutricional inerente à prematuridade predispõe a tal lesão, nomeadamente ao nível do pulmão (fundamentalmente, menor síntese de ADN). Havendo em tais RN igualmente carência em ácidos gordos polinsaturados, com acção antioxidante, compreende-se também o acréscimo de predisposição para tal tipo de lesões.
A carência em vitamina A influencia, também negativamente, o crescimento e desenvolvimento das células epiteliais, endoteliais e surfactante pulmonares. Em diversos estudos comprovou-se que o nível sérico de vitamina A está diminuído nos RN com DBP.
Predisposição genética
Com o desenvolvimento da biologia molecular, descreveu-se um estado de predisposição genética a anormal hiperreactividade brônquica, sendo que existe associação entre DBP e antecedentes familiares de asma.
Estudos com gémeos prematuros monozigóticos sugerem que em 53-79% dos casos existe uma predisposição genética para o desenvolvimento de DBP. Estudos prévios identificaram múltiplos genes com papel potencial na DBP, como por exemplo genes associados à síntese de proteínas do surfactante, à imunidade inata, a antioxidantes e a proteínas envolvidas na remodelação vascular e pulmonar.
Anomalias do desenvolvimento vascular pulmonar e pré-eclâmpsia
No contexto de DBP, é importante assinalar as anomalias da circulação pulmonar que se verificam:
- Resistência vascular pulmonar (RVP) aumentada;
- Vasorreactividade anormal.
Tais anomalias têm implicações na terapêutica (ver adiante). Em muitos casos, as mesmas podem ser suficientemente graves para conduzir a quadros de hipertensão pulmonar e cor pulmonale. Em estudos recentes verificou-se uma incidência de hipertensão pulmonar em cerca de 25% dos casos, atingindo 50% nas situações de DBP grave. O desenvolvimento de hipertensão pulmonar agrava significativamente o prognóstico, aumentando o risco de morte (48% de mortalidade 2 anos após o diagnóstico de hipertensão pulmonar).
Actualmente, a pré-eclâmpsia é considerada um factor de risco de DBP, verificando-se que naquela existe fenómeno de anti-angiogénese. Este fenómeno, com impacte no desenvolvimento vascular pulmonar e no desenvolvimento alveolar, é explicado pelo défice de determinados factores de crescimento. Com efeito, no sangue do cordão de RN de mães com pré-eclâmpsia desenvolvendo ulteriormente DBP, foram demonstrados valores baixos de VEGF (vascular endothelial growth factor) e de PlGF (placental growth factor), devido a neutralização por uma tirosinocinase (sFlt-1), a qual é produzida em excesso pelas vilosidades trofoblásticas em tal contexto (pré- eclâmpsia).
Manifestações clínicas e exames complementares
O desenvolvimento da terapia intensiva, incluindo a terapêutica substitutiva com surfactante pulmonar exógeno, tem permitido ao longo dos anos a sobrevivência de RN de peso cada vez mais baixo e mais imaturos.
Dum modo geral, a DBP surge em RN pré-termo submetidos a ventilação mecânica nos primeiros dias de vida; a dependência do ventilador para além de 1-2 semanas pode conduzir às hipóteses de diagnóstico de: DBP, de PDA, e de infecção.
São consideradas actualmente duas formas clínicas de DBP:
1. DBP clássica ou “velha”
Esta forma corresponde às situações mais graves, em geral anteriores à era da terapêutica com surfactante exógeno: necessidade de maiores concentrações de oxigénio, suporte ventilatório obrigando a pressões inspiratórias mais elevadas durante a primeira semana de vida, e elevada probabilidade de síndromas de ar ectópico e insuficiência respiratória crónica.
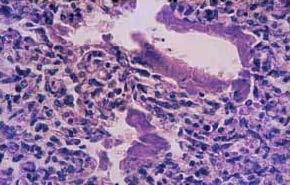
Estas características acompanham-se fundamentalmente de inflamação das vias aéreas com metaplasia do epitélio respiratório, hipoplasia alveolar, fibrose da parede sacular, obliteração bronquiolar, e muscularização excessiva das vias aéreas e ramos arteriais pulmonares. (Figura 1)
Ocorre um quadro de SDR mantida com taquipneia, retracções, episódios de cianose, e crises de agitação/ irritabilidade por hipoxémia; existe igualmente aumento muito marcado do trabalho respiratório.
Há sinais de insuficiência ventricular direita e cor pulmonale secundários a hipertensão pulmonar: edema pulmonar, cardiomegália, hepatomegália.
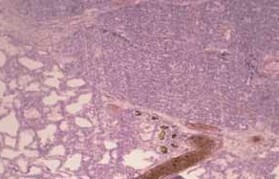
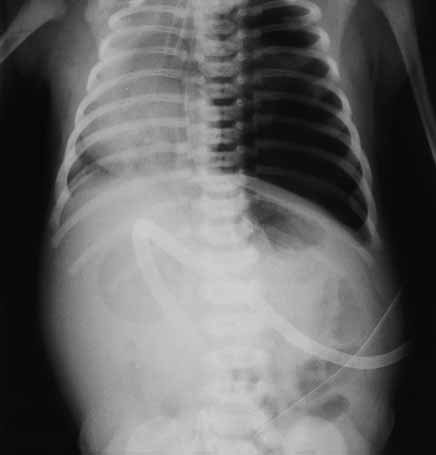
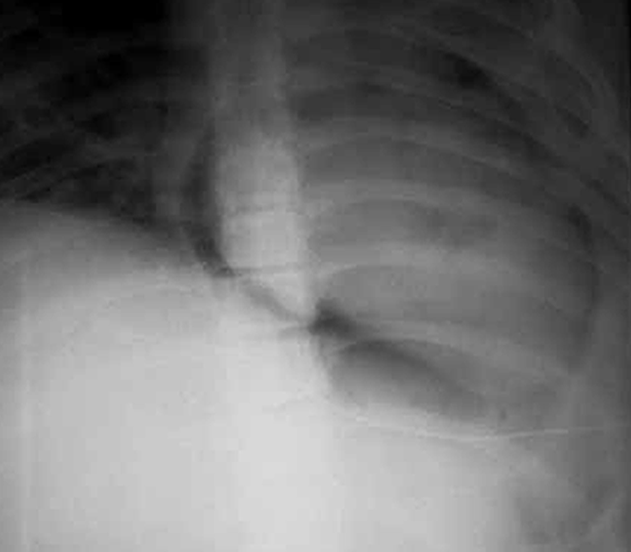
FIGURA 1. Corte histológico do pulmão: caso de óbito com DBP. Sinais de metaplasia do epitélio respiratório; grau discreto de fibrose. (UCIN-HDE)
São frequentes atelectasia recorrente, infecções pulmonares intercorrentes, e broncomalácia com consequente sibilância.
Um dos problemas associados é a dificuldade na alimentação por via oral, o que frequentemente tem repercussões negativas no crescimento.
2. DBP ”nova”
O paradigma desta forma é constituído pelas situações de imaturidade extrema (peso de nascimento <1.000 gramas) com SDR ligeira, e necessidade de suporte ventilatório tendo em conta o surgimento de episódios frequentes de apneia; nestes casos são utilizadas menores concentrações de oxigénio e mais baixas pressões inspiratórias, a dependência de oxigénio é ligeira, e o compromisso da função pulmonar menos acentuado.
Em geral, os problemas associados que determinam manutenção da disfunção respiratória relacionam-se sobretudo com infecções associadas aos cuidados prestados e a alterações hemodinâmicas em relação com a manutenção da permeabilidade do canal arterial.
Tendo em conta que esta forma surge predominantemente em RN com idades gestacionais entre 23 e 28 semanas, o quadro anatomopatológico traduzindo sinais de “agressão” em estádio de desenvolvimento muito mais precoce, é diverso do verificado na outra forma: na nova DBP verifica-se défice de desenvolvimento das vias aéreas devido a imaturidade – défice de alvéolos/ hipoplasia alveolar, sáculos dilatados, e anarquia no desenvolvimento dos capilares. Nesta forma, ao contrário do que acontece na primeira, as lesões de metaplasia e de hiperplasia epiteliais e fibrose são mínimas.
Verifica-se em geral um quadro de SDR ligeira, com possível agravamento por infecção intercorrente ou persistência do canal arterial; em comparação com a “forma clássica”, existe menor dependência do oxigénio, e sinais mais discretos de aumento do trabalho respiratório.
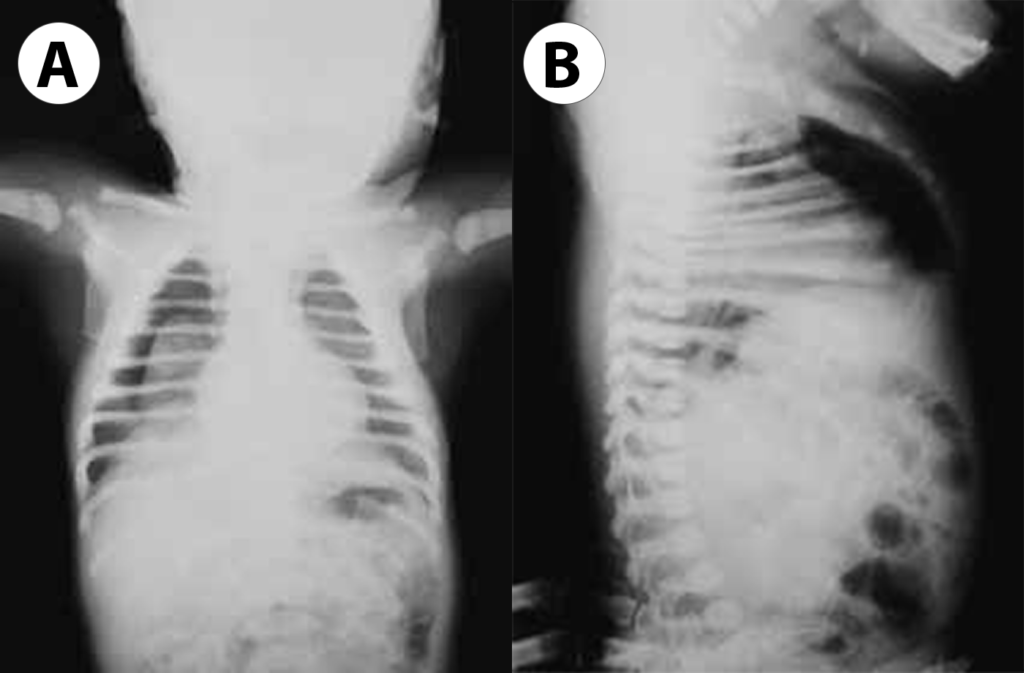
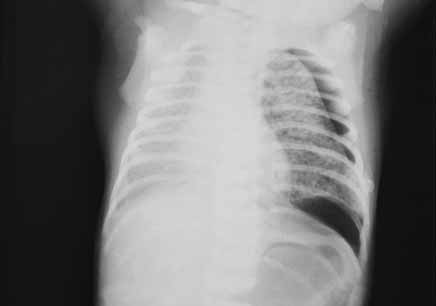
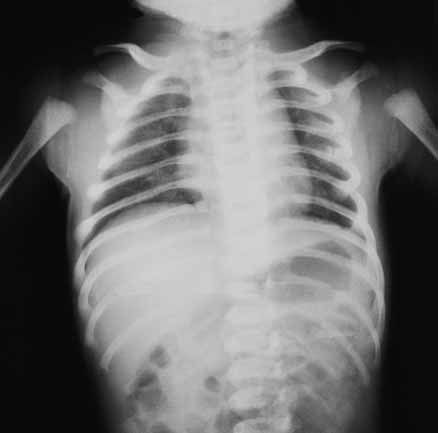
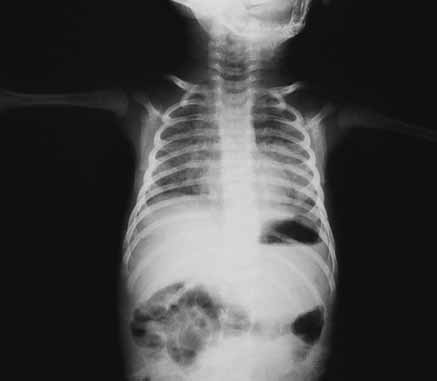
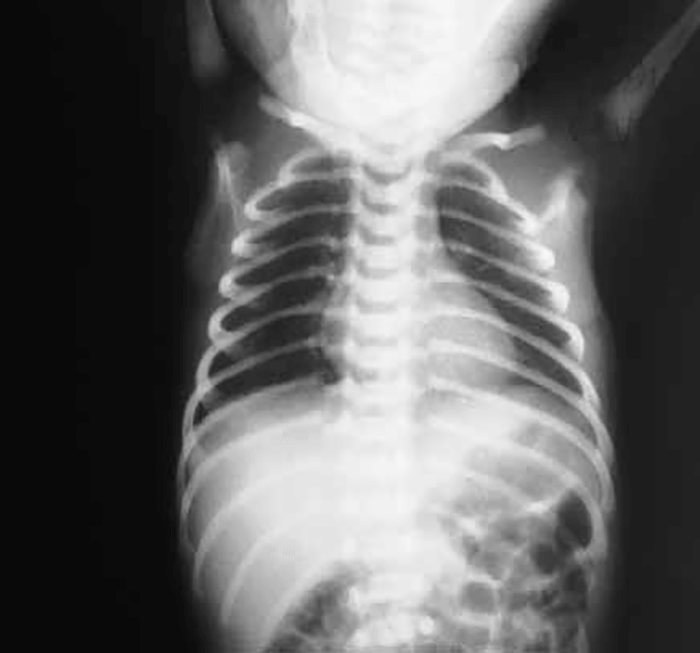
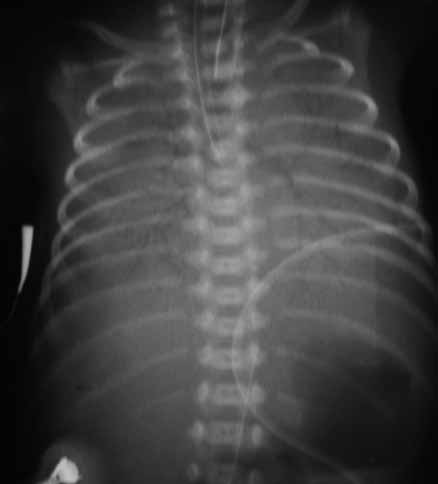
No que respeita ao padrão radiológico torácico descrito inicialmente por Northway, o Quadro 1 resume determinados sinais em diversos estádios, reflectindo a evolução das lesões.
QUADRO 1 – DBP: Classificação Radiológica de Northway.
| Estádio I Sobreponível ao quadro de DMH com “granitado” bilateral e broncograma aéreo (1º-3º dia de vida). |
| Estádio II Opacificação dos campos pulmonares (4º-10º dia de vida). |
| Estádio III Pequenas áreas quísticas alterando com zonas de densidade variável (10º-20º dia de vida). |
| Estádio IV Densidades lineares grosseiras, sobretudo nos vértices, alternando com zonas de hipertransparência e de hipotransparência, com distribuição irregular (a partir do 30º dia). |
O padrão radiológico (não específico da doença, persistente e afectando ambos os campos pulmonares; nem tão pouco critério sine qua non– ver atrás) pode também ser classificado em ligeiro, moderado e grave:
- DBP ligeira – opacidades reticulares de distribuição homogénea traduzindo compromisso intersticial com ou sem sinais de enfisema;
- DBP moderada – opacidades reticulares (ou linhas de opacificação) hilífugas associadas a sinais de enfisema;
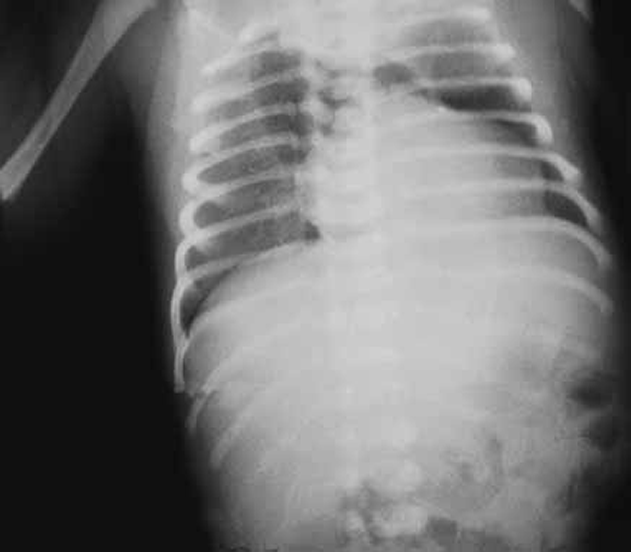
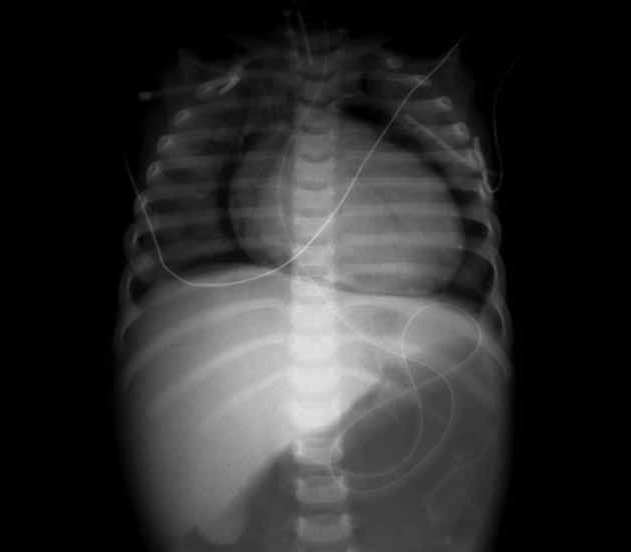
- DBP grave – opacidades mais densas, difusas e heterogéneas traduzindo zonas de fibrose ou de atelectasia; concomitância de zonas de enfisema e de atelectasia; possível cardiomegália correspondente a situação de cor pulmonale. (Figura 2)
Em muitos centros, a TAC torácica utiliza-se muito frequentemente pelo facto de permitir, com grande sensibilidade, a identificação de lesões focais tais como enfisema lobar adquirido e atelectasias localizadas. Se for utilizada com angiografia associada a ecocardiografia e, em geral, a outros exames correntes no âmbito da cardiologia de intervenção, permitirá igualmente identificar situações de hipertensão pulmonar.
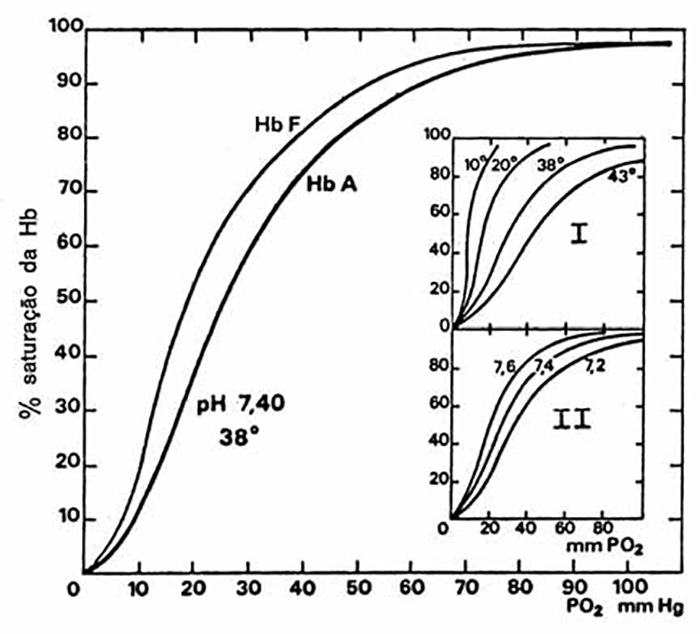
No que respeita aos achados do estudo da função pulmonar (que se podem deduzir das alterações descritas a propósito da etiopatogénese), salienta-se:
- Capacidade residual funcional diminuída;
- Compliance (ou distensibilidade) diminuída;
- Resistência aumentada das vias aéreas;
- Aumento do trabalho respiratório;
- Hipercapnia secundária à hipoventilação alveolar que, por sua vez, resulta da alteração na relação ventilação-perfusão e do aumento do espaço morto.
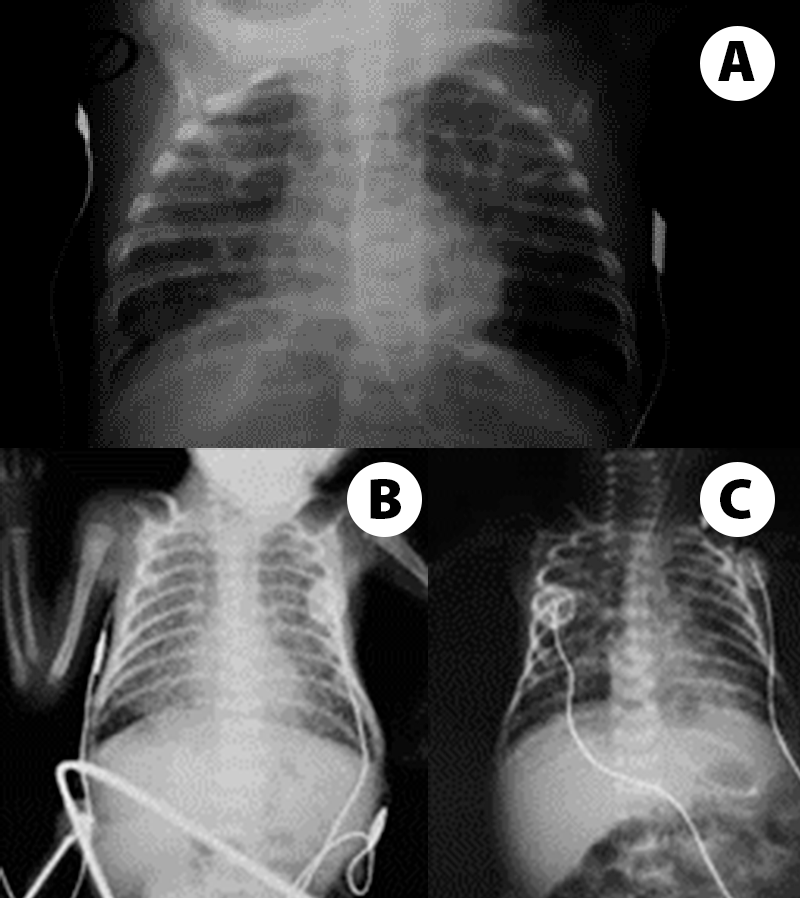
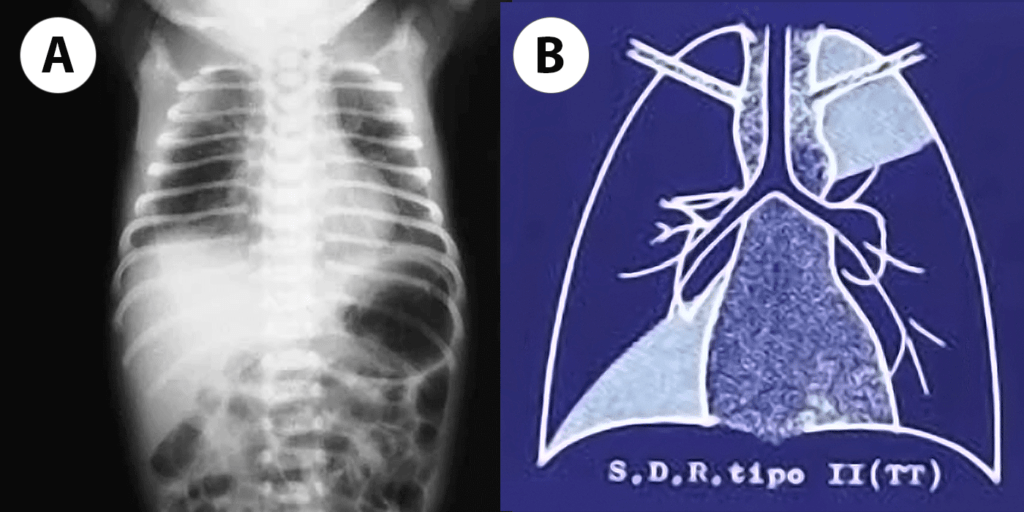
FIGURA 2. A, B e C – Imagens radiográficas de DBP tipificando os estádios II, III e IV de Northway: opacificações, pequenas áreas quísticas dispersas, densidades lineares grosseiras e áreas de hipo e hipertransparência. (NIHDE)
Prevenção e tratamento
Aspectos gerais
As estratégias que têm como objectivo prevenir a DBP (prevenção primária) devem incidir sobre a eliminação ou redução de determinados factores etiopatogénicos (com especial ênfase para prematuridade, restrição de crescimento fetal, hipertensão arterial materna, ventilação mecânica, toxicidade do oxigénio, infecção, canal arterial patente e predisposição genética), os quais contribuem para a lesão pulmonar.
Tendo em conta que a imaturidade pulmonar constitui o principal factor predisponente da doença em causa, a prevenção da DBP deve ter o seu início no período pré-natal, passando pela vigilância adequada pré-concepcional e da grávida, a fim de se detectar e tratar possíveis factores de risco para parto pré-termo. Assim, grávidas de risco devem ser enviadas atempadamente a centros de referência e, em caso de ameaça de parto pré-termo, transferidas para hospitais de nível III.
Estando iminente o parto pré-termo, a administração de corticóides pré-natais contribui de modo relevante para a diminuição, quer da incidência e gravidade do problema respiratório do pré-termo (DMH), quer da probabilidade da subsequente evolução para DBP.
O Quadro 2 resume as principais estratégias de prevenção, quer as actualmente exequíveis, quer as que são ainda objecto de investigação.
A propósito da prevenção e tratamento das infecções pré- e pós-natais, cabe referir que cerca de 30 a 40% dos partos pré-termo são provocados por infecção materna. Ainda no âmbito da prevenção primária, importa igualmente considerar o potencial papel de certos fármacos de acordo com estudos realizados, na maioria não conclusivos; a este propósito citam-se a azitromicina e outros macrólidos (activos contra Ureaplasma).
QUADRO 2 – Estratégias para a prevenção da DBP.
Actualmente exequíveis
|
Em investigação
|
Ventilação mecânica
Quanto às estratégias de assistência respiratória preventiva, os estudos realizados têm advogado globalmente:
- A vantagem de se utilizar precocemente, desde a sala de partos, CPAP nasal (nCPAP) em RNMBP, evitando a entubação traqueal e a ventilação mecânica; e
- Quando indicado, a utilização de surfactante exógeno o mais precoce possível, idealmente nas 2 primeiras horas de vida.
Tornando-se indispensável a ventilação mecânica, recomenda-se:
- Utilizar volumes correntes baixos a fim de minorar a lesão pulmonar mecânica, tendo como alvo Pa CO2 entre 55 e 65 mmHg, desde que o pH se mantenha em níveis normais (7,3-7,4). No entanto, a ventilação mecânica prolongada no RNMBP provoca distensão das vias aéreas e aumento da relação espaço morto/ volume corrente, o que obriga muitas vezes à utilização de volumes correntes mais elevados para uma ventilação eficaz;
- Usar pressões no final da expiração (PEEP) entre 5 e 7 cmH2O a fim de minorar o risco de atelectasia e de edema pulmonar;
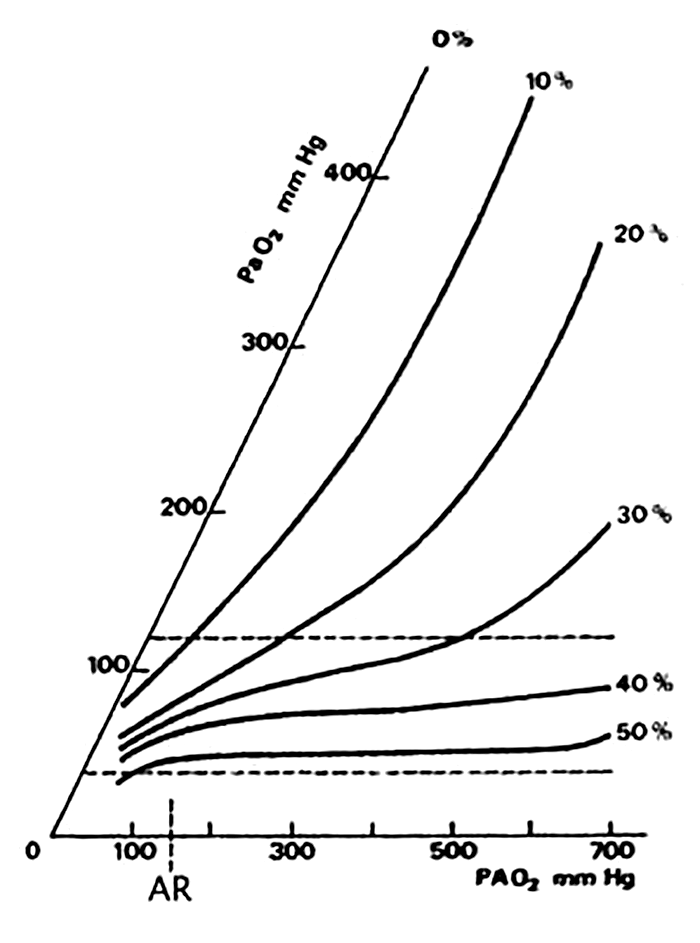
- Evitar, tanto a hipoxémia como a exposição a excesso de oxigénio, recorrendo à SpO2 alvo, em função dos valores obtidos pela oximetria de pulso e da idade pós-menstrual. (ver adiante)
Oxigenoterapia
Os objectivos da utilização de oxigénio suplementar são:
- Assegurar uma adequada oxigenação tecidual;
- Evitar a hipóxia alveolar, a qual aumenta a resistência vascular pulmonar com potencial evolução para cor pulmonale;
- Evitar a hipoxémia, que conduz a aumento da resistência das vias aéreas.
De salientar, contudo, que elevações da FiO2, ainda que escassas, podem ter um impacte negativo na evolução clínica, designadamente quanto ao risco de retinopatia da prematuridade ou de exacerbação da inflamação e do edema pulmonares.
A utilização de oxigenoterapia na criança prematura com DBP constitui, pois, um desafio, tendo em conta a necessidade, por um lado, de evitar a hipoxémia e, por outro, de evitar a exposição a concentrações excessivas de oxigénio.
Com base em provas científicas, recomenda-se uma saturação-alvo em oxigénio entre 90 e 95% no RN pré-termo (ou 95-96% nos casos com hipertensão pulmonar).
Quando a criança atinge a idade de termo e adquire maturidade vascular retiniana (documentada por observação oftalmológica) recomenda-se suplementação com oxigénio de forma a manter valores de SpO2 iguais ou superiores a 95%.
Cafeína
O tratamento com citrato de cafeína tem sido associado a menor incidência de DBP às 36 semanas de idade corrigida, o que possivelmente decorre da menor exposição à ventilação com pressão positiva. Por outro lado, a sua utilização na prematuridade extrema tem sido associada a diminuição de paralisia cerebral e de défice cognitivo aos 18 meses de idade corrigida. No entanto, este benefício não foi comprovado em estudos de seguimento na idade pré-escolar.
Antioxidantes
É importante chamar a atenção para o papel de vitamina A e do selénio na diferenciação e manutenção da integridade das células epiteliais do sistema respiratório. Alguns estudos demonstraram que doses elevadas de vitamina A em RN de peso <1.000 gramas determinaram diminuição da mortalidade por DBP e das necessidades de oxigénio ao mês de idade, a par de uma tendência para redução do número de casos de DBP.
Diuréticos
Ainda que a terapêutica diurética melhore a curto prazo a mecânica pulmonar, é pouco evidente o seu benefício a longo prazo na evolução da DBP.
Duas classes de diuréticos podem ser utilizadas na criança com DBP:
- Tiazidas – actuando no tubo distal renal (ex: hidroclorotiazida, espironolactona);
- Diuréticos de ansa – actuando no ramo ascendente da asa de Henle (ex: furosemido).
De referir, a propósito, que tais fármacos, estimulando a síntese de prostaglandinas, exercem efeito vasodilatador pulmonar e sistémico e estimulam a secreção de surfactante pulmonar.
Como complicações da utilização destes fármacos, citam-se:
- Perda urinária de sódio, potássio e cloro, podendo levar a hiponatrémia, hipocalémia e, eventualmente, a alcalose hipoclorémica;
- O furosemido aumenta a excreção de cálcio, muitas vezes levando à nefrocalcinose e nefrolitíase; igualmente, é potencialmente ototóxico, sobretudo se a administração endovenosa for rápida.
Apesar da falta de prova científica de reais benefícios a longo prazo, pode recorrer-se à terapêutica diurética em crianças dependentes da ventilação mecânica ou que necessitam de PEEP apesar de uma restrição hídrica modesta (140-150 mL/kg/dia). Em tal contexto, são utilizadas habitualmente as tiazidas (hidroclorotiazida na dose de 3-4 mg/kg/dia, em duas doses por via oral, associada ou não a espironolactona).
O furosemido utiliza-se habitualmente em dose única (1 mg/kg/dose por via endovenosa, ou 2 mg/kg por via oral) para tratar as exacerbações atribuíveis a edema pulmonar, podendo eventualmente prolongar-se o tratamento até 3 dias; muitas vezes é administrado na sequência de transfusões de hemoderivados.
Notas importantes:
|
Corticóides
Para além da acção anti-inflamatória suprimindo a produção de mediadores inflamatórios, os corticóides estimulam a síntese de surfactante pulmonar e de enzimas antioxidantes, melhorando a função pulmonar nas crianças com DBP em evolução ou já estabelecida.
Apesar da melhoria da mecânica pulmonar e da redução do suporte ventilatório, a preocupação com as sequelas neurológicas a longo prazo levou a que a Academia Americana de Pediatria e a Sociedade Pediátrica Canadiana tivessem recomendado o uso restrito de corticoterapia sistémica no RN pré-termo.
Assim, o uso de corticóides sistémicos no tratamento de DBP, não recomendado por rotina, deve ser reservado às situações de crianças com DBP grave, dependentes de suporte ventilatório e de oxigénio máximos (necessidades de MAP >8 cm H2O e de FiO2 >40%) ponderando, neste contexto, o balanço entre riscos e benefícios. Nesta perspectiva, a decisão de tratamento com corticóides sistémicos deverá ser tomada caso a caso, e após esclarecimento e concordância dos pais.
São, pois, necessários mais estudos que permitam determinar qual o corticóide mais adequado (bem como a respectiva dose, via e data de administração), que permita reduzir o risco de DBP sem aumentar o risco de sequelas a nível do neurodesenvolvimento em RN pré-termo ventilados.
A propósito de corticóides, algumas notas importantes:
|
Broncodilatadores
A administração de broncodilatadores inalados reduz a resistência das vias aéreas e aumenta a compliance pulmonar.
Tendo em conta os efeitos colaterais cardiovasculares, tais como hipertensão, taquicárdia e arritmia, as suas indicações deverão ser individualizadas, o seu uso não é recomendado por rotina em crianças com DBP.
Podem ser utilizados: beta-2 adrenérgico (como por ex. salbutamol), anticolinérgico derivado da atropina (por ex. o brometo de ipratrópio), metilxantina (por ex. aminofilina, cafeína, etc.).
Salientam-se:
- Salbutamol (nebulização): 0,1-0,5 mg/kg/dose em 3 mL de soro fisiológico 4 a 6 vezes por dia; podem ser utilizadas outras vias: oral, IV contínua, aerossol;
- Brometo de ipratrópio (nebulização): 125-250 mcg por dose em 3 mL de soro fisiológico 3 a 4 vezes por dia.
Actualmente, as novas estratégias ventilatórias menos agressivas e o uso de surfactante precoce reduzem o risco de lesão das vias aéreas, resultando em menor número de episódios de hiperreactividade brônquica nas crianças com DBP, durante o internamento.
Notas importantes:
|
Óxido nítrico
Não está provado efeito benéfico do óxido nítrico na DBP. A sua utilização está apenas recomendada nos casos de insuficiência respiratória com hipoxémia associada a hipertensão pulmonar (HPP/HTP) no RN de termo e pré-termo limiar. Recorda-se que a HPP tem sido descrita em cerca de 40% das formas mais graves de DBP.
Nutrição
Torna-se fundamental propiciar nutrição adequada (suprimento energético entre 120-180 kcal/kg/dia) com vista a garantir o processo de reparação pulmonar, assim como ganho de peso entre 20-30 gramas/dia por volta da idade pós-concepcional de 40 semanas. Haverá que ter em conta a necessidade de balanço hidroelectrolítico rigoroso, sendo muitas vezes necessário restringir o suprimento em fluidos para cerca de 140-150 ml/kg/dia.
Para incrementar o suprimento energético, podem ser administrados suplementos sob a forma de polímeros da glucose e de triglicéridos de cadeia média. Em casos seleccionados, poderá ser necessário proceder a gastrostomia.
Outras terapias
A terapia celular constitui um novo paradigma da medicina.
No pulmão em desenvolvimento, vários tipos de células, tais como as células estaminais mesenquimatosas, as células progenitoras do endotélio (designadamente as células estaminais angiogénicas) e as células epiteliais amnióticas, encerram em si a potencialidade de produzir factores de proteção e reparação de lesão pulmonar. Estas células seriam ideais, não só para o tratamento de uma doença multifactorial como a DBP, como de outras complicações da prematuridade extrema.
Experimentações em animais revelaram resultados promissores, e ensaios de Fase I com células estaminais mesenquimatosas estão já em curso. No entanto, o conhecimento do mecanismo de acção deste tipo de terapêutica, ainda limitado, e a heterogeneidade das populações celulares, dificultam a previsão quanto à sua eficácia.
Outra área de investigação no âmbito da prevenção da inflamação pulmonar envolve o estudo de compostos não esteróides, citando-se a inibição de citocinas pró-inflamatórias utilizando, entre outras, fármacos/ moléculas tais como pentoxifilina e o inibidor NLRP3, este último, fazendo parte do sistema imune.
Plano da alta hospitalar
A alta para o domicílio duma criança com DBP, que deve ser planeada por uma equipa multidisciplinar, é dirigida pelo neonatologista, associando pneumologista pediátrico, enfermeiro, nutricionista, fisioterapeuta, terapeuta ocupacional, audiologista e assistente social.
Os pais devem ser envolvidos precocemente neste processo, de forma a se familiarizarem, não só com os cuidados básicos, mas também com os aspectos tecnológicos, por vezes necessários em domicílio (oxigenoterapia, monitorização, etc). Antes da alta, e entre outras competências, os mesmos devem ser treinados em técnica de reanimação cardiorrespiratória.
Do ponto de vista clínico, considera-se genericamente que a criança está apta para a alta hospitalar nas seguintes circunstâncias:
|
Por outro lado, os pais ou os prestadores de cuidados devem sentir-se confiantes nos cuidados ao bebé, e ter procedido à preparação do ambiente em casa para o receber.
O seguimento em ambulatório da criança com DBP é pluridisciplinar e deve ter em atenção os seguintes aspectos:
- Vigilância da função respiratória, especialmente nas crianças submetidas a oxigenoterapia ou ventilação domiciliárias;
- Prevenção das infecções respiratórias, a qual passa pelas medidas gerais preventivas, a mais importante das quais é a lavagem correcta e frequente das mãos dos pais e outros cuidadores; há que evitar contacto com poluentes ambientais, especialmente tabaco, desaconselhando-se a frequência da escola durante os primeiros 2 anos de vida;
- Imunizações – para além do cumprimento do programa nacional de vacinação:
- a prevenção com vacina antigripe está indicada se a criança tiver idade superior a 6 meses (idade pós-natal), anualmente, no Outono: entre os 6-35 meses à 0,25 mL/ mês, duas doses; após 36 meses à 0,5 mL em dose única; a família e contactos deverão ser também vacinados;
- a prevenção da infecção por vírus sincicial respiratório (VSR) está indicada, nas crianças com DBP com idade pós-natal inferior a 24 meses, nos casos de as mesmas terem necessitado de tratamento relacionado com a doença, pelo menos durante uma semana, nos seis meses antecedentes; utiliza-se o anticorpo monoclonal-palivizumab (Synagis®) 15 mg/kg/mês a partir do início da “época do VSR”, e durante a referida época (de Outubro a Março, no nosso clima), no máximo de 5 doses em cada época. Nalguns centros são utilizadas variantes deste plano;
- Crescimento, com especial atenção aos aspectos nutritivos e suplementos vitamínicos e marciais;
- Neurodesenvolvimento, com avaliações quantificadas e referenciação atempada às equipas de intervenção precoce.
Prognóstico
O prognóstico depende dos vários tipos de complicações surgidas e, designadamente, do grau de disfunção cardiorrespiratória. A mortalidade (entre 30 e 40%) ocorre predominantemente no primeiro ano de vida, em geral como consequência de insuficiência cardiorrespiratória, sépsis, infecção respiratória ou morte súbita.
Quanto à função pulmonar, a curto prazo, a evolução pode considerar-se favorável, inclusivamente nos casos de crianças que têm alta com necessidade de oxigenoterapia continuada. A redução progressiva do suplemento de O2 até à respiração em ar ambiente (FiO2) é geralmente possível antes do 1º ano; a progressão ponderal – um dos problemas face às dificuldades alimentares – é proporcional à melhoria da função pulmonar.
A melhoria da função pulmonar verificada ao longo do tempo pode explicar-se pelo processo de crescimento e desenvolvimento da via respiratória, que continua na 2ª e 3ª infância. No entanto, as re-hospitalizações são frequentes no 1º ano de vida (salientando-se que cerca de 25-30% são devidas a infecções respiratórias acompanhadas de sibilância recorrente).
Estudos a longo prazo demonstraram que em crianças com idade superior a 10 anos, adolescentes e adultos se verifica elevada prevalência de hiperreactividade brônquica.
Relativamente à repercussão sobre a função pulmonar na idade adulta em indivíduos com antecedentes de DBP e muito baixo peso de nascimento, identificou-se um quadro com sinais de obstrução ao fluxo de ar, ineficiência das trocas gasosas e heterogeneidade ventilatória.
No que respeita ao prognóstico do foro neurológico, os doentes com DBP evidenciam maior incidência de sequelas em comparação com as crianças sem a doença. Tais sequelas traduzem-se fundamentalmente por paralisia cerebral, défice cognitivo, dificuldades de aprendizagem, défice de atenção e problemas de comportamento.
Existe, por outro lado, risco aumentado de retinopatia da prematuridade e de alterações da audição.
No que respeita a complicações do foro cardiovascular, de grande relevância no prognóstico, citam-se: cor pulmonale, hipertensão pulmonar, hipertensão sistémica, hipertrofia ventricular esquerda e desenvolvimento de vasos colaterais aorto-pulmonares que podem originar insuficiência cardíaca.
BIBLIOGRAFIA
Adams JM, Stark AR. Pathogenesis and clinical features of bronchopulmonary dysplasia. UpToDate 2015; www.uptodate.com/contents/pathogenesis-and-clinical-features-of-bronchopulmonary-dysplasia (acesso em Dezembro, 2019)
Adams JM, Stark AR. Management of bronchopulmonary dysplasia. Waltham MA/USA: UpToDate /Wolters Kluwer, 2015; www.uptodate.com/contents/management-of-bronchopulmonary-dysplasia (acesso em Dezembro, 2019)
Alvira CM, Morty RE. Can we understand the pathobiology of bronchopulmonary dysplasia? J Pediatr 2017;190:27–37
Arai H, Ito T, Ito M, et al. Impact of chest radiography‐based definition of bronchopulmonary dysplasia. Pediatr Intern 2019;61:258-263
Augustine S, Avey MT, Harrison B, et al. Mesenchymal stromal cell therapy in bronchopulmonary dysplasia: systematic review and meta-analysis of preclinical studies. Stem Cells Transl Med 2017;6:2079–2093
Ballard HO, Shook LA, Bernard P, et al. Use of azithromycin for the prevention of bronchopulmonary dysplasia in preterm infants. Pediatr Pulmonol 2011;46:111-118
Bancalari E, Claure N, Sosenko IRS. Bronchopulmonary dysplasia: changes in pathogenesis, epidemiology and definition. Semin Neonatol 2003;8:63-71
Berkelhamer SK, Mestan KK, Steinhorn RH. Pulmonary hypertension in bronchopulmonary dysplasia. Semin Perinatol 2013;37:124-131
Bhandari A, Panitch H. An update on the post-NICU discharge management of bronchopulmonary dysplasia. Semin Perinatol 2018;42:471-477
Bose C, Van Marter LJ, Laughon M, et al. Fetal growth restriction and chronic lung disease among infants born before the 28th week of gestation. Pediatrics 2009;124:450-458
Brady JM, Zhang H, Kirpalani H, et al. Severe bronchopulmonary dysplasia-parental views of their child’s quality of life. J Pediatr 2019;207:117-121
Brumbaugh JE, Bell EF, Grey SF, et al. Behavior profiles at 2 years for children born extremely preterm with bronchopulmonary dysplasia. J Pediatr 2020;219:152-158
Cole FS, et al. NIH Consensus Development Conference statement: inhaled nitric-oxide therapy for premature infants. Pediatrics 2011;127:363-369
Cuna A, Lewis T, Dai H, et al. Timing of postnatal corticosteroid treatment for bronchopulmonary dysplasia and its effect on outcomes. Pediatr Pulmonol 2019;54:165-170
Dani C, Pratesi S, Migliori C, Bertini G. High flow nasal cannula therapy as respiratory support in the preterm infant. Pediatr Pulmonol 2009;44:629-634
Direção Geral da Saúde. Prescrição de palivizumab para prevenção da infeção pelo vírus sincicial respiratório em crianças de risco. Norma nº 012/2013 de 30/07/2013 actualizada a 08/10/2014
Dumpa V, Bhandari V. Surfactant, steroids and non-invasive ventilation in the prevention of BPD. Semin Perinatol 2018;42:444-452
Gien J, Kinsella JP. Pathogenesis and treatment of bronchopulmonary dysplasia. Curr Opin 2011;23:305-313
Hines D, Modi N, Lee SK, Isayama T, et al. International Network for Evaluating Outcomes (iNeo) of Neonates. Scoping review shows wide variation in the definitions of bronchopulmonary dysplasia in preterm infants and calls for a consensus. Acta Paediatr 2017;106:366–374
Hunt K, Dassios T, Ali K, et al. Volume targeting levels and work of breathing in infants with evolving or established bronchopulmonary dysplasia. Arch Dis Child Fetal & Neonatal Ed 2019;104:F46-F49
Kair LR, Leonard DT, Anderson JDM. Bronchopulmonary Dysplasia. Pediatr Rev 2012;33:255-263
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lagatta J, Murthy K, Zaniletti I, et al. Home oxygen use and 1-year readmission among infants born preterm with bronchopulmonary dysplasia discharged from children’s hospital neonatal intensive care units. J Pediatr 2020;220:40-47
Lal CV, Vineet Bhandari V, Ambalavanan N. Genomics, microbiomics, proteomics, and metabolomics in bronchopulmonary dysplasia. Semin Perinatol 2018;42:425-431
Lesage F, Thébaud B. Nanotherapies for micropreemies: Stem cells and the secretome in bronchopulmonary dysplasia. Semin Perinatol 2018;42:453-458
Lowe J, Watkins WJ, Edwards MO, et al. Association between pulmonary Ureaplasma colonization and bronchopulmonary dysplasia in preterm infants: updated systematic review and meta-analysis. Pediatr Infect Dis J 2014;33:697-702
Meyer S, Gortner L, NeoVitaA Trial Investigators. Early postnatal additional high-dose oral vitamin A supplementation versus placebo for 28 days for preventing bronchopulmonary dysplasia or death in extremely low birth weight infants. Neonatology 2014;105:182-188
Meyer S, Gortner L, NeoVitaA Trial Investigators. Developing a better and practical definition of bronchopulmonary dysplasia. Acta Paediatrica 2017;106:842
Mobius MA, Thebaud B. Cell therapy for bronchopulmonary dysplasia: promises and perils. Paediatr Respir Rev 2016;20:33–41
Morty RE. Recent advances in the pathogenesis of BPD Semin Perinatol 2018;42:404-412
Northway WHJr. Broncopulmonary dysplasia: then and now. Arch Dis Child 1990;65:1076-1081
Paris C. Papagianis PC, Pillow JJ, Timothy J. Moss TJ. Bronchopulmonary dysplasia: Pathophysiology and potential anti-inflammatory therapies Paediatr Respiratory Rev 2019;30:34-41
Poets C, Franz AR. Automated FiO2 control: nice to have, or na essential addition to neonatal intensive care? Arch Dis Child Fetal Neonatal Ed 2017;102:F5-F6
Polin RA, Carlo WA. Surfactant replacement therapy for preterm and term neonates with respiratory distress. Pediatrics 2014;133:156-163
Polin RA, Yoder MC. Workbook in practical neonatology. Philadelphia: Elsevier Saunders, 2015
Reiterer F, Scheuchenegger A, Resch B, et al. BPD in very preterm infants: outcome up to pre-school age in a single center of Austria. Pediatr Intern 2109;61:381-387
Schmidt B, et al. Survival without disability to age 5 years after neonatal caffeine therapy for apnea of prematurity. JAMA 2012;307:275-282
Secção de Neonatologia da SPP. Consensos Nacionais em Neonatologia. Guimarães H, Tomé T, Albuquerque M, Martins V(eds). Lisboa: Angelini, 2004
Secção de Neonatologia da SPP. Grupo do Registo Nacional do RNMBP. Nascer Prematuro em Portugal. Estudo Multicêntrico Nacional 1996 – 2000. Lisboa: Fundação Bial, 2002
Soll RF, Barkhuff W. Noninvasive ventilation in the age of surfactant administration. Clin Perinatol 2019;46:493-516
Strueby L, Thébaud B. Novel therapeutics for bronchopulmonary dysplasia. Curr Opin Pediatr 2018;30:378-383
Taglauer E, Abman SH, Keller RL. Recent advances in antenatal factors predisposing to bronchopulmonary dysplasia. Semin Perinatol 2018;42:413-424
Thebaud B, Kourembanas S. Can we cure bronchopulmonary dysplasia? J Pediatr 2017;191:12–14
Thebaud B. Stem cell-based therapies in Neonatology: a new hope. Arch Dis Child Fetal Neonatal Ed 2018;103:F583–F588. doi:10.1136/archdischild-2017-314451
Tipple TE, Ambalavanan N. Oxygen toxicity in the neonate: thinking beyond the balance. Clin Perinatol 2019;46:435-448
Trittmann JK, Bartenschlag A, Zmuda EJ, et al. Using clinical and genetic data to predict pulmonary hypertension in bronchopulmonary dysplasia. Acta Paediatrica 2018;107:2158-2164
Vayalthrikkovil S, Vorhies E, Stritzke A, et al. Prospective study of pulmonary hypertension in preterm infants with bronchopulmonary dysplasia. Pediatr Pulmonol 2019;54:171-178
Wang Q, Zhou B, Cui Q, Chen C. Omega-3 long-chain polyunsaturated fatty acids for bronchopulmonary dysplasia: A meta- analysis. Pediatrics Jul 2019, 144 (1) e20190181; DOI: 10.1542/peds.2019-0181
Yang J, Kingsford RA, Horwood J, et al. Lung function of adults born at very low birth weight. Pediatrics 2020;145(2):e20192359
Zhou D, Shi F, Xiong Y, et al. Increased serum Th2 chemokine levels are associated with bronchopulmonary dysplasia in premature infants. Eur J Pediatr 2019;178:81-87