Definição e importância do problema
O termo Cardiomiopatias designa um grupo heterogéneo de doenças do miocárdio associadas a disfunção, mecânica ou eléctrica, cursando habitualmente com hipertrofia ou dilatação ventricular, na ausência de anomalias estruturais anatómicas.
De acordo com a classificação mais recente, dividem-se em dois grupos:
- cardiomiopatias primárias (com envolvimento confinado ao miocárdio, de causa genética, adquirida ou mista); e
- cardiomiopatias (resultantes de doença sistémica com envolvimento cardíaco) (Quadro 1).
QUADRO 1 – Classificação das cardiomiopatias
| Cardiomiopatias primárias | Genéticas | Cardiomiopatia hipertrófica, displasia arritmogénica do ventrículo direito, não compactação do ventrículo esquerdo, doenças do tecido de condução, doenças dos canais celulares (canalopatias) |
| Adquiridas | Miocardite | |
| Mistas | Cardiomiopatia dilatada, cardiomiopatia restritiva não hipertrófica | |
| Cardiomiopatias secundárias | Infiltrativas, doenças metabólicas de armazenamento, toxicidade, endócrinas, neuromusculares, neurofaciais, carências nutricionais, doenças autoimunes, desequilíbrios hidroelectrolíticos, secundárias a neoplasias | |
De acordo com uma classificação funcional, as cardiomiopatias incluem as formas hipertrófica, dilatada e restritiva. Considera-se ainda um quarto grupo não classificável de cardiomiopatias, susceptível de enquadramento nos três grupos anteriores. De acordo com o Registo Nacional de Cardiomiopatias dos Estados Unidos da América, a forma dilatada é a mais frequente (58%), seguida da hipertrófica (25%). As formas restritiva e as não classificadas representam 3% e 4%, respetivamente.
A incidência anual é de 1,1 a 1,2 por 100.000 indivíduos em idade pediátrica; os internamentos por cardiomiopatia não ultrapassam 1% do total de internamentos por doença cardíaca em crianças e jovens. Tratando-se duma doença grave, cabe salientar que cerca de 40% das crianças atingidas morrem ou necessitam de transplante cardíaco nos primeiros dois anos após o início dos sintomas.
A apresentação é mais frequente no primeiro ano de vida, registando-se um segundo pico durante a adolescência. Os estudos genéticos confirmam etiopatogénese hereditária numa percentagem elevada de casos.
Seguidamente procede-se a breve descrição das miocardiopatias mais comuns e clinicamente mais relevantes.
1. Cardiomiopatia dilatada
A cardiomiopatia dilatada é uma doença do músculo cardíaco caracterizada por dilatação ventricular com diminuição da contractilidade (primariamente disfunção sistólica).
Aspectos epidemiológicos
A incidência anual é cerca de 0,58 a 0,73 por 100.000 crianças e jovens. Existem múltiplas causas identificadas, sendo a causa vírica responsável por 9% a 13% dos casos.
As doenças neuromusculares, em particular a distrofia muscular de Duchenne, representam cerca de 12% dos casos. Os casos familiares constituem cerca de 6% do total.
Outras causas incluem alterações isquémicas (anomalias das coronárias, disritmias prolongadas), doenças hereditárias do metabolismo (mucopolissacaridoses, doenças de armazenamento de glicogénio/glicogenoses, esfingolipidoses), lesões por tóxicos (destacando-se os antineoplásicos), alterações endócrinas (por exemplo da tiróide) ou carências nutricionais (beribéri, kwashiorkor).
Em cerca de 65% a 70% dos casos considerados idiopáticos foram demonstrados defeitos genéticos e antecedentes de miocardite vírica por estudo PCR (Polymerase Chain Reaction).
Manifestações clínicas
A cardiomiopatia dilatada apresenta-se como insuficiência cardíaca congestiva que, nos recém-nascidos e lactentes, se manifesta por cansaço durante a alimentação e má progressão estaturo-ponderal.
O exame objectivo revela polipneia, má perfusão periférica, hepatomegália e edema. A auscultação cardíaca revela taquicardia, diminuição da intensidade dos ruídos cardíacos e ritmo de galope. Notam-se sinais de congestão venosa e diminuição do murmúrio vesicular nas bases pulmonares. Os casos mais graves apresentam-se com falência circulatória por choque cardiogénico.
Exames complementares
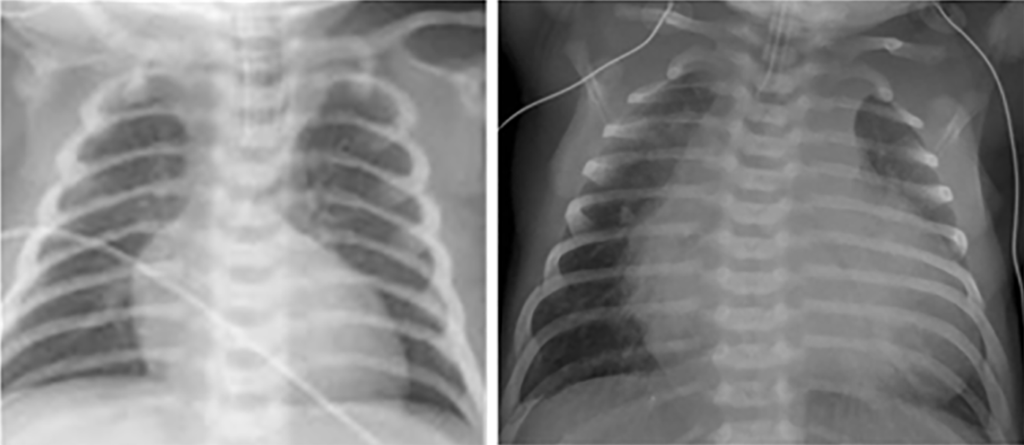
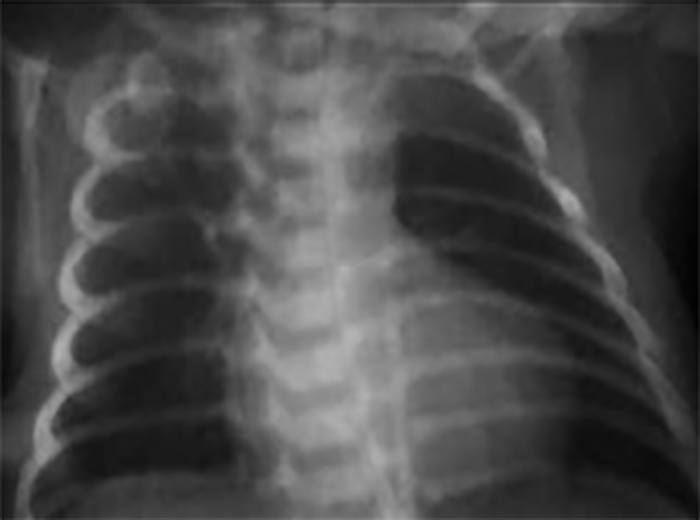
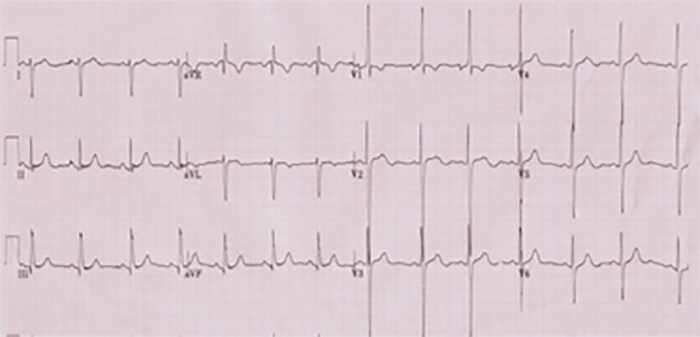
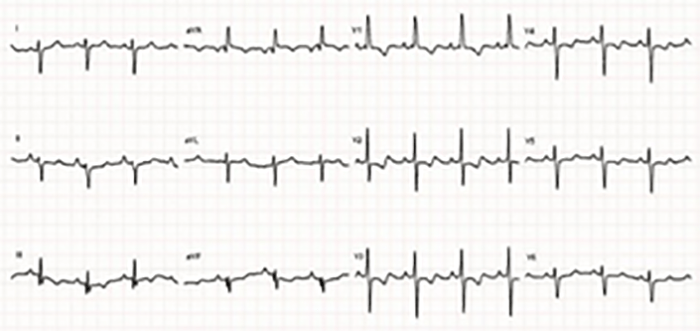
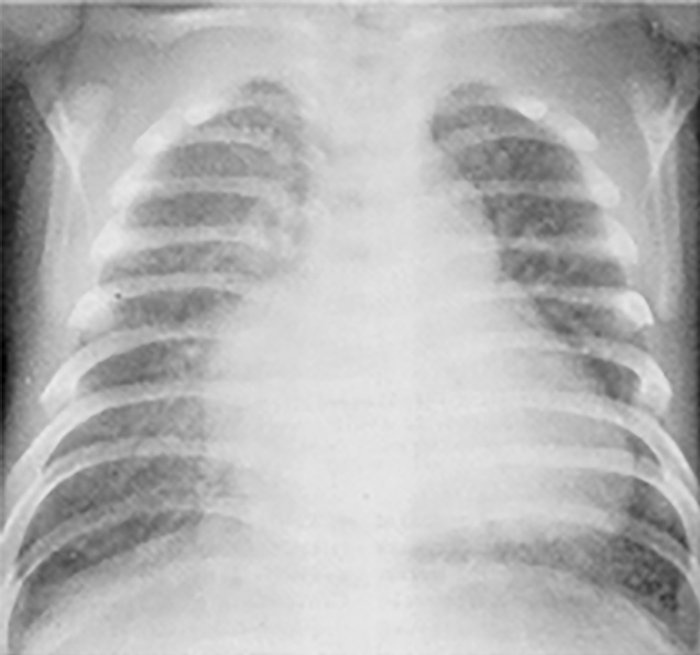
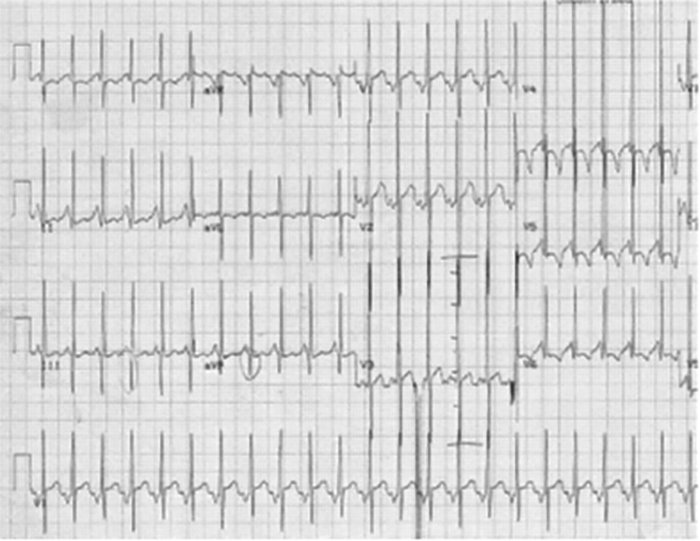
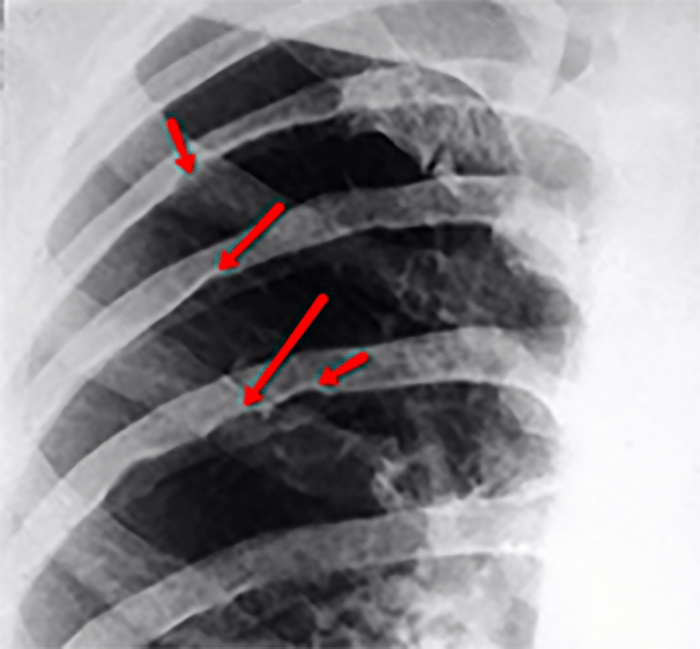
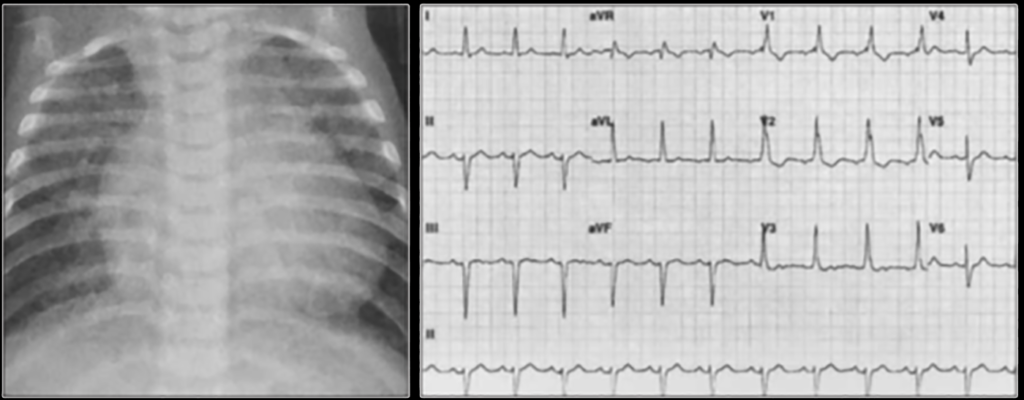
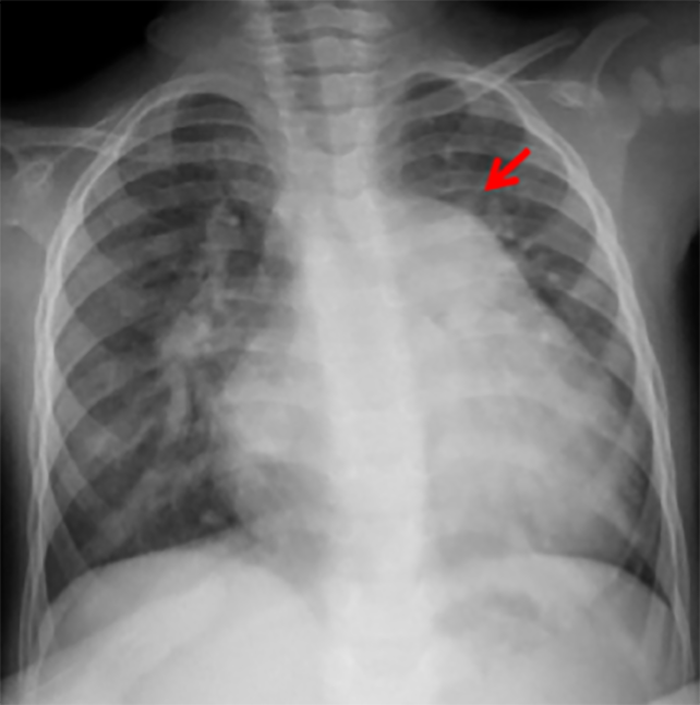
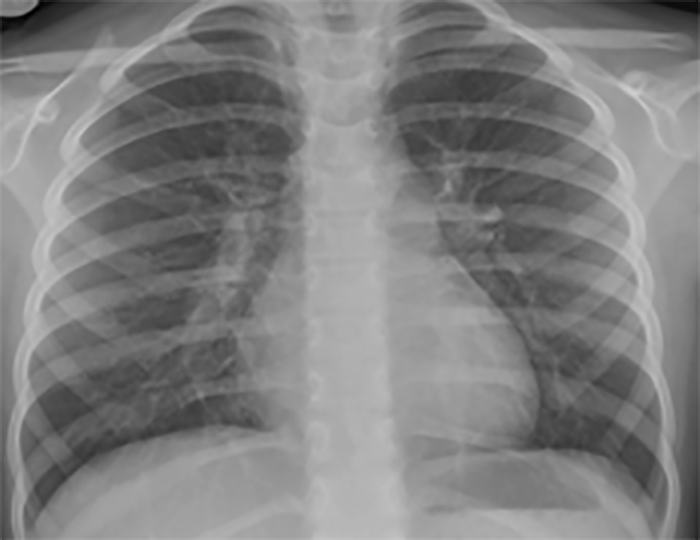
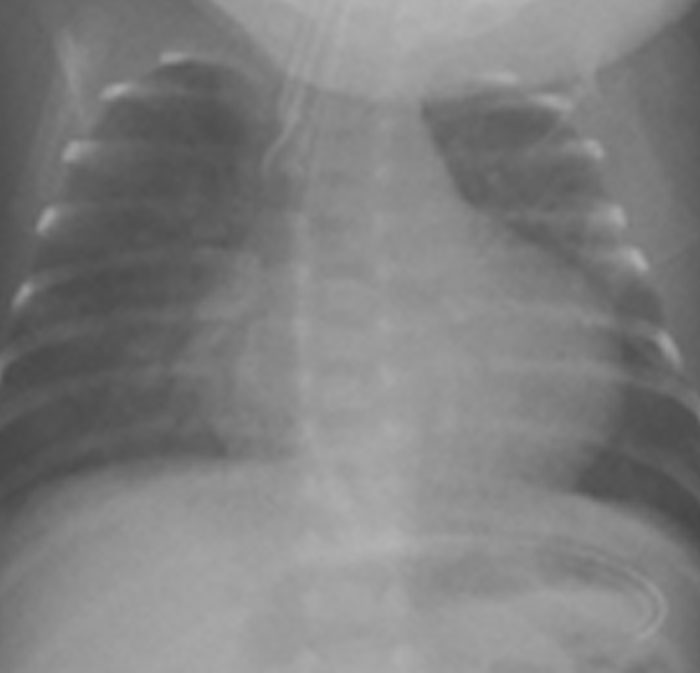
No electrocardiograma observam-se sinais de taquicardia sinusal, alterações da repolarização, e hipertrofia ventricular. A presença de ondas Q profundas em derivações esquerdas deve alertar para a possibilidade de anomalia coronária. A radiografia do tórax revela cardiomegália e congestão venosa pulmonar.
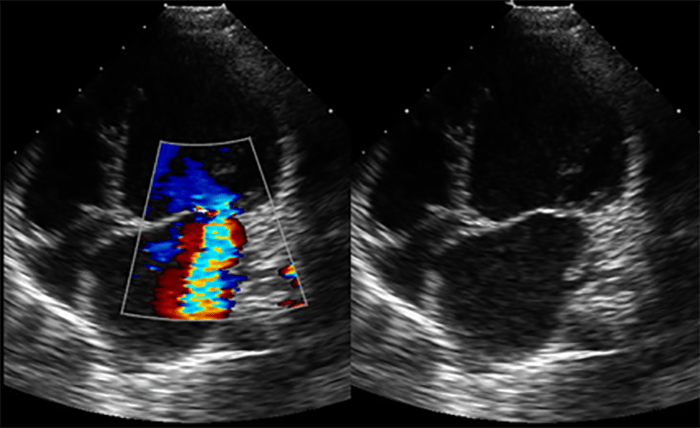
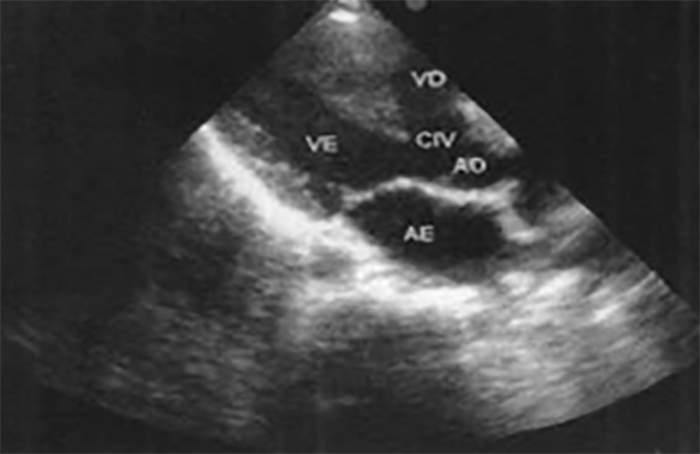
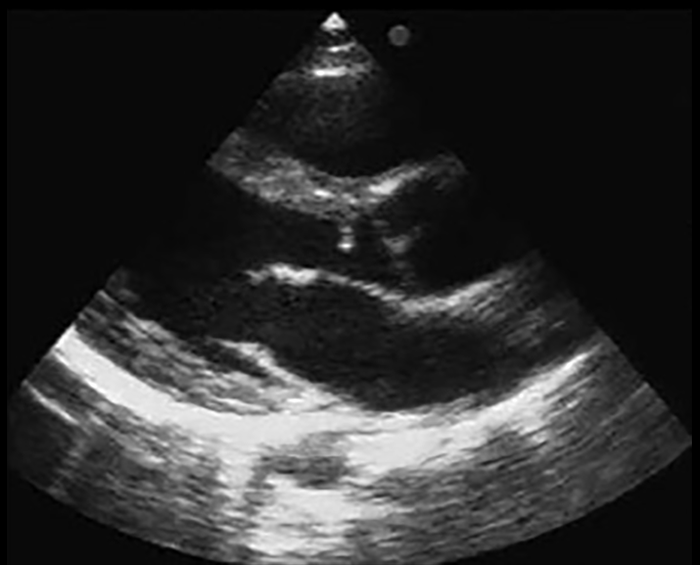
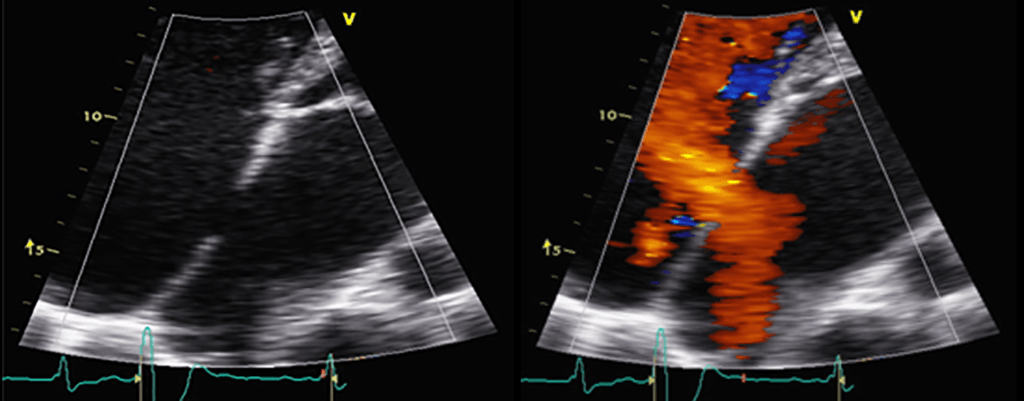
O ecocardiograma permite identificar a dilatação ventricular, detectar anomalias, avaliar a função valvular e a presença de derrame pericárdico ou de trombos.
Os métodos de diagnóstico etiológico devem incluir biópsia endomiocárdica, doseamento de enzimas musculares, estudos metabólicos, genéticos, víricos por PCR e rastreio familiar.
Tratamento e prognóstico
O tratamento é sintomático. Nos casos ligeiros, o tratamento consiste em facilitar o débito sistémico através da vasodilatação periférica com inibidores da enzima de conversão da angiotensina (captopril e outros) e beta-bloqueantes (propranolol e, mais recentemente, carvedilol).
O agravamento de sintomas requer uma actuação mais agressiva que inclui diuréticos e inotrópicos (digoxina, perfusão endovenosa de dopa e/ou dobutamina, milrinona). As arritmias devem ser controladas com medicação apropriada. Nos casos mais graves pode ser necessário recorrer a meios de suporte circulatório mecânico externo transitoriamente, ou a transplantação cardíaca.
O prognóstico é reservado: com os recursos atualmente disponíveis, cerca de um terço das crianças morre ou necessita de transplante cardíaco.
2. Cardiomiopatia hipertrófica
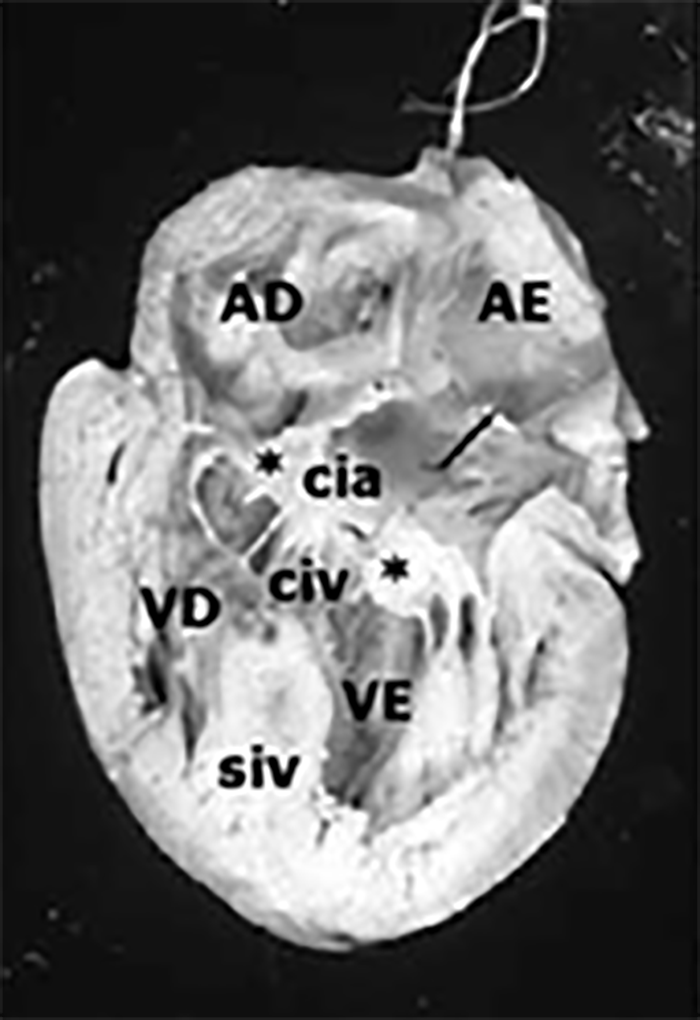
A cardiomiopatia hipertrófica consiste em hipertrofia ventricular assimétrica com função sistólica habitualmente conservada e disfunção diastólica.
Aspetos epidemiológicos
A incidência anual é cerca de 0,32 a 0,47 casos por 100.000 crianças e jovens. A cardiomiopatia hipertrófica pode ser primária ou secundária. A forma primária resulta de anomalias genéticas das proteínas contrácteis do sarcómero cardíaco.
Existem cerca de 200 anomalias identificadas na base de dados das mutações da Universidade de Harvard (USA) em cerca de 10 genes das proteínas do sarcómero. Destacam-se como mais frequentes e responsáveis pela maioria dos casos, as anomalias localizadas na cadeia pesada da miosina, na proteína C de ligação à miosina, e na troponina T.
Apesar de estar provada cientificamente a importância da genética para a clínica, não estão ainda generalizados os métodos de diagnóstico genético nesta área.
A cardiomiopatia hipertrófica pode ser secundária a múltiplas doenças ou síndromas de que se destacam: embriofetopatia diabética, síndroma de Noonan, défice de L-carnitina, doenças de armazenamento de glicogénio e da cadeia respiratória.
Manifestações clínicas
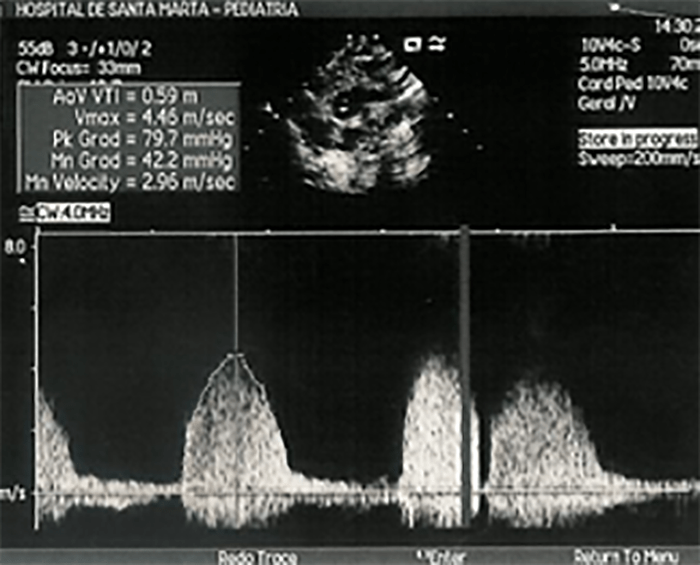
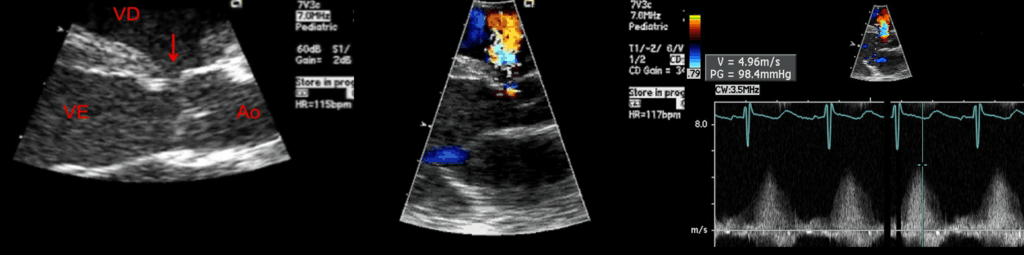
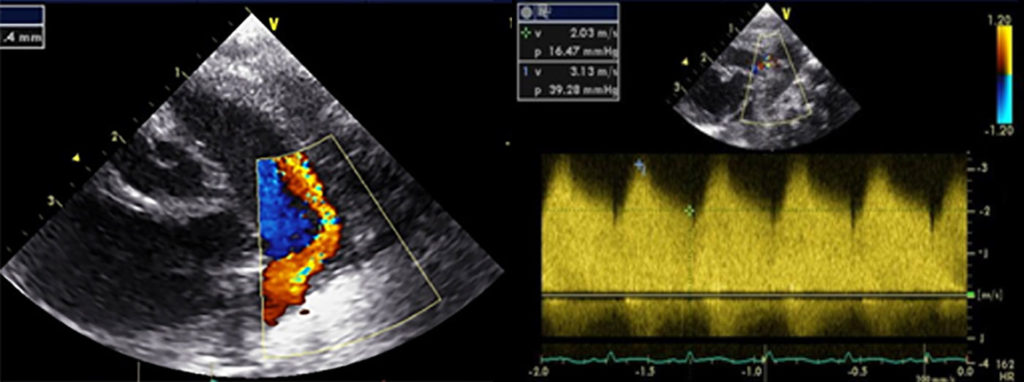
Do ponto de vista clínico, as cardiomiopatias hipertróficas são subdivididas em obstrutivas (gradiente de saída ventricular > 30 mmHg) e não obstrutivas. A presença e o grau de obstrução constituem um factor com influência no quadro clínico e no prognóstico.
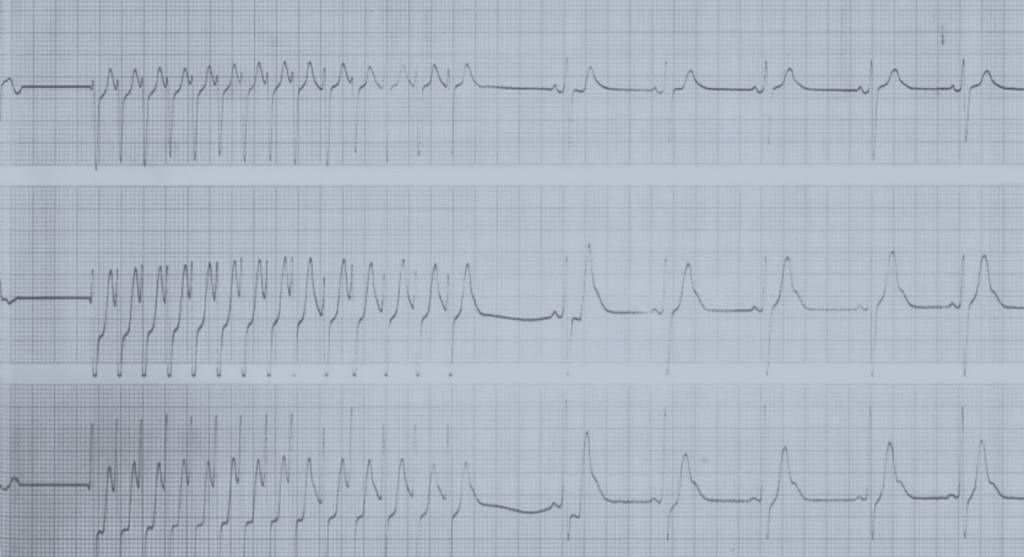
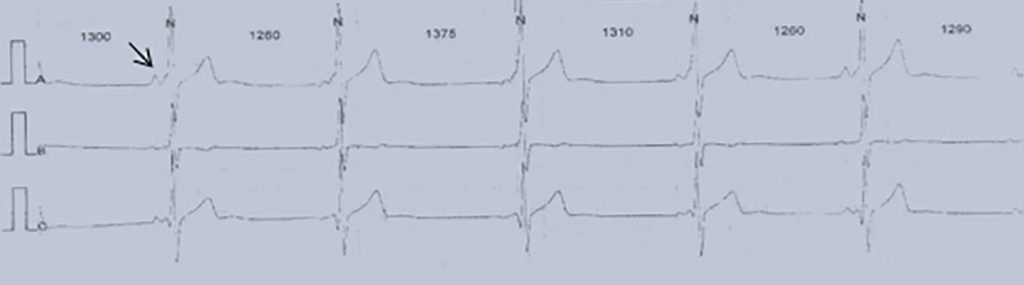
As formas não obstrutivas são geralmente assintomáticas. Os sintomas na forma obstrutiva (diminuição da tolerância ao esforço, angina, dispneia, palpitações e síncope) resultam da combinação da disfunção diastólica e do obstáculo dinâmico. As manifestações clínicas da cardiomiopatia hipertrófica primária surgem habitualmente na adolescência (12-18 anos) sendo esta doença a causa mais frequente de morte súbita (por taquicardia ventricular e/ou isquémia aguda) em adolescentes.
Exames complementares
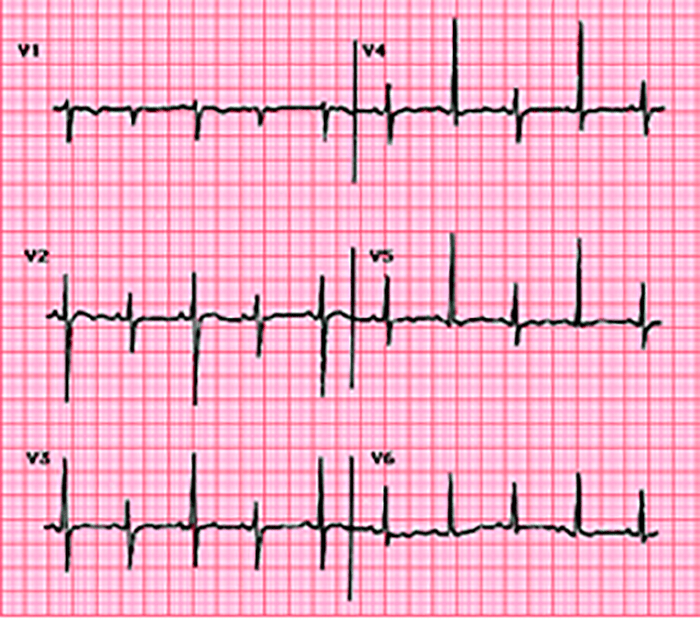
O electrocardiograma apresenta alterações como sinais de hipertrofia ventricular esquerda ou biventricular, alterações inespecíficas da repolarização ventricular e, mais raramente, prolongamento do intervalo QT e ondas Q anómalas.
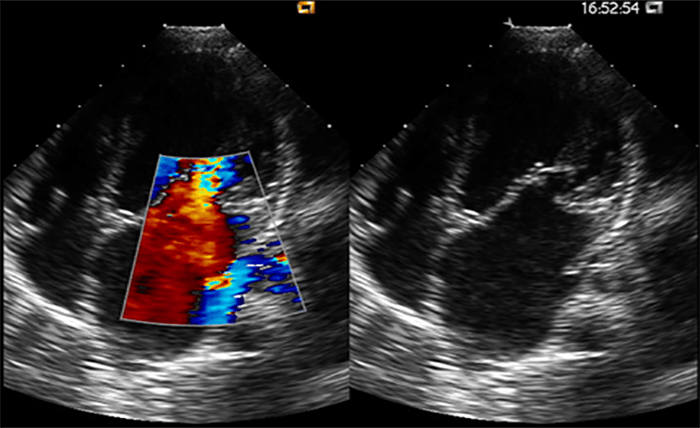
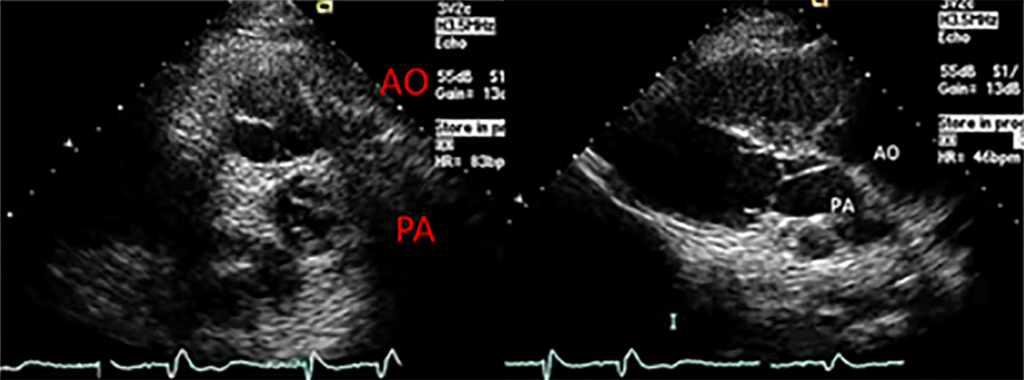
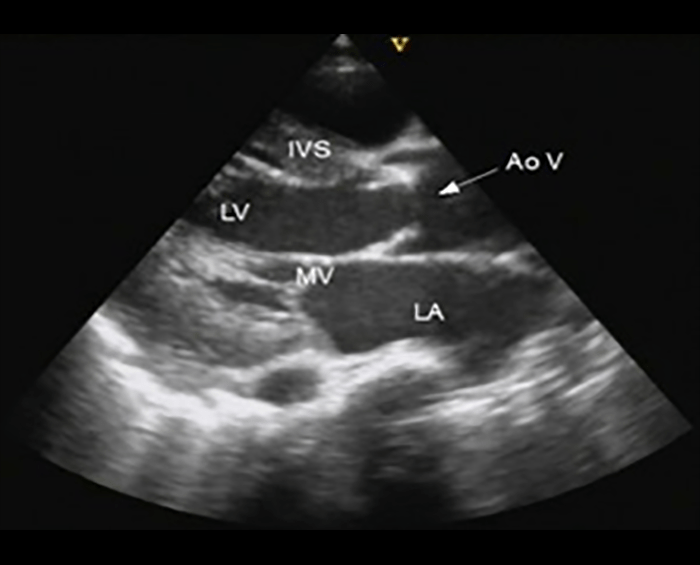
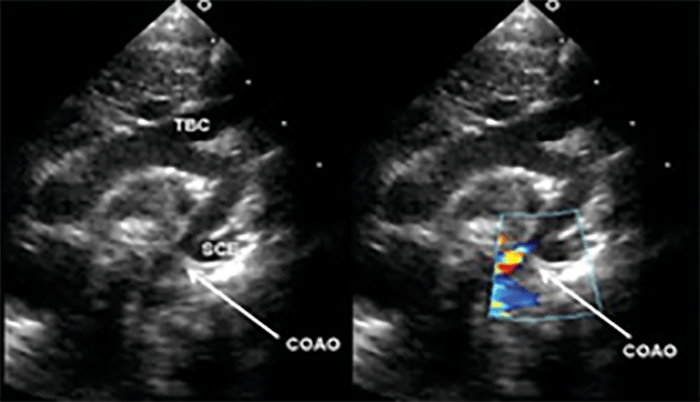
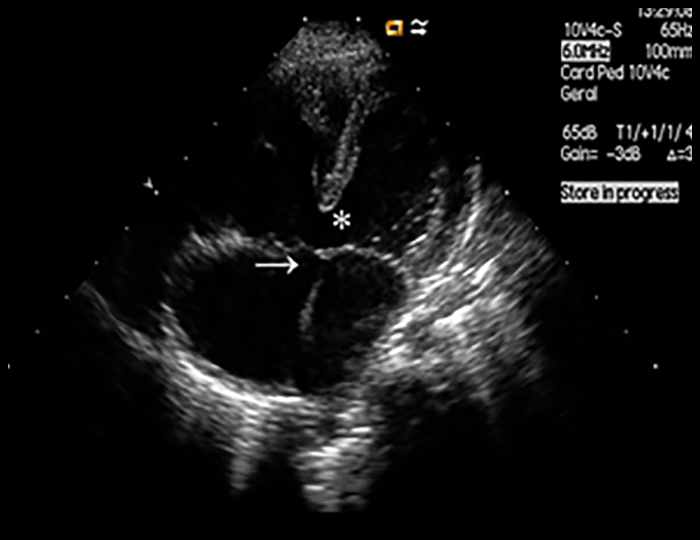
A radiografia do tórax revela sinais de cardiomegália. O ecocardiograma permite identificar sinais de hipertrofia ventricular assimétrica (mais acentuada no septo interventricular), avaliar o grau de obstáculo da saída ventricular, a função miocárdica, e o grau de envolvimento da válvula mitral.
Os doentes devem ser seguidos com electrocardiograma (incluindo registos de Holter) e ecocardiogramas seriados.
Tratamento e prognóstico
A terapêutica está indicada nos casos sintomáticos ou quando existem factores de risco de morte súbita, tais como história familiar de morte súbita, evidência de taquicardia ventricular persistente e identificação de mutação de alto risco.
A terapêutica médica inclui o evitamento de esforços intensos e a utilização de beta-bloqueantes (com a finalidade de aliviar o obstáculo de saída do ventrículo esquerdo e melhorar a dinâmica diastólica ventricular esquerda).
A eficácia da utilização profiláctica de beta-bloqueantes em doentes assintomáticos, com a finalidade de alterar a progressão da doença, não está demonstrada. Nos casos de défice de L-carnitina, está indicada a administração oral deste nutriente. As indicações para colocação de dispositivos para cardioversão – desfibrilhadores implantáveis em crianças são controversas; justificam-se apenas como prevenção secundária nos doentes submetidos a ressuscitação após episódios de “morte aparente”, e como prevenção primária nos casos comportando múltiplos factores de risco de morte súbita.
Em casos refractários, está indicada a remoção cirúrgica do obstáculo subaórtico por miectomia. O transplante cardíaco é uma opção que deve ser cuidadosamente avaliada depois de excluídas causas extracardíacas da doença. A terapia génica dá, neste momento, os primeiros passos de um futuro promissor.
O prognóstico é variável devido à heterogeneidade genética e à variabilidade das causas secundárias. Estima-se, para a totalidade da população (crianças e adultos), um risco de morte súbita de 1% por ano. Nos doentes sintomáticos com menos de um ano de idade, o prognóstico é particularmente adverso e a causa de morte é habitualmente insuficiência cardíaca (90%).
3. Cardiomiopatia restritiva
As cardiomiopatias restritivas caracterizam-se por disfunção ventricular diastólica com função sistólica preservada, ausência de hipertrofia ou dilatação ventricular, e dilatação biauricular (primeiramente disfunção diastólica, muitas vezes combinada com disfunção sistólica).
Aspectos epidemiológicos
Constituem 2,5 a 5% dos casos de cardiomiopatia. Na maioria dos casos, não é possível identificar a causa (formas idiopáticas). Alguns casos são secundários a doenças infiltrativas miocárdicas, fibrose endomiocárdica ou miopatias familiares.
Manifestações clínicas
A restrição da drenagem venosa pulmonar (para a aurícula esquerda) e sistémica (para a aurícula direita) resulta em aumento das pressões de enchimento ventriculares (telediastólica) e hipertensão pulmonar.
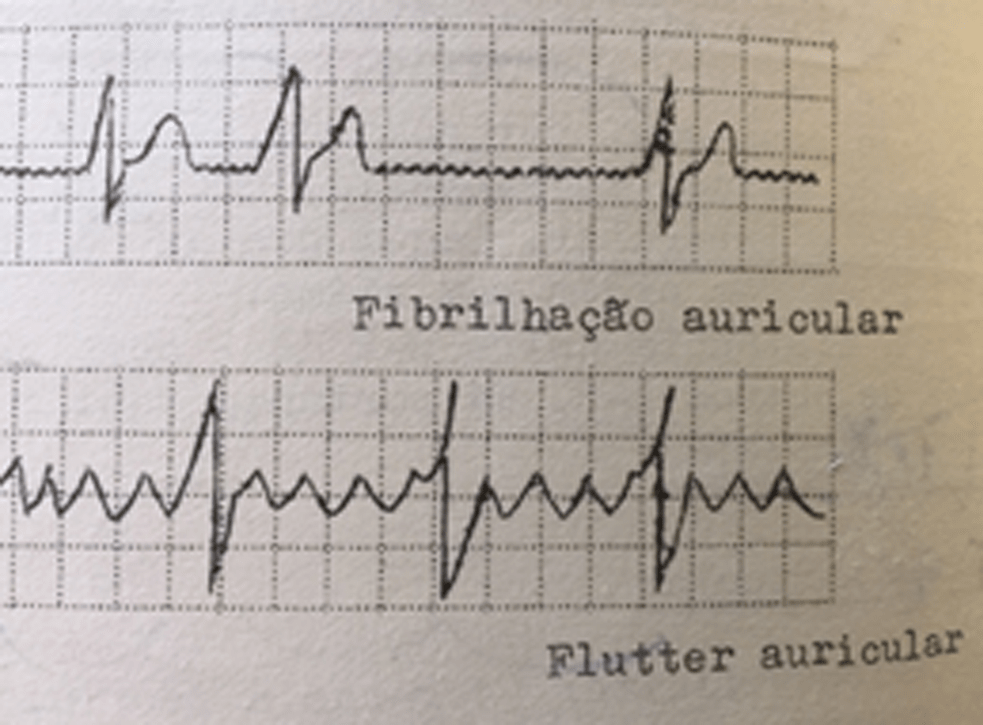
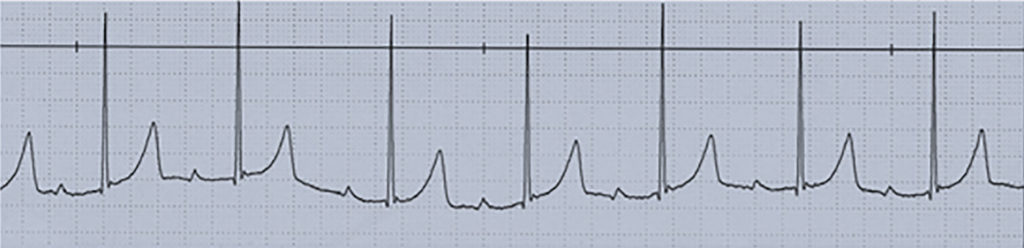
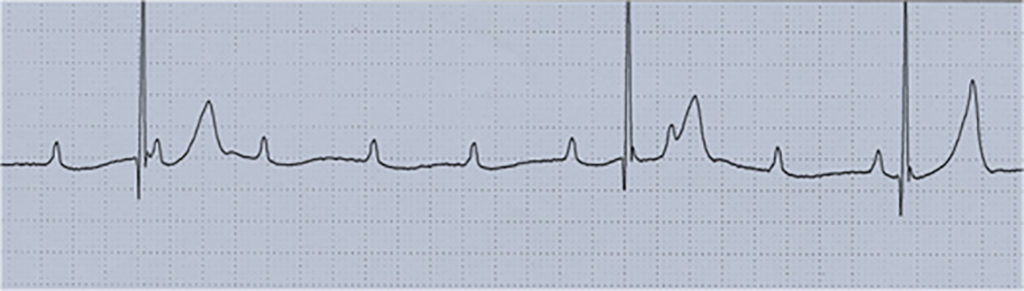
A maioria dos doentes apresenta sinais discretos de compromisso cardíaco, sendo a doença detectada em exames “de rotina”. Alguns doentes referem intolerância e dispneia com o esforço e síncope. As manifestações da doença surgem habitualmente entre os cinco e oito anos de idade. Há uma incidência elevada de fenómenos tromboembólicos sistémicos e de perturbações do ritmo cardíaco (taquidisritmias e bloqueio auriculoventricular completo).
Exames complementares
O electrocardiograma apresenta sinais de dilatação biauricular. Na radiografia do tórax destacam-se sinais de cardiomegália e congestão pulmonar. A ecocardiografia mostra sinais de dilatação auricular sem alterações ventriculares evidentes. O cateterismo cardíaco revela pressões telediastólicas elevadas, hipertensão pulmonar e aumento da resistência vascular pulmonar.
Tratamento e prognóstico
A terapêutica médica anticongestiva (vasodilatadores sistémicos, diuréticos, inotrópicos) não altera o curso desta doença, considerando-se que o único tratamento adequado é o transplante cardíaco. A utilização de vasodilatadores pulmonares antes do transplante pode contribuir para melhorar o pós-operatório destes doentes.
O prognóstico dos doentes não transplantados é reservado, com sobrevida de 20 a 30% aos 10 anos. O tempo médio entre o diagnóstico e o transplante é ~ 2 a 3 anos. Como a história natural da doença é heterogénea, é difícil estabelecer momento ideal para o transplante cardíaco. No entanto, a descompensação hemodinâmica condiciona negativamente o prognóstico da cirurgia.
4. Outras cardiomiopatias
Ventrículo esquerdo não compactado
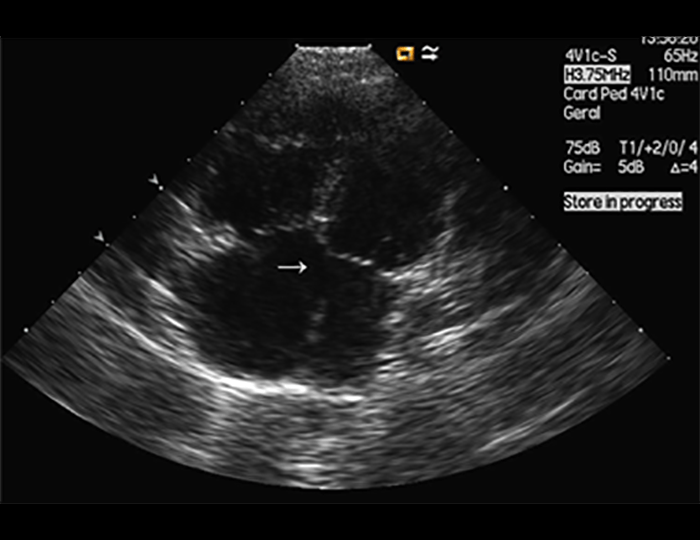
O ventrículo esquerdo não compactado é uma cardiomiopatia secundária a provável paragem na morfogénese endomiocárdica fetal, a qual resulta em múltiplas trabeculações ventriculares proeminentes e recessos intraventriculares profundos.
Aspectos epidemiológicos
Embora estejam descritas apenas algumas centenas de casos em idade pediátrica, publicações recentes sugerem que a doença corresponde a cerca de 10% do total das cardiomiopatias.
Regista-se uma incidência familiar de 20 a 50% e uma associação a malformações cardíacas simples, como comunicações interventriculares em cerca de 40% dos casos. Estudos referentes a populações adultas referem coexistência de doenças neuromusculares em 80% dos casos.
Manifestações clínicas
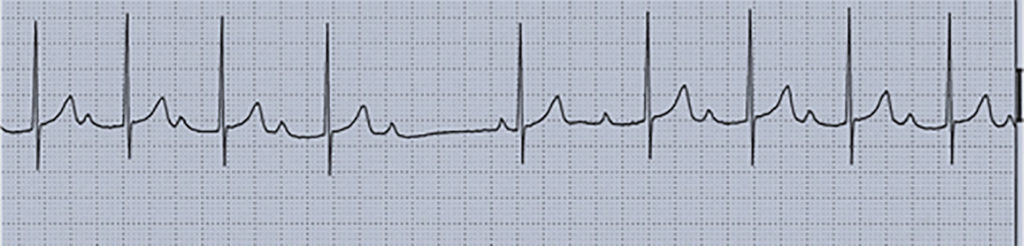
A apresentação clínica é variável. Cerca de dois terços dos doentes apresentam insuficiência cardíaca no primeiro ano de vida; nos restantes, a doença é detectada em ecocardiogramas efectuados por sopro cardíaco ou por alterações electrocardiográficas minor. Estão descritos casos de embolias e arritmias ventriculares.
Exames complementares
As alterações electrocardiográficas, presentes em 75% dos doentes, consistem em hipertrofia ventricular, alterações da repolarização, vias de condução acessórias e extrassistolia.
O ecocardiograma identifica a anatomia característica, que inclui o aspecto “espongiforme” do ventrículo esquerdo, habitualmente no septo e parede posterior. A função ventricular sistólica está geralmente afectada. Os critérios ecocardiográficos quantitativos, propostos para doentes adultos, não são consensuais para a população pediátrica.
Tratamento e prognóstico
O tratamento é sintomático. A transplantação cardíaca é a única opção nos casos refractários. A evolução da doença é variável, registando-se melhoria da função ventricular nalguns casos. A mortalidade é ~ 25% aos 10 anos de seguimento.
Displasia arritmogénica do ventrículo direito
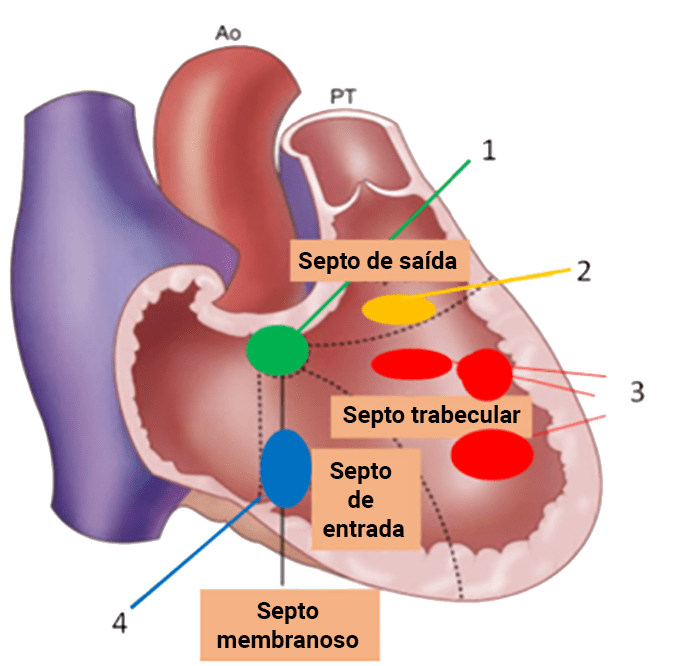
A displasia arritmogénica do ventrículo direito é uma cardiomiopatia geneticamente determinada que consiste na substituição do miocárdio do ventrículo direito por tecido fibroso e adiposo.
Aspectos epidemiológicos e genéticos
Verifica-se em geral hereditariedade autossómica dominante com penetrância variável. Descrita há três décadas, tem sido progressivamente reconhecida como causa importante de morte súbita em adultos.
Manifestações clínicas
As arritmias ventriculares são a forma predominante de apresentação da doença, habitualmente na idade adulta. A doença é rara em crianças, estando, no entanto, descrita em adolescentes. Os casos avançados apresentam-se com insuficiência cardíaca direita.
Exames complementares
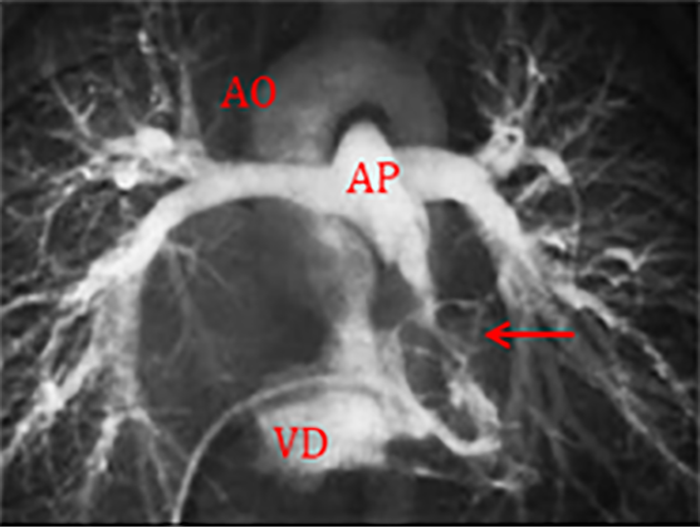
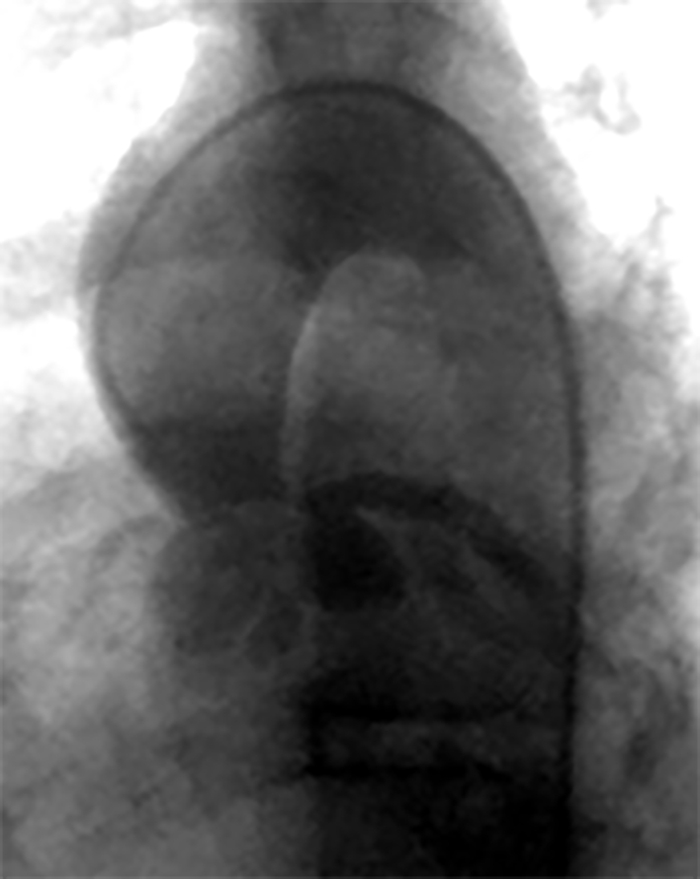
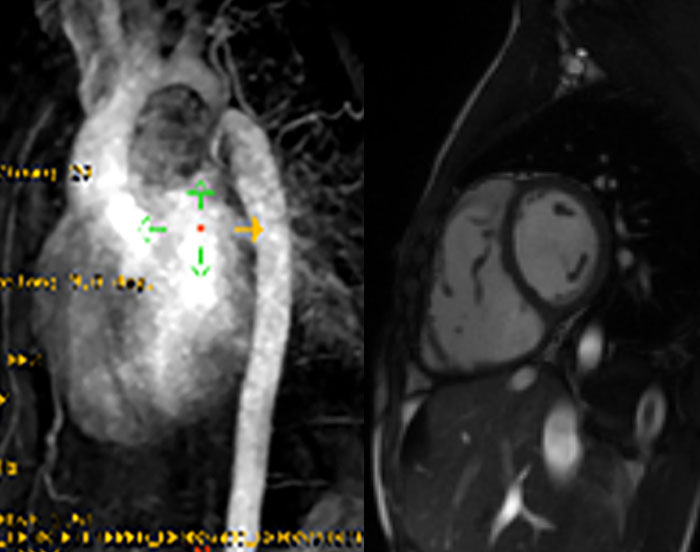
O diagnóstico resulta da combinação de dados relativos à história familiar, alterações electrocardiográficas (ondas T invertidas nas derivações pré-cordiais direitas, taquicardia ventricular com bloqueio de ramo esquerdo, potenciais tardios, entre outros), detecção de arritmias (em registos de Holter ou provas de esforço) e alterações macro ou microscópicas do ventrículo direito. A RM tem sido recentemente sugerida como meio de diagnóstico morfológico não invasivo ideal.
Tratamento e prognóstico
O tratamento médico consiste na utilização de antiarrítmicos, estando a utilização de cardioversores-desfibrilhadores implantáveis reservada para casos refractários ou com história de síncope.
GLOSSÁRIO
Gradiente de saída ventricular > Gradiente de saída é o valor da diferença de pressão entre a cavidade ventricular, neste caso a esquerda e a aorta, avaliada por ecocardiografia ou invasivamente por cateterismo cardíaco.
BIBLIOGRAFIA
Ali SK, Godman MJ. The variable clinical presentation of, and outcome for, noncompaction of the ventricular myocardium in infants and children, an underdiagnosed cardiomyopathy. Cardiol Young 2004; 14: 409-416
Cruz E, Ivy D, Jaggers J (eds). Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care. London: Springer-Verlag, 2014
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Hulot JS, Jouven X, Empana JP, Frank R, Fontaine G. Natural history and risk stratification of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Circulation 2004; 110: 1879-1884
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lipshultz SE, Sleeper LA, Towbin JA, et al. The incidence of pediatric cardiomyopathy in two regions of the United States. N Engl J Med 2003; 348: 1647-1655
Maron BJ, McKenna WJ, Danielson GK, et al. American College of Cardiology/European Society of Cardiology clinical expert consensus document on hypertrophic cardiomyopathy. J Am Coll Cardiol 2003; 42: 1687-1713
Maron BJ, Towbin JA, Thiene G, et al. Contemporary Definitions and Classification of the Cardiomyopathies. An American Heart Association Scientific Statement. Circulation. 2006; 113: 1807-1816
Nogueira G, Pinto FF, Paixão A, Kaku S. Idiopathic dilated cardiomyopathy in children: clinical profile and prognostic determinants. Rev Port Cardiol 2000; 19: 191-200
Nugent AW, Daubeney PE, Chondros P, et al. National Australian Childhood Cardiomyopathy Study. The epidemiology of childhood cardiomyopathy in Australia. N Engl J Med 2003 24; 348: 1639-1646
Park MK (ed). Park’s Pediatric Cardiology for practitioners. Philadelphia: Elsevier, 2014
Pignatelli RH, McMahon CJ, Dreyer WJ, et al. Clinical characterization of left ventricular noncompaction in children: a relatively common form of cardiomyopathy. Circulation 2003; 108: 2672-2678
Sen-Chowdhry S, Lowe MD, Sporton SC, McKenna WJ. Arrhythmogenic right ventricular cardiomyopathy: clinical presentation, diagnosis, and management. Am J Med 2004; 117: 685-695