Definições e importância do problema
Arritmia etimologicamente significa ausência de ritmo. Na perspectiva da cardiologia, refere-se a alterações do automatismo e da condução do impulso cardíaco. Disritmia significa perturbação da frequência e/ou do ritmo cardíaco. Na prática clínica os referidos termos são utilizados como sinónimos, salientando-se que muitos autores dão preferência ao termo “disritmia”. Extrassistolia é definida como contracções anormais, prematuras ou antecipadas do coração, traduzidas por irregularidade do ritmo cardíaco (extrassístoles). Arritmia respiratória é uma situação frequente e benigna em que se verifica variabilidade da frequência cardíaca com os movimentos respiratórios: aumento na inspiração, e diminuição na expiração.
Nas últimas décadas tem surgido um interesse crescente por esta patologia pelas seguintes razões: – incremento da respectiva prevalência, relacionada com o desenvolvimento da genética e a detecção crescente de formas hereditárias; – desenvolvimento da cirurgia e cateterismo cardíacos; – desenvolvimento da quimioterapia; – efeito de acidentes tóxicos; – suporte vital no contexto de situações críticas requerendo terapia intensiva, etc.. Surgiram, entretanto, novos métodos de estudo e novos tratamentos incluindo os realizados no período pré-natal e utilizando a via transplacentar.
Testemunhando a importância deste problema clínico, citam-se alguns dados epidemiológicos:
- as disritmias surgem entre 1 e 2% em fetos na fase final da gravidez; entre 1 e 5% em recém-nascidos; globalmente, em cerca de 5% de crianças com menos de 7 anos; e, podem atingir 90% em recém-nascidos pré-termo, com base em dados obtidos em registos Holter;
- a extrassistolia pode ocorrer em cerca de 1-2% de crianças consideradas saudáveis;
- as taquicardias supraventriculares, as arritmias mais comuns em idade pediátrica, podem, em cerca de 30% das mesmas, manifestar-se nas primeiras semanas de vida.
A prevalência das disritmias é mais elevada em crianças com cardiopatia congénita submetida ou não a cirurgia cardíaca, salientando-se que o miocárdio na criança tolera frequências cardíacas mais elevadas que o do adulto.
Na maioria dos casos as disritmias têm características benignas, não necessitam de tratamento e têm bom prognóstico. O diagnóstico é fundamental para o tratamento correcto, para tal, além da história clínica (anamnese e exame objectivo), importa a execução de determinados exames complementares, destacando-se, entre estes, o ECG nas suas diversas modalidades, pela sua simplicidade e importância.
Neste capítulo abordam-se as disritmias cardíacas mais frequentes em idade pediátrica.
Etiopatogénese
I – Generalidades
No coração, como se sabe, todos os miócitos têm, entre outras, a propriedade do automatismo. Isto é, todas as células conseguem despolarizar-se e contrair-se; no entanto, não o fazem da mesma forma relativamente ao ritmo a que conseguem despolarizar-se.
Importa salientar que existem células especiais ou “especializadas” que têm capacidade de o fazer mais rapidamente; tais células, que integram o tecido de condução cardíaco, dispõem-se em grupos, formam verdadeiras “estradas” ou vias, e conduzindo os estímulos ou influxos nervosos que permitem marcar o ritmo da frequência cardíaca de cada indivíduo). (ver Glossário do capítulo anterior)
Na verdade, os estímulos ou influxos não circulam ao acaso, mas por estas vias. Para que o ritmo seja síncrono e haja tempo para o sangue entrar e sair em cada contracção ventricular, a contracção não se verifica em todas as células em simultâneo; designadamente, tem de existir tempo de latência entre a contracção das aurículas e a dos ventrículos.
E, para que tal aconteça, existem determinados pontos, ao longo do trajecto da via, que “travam a velocidade” do influxo, tornando-o mais lento (sendo o nódulo auriculoventricular/NAV um deles), permitindo que os influxos despolarizem rapidamente toda a aurícula, “esperem um pouco” no referido NAV e, um pouco depois, despolarizem as células ventriculares, permitindo a contração ventricular depois da auricular.
Acontece que, em determinadas circunstâncias, poderão existir “grupos de células que se organizam” para se constituir uma via de condução rápida, passando ao lado (fazendo bypass) ao NAV. Assim, os influxos, chegando a esta via, que permite passagem ”rápida”, poderão “voltar para trás” e entrar (ou melhor, reentrar) na via normal caso esta esteja “desimpedida”, com possibilidade de receber tal influxo em direcção ao ventrículo.
Ou seja, o influxo segue um trajecto ou movimento circular até reentrar/reencontrar a via normal em direcção ao ventrículo (movimento de reentrada), ou que se transmite ao ventrículo. Esta explicação “simplista” permitirá compreender melhor o conceito de mecanismo de reentrada, adiante abordado.
II – Factores etiopatogénicos
Os factores etiopatogénicos das disritmias, que importa investigar, são muito diversos. Em idade pediátrica os mais frequentemente implicados são: cardiopatia estrutural (congénita ou adquirida); pós-operatório de intervenção cardíaca; inflamações/infecções cardíacas (pericardite e miocardite); doenças do miocárdio (cardiomiopatia; doenças metabólicas ou de depósitos); alterações da tiróide; tumores cardíacos; alterações genéticas do sistema de condução (síndromas do QT longo, de Wolff-Parkinson-White, de Jervel, etc.); alterações electrolíticas (envolvendo os iões K+, Ca++, Mg++); intoxicação acidental (medicamentosa, farmacológica ou outra); e hipotermia, entre outros.
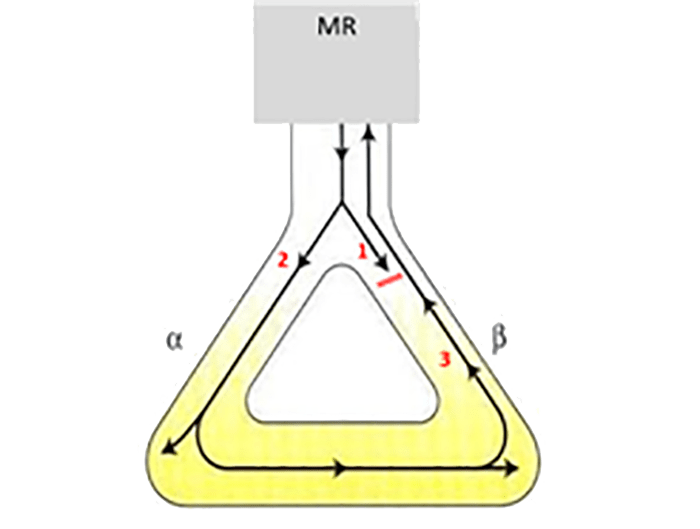
FIGURA 1. Esquema do mecanismo de reentrada (MR): o impulso encontra a via habitual (β) bloqueada (1) e uma via acessória ou anómala (α) disponível para a sua condução, esta via conduz anterogradamente de forma mais rápida (2) e está disposta em forma circular, permitindo a condução retrógrada pela via inicial (3) agora desbloqueada, perpetuando este ritmo
Os mecanismos fisiopatológicos das disritmias podem envolver o sistema gerador dos impulsos, condicionando o aparecimento de fenómenos de automatismo anómalo ou, mais frequentemente, o sistema de condução dos estímulos, provocando mecanismos de condução anormal através de vias de reentrada ou bloqueios de condução. (ver atrás capítulo sobre ECG, abordando aspectos da anatomofisiologia fundamental)
- A anomalia de automatismo surge quando uma zona localizada do miocárdio gera impulsos mais rapidamente do que o nódulo sinusal, passando a assumir o controlo do ritmo. Geralmente surgem a partir de um único local, sendo designadas por focais. Caracterizam-se por apresentarem variabilidade da frequência cardíaca, com um aumento progressivo no início (warm-up) e diminuição no final (cool-down). A frequência cardíaca é em geral menor do que nas taquicardias que se originam devido a mecanismo de reentrada.
- O mecanismo de reentrada é o mais frequente, ocorrendo em 90% dos casos. Caracteriza-se pela presença de um impulso que sendo conduzido pelas vias habituais encontra um circuito circular, com uma das vias bloqueada. O impulso é conduzido pela via disponível de forma mais rápida, e alcança por condução retrógrada a via inicial, agora desbloqueada, formando-se um movimento circular que perpetua este ritmo. Para que surja, devem existir, pelo menos, duas vias distintas em redor da área de bloqueio de condução, vias de condução acessória ou anómala. O impulso que produz a reentrada pode ser normal, gerado no nódulo sinusal, ou anómalo, consequência de automatismo. (Figura 1)
A maioria das disritmias na criança pequena e no feto deve-se a mecanismo de reentrada por via acessória. No adolescente e no adulto é mais frequente a taquicardia de reentrada a nível do nódulo auriculoventricular.
Manifestações clínicas
A apresentação clínica das disritmias em idade pediátrica é muito variável, dependendo da idade, da presença ou ausência de alterações cardíacas estruturais, assim como do tipo de disritmia. (ver adiante)
O recém-nascido e o lactente podem apresentar-se com sintomas e sinais inespecíficos, por vezes confundidos com sépsis: palidez, má perfusão periférica, cianose, irritabilidade, recusa alimentar, taquipneia e hipersudorese. A evolução do quadro clínico pode ser progressiva e conduzir a insuficiência cardíaca (IC) e choque cardiogénico. A probabilidade de desenvolvimento de IC é tanto maior quanto maior a frequência ventricular, menor a idade do doente, maior a duração do episódio, e na presença de cardiopatia congénita. Em cerca de 20% dos lactentes a disritmia é detectada durante uma avaliação médica de rotina, sem sintomas prévios.
As crianças maiores e os adolescentes são capazes de identificar e referir frequências cardíacas elevadas, podendo relatar queixas de palpitações, dispneia e dor torácica, tonturas e síncope. Nestas idades a apresentação em IC é mais rara.
As taquiarritmias são geralmente autolimitadas e intermitentes, quando se mantêm, pelo menos, durante cerca de 10-15% do período de 24 horas do dia, documentada em registo Holter; designam-se por incessantes ou permanentes e podem evoluir para cardiomiopatia dilatada secundária.
Durante os episódios de taquicardia, a frequência cardíaca pode ser da ordem de 250-350 batimentos por minuto (bpm) em recém-nascidos e lactentes, e de 160-200 bpm em crianças maiores e adolescentes.
Na vida fetal, a frequência pode ser mais elevada se persistir por mais de 12 horas; em tal circunstância: – poderá surgir insuficiência cardíaca grave e hidropisia fetal; – as taquicardias são persistentes (65%); – a frequência de hidropisia fetal é ~ 40%, e; – a taxa de mortalidade é significativa (6-12% dos fetos/ano). A taquicardia pode ser identificada pela mãe ou detectada na monitorização pré-natal de rotina.
Diagnóstico
O diagnóstico da disritmia cardíaca deve basear-se no registo electrocardiográfico embora seja obrigatório valorizar sempre o contexto clínico. Em doentes com manifestações clínicas ou crises frequentes mas transitórias, não documentadas por ECG, poderá ser necessário proceder a registos electrocardiográficos contínuos de duração variável (Holter, durante 24 horas, ou Detector de eventos, durante várias semanas) de modo a documentar os episódios e as suas características.
A análise do registo electrocardiográfico deve valorizar os seguintes parâmetros:
- Regularidade do ritmo? (regular ou irregular);
- Duração dos complexos QRS? (amplos ou não);
- Morfologia das ondas P – (normal, anormal ou ondas P não visíveis);
- Frequência das ondas? (P > 250 bpm)?;
- Relação entre as ondas P e as ondas R? (1:1, 2:1, 3:1 ou > 3:1);
- Resposta à adenosina ou manobras vagais?
Numa primeira avaliação poderá ainda estar indicada a realização de ecocardiograma, a fim de excluir a presença de cardiopatia congénita, e de avaliar as dimensões e função ventriculares. No feto, o diagnóstico de arritmia realiza-se por ecocardiografia e por Döppler pulsado.
Numa perspectiva prática, podemos classificar as disritmias em: extrassístoles isoladas, taquicardias e bradicardias.
Extrassístoles isoladas
As extrassístoles isoladas são batimentos independentes e diferentes do ritmo de base, podendo ter origem auricular ou ventricular:
- Extrassístoles auriculares: são precedidos de ondas P. Têm carácter benigno, estão presentes em 20% das crianças saudáveis, diminuem com a idade, e não requerem tratamento. É prudente proceder a avaliação com ECG-Holter, para excluir a presença de taquicardia.
- Extrassístoles ventriculares: não são precedidos de ondas P, o complexo QRS é largo, em geral com pausa compensadora. Na sua maioria, trata-se de situações benignas, geralmente não requerendo tratamento, e surgem em 2% das crianças e em cerca de 30% dos recém-nascidos. Se a sua frequência for elevada, está indicado proceder a ecocardiografia para excluir miocardite ou miocardiopatia dilatada. Em casos particulares poderá estar indicada terapêutica anti-arrítmica com beta-bloqueantes.
Taquicardias
As taquicardias são ritmos acelerados (frequência cardíaca aumentada), relativamente ao ritmo de base, podendo ter origem a diversos níveis: auricular, nodal (nódulo aurículo-ventricular), ou ventricular.
1. Taquicardias auriculares
- Taquicardia sinusal: origina-se no nódulo sinusal (ou de Keith-Flack) e apresenta uma frequência superior à do ritmo normal (é um ritmo sinusal normal, mas com frequência elevada); pode ser secundária a aumento do tono do simpático, explicável por múltiplos factores como estresse, febre ou efeito de certos fármacos, e hipertiroidismo.
Os achados do ECG caracterizam-se pela presença de ondas P sinusais antes de cada complexo QRS (relação P:R =1:1). Não necessita de tratamento.
- Taquicardia auricular focal: é uma aceleração ou frequência cardíaca elevada, regular, por estimulação que se origina num foco auricular ectópico (em qualquer local auricular, que não o nódulo sinusal).
Os achados do ECG podem apresentar uma onda P antes de cada QRS (P:R = 1:1) ou P:R 2:1, 3:1 ou superior, mas sempre com morfologia anómala (não sinusal). Em geral é assintomática, mas crianças mais velhas podem referir queixas de palpitações. Tem indicação para terapêutica farmacológica se as palpitações forem frequentes e interferirem com a vida da criança. Em casos selecionados poderá estar indicada ablação por radiofrequência.
- Taquicardia auricular multifocal ou caótica: aceleração ou frequência cardíaca aumentada, irregular, similar à anterior, mas originada em múltiplos focos auriculares. O ECG evidencia: ondas P de morfologia anómala com, pelo menos, três morfologias distintas e intervalos entre os complexos RR, PP e PR grosseiramente irregulares. Geralmente é incessante e pode associar-se a doenças do miocárdio (miocardiopatias, doenças metabólicas de armazenamento) ou iatrogenia farmacológica, entre outras. Nos casos sintomáticos, com repercussão relevante na vida do doente, pode estar indicada a terapêutica farmacológica, com sotalol e/ou flecainida; contudo, como tratamento definitivo, torna-se fundamental actuar ao nível da doença de base.
- Flutter auricular: aceleração irregular, com origem auricular. O ECG caracteriza-se por ondas “P” atípicas (dentes de serra ou ondas F) com frequência > 250 bpm e sem uma relação regular com os QRS, cuja frequência é menor. É rara em crianças saudáveis, sendo mais frequente no feto e no recém-nascido sem patologia. As causas mais frequentes são alterações hidroelectrolíticas (hipocalcémia e hipopotassémia), intoxicação digitálica e o pós-operatório de intervenções por cardiopatia congénita implicando manipulação auricular. Requerem tratamento, o qual deve ser individualizado; sempre que possível, tal alteração deverá ser convertida a ritmo sinusal com cardioversão eléctrica; o tratamento farmacológico inclui associação de digoxina a anti-arrítmicos vários. Se a duração ultrapassar 48 horas, está indicada terapêutica antiagregante/anticoagulante e, eventualmente, ablação por radiofrequência. (Figura 2)
- Fibrilhação auricular: ritmo acelerado caótico com origem auricular.
O ECG revela um ritmo irregular, com oscilação do ritmo de base (ondas f) sendo de difícil identificação os complexos auriculares (ausência de ondas P); a frequência pode ultrapassar os 400 bpm, e os complexos QRS, irregulares, têm menor frequência. É muito rara na idade pediátrica e na ausência de patologia. Pode associar-se a miocardiopatias. O tratamento consiste em tentar reverter a situação ao ritmo sinusal com fármacos ou cardioversão eléctrica. Pode empregar-se o termo Fibrilação.
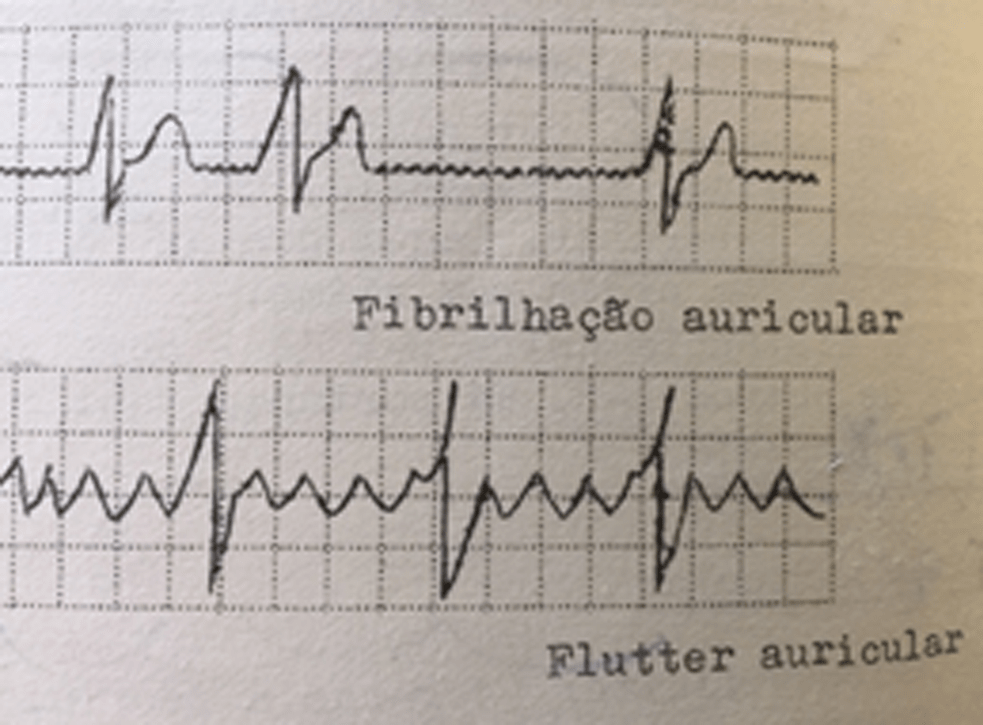
FIGURA 2. Traçado ECG de flutter auricular, sendo bem visíveis no traçado inferior as ondas em forma de serra dos impulsos auriculares. No traçado superior, em desenho esquemático, fibrilação auricular: ausência de ondas P.
2. Taquicardias nodais
- Taquicardia ectópica aurículo-ventricular ou juncional (JET<> junctional ectopic tachycardia): ritmo acelerado regular, mas com frequência menor que a auricular (120-180 bpm).
Manifesta-se com complexos QRS estreitos com dissociação aurículo-ventricular (ondas P não relacionadas com os complexos QRS).
Caracteriza-se pela ausência de resposta à administração de adenosina ou de antagonistas do cálcio. É rara, sendo mais frequente a forma adquirida (intoxicação digitálica ou no pós-operatório de cardiopatias congénitas).
A forma congénita comporta elevada mortalidade. Causa repercussão hemodinâmica importante importante traduzida por disfunção e dilatação ventriculares. O tratamento é fulcral e baseia-se na redução da frequência com amiodarona. - Taquicardia paroxística aurículo-ventricular ou taquicardia paroxística supraventricular (TPSV)*: ritmo acelerado regular com frequência cardíaca muito elevada (200-300 bpm), respondendo a manobras vagais e a fármacos que tornam mais lenta a condução pelo nódulo aurículo-ventricular. É bem tolerada clinicamente; contudo, se a duração for prolongada, poderá surgir insuficiência cardíaca. (Figuras 3 e 4)
* Notas importantes:
|
Produz-se por mecanismo de reentrada, a nível nodal por duplo sistema de condução dentro do nódulo aurículo-ventricular (não se visualizando ondas P) ou por via anómala acessória. Esta é o principal mecanismo das síndromas de pré-excitação, como o Wolff-Parkinson-White (WPW), podendo apresentar-se com complexos QRS estreitos ou largos.
Vem a propósito recordar as características da síndroma de WPW: encurtamento do intervalo PQ, QRS alargado com a característica onda δ e episódios de taquicardia paroxística supraventricular, geralmente assintomática. (Figura 5). A sua apresentação é mais frequente em lactentes, principalmente nos quatro primeiros meses de vida.
Podem apresentar-se também, na vida fetal, maioritariamente entre as 28 e as 30 semanas de idade gestacional, calculando-se uma prevalência de 1/200 fetos. Associa-se com frequência a cardiomiopatia ou a cardiopatia congénita.
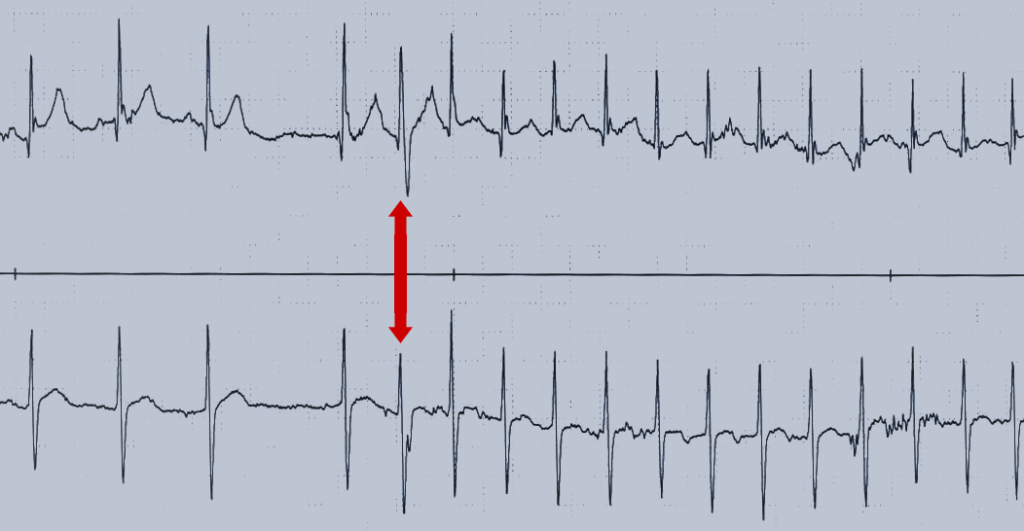
FIGURA 3. Traçado demonstrando o início de taquicardia supraventricular de complexos estreitos. A extrassístole prematura supraventricular (seta) inicia a taquicardia
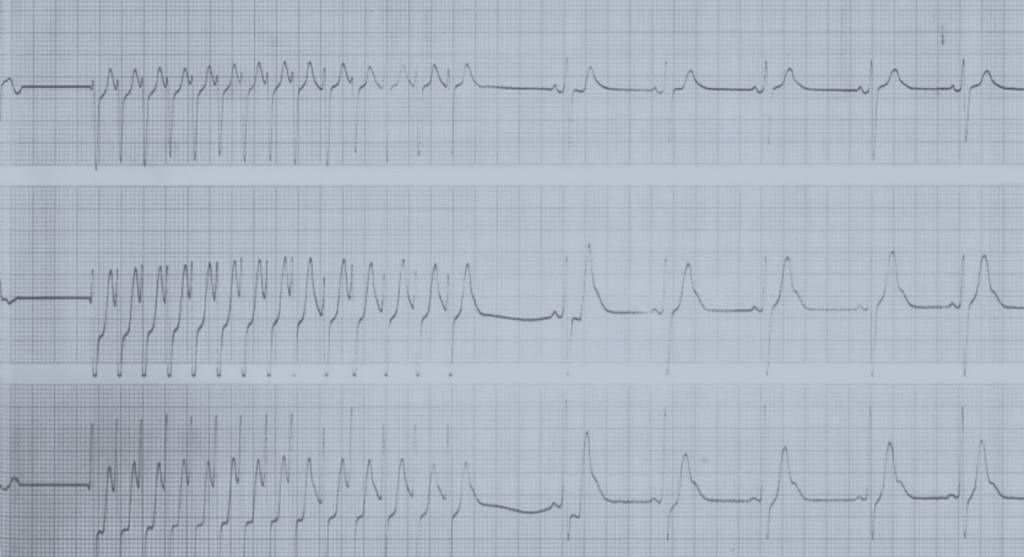
FIGURA 4. Traçado demonstrando a cessação de uma taquicardia supraventricular e conversão a ritmo sinusal
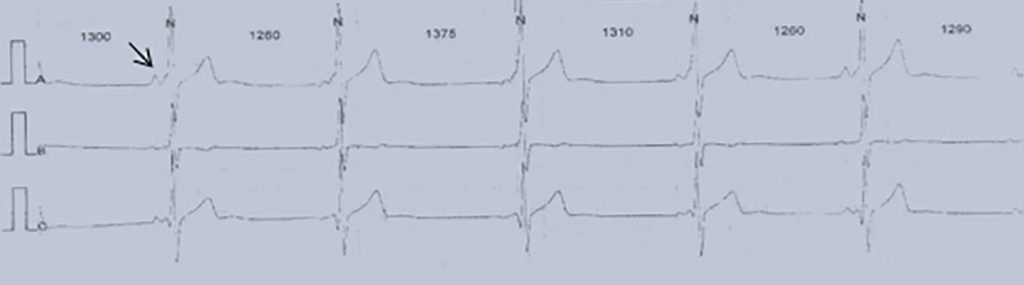
FIGURA 5. Traçado demonstrando a presença PQ curto e onda δ (seta) em doente com W-P-W
3. Taquicardias ventriculares
Tratando-se de situações muito raras e complexas, no âmbito da pediatria geral, apenas são citadas as entidades que integram este grupo:
- Ritmo idioventricular acelerado;
- Taquicardia do tracto de saída do ventrículo direito;
- Taquicardia idiopática do ventrículo esquerdo (incluindo variante “torsades des pointes”);
- Fibrilhação ventricular.
Bradicardias
As arritmias cardíacas que cursam com bradicardia (diminuição temporária ou permanente da frequência cardíaca, abaixo do mínimo considerado para a idade) designam-se por bradiarritmias.
São geralmente causadas por disfunção na génese do impulso eléctrico no nódulo sinusal, ou por alterações na condução AV. Podem ser persistentes ou intermitentes, congénitas ou secundárias a factores extrínsecos (por exemplo, como complicações de cirurgia cardíaca), ou intrínsecas (como a fibrose e a disfunção do nódulo sinusal).
O achado de bradicardia na criança poderá também constituir a única manifestação do efeito tóxico de vários fármacos e substâncias, tais como: digoxina, beta-bloqueantes, clonidina, opióides, neurolépticos, pesticidas, etc..
A resposta hemodinâmica às bradiarritmias é complexa, dependendo da função ventricular, da resistência vascular sistémica, da duração e da frequência cardíaca.
As formas clinicamente importantes de bradiarritmias em idade pediátrica incluem a bradicardia sinusal por disfunção do nódulo sinusal, o bloqueio AV de alto grau e o bloqueio AV completo, a seguir descritos.
- Bradicardia sinusal: ritmo lento regular, com origem no nódulo sinusal. A bradicardia sinusal em repouso, resultante de elevada estimulação vagal, é normal, principalmente em jovens atletas.
O ECG evidencia ritmo sinusal (onda P de morfologia normal antes de cada QRS) com frequência cardíaca < 2 desvios-padrão da média para a idade. Factores etiológicos secundários incluem hipóxia, aumento da pressão intracraniana, alterações iónicas ou acção de fármacos (digitálicos, bloqueadores dos receptores β-adrenérgicos). O tratamento é o da causa subjacente. - Bloqueio AV do 1º grau: ritmo sinusal sem alteração da frequência; na realidade não é uma bradicardia.
O ECG mostra um prolongamento do intervalo PR (> 0,12-0,15 s), secundário a um atraso na condução do impulso eléctrico da aurícula para o ventrículo, regra geral ao nível do nódulo AV (Figura 6). Pode ocorrer como resultado de um aumento da estimulação vagal, ser idiopático, secundário a fármacos (digitálicos, bloqueadores dos receptores β-adrenérgicos), a alterações iónicas e a miocardite, e a cardite reumática, no contexto de doença cardíaca congénita; pode igualmente ocorrer no pós-operatório de cirurgia cardíaca. Geralmente não causa sintomatologia; por isso, raramente requer terapêutica, excepto nos casos de intoxicação digitálica.
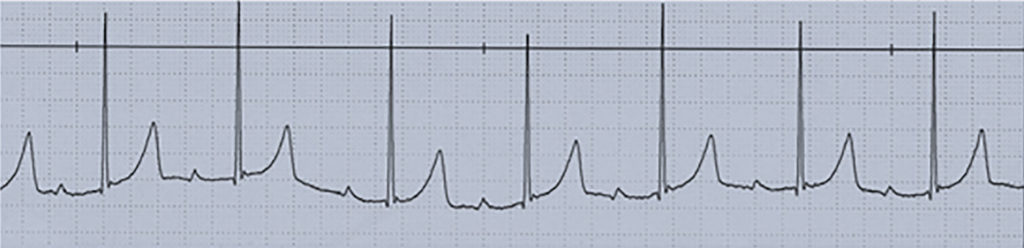
FIGURA 6. Traçado ECG em ritmo sinusal e bloqueio AV do 1º grau
- Bloqueio AV de 2º grau, engloba dois tipos, descritos a seguir:
- Mobitz tipo I/Wenckeback: ritmo lento, sinusal, caracterizado por falha intermitente da condução do impulso eléctrico da aurícula para o ventrículo, com aumento progressivo dos intervalos PR, até que um impulso é bloqueado e a onda P não é conduzida. É a forma mais comum de bloqueio AV de segundo grau; geralmente assintomática e com baixo risco de evolução para um grau de bloqueio AV mais elevado, não necessita, em regra, de terapêutica.
- Mobitz Tipo II: ritmo lento, sinusal. O ECG demonstra uma falha intermitente da condução do impulso eléctrico da aurícula para o ventrículo, com intervalos PR fixos e um bloqueio súbito na condução do impulso. Pode ser idiopático, ou secundário a fármacos ou doença materna do tecido conjuntivo, e associar-se a doença significativa do sistema de condução abaixo do feixe de His (Figura 7). Por vezes evolui para bloqueio AV de alto grau, devendo ser tratada a causa subjacente. A aplicação de pacemaker instrumental/artificial está indicada (pacing) em doentes sintomáticos.
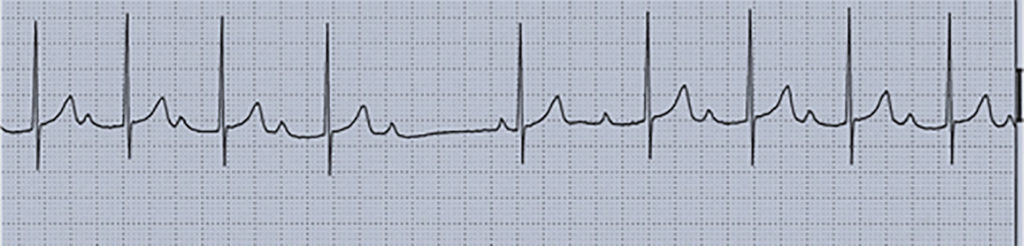
FIGURA 7. Traçado ECG em ritmo sinusal e bloqueio AV do 2º grau Mobitz tipo II
- Bloqueio AV de 3º grau ou completo: o ECG evidencia uma interrupção completa na condução do impulso eléctrico da aurícula para o ventrículo; assim, as ondas P sinusais encontram-se dissociadas do ritmo ventricular regular e lento. De salientar que este ritmo ventricular depende do desencadeamento de impulsos com origem em focos ectópicos (chamados pacemakers subsidiários) localizados designadamente na junção A-V (ritmo juncional), activando os ventrículos com frequências de 20 a 50 bpm. (Figura 8)
(Como nota à margem, para melhor compreensão da fisiopatologia, importa referir que o ritmo juncional poderá assumir o controlo do ritmo cardíaco se existir lesão ou depressão do nódulo sinusal).
O bloqueio AV de 3º grau ou completo pode ser idiopático e isolado, ou secundário a diversas situações clínicas, tais como: doença materna do tecido conjuntivo (exposição in utero a anticorpos anti-Ro e anti-La, mais frequentes no LES e síndroma de Sjögren), doença de Lyme, cardite reumática, cardiomiopatia, e no contexto de cardiopatias congénita, ou da sua correcção cirúrgica.
Geralmente sintomático, os doentes mais velhos podem apresentar-se com sintomas inespecíficos como tonturas, lipotímia, síncope, cansaço fácil ou, em casos mais graves, com clínica de insuficiência cardíaca congestiva e de baixo débito, podendo ocorrer morte súbita. A forma AV congénita fetal associa-se a complicações graves in utero, podendo resultar em hidropisia e morte fetal.
Sucintamente, importa salientar as bases do tratamento, indicado em todos os doentes sintomáticos, bem como em doentes assintomáticos com frequência ventricular média < 45 bpm (ou com frequência ventricular < 70 bpm associada a anomalias estruturais congénitas cardíacas). Deve ser iniciada isoprenalina EV e proceder-se a implantação de pacemaker.
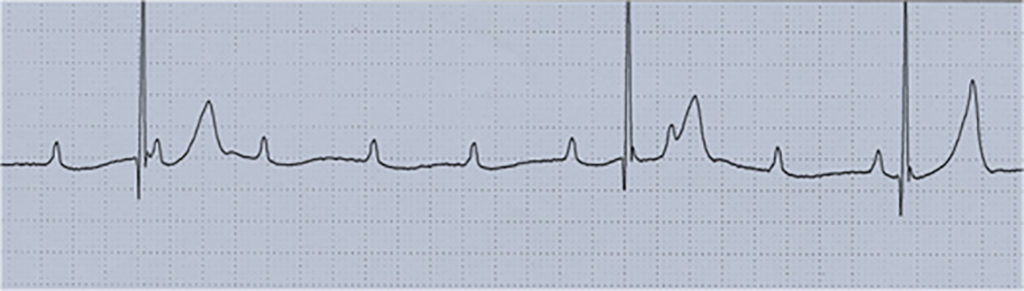
FIGURA 8. Traçado ECG em boqueio AV de 3º grau
Tratamento da taquiarritmia
O tratamento agudo das taquicardias supraventriculares depende do estado do doente e do mecanismo subjacente às arritmias. As taquiarritmias que causam compromisso hemodinâmico grave exigem uma intervenção urgente, habitualmente com cardioversão eléctrica. A terapêutica com fármacos exige tempo e estabilidade hemodinâmica.
Em doentes hemodinamicamente estáveis, o tratamento agudo das TSV (na maioria dos casos secundárias a mecanismos de reentrada dependentes do nódulo AV) envolve manobras vagotónicas (manobra de Valsalva, massagem do seio carotídeo, saco com mistura de gelo e água a cobrir a região frontal até à raiz do nariz durante 30 segundos, imersão da cabeça e ombros de modo a induzir diving reflex, estimulação rectal com sonda) ou a administração de adenosina endovenosa.
A adenosina administra-se sob registo electrocardiográfico contínuo, na dose inicial de 200 mcg/kg (se ineficaz deve duplicar-se a dose até 500 mcg/kg), em via de bom calibre e o mais proximal possível, em bolus de forma rápida, seguido de lavagem, obtendo-se uma taxa de conversão a ritmo sinusal de aproximadamente 80%. Verifica-se, contudo, recidiva da TSV em 1/3 dos doentes, nos quais é necessário administrar repetidamente o fármaco. Os efeitos secundários, tais como precordialgia, rubor, tremor e dificuldade respiratória, são frequentes e de curta duração (escassos segundos).
São contraindicação para administração da adenosina a existência de doença do nódulo sinusal, distúrbios da condução AV e doentes com broncorreactividade grave. A adenosina tem uma semivida muito curta, induzindo bloqueio AV; assim, a falta de resposta à sua administração pode dever-se a: – dose inadequada; – administração lenta ou numa via demasiado distal ao coração (por exemplo, nos membros inferiores), ou; – ao facto de a situação de taquicardia não ser dependente da condução AV. Na presença de uma administração adequada, a não conversão a ritmo sinusal pode permitir fazer o diagnóstico da taquicardia com origem auricular. (Figura 9)
Na ausência de resposta à adenosina deve recorrer-se a outros fármacos, como a amiodarona, na dose de carga inicial de 25 mcg/kg/min durante quatro horas, eventualmente seguida de perfusão de 5-15 mcg/kg/min. Nas taquicardias refractárias, a flecainida e o sotalol são bastante eficazes, tanto isolados, como em combinação com os betabloqueadores ou a digoxina. Os antagonistas dos canais de cálcio estão contraindicados no recém-nascido e lactente.
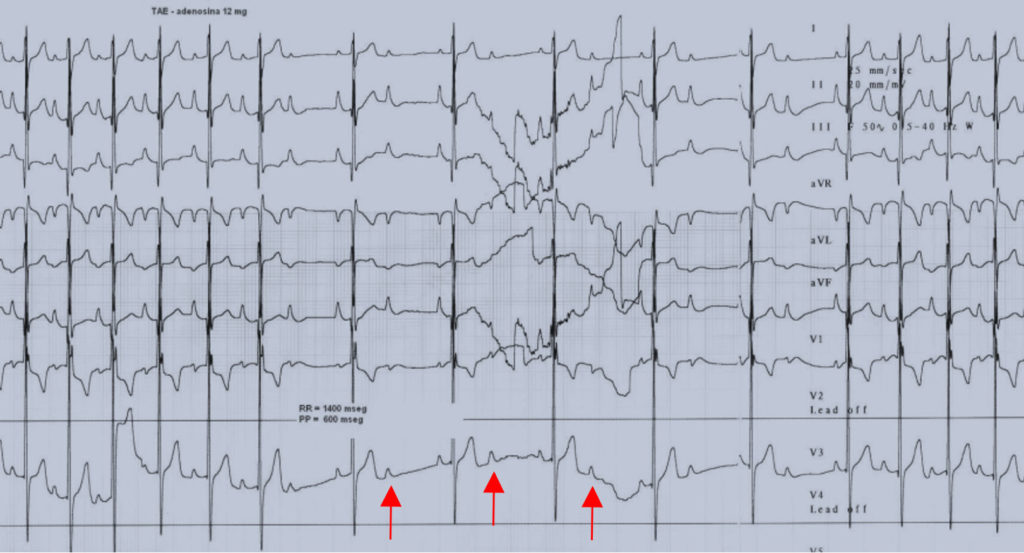
FIGURA 9. Traçado demonstrando taquicardia auricular focal; durante a administração de adenosina é evidente a indução de bloqueio AV
Os doentes hemodinamicamente instáveis, em choque cardiogénico, exigem um tratamento urgente, procedendo-se a cardioversão eléctrica sincronizada com 0,25-2J/kg: 1º choque 0,5-1J/kg, 2º choque 2J/Kg, sob sedação e/ou anestesia. As manobras vagotónicas e a adenosina ev (quando existir acesso vascular disponível) podem ser usadas no doente instável, mas apenas se não atrasarem a cardioversão eléctrica.
Em relação ao tratamento crónico/de manutenção, deve ser ponderada a relação entre o risco e o benefício do mesmo, tendo em conta simultaneamente a frequência, duração e gravidade dos episódios de taquicardia, bem como os efeitos secundários de cada um dos fármacos utilizados. Uma vez que a identificação dos episódios de taquicardia em recém-nascidos e lactentes é difícil, nesta faixa etária, após um primeiro episódio de TSV, está geralmente indicada a terapêutica profiláctica. Em crianças com mais de um ano de idade o tratamento profiláctico está apenas indicado em doentes com episódios recorrentes, de longa duração ou mal tolerados. Em doentes com sintomas escassos, a terapêutica de manutenção não é geralmente necessária.
Existe actualmente controvérsia em relação ao tipo de tratamento profiláctico, farmacológico ou por ablação por cateter. Em recém-nascidos e lactentes com menos de um ano, a digoxina é o fármaco de primeira linha, devendo ser mantido até ao primeiro ano de idade. Na falência da digoxina em monoterapia, podem ser adicionados propranolol, sotalol ou propafenona. No tratamento de manutenção de doentes com mais de um ano de idade as principais opções farmacológicas são os betabloqueadores, flecainida, propafenona ou sotalol. A digoxina deve ser evitada em doentes com pré-excitação ventricular (WPW), face ao risco de facilitar a condução AV e desencadear fibrilhação auricular. A amiodarona, o fármaco mais potente, face aos seus múltiplos efeitos secundários extracardíacos, deve ser reservada para última opção, na falência dos antiarrítmicos supra mencionados.
Em lactentes e crianças pequenas com taquicardia supraventricular, o papel da ablação por radiofrequência no seu manejo não está ainda bem definido. Nesta população, a indicação para ablação por radiofrequência deve ser considerada somente quando todos os regimes farmacológicos falharem.
Em crianças mais velhas (aproximadamente 8-9 anos de idade), com episódios frequentes de taquicardia supraventricular, a ablação por radiofrequência passou a ser a opção terapêutica de primeira linha face à terapêutica farmacológica crónica. Em doentes assintomáticos, mesmo que com pré-excitação ventricular, não está indicada qualquer intervenção terapêutica, excepto em situações particulares.
Tratamento da bradiarritmia
O tratamento em fase aguda depende da frequência cardíaca, da presença de sintomas clínicos como síncope, pré-síncope, tonturas e lipotímia, de sinais de insuficiência cardíaca e da avaliação da função sistólica cardíaca. Nos doentes sintomáticos, a terapia farmacológica é apenas uma ponte para implantação de pacemaker definitivo.
A atropina é o fármaco de primeira escolha nas bradiarritmias sintomáticas. Pode ser administrada para o tratamento na fase aguda, sendo mais útil em doentes com disfunção do nódulo sinusal. Em doentes com bloqueio AV de segundo grau ou de grau elevado, uma amina simpaticomimética como a isoprenalina (dose inicial 0,02 μg/kg/min, aumentar até à dose máxima de 0,5 μg/kg/min) ou a dobutamina (1-5 μg/kg/min) podem ser utilizadas para aumentar a frequência cardíaca temporariamente.
O pacing temporário é usado quando os doentes evidenciam bradiarritmias hemodinamicamente significativas e persistentes, como ponte para a resolução de determinada etiologia temporária, ou na transição para a implantação de um pacemaker definitivo nos casos de bradiarritmia persistente.
Evolução e prognóstico
Cerca de 90% das TSV durante a idade pediátrica têm um mecanismo de reentrada subjacente. Apesar de a apresentação inicial poder ser fatal, numa minoria dos doentes o prognóstico geral é bom. Mais de metade dos lactentes cujos episódios de TSV ocorreram no período neonatal estarão assintomáticos, sem necessidade de tratamento farmacológico, aos 9-12 meses de vida. Entre aqueles cujo episódio inaugural tenha ocorrido durante o primeiro ano de vida, apenas 40% apresentarão novos episódios depois dos cinco anos de idade; por outro lado, a maioria dos que tiverem tido o episódio inaugural durante a infância, ou mais tarde, manterá episódios de taquicardia a longo prazo. No feto, cerca de 65% das taquicardias são persistentes. O flutter auricular de início no período neonatal raramente recidiva.
Nos lactentes com síndroma de WPW e quadro de taquicardia supraventricular iniciado antes dos 2 meses de idade, em cerca de 90% dos casos verificar-se-á desaparecimento da pré-excitação ventricular e dos episódios de taquicardia durante a infância, podendo, contudo, verificar-se recidiva em 1/3 dos casos a partir dos 8 anos de idade.
Nas formas incessantes de taquicardia, como foi referido anteriormente, poder-se-á desencadear cardiomiopatia dilatada secundária, a qual se resolve com o término da taquicardia.
O risco de morte súbita é variável, sendo de 6-12% fetos/ano nas taquicardias fetais. Em doentes com síndroma de WPW, o risco de morte súbita, é de 2,3% em indivíduos assintomáticos, podendo atingir a proporção de 4% em indivíduos sintomáticos.
BIBLIOGRAFIA
Bobbo M, Amoroso S, Tamaro G, et al. Retrospective study showed that palpitations with tachycardia on admission to a paediatric emergency department were related to cardiac arrhythmias. Acta Paediatrica 2019; 108: 328-332
Campbell RWF. Supraventricular tachycardia. In: Paediatric cardiac arrhythmias. C Wren, RWF Campbell (eds). Oxford: Oxford University Press 1996; 94-126
Garson A Jr, Gilette PC, McNamara DG. Supraventricular tachycardia in children: clinical features, response to treatment, and long-term follow-up in 217 patients. J Pediatr 1981; 98: 875-82
Hernández-Madrid A, Paul T, Abrams D, et al. Arrhythmias in congenital heart disease: a position paper of the European Heart Rhythm Association (EHRA), and the European Society of Cardiology (ESC). Europace 2018; 20: 1719-1753. doi: 10.1093/europace/eux380.
Jackman WM, Beckman KJ, McClelland JH, et al. Treatment of supraventricular tachycardia due to atrionodal reentry by radiofrequency ablation of slow pathway conduction. N Engl J Med 1992; 327: 313-318
Kawaguchi N, Iwaki T, Wakabayashi T, et al. Balloon angioplasty in a pediatric patient with nutcracker syndrome. Pediatrics International 2019; 61: 300-301
Karvonen S, Sipola M, Kiviniemia A, et al. Cardiac autonomic function in adults born preterm. J Pediatr 2019; 28: 96-103
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Ko JK, Deal BJ, Strasburger JF, et al. Supraventricular tachycardia mechanisms and their age distribution in pediatric patients. Am J Cardiol 1992; 62: 1028-1032
Kugler JD, Danford DA, Deal BJ, et al. Radiofrequency catheter ablation for tachyarrhythmias in children and adolescents. N Engl J Med 1994; 330: 1481-1487
Kugler JD. Radiofrequency catheter ablation for supraventricular tachycardia: should it be used in infants and small children? (editorial) Circulation 1994; 90: 639-641
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Muller G, Deal BJ. Vagal manoeuvers and adenosine for termination of atrioventricular reentrant tachycardia. Am J Cardiol 1994; 74: 500-503
Nagatome Y, Ueno K, Takahashi Y, et al. Neonatal ventricular tachycardia: Adverse event possibly due to maternal ritodrine. Pediatrics International 2019; 61: 298-299
Naheed ZJ, Strasburger JF, Benson DW, BJ Deal. Natural history and management strategies of automatic atrial tachycardia in children. Am J Cardiol 1995; 75: 405-407
Perry JC, Garson A Jr. Supraventricular tachycardia due to Wolff-Parkinson-White syndrome in children: early disappearance and late recurrence. J Am Coll Cardiol 1990; 16: 1215-1220
Till J, Shinebourne EA, Rigby ML, Clarke B, Ward De, Rowland E. Efficacy and safety of adenosine in the treatment of supraventricular tachycardia in infants and children. Br Heart J 1989; 62: 204-211
Valdés SO, Miyake CY, Niu MC, et al. Early experience with intravenous sotalol in children with and without congenital heart disease. Heart Rhythm 2018; 15: 1862-1869. doi: 10.1016/j.hrthm.2018.07.010
Walsh EP, Saul JP, Hulse JE, et al. Transcatheter ablation of ectopic atrial tachycardia in young patients using radiofrequency current. Circulation 1992; 86: 1138-1146
Weindling SN, Saul JP, Walsh EP. Efficacy and risk of medical therapy for supraventricular tachycardia in neonates and infants. Am Heart J 1996; 131: 66-72
Wren C, Campbell FWF (eds). Paediatric cardiac arrhythmias. Oxford: Oxford University Press, 1996