Definição e importância do problema
A comunicação interventricular (CIV) consiste numa região de descontinuidade no septo interventricular, permitindo desta forma uma ligação entre o ventrículo direito e esquerdo.
Trata-se da cardiopatia congénita mais frequente: ocorrendo em 2-6 por cada 1.000 nascimentos, constitui 20% de todos os defeitos cardíacos, sem predomínio quanto aos géneros. Manifestando-se com gravidade variável, pode estar presente de forma isolada, ou constituir parte de uma associação de lesões, como na tetralogia de Fallot, na atrésia da pulmonar com CIV, e no truncus arteriosus, entre outras.
A CIV mais frequente é de pequenas dimensões e localizada à região perimembranosa do septo; nesta variante, a evolução é habitualmente benigna, podendo ocorrer o encerramento espontâneo. Por outro lado, se o defeito persistir, em geral não há necessidade de qualquer tratamento.
Anatomia e classificação
O defeito anatómico de comunicação interventricular pode ocorrer em qualquer região do septo interventricular. Pode ser classificada como: – perimembranosa, se localizada no septo membranoso (situação mais frequente, em cerca de 70% dos casos); – muscular de entrada, trabecular ou de saída (subarterial) quando se localiza no septo muscular (restantes casos).
Considerando o critério “dimensão” em comparação com a “dimensão da raiz da aorta” avaliada por ecocardiograma transtorácico, pode ser classificada: pequena, moderada ou grande. (Figura 1)
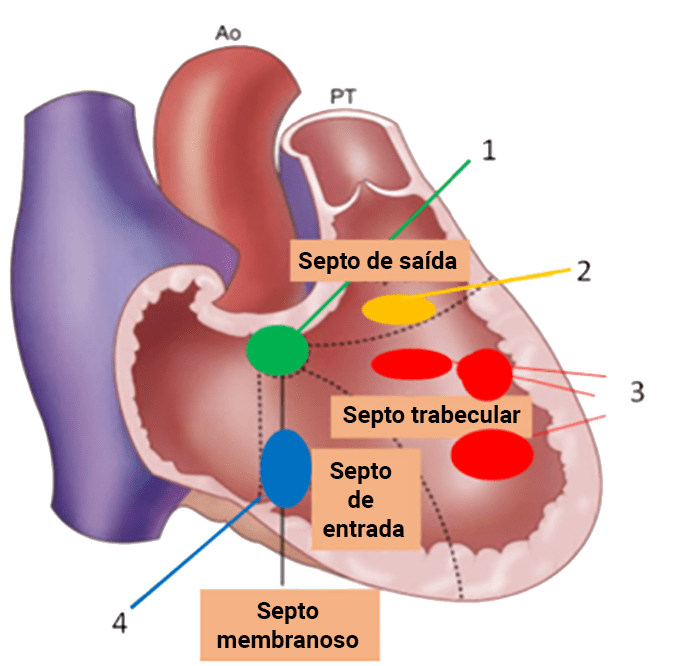
FIGURA 1. Diagrama ilustrando a classificação das CIV, adaptada de Soto et al.
1 – perimembranosa;
2 – subarterial, de saída ou duplamente relacionada;
3 – musculares trabeculares e apicais;
4 – musculares de entrada.
Fisiopatologia
A presença de uma CIV condiciona uma alteração ao percurso normal do sangue durante o ciclo cardíaco: um volume de sangue oxigenado do ventrículo esquerdo (VE) passa através da CIV para o ventrículo direito (VD) e, deste, para a artéria pulmonar, fazendo bypass à circulação sistémica (shunt esquerdo-direito). O volume do shunt depende das dimensões da CIV e da resistência vascular pulmonar.
Nos defeitos de pequenas dimensões, o tamanho do orifício é o principal factor que limita o shunt esquerdo-direito, que será sempre pequeno. Nas CIV grandes, as pressões são semelhantes nos VE e VD, e o factor que mais condiciona o shunt é a resistência vascular pulmonar. Quanto mais baixa for esta resistência, maior será a quantidade de sangue que passa do VE para a artéria pulmonar. Nesta situação as artérias pulmonares dilatam-se para acomodar o aumento de volume de sangue, o que condiciona aumento da pressão arterial pulmonar.
A evolução natural, se o defeito não for encerrado, será o desenvolvimento de doença vascular pulmonar, com espessamento da parede das arteríolas e consequente aumento da resistência, inicialmente com variabilidade dinâmica e depois de modo fixo. A hipertensão pulmonar fixa, pode ultrapassar o valor da pressão arterial sistémica, o que provoca inversão do shunt: tal corresponde ao chamado conceito de “fisiologia de Eisenmenger”.
Manifestações clínicas
As manifestações clínicas dependem da magnitude do shunt e, portanto, das dimensões da CIV e do estado da resistência vascular pulmonar:
- CIV pequena e resistências vasculares pulmonares normais: situação assintomática, cursando apenas com sopro holossistólico de grau II-III/VI no bordo esquerdo do esterno, detectado em “observação de rotina”, a partir da 2ª semana de vida;
- CIV moderada a grande com resistências pulmonares normais: manifestando-se a partir do 1º mês de vida e cursando com sinais clínicos de insuficiência cardíaca por aumento do débito pulmonar. Nestes casos, o exame objectivo cardiovascular evidencia: pré-córdio hiperdinâmico, sopro holossistólico com intensidade variável e, geralmente, rodado mitral de débito. Quando a insuficiência cardíaca é muito marcada pode ser auscultado ritmo de galope e terceiro ruído;
- CIV moderada a grande com resistências pulmonares elevadas: com quadro de insuficiência cardíaca de menor intensidade por redução do shunt esquerdo-direito, salientando-se que o doente parece ter melhorado da sintomatologia inicial. O exame cardiovascular mostra: sopro holossistólico de menor intensidade, aumento significativo da intensidade do segundo ruído cardíaco, e ausência do ritmo de galope e do rodado.
Em geral, e na ausência de complicações, o quadro clínico de insuficiência cardíaca desenvolve-se depois das 3 semanas de vida. As suas manifestações estão relacionadas com o esforço respiratório para acomodar o aumento de débito pulmonar, apresentando polipneia, cansaço e diaforese durante o aleitamento, má progressão ponderal e infecções frequentes das vias respiratórias inferiores. É ainda habitual a hepatomegália.
Se o quadro de insuficiência cardíaca se desenvolver precocemente, ou seja na 1ª/2ª semanas de vida, deve investigar-se a associação de obstáculo esquerdo (geralmente coarctação da aorta) ou de regurgitação da válvula mitral. Neste contexto, pressupõe-se que já foram excluídas e corrigidas todas as situações extra-cardíacas que podem causar ou agravar a insuficiência cardíaca, designadamente, anemia, hipoglicémia, hipocalcémia, taquiarritmias, entre outras.
Tipicamente não existe má perfusão periférica: assim, o tempo de reperfusão capilar é normal, bem como a coloração da pele. Por outro lado, os pulsos periféricos podem, até, evidenciar aumento da amplitude. É importante referir que a presença de edema periférico não é sinal de insuficiência cardíaca na criança; em tal circunstância haverá que admitir a possibilidade de hipoalbuminémia de etiologia a esclarecer.
Em idade pediátrica, a insuficiência cardíaca pode ser quantificada e classificada de acordo com escalas que integram determinados parâmetros a ponderar. O Quadro 1 integra uma das escalas usadas – a escala de Ross, modificada. Recentemente desenvolveu-se a escala New York University Pediatric Heart Failure Index (PHFI) para crianças e adolescentes, a qual combina critérios fisiológicos e de terapêutica instituída.
QUADRO 1 – Escala de Ross modificada para classificação de insuficiência cardíaca
| Classe de Ross | Sintomas |
| I | Assintomático |
| II | Taquipneia ligeira ou diaforese acompanhando o acto da alimentação (em lactentes) |
| Dispneia de esforço (em crianças) | |
| III | Taquipneia marcada ou diaforese acompanhando a alimentação em lactentes |
| Prolongamento dos tempos de alimentação, associado a má progressão ponderal | |
| Dispneia marcada com o esforço | |
| IV | Taquipneia, retracções intercostais, gemido, diaforese em repouso |
A presença de cianose num lactente com uma CIV pequena a moderada é sempre explicável por patologia associada (por exemplo: patologia pulmonar ou infecção respiratória com hipoxémia). A cianose também está presente nos casos de evolução a longo prazo de uma CIV grande não tratada, já com doença pulmonar vascular obstrutiva e shunt direito-esquerdo sobrepondo-se à patologia inicial, de base.
Evolução
A história natural da CIV é dinâmica, dependendo fundamentalmente das características da lesão (ver classificação).
As comunicações de pequenas dimensões têm grande probabilidade de encerramento espontâneo, sobretudo nas lesões localizadas à porção apical do septo interventricular. O encerramento espontâneo pode ser suspeitado pelo desaparecimento do sopro pré-existente, e corroborado pela ausência de sinais de shunt no ecocardiograma. Podem, no entanto, manter-se patentes durante vários anos e sem indicação para cuidados específicos.
Nas comunicações de grandes dimensões, e na ausência de tratamento, a evolução para doença vascular pulmonar é a regra, o que pode ocorrer a partir do primeiro ano de vida. A associação com síndromas (como a trissomia 21), e com infecção por vírus sincicial respiratório (VSR), frequente nos dois primeiros anos de vida, poderão antecipar tal evolução. Por este motivo, está recomendada a administração de imunoglobulina específica para VSR a estes doentes como profilaxia.
Se o tratamento cirúrgico for eficaz, os doentes têm uma capacidade funcional e de tolerância ao exercício físico semelhante aos seus pares. Dum modo geral, pode afirmar-se que o prognóstico a médio e longo prazo dependerá da presença de complicações cirúrgicas e/ou do número e gravidade das lesões residuais, designadamente, do não encerramento completo da comunicação.
Radiografia do tórax
Nos defeitos de pequenas dimensões, a radiografia do tórax é normal. Nos defeitos moderados já é visível a dilatação do tronco da artéria pulmonar e plétora, sobretudo na região hilar. Nos defeitos de grandes dimensões (Figura 2) existem sinais de plétora marcada, com índice cardiotorácico aumentado (cardiomegália), podendo verificar-se sinais de oligoémia periférica se coexistir doença vascular obstrutiva pulmonar (hipertensão pulmonar).
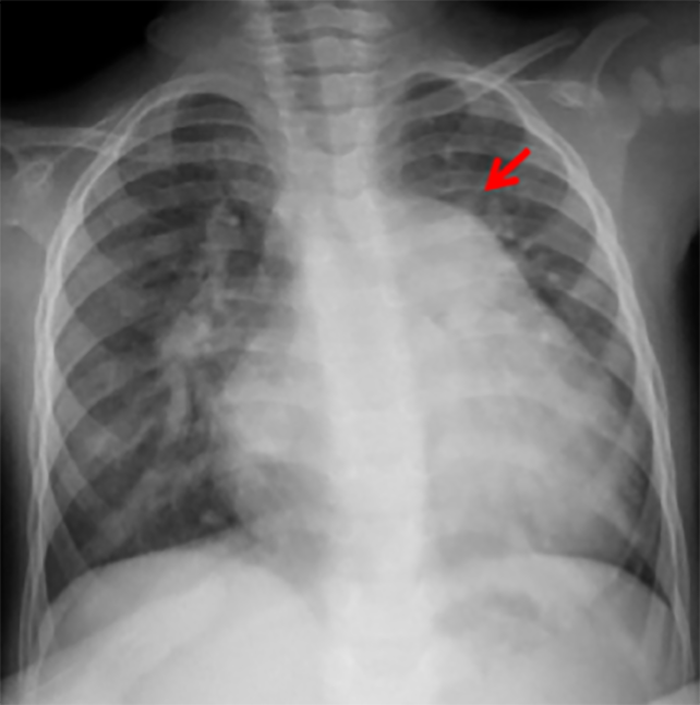
FIGURA 2. Radiografia do tórax de lactente com 6 meses de idade e CIV grande: é evidente o aumento do índice cardiotorácico com sinais de dilatação do ventrículo esquerdo e dilatação do tronco da artéria pulmonar (seta) e plétora bilateral
Electrocardiograma
Na CIV pequena o electrocardiograma (ECG) pode ser incaracterístico, atendendo às particularidades e critérios de normalidade em função da faixa etária. Na CIV moderada podem já existir critérios de hipertrofia ventricular esquerda ou biventricular nos casos de CIV grande.
Ecocardiograma transtorácico
Actualmente é aceite que a maior parte das lesões cardíacas congénitas pode ser diagnosticada de forma completa e detalhada por ecocardiograma transtorácico com modo 2D, modo M e Döppler codificado em cor.
Tal exame permite determinar a localização e a dimensão da CIV (e, eventualmente, identificar a presença de mais do que uma comunicação), avaliar função global (sístole e diástole) assim como eventuais lesões associadas. As dimensões da artéria pulmonar e aorta são importantes, permitindo com outros dados o cálculo de shunt intracardíaco. (Figura 3)
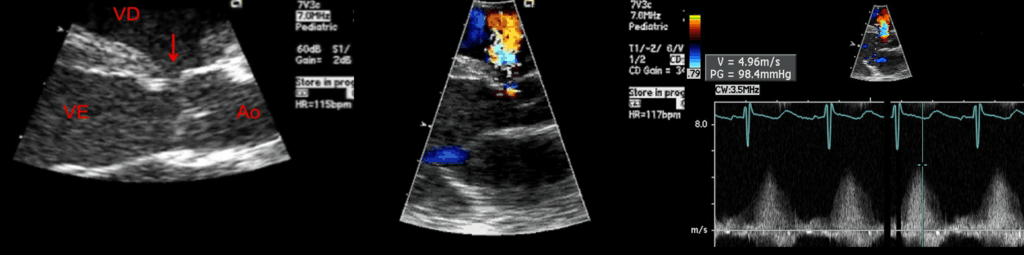
FIGURA 3. Imagens de ecocardiografia de CIV perimembranosa: pode observar-se a solução de descontinuidade do septo interventricular (seta); o shunt esquerdo-direito (fluxo laranja) e o cálculo do gradiente através da CIV por Döppler contínuo. (VD – ventrículo direito; VE – ventrículo esquerdo e Ao – aorta)
Ecocardiograma transesofágico (ETE)
Este exame é habitualmente reservado para crianças com “má janela” acústica e incapacidade para obter boa definição; ou se existirem dúvidas em relação à anatomia intracardíaca: por exemplo, para excluir alterações da válvula mitral ou tricúspide em determinados casos que possam eventualmente contraindicar a intervenção cirúrgica de correcção.
Cateterismo cardíaco
O cateterismo cardíaco diagnóstico não tem actualmente indicação para o diagnóstico funcional e morfológico de CIV. Poderá estar indicado para: – excluir doença vascular obstrutiva em crianças mais velhas com CIV e hipertensão pulmonar na ausência de sinais de insuficiência cardíaca; – avaliar a vasorreactividade das resistências vasculares pulmonares através duma prova de provocação consistindo na inalação de óxido nítrico ou oxigénio.
Exames laboratoriais
Do ponto de vista laboratorial importa salientar que o doseamento seriado do péptido natriurético (BNP) é actualmente utilizado como indicador importante para avaliar a insuficiência cardíaca. A análise dos doseamentos seriados permite avaliar a evolução e gravidade do quadro de insuficiência cardíaca, o seu agravamento (valores aumentados) e a resposta à terapêutica médica (redução progressiva).
Tratamento
Tratamento médico
A abordagem terapêutica médica das CIV somente está indicada nos casos de quadro clínico de hiperfluxo pulmonar com repercussão hemodinâmica levando a insuficiência cardíaca. A terapêutica consiste em restrição de líquidos (tendo em consideração a idade), suplementação calórica, diuréticos, inibidores da enzima de conversão da angiotensina, antagonistas dos receptores da aldosterona e digitálicos. (Partes XI e XXXI)
O tratamento definitivo destas lesões implica a realização de cirurgia cardíaca ou cateterismo cardíaco de intervenção (dependendo do número, dimensão e anatomia da comunicação interventricular).
Tratamento cirúrgico
Têm indicação para cirurgia correctiva as comunicações interventriculares que evidenciem repercussões hemodinâmicas em qualquer idade de diagnóstico no pressuposto de que previamente se propiciaram ao doente condições aceitáveis de estado geral, assim como de estabilização e equilíbrio hemodinâmico e nutricional.
De referir que: – a idade e o peso do doente são aspectos relevantes e determinantes do grau de risco; – nos doentes com hipertensão pulmonar fixa e síndroma de Eisenmenger a situação clínica impede o tratamento cirúrgico definitivo.
A cirurgia implica esternotomia mediana, salientando-se que a técnica mais habitual é o encerramento da CIV com remendo de Dacron®, sob circulação extracorporal e em hipotermia.
Encerramento percutâneo
O cateterismo de intervenção, embora ainda não consensual, tem sido utilizado com bons resultados nas CIV musculares trabeculares. O procedimento, laborioso, pode substituir a técnica cirúrgica em doentes seleccionados. Por outro lado, nas CIV perimembranosas o encerramento percutâneo poderá comportar taxas significativas de complicações.
O cateterismo de intervenção associado à cirurgia cardíaca num mesmo acto – técnica híbrida está a ser utilizado mais recentemente para o encerramento de defeitos septais grandes, sem as complicações associadas à circulação extracorporal.
Nota: Os doentes submetidos a tratamento cirúrgico ou percutâneo têm sempre indicação para profilaxia da endocardite bacteriana.
BIBLIOGRAFIA
Anderson BR, Stevens KN, Nicolson SC, Gruber SB, Spray TL, Wernovsky G, Gruber PJ. Contemporary outcomes of surgical ventricular septal defect closure. J Thorac Cardiovasc Surg 2013; 145: 641-647
Auerbach SR1, Richmond ME, Lamour JM, Blume ED, Addonizio LJ, Shaddy RE, Mahony L, Pahl E, Hsu DT. BNP levels predict outcome in pediatric heart failure patients: post hoc analysis of the pediatric carvedilol trial. Circ Heart Fail 2010 ;3 :606-611
Balzer D. Current status of percutaneous closure of ventricular septal defects. Pediatr Therapeut 2012; 2: 112
Holzer R, Balzer D, Cao QL, Lock K, Hijazi ZM, et al. Device closure of muscular ventricular septal defects using the Amplatzer muscular ventricular septal defect occluder: immediate and mid-term results of a U.S. registry. J Am Coll Cardiol 2004; 43: 1257-1263
Haponiuk I, Chojnicki M, Jaworski R, Steffek M, et al. Hybrid approach for closure of muscular ventricular septal defects. Med Sci Monit 2013; 19: 618-624
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Minette MS, Sahn DJ. Congenital heart disease for the adult cardiologist. Ventricular septal defects. Circulation 2006; 114: 2190-2197
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Patel ND, Justino H, Ing FF. Hybrid approach to ventricular septal defect enlargement.
Catheter Cardiovasc Interv 2019; Apr 14. doi: 10.1002/ccd.28227
Soto B, A E, Moulaert, A J, Lie JT et Anderson R. Classification of ventricular septal defects. Br Heart J 1980; 43: 332-343