Definição e importância do problema
A icterícia, síndroma resultante da impregnação da pele e mucosas pelo pigmento bilirrubina quando o mesmo ultrapassa determinado valor sérico (>7 mg/dL no RN versus >2 mg/dL no adulto), constitui uma das manifestações clínicas mais frequentes no período neonatal (entre 25 e 50% dos RN de termo e percentagem superior no pré-termo).
Em cerca de 6% dos RN de termo são atingidos valores de bilirrubinémia >13 mg/dL e, em cerca de 3%, >15 mg/dL.
Não existe uma definição universalmente aceite sobre o que se considera “valor normal de bilirrubinémia no RN”. Em termos práticos considera-se habitualmente hiperbilirrubinémia do RN toda e qualquer situação clínica associada a bilirrubinémia total superior a 13 mg/dL no RN de termo, e superior a 10 mg/dL no RN pré-termo; torna-se óbvio que este critério se pode considerar arbitrário uma vez que valores inferiores àqueles limites nas primeiras 24 horas de vida, e em determinadas circunstâncias, poderão constituir já risco importante para o SNC (ver adiante).
De acordo com o nomograma de Bhutani, a hiperbilirrubinémia neonatal é definida, acima das 35 semanas de gestação, por valores superiores ao percentil 95 para a idade em horas (>8 mg/dL às 24 horas, >13,1 mg/dL às 48 horas, >15,8 mg/dL às 72 horas).
Na grande maioria dos casos, a icterícia relacionada com elevação da fracção não conjugada da bilirrubina (ou indirecta, retomando a nomenclatura antiga relacionada com a reacção de Van den Bergh) tem uma evolução benigna, sendo considerada classicamente como icterícia fisiológica, isto é manifestação própria e expectável no RN.
Todavia, num pequeno número de casos, poderão surgir níveis elevados de bilirrubinémia não conjugada comportando risco de toxicidade para o SNC e de encefalopatia de grau variável (com lesões ligeiras, moderadas ou graves); o substrato anátomo-patológico de tal encefalopatia corresponde fundamentalmente a impregnação do pigmento nos núcleos da base. A forma mais grave, hoje rara, é constituída pelo chamado kernicterus que pode ter evolução fatal.
Em síntese, a hiperbilirrubinémia e a sua expressão clínica, a icterícia, constituem a manifestação clínica mais frequente no período neonatal.
Neste capítulo é dada ênfase às situações associadas a hiperbilirrubinémia não conjugada.
Etiopatogénese
Para a compreensão dos diversos quadros clínicos da icterícia neonatal e das medidas profiláctico-terapêuticas a instituir, designadamente no âmbito das hiperbilirrubinémias à custa da fracção não conjugada da bilirrubina (com riscos potenciais em função do valor, idade gestacional, idade pós-natal e contexto clínico), será útil abordar as etapas fundamentais do metabolismo da bilirrubina, a sua toxicidade e os principais factores predisponentes da síndroma ictérica.
Metabolismo da bilirrubina
Síntese
A bilirrubina é o produto final do catabolismo dos pigmentos contendo heme (Figura 1). A maior parte da sua produção (80-85%) tem lugar ao nível do SRE (especialmente fígado, baço, medula óssea e tecidos com macrófagos) por degradação oxidativa da Hb que provém dos eritrócitos envelhecidos; mediante a intervenção da enzima heme-oxigenase e do pigmento celular citocrómio P450, formam-se quantidades equimolares de CO e de biliverdina. A biliverdina-redutase ao nível dos microssomas dos macrófagos promove a hidrogenação da biliverdina IX-a, que se transforma em bilirrubina indirecta, livre, não conjugada, lipossolúvel.
Uma pequena parcela da produção da bilirrubina (15-20%) tem origem em moléculas proteicas com heme (mioglobina, peroxidase, triptofano-pirrolase, catalase, citocrómios, citocrómio-oxidase, etc.) e na chamada eritropoiese ineficaz. Nesta fase do metabolismo da bilirrubina (síntese) o mecanismo principal da hiperbilirrubinémia é uma hiper-hemólise. Sabendo que 1 g de hemoglobina catabolizada origina 34 mg (600 µmol) de bilirrubina, pode deduzir-se que a descida de 1 g de Hb/dL/dia é responsável pela quadruplicação da produção diária de bilirrubina, a qual pode atingir 28 mg/kg/dia.
FIGURA 1. Metabolismo da bilirrubina. A designação formal da molécula de bilirrubina nativa é: 4Z, 15Z-bilirrubina IX-a ou α.
A bilirrubina assim sintetizada (chamada bilirrubina IX-a, indirecta, livre, não conjugada) é lipossolúvel, ultrafiltrável, com grande poder de difusão extravascular, difusível em todos os tecidos e tóxica para as células, sobretudo as dos núcleos basais do encéfalo; cerca de metade da bilirrubina sintetizada, pela sua lipossolubilidade, deposita-se rapidamente nos tecidos onde se forma, e igual quantidade atinge a circulação. A produção aumentada de bilirrubina pode ser determinada pela taxa de excreção de CO (ver adiante).
Transporte sérico
Parte da bilirrubina que deixa o SRE é transportada em ligação principalmente à albumina (complexo bilirrubina-albumina) e, acessoriamente, em ligação a ácidos gordos plasmáticos e a certas lipoproteínas eritrocitárias e globulinas. O complexo albumina-globulina é hidrossolúvel, não ultrafiltrável, ou seja, de menor difusão extravascular, não penetrando no espaço intracelular, nomeadamente nas células nervosas.
A união bilirrubina-albumina é possível em 2 centros de ligação: ao primeiro liga-se uma molécula de bilirrubina intensamente, sendo dificilmente deslocável; ao segundo ligam-se duas, mas a afinidade é menor. Portanto, cada molécula de albumina é capaz de transportar, pelo menos, três moléculas de bilirrubina.
Outra parte da bilirrubina encontra-se livre do plasma. Segundo a lei da acção de massa, aplicando a fórmula:
[Bilirrubina] x [Albumina] / [Bilirrubina-Albumina] = K
a quantidade de bilirrubina livre varia inversamente à concentração de albumina disponível para se lhe ligar. (Figura 2)
FIGURA 2. Transporte, captação e conjugação da Bilirrubina.
A capacidade de fixação bilirrubina-albumina é susceptível de ser diminuída por certos factores (traduzindo competição com a bilirrubina na sua ligação à albumina):
- diminuição do pH;
- diminuição da concentração de albumina na circulação, por ex. no RN pré-termo;
- fenómenos competitivos desempenhados por substâncias biológicas (por ex. AGNE ou ácidos gordos não esterificados, alfa-globulinas, lipoproteínas, etc.);
- fenómenos competitivos desempenhados por certos fármacos, por ex. drogas aniónicas, sulfamidas, antibióticos (moxalactam, ácido fusídico, infusão rápida de ampicilina); e
- fenómenos competitivos desempenhados por meios de contraste imagiológico (ácido ipanóico, e outros), ácido acetilsalicílico, etc.).
Em suma, os referidos factores diminuem a probabilidade de ligação da bilirrubina à albumina, passando aquela a circular livre no plasma, e em quantidade tanto maior quanto maior a taxa de ocupação dos centros de ligação da albumina por outras “substâncias concorrentes”, menor a quantidade de albumina e o pH.
Por outro lado, quanto maior o teor de bilirrubina livre, não ligada à albumina, maior a probabilidade de passagem daquela para o espaço intracelular (e, designadamente, células nervosas).
Este risco pode ser quantificado do seguinte modo (considerando as relações molares bilirrubina/albumina a um pH de 7,40):
- 1 grama de albumina fixa, no máximo, 17 mg de bilirrubina (29 µmoles);
- albuminémia normal <> 35 g/L (ou 3,5 g/dL) <> (510 µmoles).
Ora, a saturação (ou capacidade máxima de fixação de bilirrubina pela albumina) atinge-se quando o valor da bilirrubina em µmoles atingir 510 µmoles (ver acima), ou seja, quando atingir cerca de 29 mg/dL (ou 290 mg/L<> 510 µmoles), ou relação molar de 1/1.
Se o valor de albuminémia for inferior a 35 g/L (por ex. no RN pré-termo), tal saturação (e risco consequente de passagem de bilirrubina para a célula nervosa) atinge-se com valores inferiores de bilirrubina.
Em conclusão, o risco de neurotoxicidade deve ter em conta, não só o valor da bilirrubinémia indirecta ou não conjugada, mas também o teor de albumina no sangue (verificando-se risco se relação molar ≥1/1).
Captação da bilirrubina pelo hepatócito e conjugação
Não obstante a ligação estreita bilirrubina-albumina, a bilirrubina não conjugada é separada da albumina ao nível dos sinusóides com a comparticipação de receptores de membrana da bilirrubina à superfície dos hepatócitos, sendo depois captada pelo hepatócito. (Figura 2)
A transferência da bilirrubina do líquido extracelular para o citosol hepático parece ser influenciada pelos respectivos gradientes de concentração através da membrana celular e pelo teor em proteínas disponíveis no referido citosol, chamadas proteínas captadoras de aniões: Y e Z. São precisamente as proteínas Y e Z (esta última em menor grau) que transportam a bilirrubina até ao retículo endoplásmico onde tem lugar a glucurono-conjugação, principalmente com o ácido glucurónico (uridina-di-phosfato-glucurónico-ácido ou UDPGA), realizada sob a dependência duma enzima dos microssomas, a UDPG-T (uridina-di-phosfato-glucurónico-transferase).
A UDPGA provém da uridina-di-phosfato-glucose (UDPG) através dum processo de desidrogenação dependente da enzima UDPG-desidrogenase. A função da UDPG-desidrogenase depende dum suprimento contínuo de glucose e/ou de reservas de glicogénio; isto é, a glucose actua como fonte de ácido glucurónico, sendo, portanto, fundamental para a função normal do sistema de conjugação da bilirrubina.
De salientar que a bilirrubina também se pode conjugar, acessoriamente, com a xilose, glucose, outros glúcidos, e possivelmente, com sulfatos e aminoácidos.
No RN de termo e, sobretudo, no RN pré-termo reúnem-se um certo número de circunstâncias susceptíveis de dificultar directa ou indirectamente a conjugação: défice enzimático transitório, tendência para a hipoglicémia associada a deficientes reservas de glucose e/ou imaturidade enzimática, défice de proteína Y, etc.. A maturação ou intensificação da actividade da UDPG-T depende da presença da hormona tiroideia e dum substrato – a bilirrubina – que, na vida fetal, é eliminada através da placenta. Por outro lado, a referida actividade pode ser induzida pelo fenobarbital ou outros fármacos (ver adiante icterícia fisiológica).
Polimorfismos e mutações nos genes das enzimas de conjugação podem explicar situações caracterizadas por não conjugação da bilirrubina, originando hiperbilirrubinémia não conjugada (indirecta) a que se fará referência adiante.
No feto não existe glucurono-conjugação, sendo que toda a bilirrubina formada passa livremente a barreira placentária e é metabolizada no fígado da mãe.
Excreção da bilirrubina
Somente após a conjugação se torna possível a excreção (de modo activo com a participação de sistema de transporte dependente de energia – bombas MRPR2 e MDR3-) pelo hepatócito nos canalículos biliares e tubo digestivo: a bilirrubina conjugada, chegando ao intestino veiculada pela bílis, é ulteriormente reduzida e degradada pelas bactérias saprófitas do tubo digestivo em urobilinogénio e estercobilinogénio. (Figura 3)
Acontece, no entanto, que no período pós-parto imediato não existem bactérias no tubo digestivo; o microbioma, com efeito, só surge após se iniciar a alimentação; ou seja, o urobilinogénio e estercobilinogénio (precursores de urobilina e estercobilina, respectivamente) somente se formam se for iniciada a alimentação per os. Uma pequena fracção de urobilinogénio é excretada na urina. A oxidação de urobilina e estercobilina contribui para a cor das fezes e urina.
Existe também outra particularidade da fisiologia do intestino do feto e RN: é a existência da beta-glucuronidase no lume e epitélio cuja função consiste em catalizar a desconjugação da bilirrubina (função que está aumentada na ausência de microbiota), dando origem a ácido glucurónico e a bilirrubina não conjugada. Esta última é reabsorvida para a circulação, contribuindo para aumentar significativamente a taxa sérica de bilirrubina não conjugada ou indirecta (recirculação êntero-hepática).
FIGURA 3. Excreção da Bilirrubina (Consultar Glossário geral: Microbiota).
Pode concluir-se que a bílis contém elevada concentração de bilirrubina que, no adulto, é sobretudo bilirrubina IXa*, pigmento que não poderá ser excretado sem conjugação. Contudo, no RN, para além da bilirrubina IXa, formam-se outros isómeros hidrossolúveis que podem ser excretados directamente (pela bílis e urina), isto é, sem necessidade de conjugação. Por outro lado, esta particularidade permite tirar partido do efeito fotoquímico da luz com comprimento de onda entre 420 e 480 nm, a qual promove a transformação de bilirrubina IXa em isómeros hidrossolúveis (por ex. Z-lumirrubina) excretados pela bílis e urina, o que pode constituir estratégia para reduzir o nível sérico de risco da hiperbilirrubinémia em determinadas situações, rendibilizando a eliminação do pigmento. (ver adiante)
*Bilirrubina IX-a ou IX-α (sinónimos). De acordo com a configuração dos arranjos espaciais dos átomos são descritas 2 configurações da molécula: Z ou cis e E ou trans. |
Toxicidade da bilirrubina
Ao abordar a problemática da neurotoxicidade da bilirrubina é importante uma referência sucinta ao conceito fisiológico clássico da chamada barreira hemato-encefálica que se opõe à passagem de macromoléculas e compostos polares; tal barreira corresponde a um substrato estrutural constituído pelas células endoteliais dos capilares cerebrais e pelas junções intercelulares que restringem a difusão intercelular e o movimento de solutos.
Ora, a fracção de bilirrubina livre, não ligada à albumina e não conjugada, atravessa mais facilmente tal barreira, o que determina maior risco de toxicidade da célula do SNC. Os factores críticos que comprometem o funcionamento de tal barreira são a imaturidade, o nível de bilirrubina livre não conjugada (condicionada por exemplo, pela hipoalbuminémia, como foi atrás referido) e a velocidade de subida da concentração sanguínea da mesma.
Outros factores podem tornar tal barreira mais permeável, quer no RN de termo, quer no pré-termo, tais como: acidose metabólica ou respiratória graves, hipoxémia persistente e infecção sistémica; estes últimos factores podem explicar situações de kernicterus ou encefalopatia bilirrubínica em RN de termo ou quase de termo. Em suma, todos estes factores contribuem para aumentar a toxicidade da bilirrubina.
Factores predisponentes de icterícia neonatal
A elevada frequência com que surge icterícia no RN e, de modo especial, no RN pré-termo relativamente a outros grupos etários, é explicável por um conjunto de factores (predisponentes), os quais podem ter papel importante, mesmo em situações consideradas não patológicas:
Factores predisponentes
|
Classificação etiopatogénica
Em função das alterações verificadas nos diversos passos do metabolismo da bilirrubina e dos principais mecanismos responsáveis pela elevação da bilirrubina são deduzidos os três grandes grupos de síndroma ictérica:
- Multifactorial;
- Não hemolítica, englobando situações, quer acompanhadas de elevação da bilirrubina não conjugada, quer acompanhadas de elevação da bilirribina conjugada (directa);
- Hemolítica, englobando situações acompanhadas de elevação da bilirrubina não conjugada (indirecta).
O Quadro 1 sistematiza os grandes grupos etiopatogénicos de hiperbilirrubinémia não conjugada.
QUADRO 1 – Hiperbilirrubinémia não conjugada (indirecta) (Icterícia hemolítica e não hemolítica).
Multifactorial
|
Causa não hemolítica
|
Causa hemolítica
|
Factores de risco
Na prática clínica é importante identificar, logo desde o nascimento, em RN de termo e pré-termo, os principais factores de risco elevado de hiperbilirrubinémia indirecta:
- Predisposição genética para hiperbilirrubinémia neonatal (frequente em determinadas etnias asiáticas);
- Antecedentes familiares de afecção hemolítica;
- Diabetes materna;
- Prematuridade (risco mais elevado se idade gestacional entre 35 e 38 semanas);
- Irmão anterior com síndroma ictérica necessitando de intervenção;
- Sexo masculino;
- Macrossomia fetal (>4.000 gramas) associada a diabetes materna;
- Incompatibilidade de grupos sanguíneos mãe-filho com prova de Coombs directa positiva no RN (ver adiante);
- Icterícia neonatal surgida nas primeiras 24 horas de vida (precoce) apontando para causa hemolítica (em geral, doença hemolítica por incompatibilidade sanguínea mãe-filho);
- Exame físico evidenciando sufusões, equimoses ou hematomas;
- Hipogalactia associada a perda ponderal significativa, etc..
Notas Importantes:
|
Semiologia e exames complementares
Perante um RN ictérico, a anamnese perinatal e o exame físico do RN poderão determinar, em certos casos, a realização dum conjunto de exames complementares para esclarecimento etiológico, salientando-se que o aparecimento de icterícia nas primeiras 24 horas de vida pós-natal (situação, até prova em contrário, patológica) obrigará sempre a investigação laboratorial, cuja sequência é ditada pelo contexto clínico. (ver adiante)
Nas alíneas seguintes são discriminados os principais exames complementares a realizar:
- Alíneas 1. e 2. em situações de icterícia de aparecimento precoce (< 24 horas de vida), sugerindo, até prova em contrário, factor etiológico de hemólise;
- Alínea 3. em situações de icterícia de aparecimento não precoce, sugerindo factor etiológico de obstrução do fluxo normal da bílis (colestase), sendo que pode haver situações mistas (associadas a hemólise).
- Os exames laboratoriais de primeira linha, prioritários e essenciais são:
- Grupo sanguíneo (Rh/antigénios D, d; AB0) na mãe; idem no RN (sangue do cordão ou sangue periférico) se mãe Rh negativo e/ou 0; pressupõe-se, claro, que o grupo sanguíneo da mãe deverá já ser conhecido tendo em conta a vigilância pré-natal;
- Provas de Coombs (pesquisa de anticorpos maternos anti-D) (prova directa no RN e indirecta na mãe) se mãe Rh negativo (dd ou Du) e RN Rh positivo (DD ou Dd)**;
- Pesquisa de anticorpos anti-A e anti-B no sangue do cordão ou no sangue periférico (RN) tratando-se de mãe do grupo 0 e de RN do grupo A ou B;
- Hemoglobina e hematócrito no RN;
- Doseamento de bilirrubina total, fracções conjugada e não conjugada;
- Estudo morfológico do sangue periférico no RN [a detecção de esferócitos no sangue do RN poderá ser (no período neonatal) sinal indirecto de iso-imunização AB0 e não de esferocitose hereditária];
- Contagem de reticulócitos no RN.
** Notas Importantes → A prova de Coombs (ou prova da antiglobulina) directa permite pesquisar anticorpos (imunoglobulinas) fixados sobre os eritrócitos do doente. Compreende esquematicamente os seguintes passos: 1) Junção de eritrócitos do doente, com anticorpos fixados sobre os eritrócitos, ao soro de Coombs (obtido por injecção no coelho de gama-globulina humana permitindo obter anticorpos anti-imunoglobulina humana- ou anticorpos anti-anticorpos do doente fixados sobre os eritrócitos; 2) A ligação anticorpo anti-imunoglobulina humana aos anticorpos fixados sobre os referidos eritrócitos provoca aglutinação dos mesmos (prova não específica dos anticorpos anti-D). → A prova de Coombs indirecta permite pesquisar anticorpos no soro do doente (livres ou não fixados sobre os eritrócitos). Compreende os seguintes passos: 1) Junção ao soro (com anticorpos livres) de eritrócitos supostamente com antigénios correspondentes aos referidos anticorpos; 2) Se tal acontecer, os anticorpos fixam-se sobre esses eritrócitos, recobrindo-os; 3) Procedimento, a partir daqui semelhante ao descrito para a prova de Coombs directa. |
- Após exclusão de situações mais frequentes no nosso meio (tendo em conta que a prevalência de determinadas situações pode variar de região para região), são citados outros exames:
- Pesquisa de anticorpos maternos para antigénios irregulares (anti-c, anti-E, anti-Kell, etc.) se mãe Rh positivo no contexto clínico sugestivo de doença hemolítica perinatal;
- Doseamento quantitativo de G-6PD (glucose-6 fosfato desidrogenase);
- Outros doseamentos enzimáticos em função do contexto clínico;
- Resistência globular.
*Nota importante: em função do grau de hemólise, a icterícia poderá ser notória entre as 24 e 48 horas. |
- Nos casos associados a bilirrubinémia conjugada >2 mg/dL (icterícia raramente presente na data do nascimento, em geral notória durante ou a partir da 1ª semana de vida) estão indicados exames tais como pesquisa de pigmentos e sais biliares na urina e fezes, pesquisa de substâncias redutoras na urina, provas de função hepática, tempo de protrombina, ALT, AST, fosfatase alcalina, serologia do grupo TORCHS, rastreio de doenças metabólicas, ecografia hepatobiliar, etc.
Hiperbilirrubinémia multifactorial
Icterícia fisiológica
Etiopatogénese
A chamada “icterícia fisiológica” constitui um quadro clínico que surge em mais de 50% dos RN aparentemente saudáveis; pode considerar-se que faz parte do desenvolvimento pós-natal normal. A sua etiopatogénese, multifactorial, diz respeito a alterações, em grau moderado e em simultâneo, de fases diversas do metabolismo da bilirrubina antes descrito:
- Excesso de oferta de bilirrubina ao hepatócito devido à policitémia relativa; a destruição eritrocitária no sistema reticuloendotelial produz maior quantidade de bilirrubina – 6 mg/kg/dia versus 3-4 mg/kg/dia no adulto, sendo que, como foi referido antes, os eritrócitos do RN têm uma vida média mais curta (cerca de 80 dias versus 120 dias no adulto) e 1 grama de Hb produz cerca de 34 mg de bilirrubina;
- Devido à imaturidade enzimática do fígado, verifica-se captação e conjugação diminuídas (designadamente por défice de proteína Y e de UDPG-T);
- Microbiota intestinal deficitária ou ausente, limitando a transformação da bilirrubina conjugada em urobilinogénio;
- Maior actividade da enzima beta-glucuronidase no intestino do RN, contribuindo para a hidrólise da bilirrubina conjugada, formando-se bilirrubina não conjugada que, sendo reabsorvida pela circulação êntero-hepática, contribui para a elevação da bilirrubina não conjugada no sangue periférico.
Manifestações clínicas
Tendo em conta que a síndroma ictérica é um processo dinâmico, face a determinado caso surgido, será mais rigoroso no momento da observação excluir icterícia fisiológica do que confirmar o diagnóstico com segurança, pois um dos critérios habitualmente utilizado é a sua duração.
Assim, uma icterícia, provavelmente, não é fisiológica se:
- Surgir antes das 24 horas de vida;
- Corresponder a valor de bilirrubinémia total no sangue do cordão superior a 4 mg/dL;
- A velocidade de subida da bilirrubinémia total for superior a:
→ >0,5 mg/dL/hora
→ >5 mg/dL/dia - A bilirrubinémia total for >13 mg/dL no RN de termo (ou >10 mg/dL no pré-termo);
- Tiver duração:
→ >10 dias no RN de termo (excepto se alimentado ao peito)
→ >21 dias no RN pré-termo - Corresponder a valor de bilirrubinémia conjugada (directa) >2 mg/dL
- Existir anemia
- Existir hepatosplenomegália
Inversamente, a evolução natural da icterícia fisiológica no RN de termo saudável pode ser assim descrita: início depois das 24 horas de vida, não devendo exceder 13 mg/dL na primeira semana, ritmo de incremento inferior a 5 mg/dL/dia; início da descida de valores em cerca de 1 semana no RN de termo, e em cerca de 2 semanas no RN pré-termo.
Nota: de acordo com estudos epidemiológicos concluiu-se que cerca de 50% das icterícias com valor de bilirrubinémia superior a 13 mg/dL não são fisiológicas. |
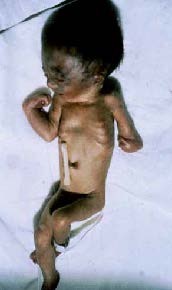
A icterícia neonatal progride no sentido craniocaudal (cabeça-pescoço àtórax àabdómen-coxas àbraços-antebraços-pernas àmãos-pés) devido à afinidade do pigmento bilirrubínico lipossolúvel para os lípidos do SNC. De acordo com estudos empíricos de correlação, que datam da década de 60 do século passado, a cor ictérica verificada na cabeça e pescoço corresponde grosseiramente a valores séricos de bilirrubina entre 4,5 e 8 mg/dL; até ao umbigo entre 9 e 12 mg/dL; até aos joelhos entre 8 e 15 mg/dL; até à região palmoplantar >15 mg/dL. De realçar que a avaliação clínica através deste critério clínico não é suficientemente segura, implicando designadamente boa visibilidade com luz natural.
Actuação prática
No contexto de presumível quadro de icterícia fisiológica, e tratando-se de criança saudável de termo, não haverá necessidade de exames complementares laboratoriais. No entanto, hoje em dia muitas unidades dispõem de aparelhos de avaliação não invasiva da bilirrubinémia (bilirrubinómetros transcutâneos), utilizando os princípios da reflectância espectrofotométrica para determinação da taxa de bilirrubina impregnando a pele, a qual é considerada representativa da bilirrubina no sangue.
Tais aparelhos avaliam determinado índice que, de acordo com tabelas (com valores de correlação para RN pré-termo, e RN com pele pigmentada), permitem estabelecer a correspondência com a bilirrubinémia com boa correlação (coeficiente entre 0,91-0,93).
Os mesmos estão hoje vulgarizados e, diminuindo a necessidade de colheitas sanguíneas, devem ser utilizados como aparelhos para rastreio; embora confiáveis, as medições da bilirrubina transcutânea poderão subestimar valores acima de 13-14 mg/dL; nestas circunstâncias, deve confirmar-se o valor pelo método convencional de colheita de sangue.
Se o RN estiver submetido a fototerapia (que origina pigmentação cutânea), há que colocar um adesivo na zona da pele a ser testada caso se proceda a ulteriores determinações com este método, a fim de não falsear os resultados.
Nalguns centros, como rastreio, é utilizada tecnologia para determinar a carboxiemoglobina (COHb) ou o monóxido de carbono expirado (ETCO <> end-tidal carbon monoxide), sendo que, ambos corrigidos para o monóxido de carbono ambiente, constituem um índice da produção de bilirrubina in vivo. Esta tecnologia baseia-se na produção de CO em resultado do catabolismo do heme. (ver atrás Metabolismo da bilirrubina)
Embora este método não tenha evidenciado especificidade e sensibilidade mais elevadas que a bilirrubinometria transcutânea, perante situação de icterícia poderá contribuir para o diagnóstico diferencial entre hiperbilirrubinémia não conjugada e hiperbilirrubinémia conjugada (nesta última situação, não se verificando aumento de CO expirado).
Dada a possibilidade de evolução de certos casos de icterícia para valores de risco de bilirrubinémia após a alta hospitalar, mesmo em recém-nascidos de termo ou quase de termo, saudáveis e sem sinais de hemólise, Buthani nos EUA concebeu um nomograma aplicável em recém-nascidos a partir de 35 semanas de idade gestacional inclusive, em que são estratificados determinados valores de bilirrubinémia em mg/dL e respectivos percentis (P) em função da idade em horas; foram consideradas curvas evolutivas entre as 12 horas e as 144 horas, delimitando 4 zonas:
- de baixo risco (percentil < 40);
- risco intermédio inferior (percentil 40-75);
- risco intermédio superior (percentil 76-95); e
- risco elevado (percentil > 95).
Ou seja, do valor de bilirrubinémia às 48, 60, 72 ou 96 horas, dependerá a atitude a tomar. Esta estratégia tem sido recomendada pela AAP, tendo em conta a realidade actual generalizada de alta precoce da maternidade, o que implica vigilância ulterior. (Quadro 2)
QUADRO 2 – Relação bilirrubinémia-idade em horas e actuação prática.
A: Alta e nova observação clínica 48 horas depois (Adaptado de Buthani & Johnson, 2000) | ||||
| Idade (horas) | P < 40 BRB | P 40-75 BRB | P 76-95 BRB | P > 95 BRB |
| 48 60 72 96 Actuação | < 8,5 < 9,5 < 11,1 <12,3 A | 8,5-10,7 9,5-12,5 11,1-13,3 12,3-15,1 B | 10,8-13,1 12,6-15,1 13,4-15,8 15,2-17,3 C | > 13,1 > 15,1 > 15,8 > 17,3 D |
Tratando-se de hiperbilirrubinémia não conjugada sem sinais de hemólise em RN pré-termo de muito baixo peso, há, pelo contrário, que ponderar a necessidade de determinação frequente de bilirrubina sérica pelo maior risco de kernicterus, havendo determinados factores predisponentes a reiterar, tais como:
- hipoalbuminémia;
- presença de factores susceptíveis de aumentar a taxa de bilirrubina não ligada à albumina com maior probabilidade de penetração na célula nervosa;
- hipoxémia, e infecção (propiciando maior permeabilidade da barreira hemato-encefálica);
- peso muito baixo (de acordo com regra empírica: considerando o peso de nascimento em gramas e o valor de bilirrubinémia em mg/dL, existe risco de kernicterus se o valor da bilirrubinémia for igual ou superior ao valor dos dois primeiros dígitos do peso; por ex. bilirrubinémia de 11 mg/dL e peso de 1.100 gramas).
Hiperbilirrubinémia não conjugada de causa não hemolítica
1. Icterícia por síntese aumentada de bilirrubina
Este grupo, englobando dum modo geral quadros benignos, é caracterizado por hiperbilirrubinémia indirecta não acompanhada de hemólise (os valores de bilirrubina ultrapassam os níveis considerados fisiológicos).
Os exemplos clássicos são:
- Policitémia
(RN nas seguintes circunstâncias: macrossómicos, de mães diabéticas, com restrição de crescimento fetal, com antecedentes fetais de hipoxémia crónica, de atraso de laqueação do cordão umbilical, no contexto de transfusão feto-fetal ou placento-fetal e de administração de ocitocina intra-parto em doses superiores a 20 Unidades, etc.); - Reabsorção de sangue extravascular
(RN com hematomas, equimoses, petéquias, “máscara equimótica”, hemorragia intracraniana, etc.).
Constituindo a prematuridade um factor de risco de kernicterus como foi dito antes, há sempre que atender aos respectivos factores predisponentes descritos na alínea anterior.
2. Icterícia por defeito de captação e/ou de conjugação da bilirrubina
Como exemplos de defeitos do metabolismo nesta etapa citam-se:
- Síndroma de Crigler-Najjar
Esta síndroma integra dois tipos:- tipo I, mais grave, transmitido hereditariamente de modo autossómico recessivo.
A etiopatogénese relaciona-se com ausência total da actividade enzimática da UDPG-T (uridino-difosfo-glucuronil-transferase) por mutações no gene UGT1A1, do que resultam: hiperbilirrubinémia não conjugada podendo atingir níveis críticos nos primeiros 2-3 dias de vida (por vezes superiores a 35 mg/dL) e risco elevado de encefalopatia. As medidas correctivas englobam, entre outras, fototerapia de longa duração, exsanguinotransfusão e eventual transplantação hepática. - tipo II, mais benigno e resultante de défice parcial de UDPG-T, traduzido na clínica por formas mais ligeiras de hiperbilirrubinémia (não ultrapassando em geral 20 mg/dL), sendo o risco de encefalopatia muito reduzido; por vezes as primeiras manifestações ocorrem após o período neonatal ou na 2ª infância. Como tratamento sintomático utiliza-se o fenobarbital pelo seu papel de indutor enzimático.
- tipo I, mais grave, transmitido hereditariamente de modo autossómico recessivo.
- Síndroma de Gilbert
Esta síndroma, com transmissão autossómica recessiva e, mais raramente, dominante, constitui o defeito de conjugação mais frequente da bilirrubina, surgindo com uma frequência de 1/1.000 nados vivos; é caracterizada por icterícia ligeira (bilirrubinémia crónica – 3-4 mg/dL, de intensidade oscilante, sendo que os valores de bilirrubinémia aumentam significativamente se houver suprimento alimentar deficiente ou episódio infeccioso. Não existe risco de kernicterus.
Foram descritos polimorfismos e mutações de genes determinando a expressão da enzima UDPG-T (genes UGT1A1, TATA box, CAT box, etc.) Descrevem-se formas homozigóticas e heterozigóticas, sendo hoje possível o estudo de biologia molecular. A benignidade do quadro não requer tratamento o qual, aliás, não existe.
A combinação de um genótipo benigno de síndroma de Gilbert com outro factor que aumente a bilirrubina pode estar na base de quadros com hiperbilirrubinémia elevada (> 20 mg/dL) ou mais prolongados (por ex. aleitamento materno). - Síndroma de Lucey-Driscoll
Caracteriza-se por um quadro de hiperbilirrubinémia familiar transitória, sendo que a bilirrubinémia poderá atingir níveis de risco de encefalopatia, o que obrigará a exsanguinotransfusão. A etiopatogénese não está esclarecida, admitindo-se o papel de um factor sérico inibidor da UDPG-T. - Outras situações
O mecanismo de captação e/ou conjugação da bilirrubina pode ser comprometido pela acção de fármacos utilizados na grávida, parturiente ou puérpera lactante (através do leite materno) como ocitocina, novobiocina, pregnandiol, etc.. No hipotiroidismo pode igualmente verificar-se défice transitório da enzima UDPG-T.
3. Icterícia por circulação êntero-hepática aumentada
O mecónio existente no intestino pesa cerca de 200 gramas, estando incluído neste peso 175 mg de bilirrubina (50% da qual não conjugada); ou seja, quantidade de bilirrubina 5 a 10 vezes superior à produção diária num RN de termo sem patologia.
Nos casos em que existe interrupção do trânsito intestinal ou diminuição do peristaltismo levando a atraso ou interrupção da eliminação do referido mecónio, criam-se condições para que a beta-glucoronidase actue com mais efectividade sobre a bilirrubina conjugada existente no mecónio “estagnado”, promovendo a sua desconjugação, absorção e aumentando consequentemente os níveis séricos de bilirrubina não conjugada.
Como exemplos de situações clínicas explicadas por este mecanismo, citam-se:
- Alimentação entérica tardia (jejum prolongado pós-parto);
- Problemas obstrutivos do tracto digestivo;
Os casos de estenose hipertrófica do piloro, estenoses ou atrésias intestinais, íleo paralítico, doença de Hirschprung, obstrução intestinal baixa, etc. tipificam quadros clínicos acompanhados de diminuição do peristaltismo intestinal - Sangue deglutido intra-parto.
Aplica-se neste caso o que foi dito a propósito do mecónio estagnado (contendo bilirrubina), uma vez que 1 grama de Hb constitui substrato para a produção de 34 mg de bilirrubina.
4. Icterícia associada à amamentação
A etiopatogénese desta forma clínica relaciona-se fundamentalmente com o défice de suprimento energético por secreção láctea insuficiente, ou por razões várias que poderão determinar diminuição da frequência das mamadas ao longo do dia. Como resultado de tal suprimento insuficiente poderá verificar-se diminuição do reflexo gastrocólico, hipoperistaltismo intestinal e atraso da eliminação do mecónio; são, assim, criadas as condições já descritas a propósito da circulação êntero-hepática aumentada. Sob o ponto de vista teleológico, estudos actuais sugerem que tal mecanismo seja fisiológico e protector do organismo considerando a acção antioxidante da bilirrubina.
A evolução natural desta síndroma ictérica pode assim resumir-se: icterícia surgida após as 24 horas de vida, sem sinais de hemólise (designadamente, anemia ou hepatosplenomegália), com maior intensidade verificada pelos 7-8 dias de vida e valores máximos de bilirrubinémia indirecta, atingindo 16-17 mg/dL, acompanhada de perda exagerada de peso e, nalguns casos, de hipernatrémia (> 150 mEq/L) com sinais de desidratação.
Para obviar esta situação (que poderá levar a internamento hospitalar), torna-se necessário acompanhar cuidadosamente o estabelecimento do aleitamento materno, reavaliar os valores de bilirrubina, os riscos do recém-nascido e a quebra ponderal existente. Para além da eventual necessidade de reidratação, poderá estar indicada fototerapia.
5. Icterícia secundária ao leite materno
A etiopatogénese desta forma clínica poderá relacionar-se fundamentalmente com dois factores:
- teor aumentado de beta-glucuronidase no leite materno, o que sucede em 20-40% das mulheres, levando a aumento da desconjugação e da circulação êntero-hepática da bilirrubina;
- teor aumentado de lipase no leite de certas mães – lactantes do qual resulta correspondente teor mais elevado em ácidos gordos não esterificados de cadeia curta que, absorvidos no duodeno, bloqueiam o sistema de captação e transporte intra-hepatócito da bilirrubina, para além de inibirem a UDPG-T.
A evolução clínica pode ser sintetizada do seguinte modo: trata-se duma icterícia que surge, em geral, após o 3º-4º dia em cerca de 20-30% dos RN com aleitamento materno exclusivo, mais intensa entre o 10º e 15º dia de vida, prolongando-se, por vezes, até aos 2 meses. Em cerca de 2-4% dos casos são atingidos valores de bilirrubinémia da ordem de 20-25 mg/dL. Inicialmente esta situação comporta-se como “icterícia fisiológica prolongada”.
Na prática, é necessário assegurar que a hiperbilirrubinémia permanece na forma não conjugada e não atinge níveis preocupantes. Assim, nos casos de hiperbilirrubinémia muito elevada, e verificando-se a presença de factores de risco de kernicterus, o RN deverá ser submetido a fototerapia, suspendendo-se a alimentação com leite materno durante 48 horas, o que pode constituir “prova” diagnóstica; com efeito, a suspensão do aleitamento levará a diminuição significativa da bilirrubinémia. Salienta-se, contudo, que a reintrodução do leite materno poderá originar subida da bilirrubinémia, embora para níveis inferiores aos anteriores.
Se a icterícia se prolongar para além de 2-3 semanas, haverá que fazer o diagnóstico diferencial com patologia associada responsável igualmente por icterícia prolongada como por exemplo atrésia das vias biliares ou outra causa de colestase. De salientar, contudo, que nesta última condição, geralmente o estado geral está comprometido, a icterícia é “verdínica“ e há antecedentes de baixo peso de nascimento e, eventualmente, outros sinais associados); uma análise sumária de urina excluindo a presença de bilirrubinúria) e a ausência de alterações macroscópicas das fezes (acolia ou hipocolia, em geral intermitente) excluem tal quadro.
Em suma, nos RN submetidos a alimentação com leite materno são descritos dois quadros clínicos associados a icterícia que importa distinguir.
Hiperbilirrubinémia não conjugada de causa hemolítica
Em complemento das noções descritas na Parte sobre Hematologia (generalidades sobre anemias hemolíticas), nesta alínea são abordadas como protótipos as diversas formas clínicas da doença hemolítica perinatal por incompatibilidade sanguínea mãe-filho (sistemas AB0, Rh e outros).
1. Doença hemolítica perinatal por iso (ou alo)-imunização Rh/anti-D
Definição e importância do problema
A doença hemolítica perinatal por iso-imunização Rh/anti-D define-se como o processo mórbido em que surge hemólise no feto e RN como consequência da ligação de anticorpos maternos anti-D aos eritrócitos fetais com antigénios D ou com a variante Du herdados do pai e inexistentes no organismo materno.
A iso-imunização materno-fetal constitui no nosso meio a causa mais frequente de icterícia hemolítica no período neonatal; em cerca de 1/3 do total de casos ocorre em RN com grupo Rh positivo, de mães com grupo Rh negativo (incompatibilidade Rh) e, em cerca de 2/3, nos RN com grupos sanguíneos A ou B, de mães 0 (incompatibilidade AB0).
Os restantes casos de iso-imunização (~ 1-2% do total de casos) são explicados por iso-imunização atípica – subgrupos Kell, Duffy, Kidd, MNS e outros mais raros -; a eles se fará referência adiante.
Globalmente, a incidência de doença hemolítica por incompatibilidade Rh é da ordem de 0,2-0,4/1.000 gravidezes; no que respeita às formas por incompatibilidades doutros grupos tal prevenção ainda não é possível.
O risco de iso-imunização Rh (mãe Rh negativo e filho Rh positivo) é cerca de 16% em cada gravidez AB0 compatível, e cerca de 1-2% em cada gravidez AB0 incompatível. (ver adiante)
Etiopatogénese
O sistema Rh depende de três pares de alelos, sendo que cada elemento do par é herdado de cada progenitor. Entre os cerca de 48 antigénios que fazem parte do sistema Rh, em combinações muito diversas (determinados por outros tantos genes), os designados por c, C, d, D, e, E são os mais importantes quanto à capacidade de originarem a produção de anticorpos. As combinações CDe, cDE (correspondentes ao fenótipo Rh positivo/Rh (+) pela presença do antigénio D) são as mais frequentes, e a combinação cde (correspondente ao fenótipo Rh negativo/Rh (-) pela ausência do antigénio D. Nos caucasianos, a ausência de antigénio D ocorre em cerca de 15% da população, nos africanos em cerca de 7%, e nos asiáticos (Japão e China) em <1%.
Um indivíduo pode, assim, evidenciar as seguintes relações fenótipo →genótipo:
- Rh (-)→ cde, cde;
- Rh (+) homozigoto→ (por ex. CDe, cDE ou simplesmente DD);
- Rh (+) heterozigoto→ (por ex. CDe, cde ou simplesmente Dd).
Conclui-se que um homem Rh (+) homozigoto casado com uma mulher Rh (-) terá sempre filhos Rh (+) Dd; um homem Rh (+) heterozigoto casado com uma mulher Rh (-) poderá ter filhos Rh (+) Dd em 50% dos casos, e Rh (-) dd em 50% dos casos.
Somente os fetos Rh (+), isto é, com o antigénio D (presente na membrana eritrocitária a partir das 4 a 7 semanas de idade gestacional), estimulando a produção por parte da mãe Rh (-) ou D (-) de anticorpos anti-D (ou seja, iso-imunização) podem ser afectados.
As mães com a variante Du raramente produzem anticorpos anti-D quando os respectivos fetos são portadores de antigénio D ou Rh (+). No entanto, mães Rh (-) poderão ser imunizadas por fetos portadores de Du.
A iso-imunização verifica-se quando há passagem transplacentar de eritrócitos fetais para a circulação materna, sendo que a hemorragia feto-materna ocorre em, pelo menos, 50% das gestações (sobretudo no 3º trimestre). Em termos quantitativos, o volume de sangue que passa para a circulação materna pode oscilar entre 1 mL e 30 mL, sobretudo se se verificar parto traumático implicando manobras e procedimentos invasivos. Ora, o grau de resposta imune materna ao antigénio D é proporcional ao volume da hemorragia/transfusão feto-materna.
Idêntico fenómeno anteriormente à gravidez, em mãe Rh (-) pode ocorrer como resultado de transfusão de sangue com antigénio D, de injecção acidental de eritrócitos D (+) pelo uso de seringas partilhadas com indivíduos toxicodependentes, e de transplantação de produtos portadores do referido antigénio D anteriormente à gravidez.
A resposta imune primária materna ao antigénio D atingindo a circulação e proveniente do feto é lenta traduzindo-se, cerca de 1 a 6 meses depois, pelo aparecimento de anticorpos IgM anti-D que, não atravessando a placenta, são inócuos; em regra, é o que se passa no decurso duma primeira gravidez.
A resposta imune secundária materna a ulterior exposição a antigénios D (correspondendo, em regra, a segunda gravidez, e a partir das 12 semanas) é mais rápida, traduzindo-se pelo aparecimento, em grande quantidade, de anticorpos anti-D predominantemente IgG que, atravessando a placenta, aderem com grande “avidez”, através da sua fracção Fc, à membrana dos eritrócitos fetais Rh (+) (isto é, com antigénio D); estes, atraindo macrófagos e monócitos, são destruídos no espaço extravascular (baço). Em suma, a probabilidade de iso-imunização vai aumentando com o número de gravidezes, pois os anticorpos anti-D formados como resposta a sucessivas estimulações antigénicas (inicialmente predominando os do tipo IgM), vão sendo, em cada vez maior número, do tipo IgG, que atravessam a placenta.
Notas Importantes:
|
Como consequência da hemólise surge:
- Anemia fetal com repercussão essencialmente em dois órgãos:
- coração, cuja função pode claudicar e levar a insuficiência cardíaca e hidropisia fetal;
- fígado, cuja função pode igualmente claudicar, levando a diminuição da síntese da albumina, diminuição da pressão oncótica que, por sua vez, agrava a hidropisia; igualmente há elevação da síntese da eritropoietina e surgem focos de eritropoiese com aparecimento de formas jovens no sangue periférico; idênticos focos surgem igualmente no baço, rins e suprarrenais; como resultado do aparecimento de focos de eritropoiese hepática e no baço verifica-se hepatosplenomegália; outra consequência da formação de focos de eritropoiese hepática é a obstrução do fluxo sanguíneo (podendo conduzir a hipertensão portal) e do fluxo biliar (podendo conduzir a colestase que passará a ser notória na vida extrauterina); nas formas graves poderá surgir morte fetal;
- Hiperprodução de bilirrubina não conjugada; durante a vida intrauterina a bilirrubina em excesso é eliminada através da mãe; após o nascimento poderá originar quadro de hiperbilirrubinémia com risco de kernicterus.
Manifestações clínicas
Classicamente são descritas três formas clínicas designadas respectivamente por ligeira, moderada e grave.
Na forma ligeira, que abrange mais de metade dos casos, pode surgir anemia com valor de Hb não inferior a 12 g/dL e bilirrubinémia no sangue do cordão < 3 mg/dL; a bilirrubinémia não ultrapassa em geral 18-20 mg/dL no período neonatal precoce, sendo que o valor de Hb poderá atingir nível da ordem de 8 g/dL após a primeira semana de vida. Trata-se, pois, duma forma clínica anteriormente designada por forma anémica.
Na forma moderada verifica-se icterícia antes das 24 horas de vida (precoce) em geral com valor de hiperbilirrubinémia atingindo > 20 mg/dL entre as 36 e 48 horas de vida.
Esta forma, anteriormente designada por “forma ictérica”, se não corrigida, associa-se a alto risco de encefalopatia ou disfunção neurológica (BIND – Bilirubin-induced neurologic dysfunction), a qual surge quando a bilirrubina atravessa a barreira hemato-encefálica e se liga aos tecidos cerebrais.
A evolução da encefalopatia bilirrubínica para kernicterus, situação actualmente rara, traduzindo as sequelas da encefalopatia bilirrubínica, processa-se em três fases com as seguintes manifestações:
- 1ª fase) hipotonia, letargia e sucção débil nos primeiros dias de vida;
- 2ª fase) febre, irritabilidade com choro frequente, episódios de apneia, hipertonia e opistótono entre o 5º e 7º dias de vida, conduzindo à morte na grande maioria dos casos;
- 3ª fase) encefalopatia com sinais estabelecidos: hipotonia, atraso motor, atetose, défice auditivo neurossensorial grave (com emissões oto-acústicas normais e potenciais evocados alterados), olhos em “sol poente”, disartria, etc., traduzindo evolução para quadro de kernicterus.
A forma grave de doença hemolítica perinatal é tipificada pela doença fetal, detectável antes da 34ª semana de gestação: hidropisia, anemia grave, hepatosplenomegália, diátese hemorrágica grave com trombocitopénia, hiperplasia das células β dos ilhéus de Langerhans com risco ulterior de hipoglicémia e défice de factores de coagulação. Tal forma conduz à morte na ausência de intervenção pré-natal.
Exames complementares
Na grávida
Os exames complementares a realizar na grávida e, mais tarde, no RN , devem ser fundamentados na anamnese perinatal (designadamente inquirindo sobre grupo sanguíneo da mãe e resultado de prova de Coombs indirecta, eventuais transfusões realizadas na mãe anteriormente à gravidez, evolução das gravidezes anteriores, antecedentes de filhos anteriores com doença hemolítica e respectiva evolução, administração profiláctica anterior de gama-globulina anti-D, etc.).
Assim, o mais precocemente possível, deve reconfirmar-se o grupo sanguíneo (AB0, D, Du) e proceder-se à prova de Coombs indirecta (pesquisa de anticorpos anti-D) no caso de mãe D (-);
- a prova de Coombs indirecta deve ser realizada mensalmente até ao dia do parto;
- se, entretanto, se verificar resultado positivo da pesquisa, deve proceder-se à titulação de anticorpos: a verificação de títulos >1/8 (indicando iso-imunização materna, mas não necessariamente doença fetal) estabelece indicação para:
- amniocentese para determinação da densidade óptica/índice óptico do líquido amniótico a 450 mm por espectrofotometria em função da impregnação bilirrubínica do mesmo) e avaliação de eventual doença fetal; (o protocolo pormenorizado a cargo da equipa de medicina fetal ultrapassa o âmbito deste capítulo; como noção geral salienta-se que, de acordo com o clássico gráfico de Lilley – em ordenada a densidade óptica e em abcissa a idade gestacional – são definidas três zonas de índice óptico elevado/doença grave, intermédio/doença moderada, e baixo/doença ligeira ou ausência de doença, implicando diferentes atitudes).
- cordocentese para colheita de sangue fetal e detecção de possível anemia (Hb < 10 g/dL), pH fetal, grupo sanguíneo fetal, e eventual transfusão fetal, etc..
- ecografia fetal para detecção de possível ascite, edema, derrame pleural, pericárdico, hepatosplenomegália, etc.;
- nos casos de mães já anteriormente iso-imunizadas ou com prova de Coombs positiva por terem recebido gama-globulina anti-D (ver adiante), a verificação de títulos de anticorpos deve ser feita entre as 16 e 18 semanas, às 22 semanas e, depois, de 2-2 semanas; se, entretanto, a titulação evidenciar valores > 1/16 são levados a cabo os procedimentos referidos em 2.
No recém-nascido
Em RN de mãe Rh (-) no pós-parto imediato deve proceder-se a colheita de sangue do cordão umbilical para determinação dos seguintes parâmetros: grupo sanguíneo (AB0, D, Du), bilirrubina conjugada e não conjugada e prova de Coombs directa; em casos de diagnóstico estabelecido na gravidez, está indicado avaliar, também, Hb, hematócrito, reticulócitos, proteínas totais e fracções.
Valores de Hb < 12 g/dL e de bilirrubina > 4 mg/dL correspondem a formas graves de doença hemolítica perinatal. |
Tratamento
As bases do tratamento da doença hemolítica perinatal por iso-imunização Rh/D, como exemplo paradigmático das hiperbilirrubinémias indirectas graves, incluem fundamentalmente a fototerapia, a exsanguinotransfusão e o emprego de fármacos.
Fototerapia
1. Princípios gerais
A chamada fototerapia é uma modalidade profiláctico-terapêutica que utiliza a energia luminosa para transformar a bilirrubina nativa em isómeros hidrossolúveis através de três mecanismos:
- foto-oxidação da qual resultam complexos pirrólicos excretados pela urina – processo lento que contribui para uma pequena percentagem de eliminação da bilirrubina;
- foto-isomerização num isómero menos tóxico – Z-lumirrubina (4Z,15E), excretado na bílis sem conjugação, sendo um processo lento e reversível e por isso pouco eficaz;
- isomerização estrutural em lumirrubina, excretada sem conjugação pela bílis e urina, constituindo o mecanismo mais eficaz de redução da bilirrubina.
A fotodegradação da bilirrubina verifica-se com o emprego de faixa de luz com os comprimentos de onda entre 420 e 480 nm.
Na prática pode ser utilizada luz branca (fluorescente), azul e verde. No que respeita à irradiância (baixa, média ou elevada), os novos aparelhos são concebidos empregando a elevada irradiância pela sua maior eficácia (entre 12-40 uW/cm2/nm) sendo que os de baixa irradiância produzem luz com menos de 6 uW/cm2/nm. Quanto maior a dose de irradiância que atinge o RN e maior a superfície corporal abrangida, maior a eficácia da fototerapia.
Existem diversos tipos de aparelhos no mercado:
- convencional com 6-8 lâmpadas de 20 W a uma distância recomendada de ~30 cm; podem ser utilizados em simultâneo dois aparelhos, o que duplica a irradiância;
- luz em foco (bilispot) de irradiância elevada com 20 cm de diâmetro e colocado a uma distância ~50 cm do doente;
- “colchão luminoso” ou “pá luminosa” de fibra óptica sobre o qual se coloca o RN;
- outras modalidades, incluindo berços com lâmpadas convencionais colocadas por cima, por baixo e de cada lado do berço (transparente).
A utilização de fototerapia intensiva durante 24 horas, com irradiâncias significativamente maiores, reduz o valor de bilirrubina em 30-40%, valor muito superior aos 10-20% obtidos com a fototerapia convencional.
Os aparelhos de fototerapia implicam esquema de manutenção e verificação periódica da irradiância (vida média das lâmpadas variando entre 500 a 2.000 horas).
2. Indicações
O Quadro 3 resume de modo integrado as indicações da fototerapia (e da exsanguinotransfusão/ET a abordar na alínea seguinte) nos casos de doença hemolítica perinatal por iso-imunização por incompatibilidade Rh (DHPNRh) em função da bilirrubina e Hb no sangue do cordão e da idade em horas; no entanto, tais indicações deverão ser ponderadas caso a caso.
QUADRO 3 – Indicações de fototerapia e exsanguinotransfusão (ET) na DHPN Rh.
| Vigilância | Fototerapia | E-T | |
| Sangue do cordão Hb (g/dL) Bilirrubina (mg/dL) | > 14 < 4 | 12-14 4 | < 12 > 4 |
| Idade Bilirrubina(mg/dL) < 24 horas 24-48 horas > 48 horas | < 7 < 10 < 12 | 7-9 10-14 12-18 | 10-14 > 14 > 18 |
Nota: |
3. Precauções
- Uma vez que a fototerapia implica incremento das perdas insensíveis, haverá que providenciar cálculos rigorosos do balanço hídrico. Empregando fototerapia convencional, os suprimentos hídricos devem ser incrementados na ordem de +20-25 mL/kg/dia; nos casos de RN pré-termo tal incremento poderá corresponder a + 50 ml/kg/dia em relação aos cálculos na ausência de fototerapia.
- Os olhos devem ser protegidos com cobertura opaca (papel de carbono negro ou veludo negro) para evitar efeitos de fototoxicidade na retina.
- O RN deverá ficar sem fralda, pois a penetração da luz não ultrapassa 2-3 mm na pele, não havendo perigo de lesão das gónadas.
- A fototerapia deve ser suspensa caso se verifique elevação da bilirrubina conjugada (colestase) para evitar a chamada síndroma do “bebé bronzeado” que consiste na verificação de coloração castanha acinzentada da pele, plasma e urina explicável pela formação de coproporfirina e retenção de fotobilirrubina no pigmento biliar.
- Nas UCIN e unidades neonatais em geral, estando o RN submetido a nutrição parentérica, os recipientes dos solutos a perfundir deverão ser protegidos com plástico impermeável à luz a fim de impedir alteração química de aminoácidos e vitaminas entre outros compostos.
- Actualmente, em determinados centros internacionais, possuindo equipas treinadas em cuidados domiciliários, a fototerapia é realizada em casa, com a colaboração da família.
- Poderá verificar-se, como efeito colateral da luz, o aparecimento de erupção cutânea maculopapular nas áreas expostas, de evolução auto-limitada cessando a exposição.
- Poderá igualmente verificar-se aceleração do trânsito intestinal com aparecimento de diarreia.
- Numa situação rara – porfíria eritropoiética congénita – a fototerapia está contra-indicada.
- Está ainda pouco clara a relação entre a fototerapia intensiva e o aparecimento de nevus melanocíticos atípicos na idade escolar.
Imunoglobulina endovenosa (IGIV)
Trata-se duma terapêutica com interesse e potencialmente eficaz se for administrada precocemente nos casos de hemólise importante (incremento de bilirrubinémia de 0,5-1 mg/dL/hora); de acordo com algumas séries estudadas, contribui para reduzir a necessidade de exsanguino-transfusão. O mecanismo de acção relaciona-se com possível bloqueio dos receptores Fc do sistema reticuloendotelial, contribuindo para diminuir a velocidade da hemólise.
Tem-se utilizado a dose de 500 mg/kg em perfusão (durante 2 horas ou 8 horas, conforme os protocolos). Poderá utilizar-se idêntica dose repetida 12 horas após a primeira.
Albumina
Nos casos de hipoalbuminémia, poderá considerar-se a administração de albumina na dose de 1 g/kg. Tendo em conta a ligação da bilirrubina à albumina (ver atrás Metabolismo da bilirrubina) e a penetração da bilirrubina livre não conjugada através da membrana da célula nervosa, se a albumina for administrada antes da fase de travessia da membrana – o que é difícil de determinar em tempo real – tal medida poderá empiricamente contribuir para reduzir tal penetração na célula nervosa e suas consequências.
Concentrado eritrocitário
Para correcção da anemia poderá estar indicada a transfusão de concentrado eritrocitário (10-15 mL/kg, a ser repetida em função do contexto clínico) muitas vezes associada a imunoterapia e a fototerapia, ou antes da exsanguinotransfusão para estabilização das condições hemodinâmicas, respiratórias e metabólicas.
Outra indicação da transfusão de concentrado eritrocitário é a verificação de anemia tardia (Hb <7,5 g/dL) entre a terceira semana e os 2 meses de idade pós-natal) nos casos de hemólise ligeira inicial submetidos apenas a fototerapia e/ou IGIV. Assim, em tais circunstâncias, o lactente deverá ser submetido a vigilância periódica do hematócrito, Hb e reticulócitos. A decisão de transfundir dependerá de eventuais sinais clínicos associados, traduzindo hipoxémia tecidual: taquipneia e taquicárdia agravadas pelo esforço (refeições), escassa progressão ponderal, palidez, etc..
Exsanguinotransfusão (ET)
1. Objectivos
Os objectivos deste procedimento invasivo são:
- remover parcela importante da bilirrubina não conjugada circulante e potencialmente tóxica para o SNC;
- remover igualmente parcela importante de eritrócitos com anticorpos aderentes e predispostos a hemólise, e, consequentemente, a agravamento da anemia e da hiperbilirrubinémia;
- substituir parte do sangue do RN com eritrócitos compatíveis com os da mãe e RN.
2. Condições técnicas essenciais
Não cabendo no âmbito deste capítulo a descrição da técnica de ET, é importante referir alguns aspectos:
- Tempo de armazenamento máximo do sangue de 72 horas, pois o nível de potássio eleva-se com o tempo, sendo aceitável o valor até 9 mEq/L.
- Sangue do dador com um hematócrito entre 55 e 60% (Hb > 12g/dL), previamente irradiado como meio de prevenir reacção enxerto contra hospedeiro, inactivando os linfócitos do dador.
- Sangue aquecido a 37ºC durante duas horas.
- Volume de troca utilizado correspondente a duas volémias, isto é ~160 mL/kg, o que permite remover cerca de 85% dos eritrócitos e cerca de 45% da bilirrubina circulante.
- Tipo de sangue Rh negativo, Du negativo, compatível com o do RN no sistema AB0.
3. Indicações
Tendo sido referidas indicações gerais no Quadro 3 (chamando a atenção para a necessidade de ponderar a indicação de ET logo após o nascimento), cabe agora referir algumas especificidades no que respeita, designadamente, à condição peso de nascimento e verificação de eventuais factores de risco susceptíveis de aumentarem o risco de neurotoxicidade da bilirrubina.
- Nas primeiras 36 horas de vida poderá haver necessidade de doseamento da bilirrubinémia cada 4 a 8 horas se o ritmo de incremento for igual ou superior a 0,5 mg/dL/hora, não considerando, no entanto, para tal cálculo, o valor inicial da bilirrubina no sangue do cordão.
- Após as 36 horas está indicada ET, equacionando a relação peso de nascimento-bilirrubinémia total (BT) são estabelecidas as seguintes normas como complemento do que é estabelecido no Quadro 3:
- <1.500 g……………….. ET se BT > 13 mg/dL
- 1.500-2.500 g……….. ET se BT > 16 mg/dL
- >2.500 g……………….. ET se BT > 18 mg/dL
- A ET deverá ser sempre realizada se houver sinais sugestivos de encefalopatia bilirrubínica independentemente dos valores de bilirrubinémia.
- Na presença de factores de risco tais como índice de Apgar < 3 aos 5 minutos, hipoglicémia, hipotermia, hipercapnia, hipoxémia (PaO2 < 40 mmHg), acidose metabólica persistente (pH <7,15), infecção sistémica com ou sem meningite, proteínas totais < 4 g/dL, albumina < 2,5 g/dL, deve ser diminuído o nível de bilirrubina indicativo para ET de – 2 mg/dL; este critério de ponderação de factores de risco aplica-se também a situações de hiperbilirrubinémia de causa não hemolítica.
- Como precaução máxima, os RN pré-termo tardio (34-36 semanas), pela sua maior vulnerabilidade, embora eventualmente a respectiva condição somática os aproxime dos RN de termo, deverão ser assistidos segundo os critérios de pré-termo.
- O valor de bilirrubinémia > 20 mg/dL deve ser considerado uma emergência médica pelo risco elevado de kernicterus.
Como nota importante salienta-se que o risco de kernicterus é mais significativo até aos 5-7 dias de vida, existindo excepções a esta regra; trata-se, com efeito, do período de maior permeabilidade da barreira hemato-encefálica. Não se deverá, pois, protelar demasiadamente a eventual ET caso esteja indicada, pois, ao decidir pela sua realização, poderá ser tarde pela possibilidade de lesão já estabelecida do SNC.
Segundo alguns autores, a relação Bilirrubina (mg/dL)/Albumina (g/L) pode ajudar na decisão de realizar a ET: valores superiores a 7,2 em RN com 38 semanas ou mais, e superiores a 6,8 em RN com < 38 semanas, são favoráveis à sua realização.
4. Complicações
As complicações mais frequentemente associadas a ET são: cardíacas (arritmia, insuficiência cardíaca por sobrecarga volémica, etc.), vasculares (tromboembolismo, vasospasmo, etc.), hematológicas (hemorragias por trombocitopénia ou défice de factores de coagulação, etc.), infecções, metabólicas (hipocalcémia, hipo e hiperglicémia, acidose metabólica, etc.).
Metalporfirinas
As protoporfirinas (SnPP) e as mesoporfirinas (SnMP) são fármacos que, inibindo a heme-oxigenase, reduzem a conversão do radical heme em bilirrubina. Têm sido realizados estudos multicêntricos cujos resultados legitimam a utilização de tais fármacos no tratamento e prevenção das hiperbilirrubinémias.
Eritropoietina
A administração de eritropoietina recombinante poderá constituir um tratamento alternativo às transfusões de concentrado eritrocitário nas anemias tardias, entre a 3ª e 6ª semanas de vida, designadamente do tipo hiporregenerativo.
Estudo evolutivo e acompanhamento
Os casos de lactentes e crianças com antecedentes de DHPNRh deverão ser submetidos a vigilância periódica em centros de desenvolvimento desde a alta hospitalar, pressupondo acção coordenada pelo respectivo médico assistente. O risco de compromisso do sistema nervoso (motor, sensorial, comportamental, etc.) é mais relevante se existirem antecedentes de bilirrubinémia > 25 mg/dL, sinais neurológicos no período neonatal precoce, ET e alterações nos resultados obtidos pelo estudo potenciais evocados auditivos do tronco cerebral.
Prevenção
A prevenção da DHPNRh centra-se nos seguintes princípios:
- proscrição absoluta de hetero-hemoterapia e respeito pelas regras de compatibilidade em transfusões;
- prevenção das hemorragias feto-maternas, reduzindo as manobras obstétricas com probabilidade de aumentarem o volume daquelas;
- administração de gama-globulina anti-D a mulheres com antigénio D negativo/Rh (-) evidenciando resultado negativo da prova de Coombs indirecta.
Experimentalmente demonstrou-se que 10 microgramas (mcg) de gama-globulina anti-D neutralizam 0,2 a 1 mL de sangue [depuração de eritrócitos fetais circulantes com antigénio D ou Rh (+) para o baço, órgão onde são destruídos por macrófagos através de diversos mecanismos]. No pressuposto de que em mais de 95% dos casos a hemorragia feto-materna tem volume inferior a 10 mL, as doses-padrão que são preconizadas têm probabilidade de eficácia na quase totalidade das situações.
De acordo com as recomendações da AAP e do ACOG (American College of Obstetricians and Gynecologists) tem sido utilizado o seguinte protocolo para a administração de gama-globulina anti-D por via IM na maioria dos centros perinatais:
- Status pós-aborto ou ruptura de gravidez ectópica:
- até 12 semanas: 50 mcg
- após 12 semanas: 300 mcg
- Status pós-biópsia das vilosidades coriónicas: 50 mcg
- Status pós-amniocentese ou cordocentese: 300 mcg
- Durante a gravidez (28-29 semanas): 300 mcg
- Pós-parto se o RN for Rh (+)/D positivo ou Du positivo: 300 mcg
Nas situações 1-, 2-, 3-, e 5- a administração de gama globulina anti-D deve realizar-se o mais precocemente possível, até às 72 horas subsequentes no sentido de garantia de eficácia.
Nota: Caso especial de Incompatibilidade Rh |
2. Doença hemolítica neonatal por iso (ou alo – imunização AB0
Definições
A doença hemolítica neonatal por iso-imunização AB0 – hoje mais frequente que a DHPNRh como foi atrás referido face à possibilidade de prevenção efectiva desta última – define-se como o processo mórbido em que se verifica hemólise no RN na circunstância de mãe do grupo 0 e RN do grupo A ou B.
[Sobre AB0, deve pronunciar-se AB zero, e não AB Ó].Recorda-se aqui, para melhor compreensão, algumas características genotípicas e fenotípicas dos eritrócitos e soro no sistema AB0 o qual diverge do sistema Rh (neste último existe um sistema antigénico nos eritrócitos humanos não associado a aglutininas (anticorpos naturais) no soro:
- no sistema AB0 os caracteres A, B, e 0 são herdados como três pares alelomórficos, pelo que são possíveis os fenótipos A, B, 0 e AB. A correspondência fenótipo-genótipo é a seguinte:
- Fenótipo A à Genótipos: AA (homozigoto) e A0 (heterozigoto)
- Fenótipo B à Genótipos: BB (homozigoto) e B0 (heterozigoto)
- Fenótipo 0 à Genótipo: 00 (homozigoto)
- Fenótipo AB à Genótipo: AB (heterozigoto);
- no sistema AB0 considera-se a existência de dois aglutinogénios/antigénios eritrocitários, respectivamente A e B, e duas aglutininas/anticorpos naturais, respectivamente B ou beta e A ou alfa; assim, por definição, não podem coexistir no mesmo indivíduo um antigénio e o correspondente aglutinogénio porque de tal resultaria a aglutinação dos próprios eritrócitos, incompatível com a vida;
- assim, existem eritrócitos com antigénio A e, no respectivo plasma, aglutinina/anticorpo natural B ou beta; eritrócitos com antigénio B e, no respectivo plasma, aglutinina/anticorpo natural A ou alfa; eritrócitos sem antigénios e, no respectivo plasma, aglutininas/anticorpos naturais A ou alfa + B ou beta; eritrócitos com antigénios A+B e, no respectivo plasma sem anticorpos naturais ou aglutininas. O Quadro 4 elucida sobre o que foi descrito.
QUADRO 4 – Sistema AB0 e relação antigénios eritrocitários – aglutininas plasmáticas (naturais).
Grupo | Antigénios eritrocitários | Aglutininas/anticorpos naturais |
A | A | anti-B ou beta |
B | B | anti-A ou alfa |
AB | AB | ausência |
0 | Ausência | anti-A (alfa) + anti-B (beta) |
Etiopatogénese
Em cerca de 20% das gravidezes verifica-se situação de incompatibilidade AB0 mãe/feto (A/B), (B/A), (0/A), (0/B), (A/0), (B/0); contudo, somente ocorre doença hemolítica no recém-nascido A ou B cujas mães são do grupo 0, possuindo aglutininas B-beta e A-alfa, quer do tipo IgM, quer do tipo IgG; ora, estas últimas têm a capacidade para atravessar a placenta no caso de estimulação antigénica por passagem prévia de eritrócitos fetais B ou A, no sentido feto-mãe.
De salientar, no entanto, que tal estimulação antigénica poderá ocorrer anteriormente à passagem prévia de eritrócitos fetais (isto é, antes duma primeira gravidez a mulher poderá já ser portadora de anticorpos/aglutininas IgG anti-A ou anti-B resultantes de estímulos antigénicos com estrutura e composição química semelhante à dos antigénios eritrocitários A ou B, presentes em certos alimentos, bactérias e produtos biológicos como o toxóide tetânico).
Nos casos de incompatibilidade A/B ou B/A não existe risco de doença hemolítica porque as aglutininas anti-B e anti-A nos grupos A ou B respectivamente são predominantemente do tipo IgM (macromoléculas) sem capacidade para atravessar a placenta no caso de passagem prévia de eritrócitos fetais B ou A no sentido feto-mãe.
Centrando a atenção na situação de mãe 0 e feto/RN do grupo A ou B, gera-se um mecanismo semelhante ao descrito a propósito da DHPNRh: os anticorpos/aglutininas, atingindo os eritrócitos fetais ou do RN, aderem à sua superfície determinado processo hemolítico com consequências semelhantes – fundamentalmente anemia e hiperbilirrubinémia.
Cabe agora analisar algumas diferenças da etiopatogénese em relação à DHPNRh:
- grau de hemólise mais ligeiro na doença AB0 condicionando, de modo geral, quadros clínicos mais ligeiros, e;
- doença fetal praticamente inexistente na doença AB0, sendo por isso mais correcto falar em doença neonatal AB0 em comparação com a designação de doença perinatal Rh.
As razões da raridade da hemólise fetal (< 2% dos casos de DH AB0) prendem-se com o facto de a membrana eritrocitária fetal ser escassa em antigénios A e B, sendo que a expressão antigénica somente se desenvolve de modo significativo a partir do final da gestação e, sobretudo, a partir do termo da gravidez, continuando o seu desenvolvimento até aos 2 anos; ou seja, a característica de “grupo A ou B” não está completamente definida no período fetal, o que determina escassa ou nula probabilidade de os eritrócitos fetais serem reconhecidos como estranhos ao organismo materno.
Por outro lado, sendo gerados anticorpos anti-A ou anti-B, para além do facto de nem todos serem hemolisantes, os mesmos poderão aderir não só a antigénios A ou B na membrana eritrocitária do RN, mas também a antigénios de estrutura semelhante a antigénios A ou B distribuídos por tecidos e secreções; ou seja, surge aqui um mecanismo de competição que poupa eritrócitos A ou B, diminuindo a exposição destes ao anticorpo materno circulante, reduzindo o grau de hemólise.
Aliás, a dupla incompatibilidae mãe-filho AB0 e Rh diminui o risco e a gravidade de DHPNRh pelo facto de os eritrócitos fetais Rh (+) e do grupo A ou B, que passam para a circulação de mãe do grupo 0 Rh (-), poderem ser destruídos pelos anticorpos maternos anti-A ou anti-B antes do estímulo antigénico para a formação de anticorpos anti-D por parte da mãe. Trata-se de mecanismo semelhante ao descrito para a imunoglobulina anti-D.
Ao contrário da iso-imunização Rh, na DH AB0, a probabilidade de iso-imunização vai diminuindo com o número de gravidezes, pois os anticorpos formados como resposta a sucessivas estimulações antigénicas, inicialmente do tipo IgG, passam mais tarde a ser predominantemente do tipo IgM, macromoléculas que não atravessam a placenta.
Manifestações clínicas
As manifestações clínicas neste tipo de iso-imunização AB0 são variadas; a anemia e a icterícia podem ser ligeiras; classicamente surge icterícia precoce, embora em certas formas o quadro se assemelhe a icterícia fisiológica. Outra particularidade da icterícia é o seu modo “oscilante” sugerindo quadro de hemólise ligeira por surtos, e o prolongamento para além das duas semanas conduzindo a anemia (excepcionalmente grave), de expressão tardia (3ª-4ª semanas de vida) e acompanhada de hepatosplenomegália. Em certas formas de incompatibilidade B-0 foram descritos casos de hiperbilirrubinémia > 20 mg/dL; os casos de encefalopatia são raros.
Em função do contexto clínico e dos antecedentes familiares haverá, por vezes, que fazer o diagnóstico diferencial com outras icterícias hemolíticas como por ex. esferocitose hereditária e enzimopatias eritrocitárias.
Exames complementares
No contexto de incompatibilidade AB0 mãe-filho e icterícia precoce, a elevada probabilidade de doença hemolítica AB0 deve ser confirmada ou infirmada através da realização de determinados exames laboratoriais (hemograma com contagem de reticulócitos e pesquisa de esferócitos). De facto, a presença de esferócitos no sangue periférico (> 4/mmc) nesta idade sugere com maior probabilidade DH AB0 do que esferocitose hereditária; considera-se reticulocitose significativa (indiciando hiperplasia medular por hemólise) o valor > 4-5%, podendo por vezes ser atingidos valores entre 15-30%.
Relativamente aos aspectos relacionados com a vigilância da bilirrubinémia aplicam-se os princípios já descritos a propósito da DHPNRh. A prova de Coombs directa no RN em geral é negativa ou fracamente positiva, o que é explicado pelo facto de haver menor número de sítios antigénicos nos eritrócitos do RN.
O diagnóstico pode ser confirmado através da pesquisa de anticorpos maternos anti-A ou anti-B adsorvidos à superfície dos eritrócitos do RN (prova do eluato).
Tratamento
No caso de DH AB0 têm perfeito cabimento as medidas descritas para a DHPNRh, incluindo fototerapia, a administração de imunoglobulina polivalente, transfusão de concentrado eritrocitário e exsanguinotransfusão.
Nesta alínea é dada ênfase a indicações de fototerapia (Quadro 5) e de exsanguinotransfusão, resumidas a seguir.
QUADRO 5 – Indicações de fototerapia na DH-ABO.
Idade | Vigilância | Fototerapia |
Bilirrubina(mg/dL) | ||
< 24 horas | < 7 | 7-9 |
24-48 horas | < 10 | 10-14 |
> 48 horas | < 12 | 12-18 |
No que respeita à ET, e no contexto de DH-AB0, em geral não existe a necessidade de realizar esta técnica imediatamente após o nascimento, tendo em conta a baixíssima probabilidade de doença fetal e de doença neonatal precoce e grave; é, no entanto, crucial observação rigorosa seriada, sendo que o risco de kernicterus é mais significativo até aos 5 dias, período de maior permeabilidade da barreira hemato-encefálica. As indicações da ET em função da bilirrubinémia total (BT) e do peso de nascimento são assim estabelecidas:
- <1.500 g………….ET se BT > 13 mg/dL
- 1.500-2.500 g….ET se BT > 16 mg/dL
- >2.500 g………….ET se BT > 18 mg/dL
Salienta-se, contudo, que a ET deverá ser sempre realizada de imediato caso se verifiquem sinais sugestivos de encefalopatia bilirrubínica independentemente dos valores de bilirrubinémia (e, idealmente, antes do surgimento dos referidos sinais, o que implica elevado índice de suspeita na avaliação clínica seriada e cuidadosa).
Na presença de factores de risco, tais como índice de Apgar < 3 aos 5 minutos, hipoglicémia, hipotermia, hipercapnia, hipoxémia (PaO2 < 40 mmHg), acidose metabólica persistente (pH< 7,15), infecção sistémica com ou sem meningite, proteínas totais < 4 g/dL, albumina < 2,5 g/dL, deve ser diminuído o nível de bilirrubina total (BT) indicativo para ET de menos 2 mg/dL do que o estabelecido para situações sem factores de risco. [Por ex. ET com BT > 11 mg/dL se factor de risco presente versus BT > 13 mg/dL na ausência de factor de risco (ver atrás)].
Este critério de ponderação de factores de risco aplica-se também a situações de hiperbilirrubinémia não hemolítica.
3. Doença hemolítica neonatal por incompatibilidade dos chamados grupos sanguíneos menores
Definição e importância do problema
Tal como foi referido antes, em cerca de 1-2% da totalidade dos casos de iso- imunização por incompatibilidade sanguínea feto-materna, poderá surgir iso-imunização em relação com determinados antigénios [c, C, e, E (no sistema Rh), Fya (no sistema Duffy), M, N, S, s (no sistema MNSs), JKa, JKb (no sistema Kidd), etc], existentes na superfície do eritrócito fetal e ausentes no eritrócito materno, designados classicamente como menores ou irregulares.
Etiopatogénese
A etiopatogénese é sobreponível à descrita para outros grupos sanguíneos. Cabe referir, no entanto, duas particularidades:
- no sistema Rh a DH surge mais frequentemente com antigénios E e c caso se verifique previamente sensibilização ao antigénio D;
- no sistema Rh também, e dentro da raridade da iso-imunização por grupos menores, a DH anti-c é a mais frequente.
Manifestações clínicas
As manifestações clínicas são semelhantes às descritas a propósito da DHPNRh; de salientar, contudo, que nestas formas pode haver doença fetal (anemia/hidropisia) e, no RN, as formas anémicas e ictérica.
Na prática clínica, e na ausência de incompatibilidade Rh e AB0, deve suspeitar-se desta de doença no pós-parto e nas seguintes circunstâncias:
- icterícia precoce (surgida antes das 24 horas de vida) com evolução rápida para valores críticos de hiperbilirrubinémia;
- anemia associada;
- hepatosplenomegália;
- prova de Coombs directa positiva, reticulocitose importante e detecção de eritroblastos no sangue periférico.
Tratamento e evolução
Os procedimentos a realizar e a possível evolução são os mesmos que foram descritos a propósito da DHPNRh. Uma vez identificado o antigénio eritrocitário que desencadeou o processo de iso-imunização, tal facto deverá ficar registado no Boletim de Saúde Infantil e Juvenil no sentido de prevenir, no futuro, eventuais transfusões de derivados sanguíneos com o referido antigénio.
Hiperbilirrubinémia conjugada
Definição e importância do problema
A hiperbilirrubinémia directa ou conjugada é devida a falência no processo de excreção para o duodeno (com consequente retenção) da bilirrubina conjugada (BC), ácidos biliares e outros compostos da bílis. Define-se quantitativamente pela verificação de nível sérico de BC > 2 mg/dL, ou de BC superior a 20% da bilirrubina total.
Esta situação classicamente está associada a hepatomegália, esplenomegália, urina escura (por bilirrubinúria conjugada) e fezes claras. Este quadro, de etiopatogénese variada, é designado pelo termo colestase.
Toda e qualquer situação de colestase, uma vez diagnosticada, deverá ser encaminhada atempadamente para centro especializado tendo em conta a necessidade de tratamento dirigido aos factores etiológicos; com efeito, a demora na actuação exequível poderá ser fatal ou originar sequelas, tais como cirrose biliar (por ex. se a intervenção cirúrgica correctiva de defeito das vias biliares não se realizar até à 4-6 semanas de vida).
Etiopatogénese
Reportando-nos ao capítulo sobre colestase (Parte XVI – Gastrenterologia/Hepatologia), em síntese, podem ser considerados os seguintes grandes grupos de colestase quanto à etiopatogénese (Quadro 6):
QUADRO 6 – Hiperbilirrubinémia conjugada (directa) (Icterícia colestática).
1. Lesão do hepatócito com ductos biliares normais
|
| 2. Oferta excessiva de bilirrubina para excretar (síndroma de bílis espessa por “entupimento”) em casos de doença hemolítica e de hemólise secundária a ECMO |
3. Obstrução ao fluxo biliar (atrésia das vias biliares intra ou extra-hepáticas)
|
| 4. Outras situações Nota importante: A causa mais frequente de colestase em doentes hospitalizados em UCIN é a nutrição parentérica prolongada. |
Algumas formas clínicas
Certas situações clínicas que integram o Quadro 6 fazem parte de diversos capítulos do livro. Nesta alínea, entre outras, optou-se por abordar sucintamente duas síndromas ainda não pormenorizadas e consideradas paradigmáticas no âmbito das hiperbilirrubinémias conjugadas: síndroma de Dubin Johnson e síndroma de Rotor.
Síndroma de Dubin Johnson
Trata-se duma situação autossómica recessiva causada por um defeito no transporte da BC e de outros aniões orgânicos, do hepatócito para a bílis. A mesma resulta de mutações (descritas mais de 10) num gene que codifica um anião orgânico transportador dependente de ATP (cMOAT, sinónimo de MRP2).
A síndroma pode manifestar-se na transição do período neonatal para a 1ª infância por sinais de colestase associados a náuseas, vómitos, hepatomegália e valores de BC ~2-5 mg/dL, os quais podem atingir cerca de 20 mg/dL durante intercorrências infecciosas; a situação pode regredir na adolescência, considerando-se dum modo geral a evolução benigna, sem doença crónica. ALT, AST, fosfatase alcalina e sais biliares no soro evidenciam valores normais. A excreção de ácidos biliares e o nível sérico de ácidos biliares são normais. Por colangiografia não se visualiza o tracto biliar e o padrão radiológico da vesícula biliar é anormal.
O coproporfirinogénio urinário é normal, mas a relação coproporfirinogénio I/ coproporfirinogénio III é muito elevada, o que pode ser considerado critério para o diagnóstico. A prova de excreção da bromossulftaleína revela resultado anormal (depuração prolongada).
O exame histológico do fígado, revela estrutura normal e acumulação de pigmento semelhante à melanina nos lisossomas.
Síndroma de Rotor
Esta síndroma colestática, tendo pontos comuns com a síndroma de Dubin-Johnson (SDJ), também se transmite de modo autossómico recessivo; sob o ponto de vista de manifestações clínicas, não existe elevação de BC desencadeada por intercorrências.
De base molecular ainda desconhecida, evidencia, para além do defeito da SDJ, deficiência na captação de aniões orgânicos e ausência de acumulação de pigmento no hepatócito. O padrão radiológico da vesícula biliar é normal.
Para o diagnóstico diferencial com SDJ tem importância o perfil de coproporfirina urinária (na síndroma de Rotor a coproporfirina urinária está, muito elevada, com relação normal coproporfirinogénio I/ coproporfirinogénio III).
Exames complementares e tratamento
Em complemento do que foi referido no Capítulo sobre Colestase (Parte XVI- sobre Gastrenterologia/Hepatologia – volume 1), cuja consulta se sugere, importa referir os seguintes factos, na sequência de resultados de investigações recentes, relacionadas com a colestase neonatal e a sua etiologia mais frequente – a atrésia das vias biliares:
- recentemente descreveu-se uma doença metabólica relacionada com o défice da citrina, a qual resulta de mutações no gene SLC25A 13 que codifica o transportador mitocondrial do aspartato-glutamato, ciclo da ureia e neoglucogénese. Manifestando-se em RN e lactentes, constitui causa de colestase intra-hepática, geralmente transitória e de bom prognóstico.
- recentemente também, em relação com as situações de atrésia das vias biliares, descreveu-se um marcador diagnóstico doseável no sangue em ng/mL, e designado por MMP-7 Matrix Metalloproteinase-7); com sensibilidade, especificidade e valor preditivo positivo elevados (> 95%) e um valor de corte de 10,37 ng/mL e mediana de 38,39 ng/mL, verificou-se igualmente que tal marcador tem interesse pela sua correlação com o desenvolvimento de fibrose hepática.
BIBLIOGRAFIA
American Academy of Pediatrics.Subcommittee on Hyperbilirubinemia. Practice parameter: Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics 2004;114:297-316
American Academy of Pediatrics, American College of Obstetricians and Gynecologists. Guidelines for Perinatal Care. Elk Grove Village: American Academy of Pediatrics, 2002
Bratlid D. How bilirubin gets into the brain. Clin Perinatol 1990;17:449-465
Bhutani VK, Gourley GR, Adler S. Noninvasive measurement of total serum bilirubin in a multiracial predischarge newborn population to assess the risk of severe hyperbilirubinemia. Pediatrics 2000;106: E17-E25
Bhutani VK, Johnson LH. Jaundice technologies: Prediction of hyperbilirubinemia. In term and near-term newborns. J Perinatol 2001;21(Suppl):S76-S87
Bhutani VK, Wong RJ, Stevenson DK. Hyperbilirubinemia in preterm neonates. Clin Perinatol 2016;43:215-232
Carvalho M, Carvalho D, Trzmielina S, et al. Intensified phototherapy using daylight fluorescent lamps. Acta Paediatr 1999;88:768-771
Cashore WJ. Bilirubin and jaundice in the micropremie. Clin Perinatol 2000;27:171-179
Chang PW, Newman TB. A simpler prediction rule for rebound hyperbilirubinemia. Pediatrics 2019;144(1) e20183712. DOI:10.1542/peds.2018-3712
Chang, PW, Waite WM. Evaluation of home phototherapy for neonatal hyperbilirubinemia. J Pediatr 2020;220:80-85
Clington A, Carvalhosa G, Amaral JMV, et al. Intravenous immunoglobulin therapy for hyperbilirubinemia due to Rh hemolytic disease. In Kazathckine MD, Morell A (eds) Intravenous Immunoglobulin Research and Therapy. New York: Parthenon, 1996
Denery PA, Seidman DS, Stevenson DK. Neonatal hyperbilirubinemia. NEJM 2001;344:581-590
Dijk PH, Hulzebos CV. An evidence-based view on hyperbilirubinemia. Acta Paediatr 2012;134:e1017-e1024
Gleason CA, Juul SE (eds). Avery’s Diseases of the Newborn. Philadelphia: Elsevier, 2018
Gonçalves A, Rocha G, Guimarães H, et al. Prospective validation of a novel strategy for assessing risk of significant hyperbilirubinemia. Pediatrics 2011;127:e126-e131
Harpavat S. MMP-7 – The next serum biomarker for biliary atresia? J Pediatr 2019;208:7-8
Ives NK. Management of neonatal jaundice. Paediatr Child Health 2011;21:270-276
Jiang J, Wang J, Shen Z, et al. Serum MMP-7 in the diagnosis of biliary atresia. Pediatrics 2019;144(5): e20190902
Kaplan M, Zimmerman D, Shoob H, Stein-Zamir CD. Post-discharge neonatal hyperbilirubinemia surveillance. Acta Paediatrica 2020;109:923-929
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Kuzniewicz MW, Wickremasinghe AC, Wu YW, et al. Incidence, etiology, and outcomes of hazardous hyperbilirubinemia in newborns. Pediatrics 2014;134:504-507
Lehlimi M, Korchi ZE, M. Chemsi M, et al. L’incompatibilité fœto-maternelle dans le système AB0. J Pédiatr Puériculture 2020;33:151-157
Maisels MJ. Managing the jaundiced newborn: a persistent challenge. CMAJ 2015;187:335-343
Maisels MJ, Bhutani VK, Bogen D, et al. Hyperbilirubinemia in the newborn infant > 35 week´s gestation: an update and clarifications. Pediatrics 2009;124:1193-1198
Maisels MJ, Clune S, Coleman K, et al. The natural history of jaundice in predominantly breastfed infants. Pediatrics 2014;134: e340-e342
Maisels MJ, Watchko JF. Improving post-discharge neonatal surveillance for the jaundiced newborn. Acta Paediatrica 2020;109:872-873
McDonagh AF. Is bilirubin good for you? Clin Perinatol 1990;17:359-369
McDonagh AF. Controversies in bilirubin biochemistry and their clinical relevance. Semin Fetal Neonatal Med 2010;15:141-147
Orkin SH, Nathan DG, Ginsburg D, et al (eds). Nathan and Oski’s Hematology and Oncology of Infancy and Chilhood. Philadelphia: Elsevier, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Ramos de Almeida JM, Rosado L. Rh Blood group of grandmother and incidence of erythroblastosis. Arch Dis Child 1972;47:609-611
Ratnavel N, Ives NK. Investigation of prolonged neonatal jaundice. Curr Paediatr 2005;15:85-91
Shapiro SM. Chronic bilirubin encephalopathy: diagnosis and outcome. Semin Fetal Neonatal Med 2010;15:157-163
Srinivasa MD, Prajwala H V, Deepti T. Stool colour test can help to decide which infants with neonatal hyperbilirubinaemia need phototherapy. Acta Paediatrica 2019;108:371-372. DOI: 10.1111/apa. 14615
Valaes TN, Harvey-Wilkes K. Pharmacologic approaches to the prevention and treatment of neonatal hyperbilirubinemia. Clin Perinatol 1990;17:245-273
Watchko JF, Maisels MJ. Enduring controversies in the management of hyperbilirubinemia in preterm neonates. Semin Fetal Neonatal Med 2010;15:136-140
Wong RJ, Bhutani VK. Treatment of unconjugated hyperbilirubinemia in term and late preterm infant. UpToDate 2018. Waltham/MA: Wolters Kluwer, 2018
Wong RJ, Bhutani VK. Evaluation of unconjugated hyperbilirubinemia in term and late preterm infant. UpToDate 2018. Waltham/MA: Wolters Kluwer, 2018.
Yu Z, Han S, Wu J, Li M, Wang H, et al. Validation of transcutaneous bilirubin nomogram for identifying neonatal hyperbilirubinemia in healthy Chinese term and late-preterm infants: a multicenter study: J Pediatr (Rio J) 2014;90:273-278
Zonneveld R, van der Meer-Kapelle L, Sylva M, et al. Severe fetal hemolysis and cholestasis due to high-titer maternal IgG anti-A antibodies. Pediatrics 2019;143:(4) e20182859; DOI: 10.1542/peds.2018-2859