Importância do problema
Os problemas clínicos relacionados com mordeduras e picadas por animais chamados venenosos são, não só pouco frequentes em crianças e adolescentes vivendo no meio urbano, como comportam baixa morbilidade e mortalidade. No que respeita às mordeduras, as situações mais prevalentes são, dum modo geral, as produzidas por animais domésticos, especialmente cães (a maioria ~80%) e gatos (~5%). As mordeduras produzidas por animais não domésticos (ratos, coelhos, répteis, etc.), assim como as lesões ou picadas por animais marinhos e insectos venenosos, constituem uma minoria (~1-2% conforme o meio em que a criança vive ou frequenta). No nosso meio é pouco comum ter primatas como animais de companhia.
Dum modo geral as lesões por mordedura de animais localizam-se nas extremidades; as lesões na face observam-se quase invariavelmente em crianças pequenas.
Neste capítulo é dada ênfase às lesões por mordedura de cão, gato, primata e réptil venenoso, assim como às lesões e picadas por animais marinhos e insectos venenosos.
1. MORDEDURA POR CÃO
Manifestações clínicas e factores etiológicos infecciosos
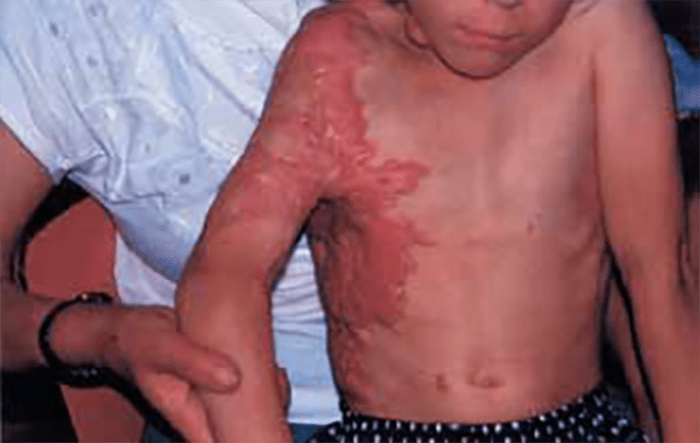
As lesões resultantes deste tipo de mordedura são variáveis, quer em extensão, quer em profundidade: entre feridas simples (punctiformes ou lineares) ou feridas múltiplas (lacerações e abrasões) e até amputações. Poderão ser atingidos, para além da pele, outras estruturas como vasos, nervos, músculos e tendões, deduzindo-se destas circunstâncias as implicações em termos de manifestações clínicas, as quais também dependem da localização.
Surgem frequentemente infecções de localização muito diversa como complicação, sobretudo por anaeróbios; tal depende das condições ambientais em que se verificou a lesão, do microbioma bucal do animal e do tempo decorrido entre a ocorrência e o início do tratamento.
Existe risco de infecção da pele e tecidos moles por S. viridans, S. aureus, Pasteurella multocida, Bacteróides sp, Fusobacterium sp, e Capnocytophaga canimorsus (DF-2). Este último agente pode dar origem a septicémia com CID em doentes asplénicos.
Tratamento
Como cuidados gerais iniciais, deve lavar-se a ferida com soro fisiológico estéril, de preferência com seringa, dirigindo o soro em jacto; em alternativa, com povidona iodada (Betadine®) diluída a 1%. De facto, uma lesão deste tipo deve ser sempre considerada ferida suja ou contaminada. Poderá haver necessidade de proceder a excisão de tecidos desvitalizados.
No âmbito dos cuidados iniciais, hospitalares ou em centro médico-cirúrgico, sob anestesia local ou no bloco operatório, deve proceder-se à excisão dos tecidos desvitalizados, retirando eventuais corpos estranhos. Como regra geral, é prudente não realizar suturas pelo risco de infecção, sobretudo se o tempo decorrido for > 8 horas após a mordedura. Tratando-se de lesão num membro, poderá estar indicada a imobilização do mesmo durante 3-5 dias.
Medidas profilácticas
A antibioticoterapia profiláctica está indicada sempre que a mordedura tenha ocorrido há mais de 8 horas, em feridas da face, profundas e em pacientes imunodeprimidos (amoxicilina+ácido clavulânico na dose de 40 mg/kg da primeira, por via oral durante 7 dias; ou ceftriaxona – 80 mg/kg IM em dose única); ou doxicilina PO em doentes com > 8 anos (dose inicial: 4 mg/kg; doses seguintes: 2 mg/kg em 1-2 doses). Em casos especiais poderá estar indicado proceder a exames culturais da ferida.
Está indicada a profilaxia da raiva nos cães não vacinados e reforço de 1 dose de vacina antitetânica – 0,5 mL por via IM.
Nos casos de feridas sujas (raros no panorama actual no nosso país – eventualmente cidadãos estrangeiros) não previamente vacinados, está indicada imunoglobulina antitetânica seguida de vacinação. Nos casos de ferida limpa, deve iniciar-se a vacinação.
No que respeita à profilaxia da raiva, cabe referir que a mesma está indicada se o estado de saúde do animal (que deve ser capturado e observado durante 10 dias) o justificar com base na decisão do delegado de saúde e autoridade veterinária. Em Portugal não há casos notificados de raiva na espécie humana desde há mais de meio século.
2. MORDEDURA/ARRANHÃO POR GATO
Manifestações clínicas
Frequentemente o gato origina mordeduras perfurantes nos membros, pescoço, tronco, fronte e face; outro tipo de lesão é o arranhão.
As complicações mais frequentes são as infecções da pele e tecidos moles (celulite, tenossinovite, linfangite) por Staphylococcus aureus, Streptococcus beta hemolítico do grupo A, Capnocytophaga canimorsus, Pasteurella multocida e Bartonella hensalae. Relativamente a este último germe microbiano é feita referência especial em capítulo próprio na Parte sobre Infecciologia.
Tratamento e medidas profilácticas
Aplicam-se os mesmo princípios gerais enunciados a propósito da mordedura por cão.
3. MORDEDURA POR RATO
Como resultado da mordedura do rato poderão surgir infecçõs da pele e tecidos moles, possivelmente causadas por Streptobacillus moniliformis ou Spirillum minus.
Em termos profilácticos, têm indicação as medidas locais referidas a propósito da mordedura por cão e gato.
Surgindo infecções da pele e tecidos moles, os antibióticos de primeira escolha são: penicilina G IM ou amoxicilina/clavulanato durante 10 dias. Como alternativa pode empregar-se doxiciclina em idades > 8 anos.
4. MORDEDURA POR PRIMATA
Embora no nosso meio, como se disse, não seja habitual a convivência com macacos, importa referir uma particularidade relacionada com o risco de transmissão de agentes como S. viridans, S. aureus, S. pyogenes, Eikenella corrodens, Bacteróides sp, Fusobacterium sp e vírus herpes.
Está indicada investigação serológica sobre VIH, VHB, VHC e Vírus herpes, dados os riscos de contrair infecções por estes agentes.
No caso de agentes bacterianos é possível o surgimento de infecções da pele e tecidos moles. Nesta perspectiva, para além doutras medidas de profilaxia abordadas na Parte sobre Infecciologia, caso surjam infecções da pele e tecidos moles, a antibioticoterapia de eleição contempla a amoxicilina-clavulanato (dose de amoxicilina: 30-60 mg/kg/dia PO ou IV em 3 doses); como alternativa: cefoxitina IV ou IM (75-200 mg/kg/dia em 3-4 doses), ou clindamicina IV, IM ou PO (15-40 mg/kg/dia em 3-4 doses) + cotrimoxazol (PO ou IV na dose de sulfametoxazol de 40-100 mg/kg/dia em 2-4 vezes, ou ciprofloxacina PO se > 18 anos: 10-30 mg/kg/dia; duração da antibioticoterapia -10 dias.
Deve proceder-se à lavagem da ferida ou feridas com água e sabão durante 3-5 minutos e nos primeiros minutos após o evento.
Para além da profilaxia da raiva, poderá ser necessária a limpeza cirúrgica da ferida e desinfecção com soluto iodado. No caso do globo ocular, se afectado, para além da indicação de observação por oftalmologista, como primeiros cuidados citam-se irrigação com soro fisiológico durante 15 minutos dado o risco de transmissão do vírus herpes; se não existir soro fisiológico, deve utilizar-se água corrente.
Está também indicada, como profilaxia, a administração de aciclovir PO quando as lesões são profundas, em crianças com > 6 anos durante 5 dias na dose de 800 mg de 4-4 horas, 5 vezes/dia.
5. MORDEDURA POR SERPENTE VENENOSA
Etiopatogénese e importância do problema
As serpentes venenosas existentes no nosso país e na Europa pertencem fundamentalmente a três espécies: Vipera aspis, Vipera latasti (víboras) e a Macroprotodon cuccullatus; esta última raramente inocula veneno porque tem dentes muito posteriores.
As víboras distinguem-se das restantes serpentes pelas seguintes características:
- comprimento em geral inferior a 1 metro; versus maior;
- cabeça achatada, larga e triangular; versus arredondada/ovóide;
- pupilas elípticas; versus circulares;
- apêndice nasal em forma de chifre; versus ausente;
- dentes ou colmilhos em forma de garra aguçada, anteriores; versus
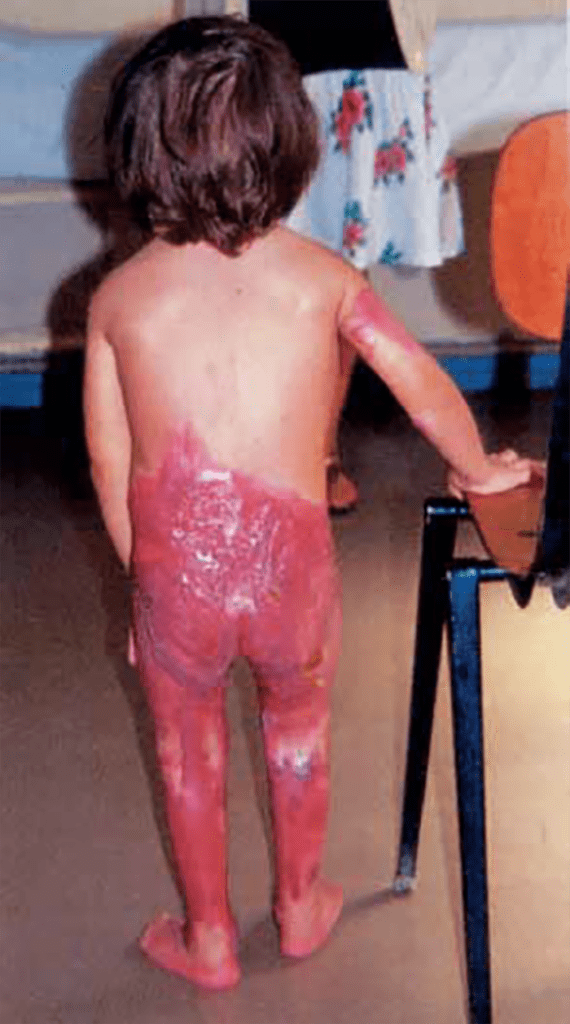
O veneno destes animais é proteolítico e coagulante em pequena dose; se inoculado em grande dose tem efeito hemolítico e anticoagulante. Não há casos registados de mortes por picada de víboras no nosso país. Tratando-se de um veneno hemotóxico, poderão surgir fenómenos hemorrágicos e trombóticos.
Manifestações clínicas e exames complementares
As manifestações clínicas variam em função do tamanho do animal, da idade e estado de saúde da criança, assim como do local da picada; a gravidade é tanto maior quanto maior o tamanho do animal e mais proximal o local da agressão.
A picada identifica-se por duas pequenas marcas ou orifícios separados entre 6 e 10 mm, sendo também possível identificar a marca de um colmilho ou mais de uma mordedura. Nos minutos que se seguem à mordedura, verifica-se inflamação localizada, com dor e edema variáveis. Se nos 30 minutos seguintes não se verificar reacção inflamatória local, é provável que a inoculação do veneno tenha sido escassa.
Para além dos fenómenos locais descritos, outros como flictenas, necrose, linfangite e tromboflebite poderão surgir. No caso de inoculação sistémica importante poderão surgir náuseas, vómitos, CID, choque, HTA, IRA, anemia hemolítica, convulsões, choque anafiláctico, rabdomiólise, etc.. São critérios de gravidade idade < 5 anos e lesões na face, pescoço e tronco.
Como prioridade, para além de ser fundamental proceder a colheita de sangue para hemograma e estudo da coagulação, o quadro descrito implica monitorização do doente durante um período ~24 horas, e evacuação para UCIP no caso de surgirem sinais de doença sistémica com disfunção multiorgânica.
Tratamento inicial
Imediatamente após a mordedura são estabelecidas as seguintes medidas gerais:
- imobilização do membro afectado, colocando-o em posição inferior ao tronco;
- arrefecimento local moderado (saco de água fria separado da pele com toalha);
- limpeza da ferida com água e sabão e, posteriormente, com peróxido de hidrogénio;
- analgésicos (paracetamol, ibuprofeno) – o ácido acetilsalicílico, hoje só utilizado em situações especiais, pode potenciar o efeito do veneno;
- antibioticoterapia (ceftriaxona – 80 mg/kg em dose única IV);
- profilaxia antitetânica, inclusivamente nos doentes vacinados (1 dose de reforço).
Tratamento hospitalar (UCIP)
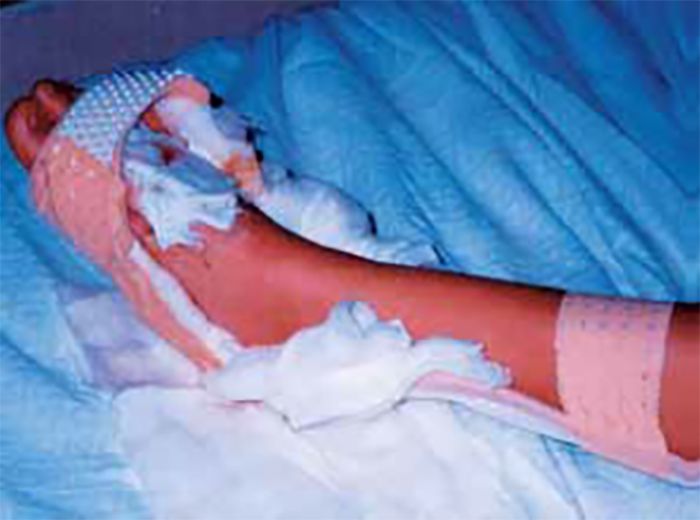
- limpeza da ferida com excisão dos tecidos no caso de necrose;
- imobilização e (agora) elevação do membro;
- sedação com diazepam se houver agitação;
- heparinoterapia se existir CIVD;
- fasciotomia se existir edema compressivo (síndroma compartimental);
- soro anti-ofídio com indicações muito precisas dado o risco de choque anafiláctico; por outro lado, o efeito é duvidoso, sendo que os corticóides e os anti-histamínicos não modificam a evolução do processo.
Nota: Não se deve garrotar o membro atingido nem fazer incisão no local da mordedura por aumentar o risco de disseminação do veneno; também o socorrista não deverá proceder à sucção da ferida.
6. LESÕES E PICADAS POR ANIMAIS MARINHOS
Nesta alínea é dada ênfase à picada pelo peixe-aranha e às lesões por medusa, anémona e hidra.
Etiopatogénese
O peixe-aranha, com duas variedades principais – uma de menor comprimento ~15 cm, e outra com cerca de 55 cm tem espinhos venenosos numa das duas barbatanas dorsais, e em torno dos opérculos branquiais. Podendo estar enterrado na areia da praia, ao ser pisado inocula o veneno neurotóxico, não deixando habitualmente o espinho; ao ser manuseado ou pisado depois de morto, sua picada continua a ser venenosa.
No caso da medusa, anémona e hidra, o veneno, actuando por contacto, é libertado por determinadas células chamadas nematocistos, as quais funcionam como reservatório do veneno.
Manifestações clínicas
No caso do peixe-aranha, a picada localizada nas mãos ou pés provoca dor intensíssima e edema duro de dimensões varáveis; poderão surgir sintomas e sinais gerais como hipertermia, náuseas, vómitos, ansiedade, cefaleia, cãibras, dificuldade respiratória, sudação, vertigens, etc..
Tratando-se dos problemas provocados por medusa, anémona e hidra há a particularizar o aparecimento de lesões de tipo urticária com disposição grosseiramente linear.
Tratamento
Nas picadas por peixe-aranha recomenda-se:
- desinfecção local e eventual extracção do espinho se partido ou espetado;
- imersão imediata (nos primeiros 30 minutos para garantir eficácia) em água a 45º durante cerca de 30-60 minutos, uma vez que o veneno é termolábil;
- analgésicos (paracetamol, ibuprofeno, eventualmente opiáceos);
- infiltração com lidocaína em situações não respondentes às medidas anteriores;
- profilaxia antitetânica;
- antibioticoterapia profiláctica durante 3 dias (amoxicilina + ácido clavulânico).
Nas lesões por medusa, anémona ou hidra:
- lavagem suave, sem exercer pressão, da zona da lesão com água salgada – e não com água doce pela possibilidade de ruptura das células contendo o veneno, o que poderá libertar mais tóxico, agravando a situação;
- limpeza de seguida com vinagre (ácido acético a 5%) durante 30 minutos;
- extracção de eventuais restos aderentes do animal com luvas;
- corticóides tópicos;
- analgésicos (paracetamol, ibuprofeno);
- antibiótico tópico.
Não estão indicadas aplicação de penso oclusivo nem antibioticoterapia profiláctica sistémica.
7. PICADAS POR INSECTOS VENENOSOS
Etiopatogénese e importância do problema
Além dos himenópteros (englobando abelhas, vespas e formigas), outros insectos poderão estar implicados, como mosca, certos aracnídeos (carraça e lacrau, e um tipo de aranha conhecida como viúva negra).
A viúva negra, que produz uma potente neurotoxina (a alfa-latrotoxina) – distingue-se doutras pelo corpo esferóide, preto brilhante, com uma marca vermelha “em vidro de relógio” no abdómen. A referida neurotoxina liga-se às membranas neuronais pré-sinápticas causando libertação de acetilcolina e nor-adrenalina ao nível da junção neuromuscular. Como resultado da libertação destes neurotransmissores, surge despolarização muscular excessiva e hiperactividade do sistema autónomo.
A carraça produz também uma neurotoxina. Quanto aos lacraus cabe referir que a variedade negra não produz veneno tóxico, ao contrário da amarela.
Manifestações clínicas
A picada por himenópteros em geral origina reacção local com aparecimento de pápulas pruriginosas. Poderão surgir reacções de hipersensibilidade ao veneno traduzidas por choque anafiláctico e, em casos menos graves, de forma retardada sob a forma de urticária papular. Como regra, pode considerar-se que quanto mais curto é o intervalo entre a picada e o início dos sintomas, mais exuberante é a reacção.
No caso da picada por carraça poderá surgir paralisia flácida do tipo Guillain-Barré por inoculação de neurotoxina, sendo tal quadro clínico reversível com a extracção do aracnídeo.
Nas picadas de moscas, aparentemente irrelevantes, está indicado apenas tratamento sintomático. A picada por lacrau origina dor local muito intensa, edema e linfangite; a mesma tem maior relevância em crianças mais pequenas pela possibilidade de taquicárdia, arritmia e edema agudo do pulmão.
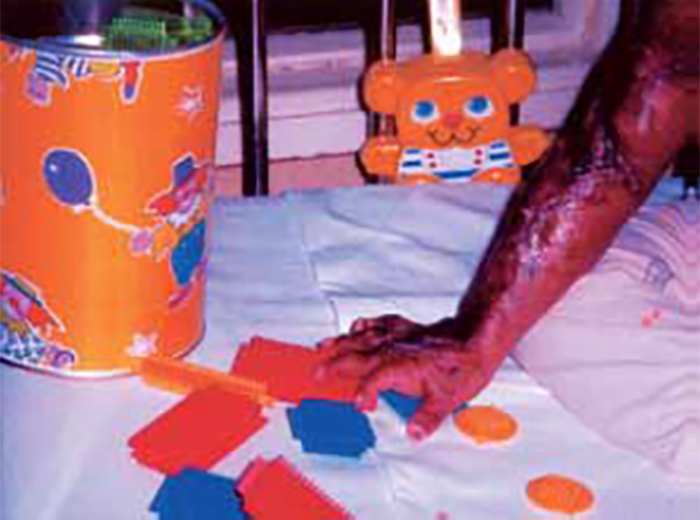
A picada da viúva negra origina reacções locais e sistémicas; na sua forma típica é indolor na primeira hora; ao cabo deste tempo surge dor local que rapidamente se generaliza pelo corpo, acompanhada de rigidez muscular regional, cefaleia, HTA, cãibras musculares e sinais muscarínicos (sialorreia, miose, hipersudorese e bradicárdia), náuseas, vómitos, irritabilidade, etc.. Em picadas nas extremidades poderão surgir lesões de necrose. Para decisão terapêutica é importante entrar em conta com quatro sintomas/sinais-chave: dor abdominal, HTA, mialgias e agitação/irritabilidade. (ver adiante)
Uma das formas de apresentação com dor abdominal, dor abdominal e rigidez muscular tipo “ventre em tábua” pode simular quadro de abdómen agudo relacionável com apendicite aguda ou peritonite. Na literatura antiga estão descritos casos fatais relacionados com laparotomia intempestiva, realizada no pressuposto de diagnóstico de apendicite aguda.
Tratamento
Nas picadas por himenópteros aplica-se tratamento que se pode generalizar a todas as picadas de insectos:
- extracção imediata do ferrão (com pinça e não espremendo);
- lavagem/limpeza da ferida;
- arrefecimento com compressas geladas e elevação do membro (caso se trate de membro afectado) para combater o edema;
- anti-histamínicos e analgésicos.
Nas reacções sistémicas, com internamento em UCIP, podem estar indicados:
- adrenalina a 1/1.000 via SC na dose de 0,01 mL/kg;
- corticóides sitémicos;
- beta-agonistas se se verificar broncospasmo;
- dopamina e cristalóides em caso de choque/hipotensão.
Nas picadas por carraça recomenda-se a extracção mediante impregnação com éter ou cloreto de etilo. Não está indicada antibioticoterapia profiláctica da febre escaronodular.
Nas picadas por lacrau deve aplicar-se gelo e, eventualmente proceder-se a infiltração de anestésico local quando a dor é muito intensa.
Nos casos de picada por viúva-negra:
- tratamento sintomático, recomendando-se atropina se surgir síndroma muscarínica e gluconato de cálcio se surgirem cãibras;
- a verificação de 3 ou menos dos sinais-chave anteriormente referidos com duração inferior a 12 horas estabelece indicação para tratamento conservador com benzodiazepinas e/ou opióides;
- a verificação de 4 ou mais dos sinais-chave ou a hipótese anterior > 12 horas obrigam à utilização de soro antiveneno específico após prova intradérmica prévia a fim de avaliar risco de anafilaxia (em geral inferior a 1%).
BIBLIOGRAFIA
Cohen JI, Davenport DS, Stewart DS, et al. Recommendations for prevention and therapy for exposure to virus B (Cercopithecine herpes virus 1). Clinical Infectious Diseases 2002; 35: 1191-1203
Dias JP, Valente P. Antibióticos no Ambulatório Pediátrico (Monografia). Lisboa: Pfizer, 2006
Dias JP, Valente P (eds) et al. Antibióticos em Pediatria (Monografia). Lisboa: SmithKline Beecham, 2000
Freeman T. Hypersensitivity to hymenoptera stings. NEJM 2004;351:1978-1984
Fuhrman BP, Zimmerman J. Pediatric Critical Care. St Louis: Mosby Elsevier, 2006
Gold BS, Dart RC, Barish RA. Bites of venomous snakes. NEJM 2002;347:347-356
Helfaer MA, Nichols DG. Roger´s Handbook of Pediatric Intensive Care. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins, 2009
Ibister G. Necrotic arachnidism. The mythology of a modern plague. Lancet 2004;364:549-553
Ibister G, Graudins A, White J, et al. Antivenom treatment in arachnidism. Clin Toxicol 2003;41:291-300
Junghanss T, Bodio M. Medically important venomous animals: biology, prevention, first aid and clinical management. Clin Inf Dis 2006;43:1309-1317
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
McIntosh N, Helms P, Smyth R, Logan S. Forfar and Arneil´s Textbook of Pediatrics. London: Churchill Livingstone, 2008
Nsabimana JMF, Moutschen M, Thiry E, Meurens F. Infection humaine par le virus B (Cercopithecine herpes virus 1) di singe en Afrique. Cahiers Santé 2008;1:3-8
O’Neill Jr JA, Rowe MI, Grosfeld JL, et al (eds). Pediatric Surgery. Philadelphia: Elsevier, 2017
Perkins RA, Morgan S. Poisoning, envenomation and trauma from marine creatures. Am Fam Phys 2004;69:885-890
Ponce P, Teixeira J. Manual de Urgências e Emergências. Lisboa; Lidel, 2006
Rogers MC. Textbook of Pediatrics Intensive Care. Baltimore: Lippincott Williams & Wilkins, 2008.
Ruza F, et al (eds). Tratado de Cuidados Intensivos Pediátricos. Madrid: Norma-Capitel, 2003
Shields WC, McDonald EM, Stepnitz R, et al. Dog bites: an opportunity for parent education in the pediatric emergency department. Pediatr Emerg Care 2012;28:966-970
Snyder R. Snake bites. JAMA Pediatrics 1962;103:85-96
Torpy JM, Schwartz LA, Golub RM. Snakebite. JAMA 2012;307(15):1657. doi:10.1001/jama.2012.433