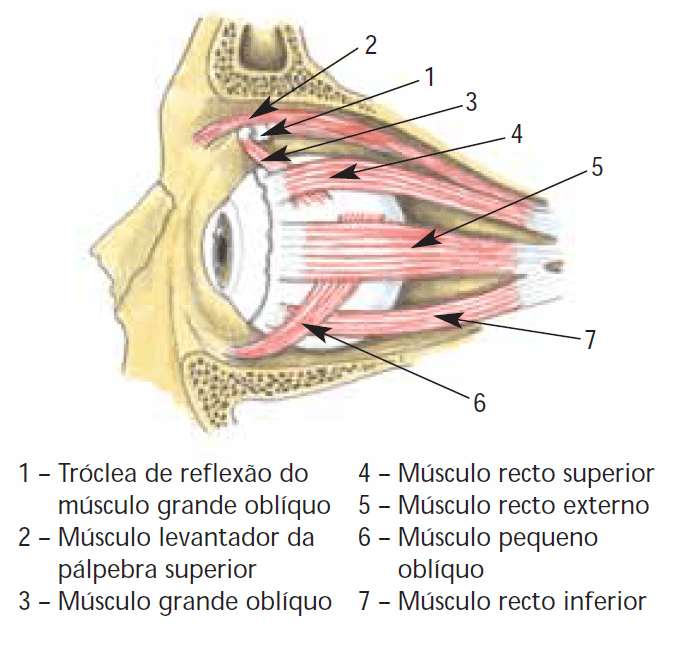
Importância do problema e sistematização
Os traumatismos óculo-orbitários constituem uma das principais causas não congénitas de cegueira monocular na idade pediátrica. Com efeito, pela sua frequência, gravidade, dificuldade de diagnóstico e de terapêutica, as suas consequências podem ser dramáticas, salientando-se entre estas a ambliopia. De referir que tal patologia pode surgir desde fase muito precoce da vida, já durante o parto, com manifestações imediatas.
As lesões traumáticas em análise podem afectar isoladamente ou em conjunto:
- as pálpebras e vias lacrimais (equimoses e lacerações palpebrais);
- o globo ocular (traumatismos fechados, abertos e por agentes físicos e químicos);
- a órbita e seu conteúdo (traumatismos directos e indirectos).
Na maioria das situações há indicação de encaminhamento urgente para o oftalmologista, sendo desejável o contacto prévio perante qualquer dúvida; efectivamente, o tratamento correcto duma determinada lesão inicial permitirá, em princípio, evitar futuras sequelas funcionais. Trata-se de situações com indicação de assistência hospitalar no serviço de urgência.
Neste capítulo são também abordadas as lesões traumáticas óculo-orbitárias no contexto de síndroma da criança maltratada.
Actuação prática
Salientando-se que a maioria das situações a tratar é confinável à Oftalmologia, importa conhecer os princípios gerais da actuação:
- Anamnese pormenorizada inquirindo sobre as condições do acidente;
- Exame objectivo implicando descrição rigorosa das lesões (designadamente estado das feridas, sua profundidade, presença ou não de corpos estranhos, medição da acuidade visual, avaliação da musculatura extrínseca e intrínseca, e presença ou ausência de enfisema subcutâneo;
- Exame neurorradiológico, o qual deve incluir exames de imagem por radiografia simples convencional, TAC e/ou RM.
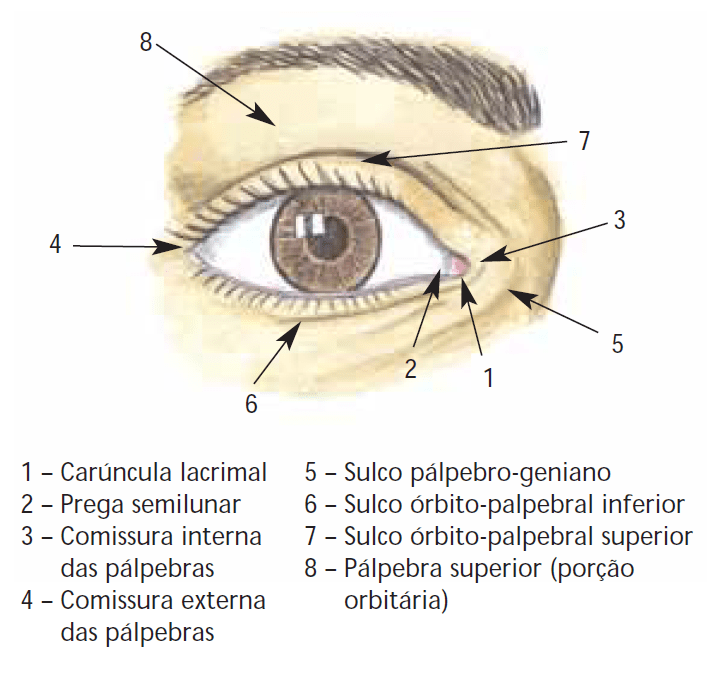
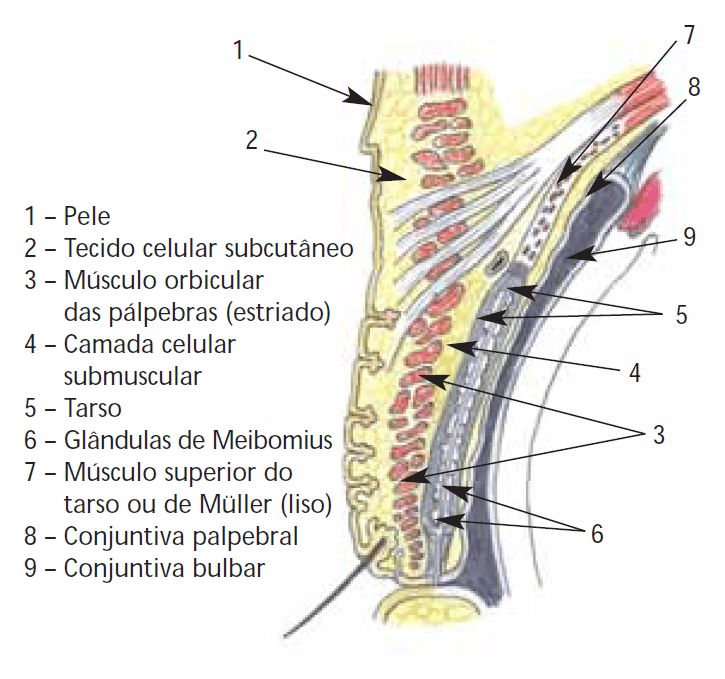
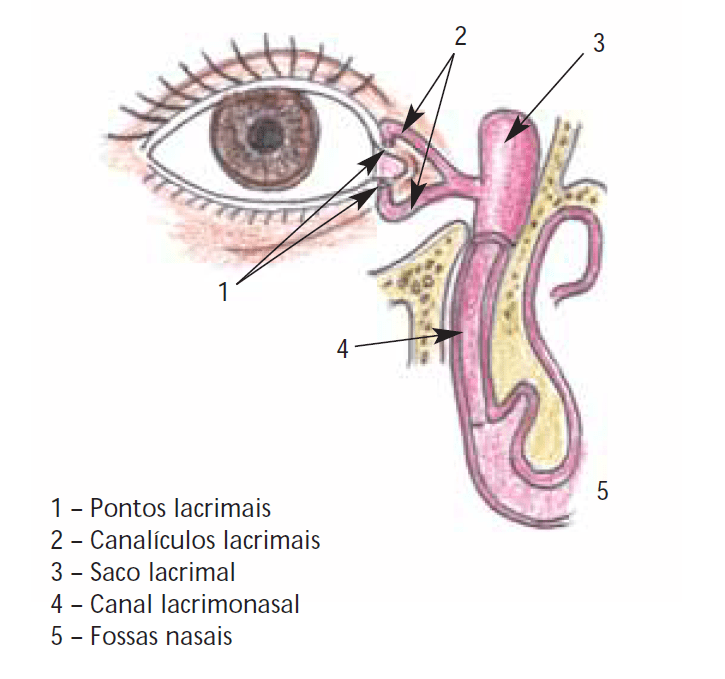
Traumatismos palpebrais
As equimoses palpebrais são infiltrações hemáticas das pálpebras, muito frequentes nos traumatismos oculares, podendo estar associadas a fracturas da órbita. Por vezes é necessário o recurso a exames complementares imagiológicos para um diagnóstico correcto.
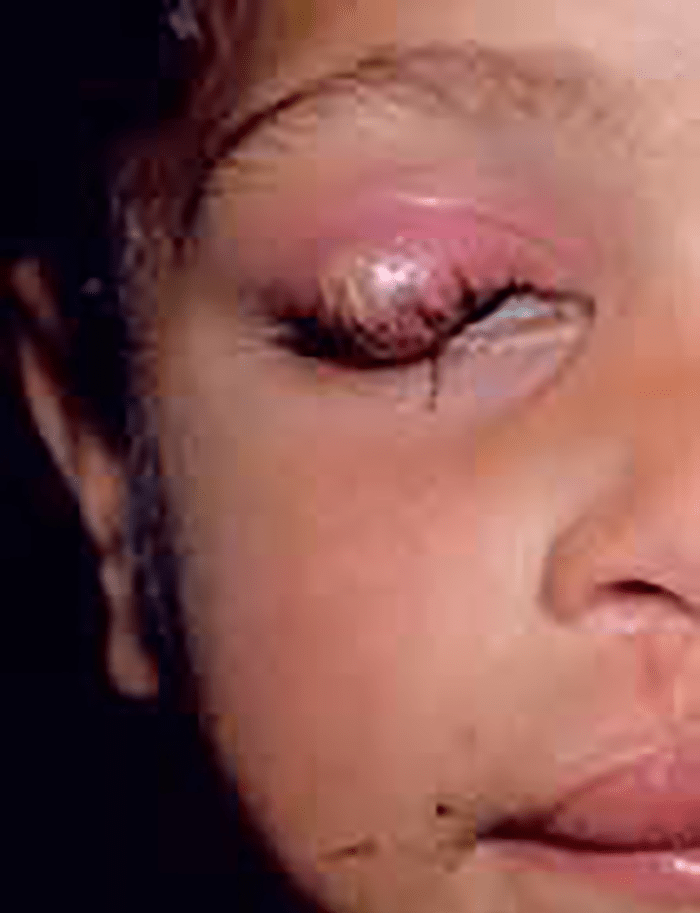
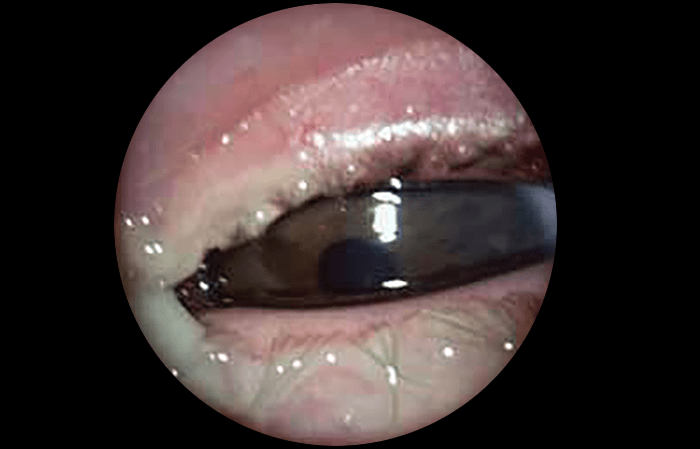
As lacerações palpebrais são lesões resultantes de rasgamento da pele até ao tecido subcutâneo. (Figura 1)
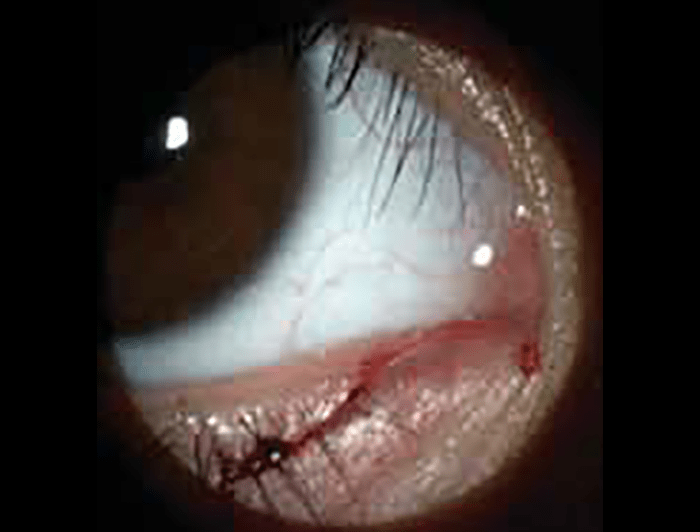
FIGURA 1. Laceração palpebral
A detecção de tais lesões implica a inspecção cuidadosa dos canalículos lacrimais, da profundidade da ferida, a pesquisa de eventuais corpos estranhos e a verificação do funcionamento do músculo levantador da pálpebra superior. Por vezes há que recorrer a anestesia geral.
Traumatismos oculares propriamente ditos
No âmbito deste tópico são considerados, respectivamente, traumatismos fechados, abertos, e lesões por agentes físicos e químicos.
Traumatismos oculares fechados
Nestas situações não há solução de continuidade das paredes do globo ocular. Para fins didácticos de sistematização são considerados, respectivamente, traumatismos do segmento anterior e do segmento posterior.
Traumatismos do segmento anterior
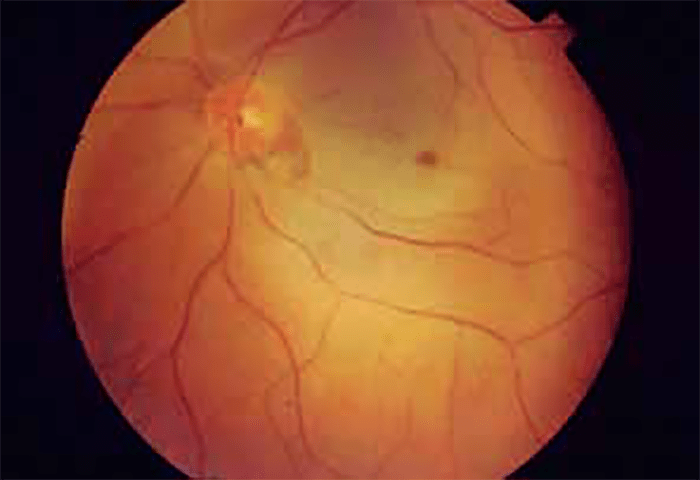
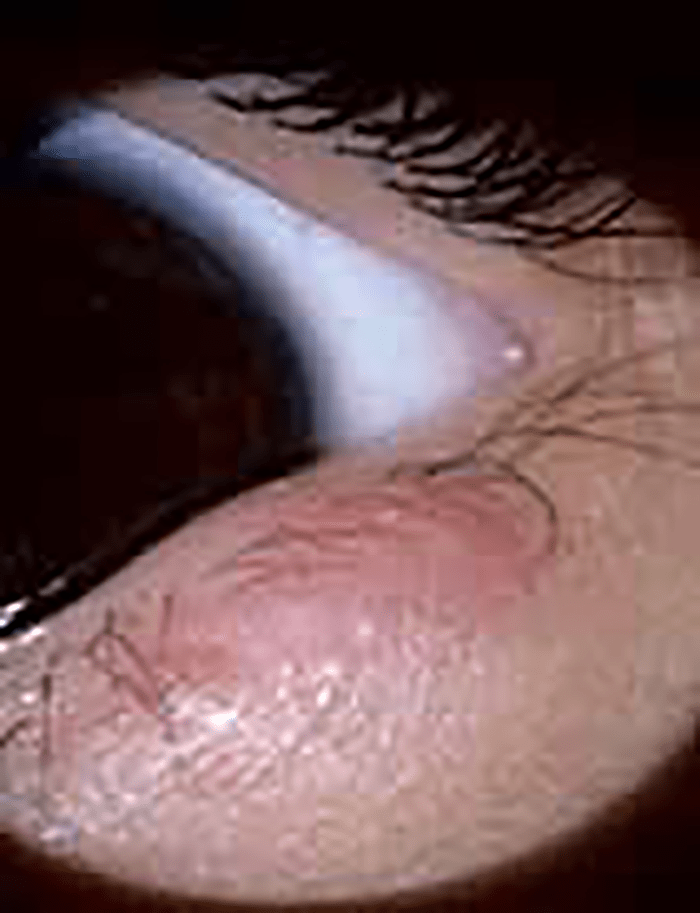
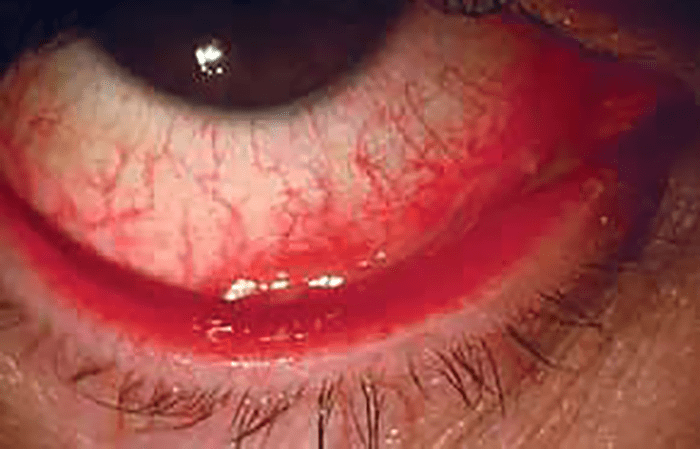
A hemorragia subconjuntival em idade pediátrica, ao contrário do que acontece no adulto, raramente é espontânea; em regra a origem é traumática. (Figura 2)
A erosão da córnea ou perda de substância superficial do epitélio corneano tem como consequência a exposição da camada basal e dos nervos corneanos superficiais.
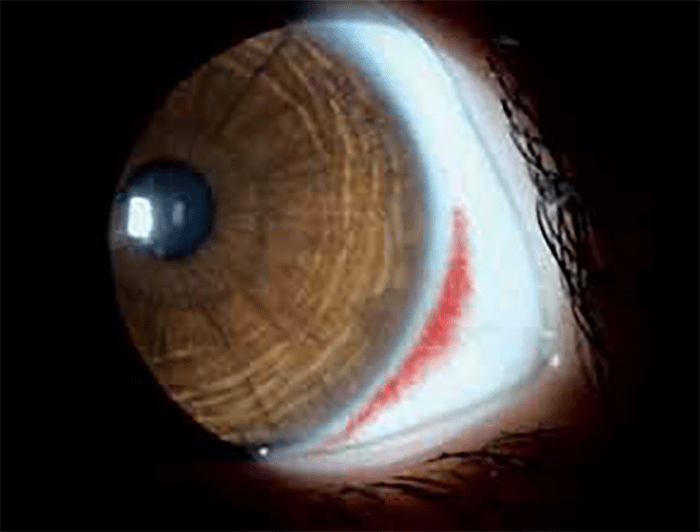
FIGURA 2. Hemorragia subconjuntival
De tal tipo de lesão no contexto de história de traumatismo, resulta dor, olho vermelho, lacrimejo e, por vezes, baixa de acuidade visual de aparecimento brusco. A aplicação de gotas de colírio anestésico e fluoresceína permite fazer o diagnóstico e orientar a terapêutica.
O corpo estranho intracorneano causa frequentemente dor ocular, olho vermelho e baixa de acuidade visual, principalmente quando se trata de corpos estranhos metálicos de localização central extraídos tardiamente.
A corectopia ou deslocação da íris pode acompanhar-se doutras lesões traumáticas; na forma congénita é rara.
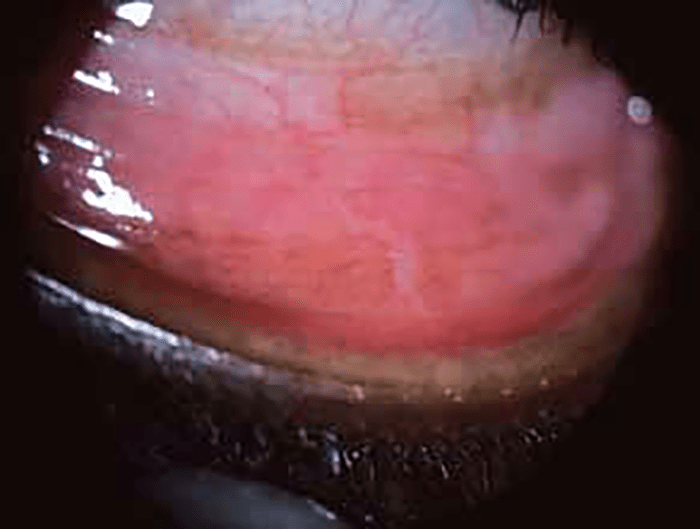
O hifema (hemorragia da câmara anterior) é uma das complicações mais frequentes que surge no contexto de compressão violenta sem solução de continuidade (contusão) do globo ocular. O hifema espontâneo pode ser uma manifestação doutras doenças (retinoblastoma, alterações da coagulação, leucemia, xantogranuloma juvenil etc.); quando abundante, não permite fazer o exame dos fundos oculares. Nestes casos deve proceder-se à avaliação ecográfica do cristalino, do vítreo e da retina. Geralmente verifica-se reabsorção em poucos dias.
A catarata traumática pode aparecer horas, dias, ou meses depois do traumatismo. Perante uma situação de catarata monocular, principalmente na segunda infância, deve efectivamente inquirir-se sobre a eventualidade de episódio traumático anterior. O tratamento das cataratas traumáticas é cirúrgico.
A luxação ou subluxação do cristalino constitui outro exemplo de lesão traumática do segmento anterior; a sua verificação na circunstância de traumatismo mínimo implica o diagnóstico diferencial com outro tipo de patologia de base (por ex. síndroma de Weill-Marchesani, de Marfan, homocistinémia ou miopia grave).
À forma congénita de deslocação do cristalino dá-se o nome de ectopia do cristalino (ectopia lentis).
A luxação anterior do cristalino é mal tolerada, acompanhando-se de dores e de diminuição da acuidade visual. A solução é cirúrgica.
A luxação posterior do cristalino é mais tolerada, mas provoca sempre uma baixa de acuidade visual que deve ser corrigida com brevidade para evitar a ambliopia. A solução, como regra geral, é cirúrgica.
A subluxação do cristalino requer apenas vigilância e correcção da acuidade visual quando é pouco acentuada. Se for muito pronunciada e com grave repercussão na acuidade visual, a solução é também cirúrgica.
Traumatismos do segmento posterior
A hemorragia do vítreo (sangue na câmara vítrea) é uma complicação frequente dos traumatismos do segmento posterior. Se pouco abundante, e permitir a observação dos fundos oculares, requer apenas vigilância. Se for muito abundante e não permitir fundoscopia, o seguimento é feito também com estudo ecográfico para avaliar o estado da retina ou a existência de possível corpo estranho. Na presença de lesões retinianas ou da não reabsorção da hemorragia, é necessário intervir cirurgicamente.
O edema retiniano, geralmente transitório, resulta de traumatismo directo do globo ocular. A visão pode estar afectada se a localização for macular.
A rotura da coroideia resulta, em geral, de traumatismo directo ântero-posterior. Pode ser compatível com boa acuidade visual se a mácula não estiver afectada.
O chamado buraco macular pode ser observado a seguir a um traumatismo (logo, ou semanas mais tarde) como complicação de edema retiniano, hemorragia sub-retiniana ou rotura da coroideia.
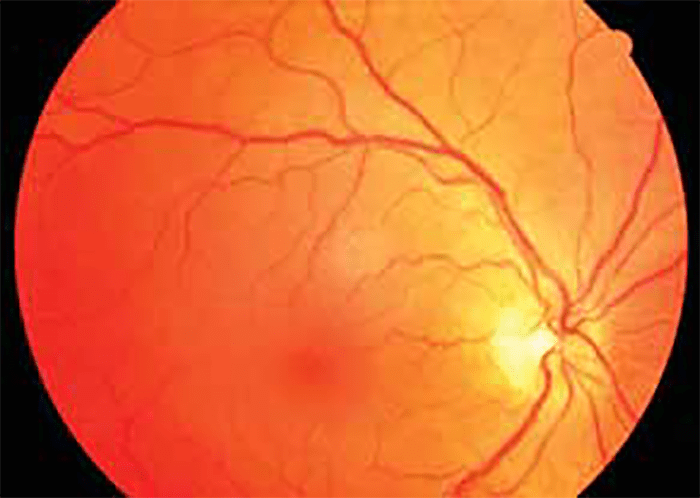
A retinopatia de Purtscher, também conhecida por angiopatia retiniana traumática, geralmente bilateral, é secundária a traumatismo craniano e torácico graves, com hiperpressão no território da veia cava superior. Manifesta-se por hemorragias retinianas e pré-retinianas abundantes, exsudados algodonosos retinianos e peripapilares, e por edema da mácula.
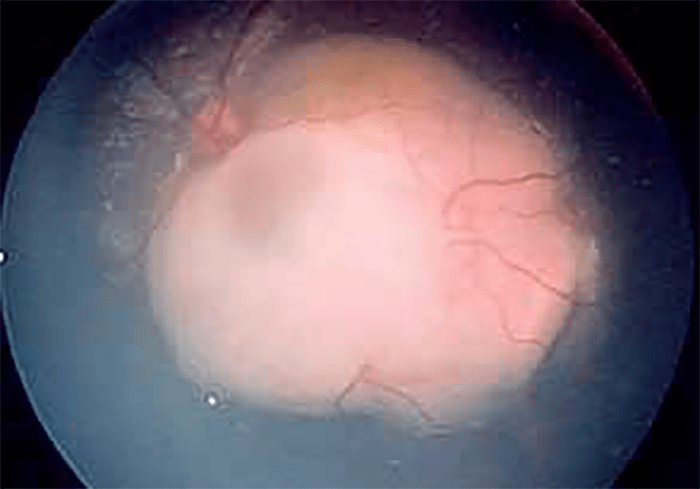
O descolamento da retina em idade pediátrica tem como primeira causa o traumatismo. A solução terapêutica é cirúrgica.
A neuropatia óptica pós-traumática resulta de compressão, ou mesmo secção anatómica, do nervo óptico. A consequência é a amaurose ou a diminuição muito acentuada da visão.
Traumatismos oculares abertos
Nestas situações há solução de continuidade das paredes do globo ocular. Como exemplos paradigmáticos consideram-se as feridas do globo ocular e os corpos estranhos.
As feridas do globo ocular, de acordo com a respectiva localização, podem ser corneanas, esclerais e córneo-esclerais. Requerem reparação cirúrgica urgente, acompanhada de tratamento anti-inflamatório e anti-infeccioso.
Os corpos estranhos intra-oculares requerem um estudo pormenorizado para se proceder à correcta localização e à extracção.
Lesões por agentes químicos e físicos
As lesões por agentes físicos são pouco frequentes na criança. O tratamento por radiações ionizantes em certos casos de tumor (retinoblastoma) pode provocar cataratas ou lesões isquémicas da retina. O traumatismo solar por fixação do sol, quando se observa um eclipse, provoca lesões maculares foveais.
As lesões por agentes químicos são mais frequentes provocando queimaduras, principalmente corneanas e conjuntivais. A gravidade depende do tipo de agente, da sua quantidade e do tempo de permanência no fundo de saco conjuntival.
Traumatismos da órbita
Nesta alínea são considerados traumatismos directos e traumatismos indirectos.
Os traumatismos directos são responsáveis por fracturas do rebordo orbitário, podendo atingir os ossos contíguos, incluindo as paredes da órbita. Podem fazer parte de um quadro traumático mais grave, com compromisso concomitante das pálpebras, vias lacrimais, globo ocular e crânio.
Os traumatismos indirectos atingem o conteúdo orbitário sem atingir o rebordo. No momento do traumatismo, o conteúdo da órbita não compressível transmite a onda de choque às paredes, sendo que as zonas de menor resistência podem sofrer fracturas (fracturas por estalido).
Os traumatismos que mais frequentemente são observados em Oftalmologia são os que atingem o pavimento, a parede interna e tecto da órbita; menos frequentes são os que atingem a parede externa e o vértice.
Traumatismos óculo-orbitários na criança maltratada
A prática de maus tratos é, infelizmente, um acontecimento frequente, por vezes mortal e sempre com sequelas físicas e psíquicas importantes.
Os sinais oftalmológicos traumáticos no contexto referido são diferentes conforme se trata de um lactente ou de uma criança com mais idade.
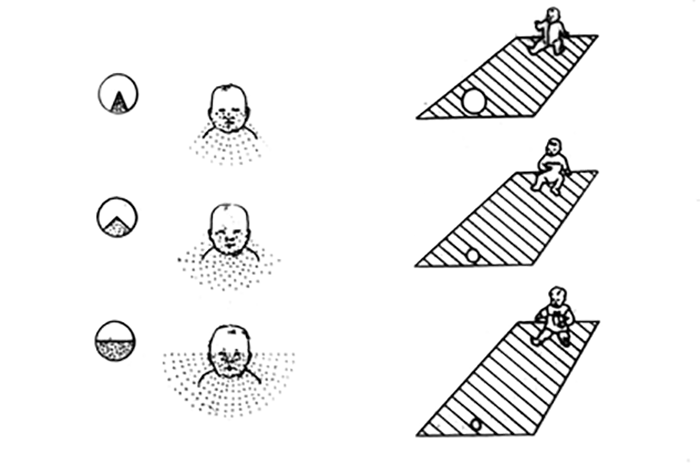
No lactente descreve-se uma síndroma especialmente grave, a síndroma da criança sacudida. Nesta síndroma a escassez de sinais traumáticos externos contrasta com a gravidade do caso (coma e crises convulsivas): a criança, chorando continuamente, é sacudida várias vezes e com violência pelo agressor. Sendo a cabeça nesta idade “suportada” com dificuldade (certa instabilidade cefálica compatível com a idade do lactente), a mesma “é projectada a cada sacudidela”.
Na ausência de anamnese, o diagnóstico é feito com base nos sinais neurorradiológicos (hematoma subdural, por vezes bilateral e edema cerebral) e oftalmológicos (hemorragias retinianas, pré-retinianas e vítreas graves).
Se a criança sobreviver, o prognóstico é grave pelas lesões retinianas, do nervo óptico e cerebrais provocadas pelo traumatismo.
Nas crianças maiores é frequente encontrar hemorragias retinianas, lesões do couro cabeludo, corpo, hematomas ou edema periorbitário, cicatrizes corneanas, hifema, desinserção da íris, luxação do cristalino, cataratas, e descolamento de retina, por vezes bilateral.
Nestes casos, a criança deve ser hospitalizada em serviço de pediatria para estudo clínico e imagiológico pormenorizado, e tratada por uma equipa multidisciplinar.
BIBLIOGRAFIA
Cruz M (ed). Tratado de Pediatria. Barcelona: Ergon, 2011
Forbes BJ, Christian CW, Judkins AR, et al. Inflicted childhood neurotrauma (shaken baby syndrome): ophthalmic findings. J Pediatr Ophthalmol Strabismus 2004; 41: 80-88
Garcia Feijoo J, Julvez P. Manual de Oftalmologia. Madrid: Elsevier, 2012
Khaw PT, Shah P, Elkington AR. Injury to the eye. BMJ 2004; 328: 36-38
Kivlin JD, Simons KB, Lazoritz S, et al. Shaken baby Syndrome. Ophthalmology 2000; 107: 1246-1254
Kliegman RM, Stanton BF, Schor NF, Geme JWSt (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier Saunders, 2011
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nelson LB, Olitsky SE. Harley’s Ophthalmology. Philadelphia: Lippincott Williams & Wilkins, 2005; 296-298
Van Heuven WAJ, Zwaan JT. Decision making in Ophtalmology. An algorithmic approach. St Louis: Mosby, 2000
Wright KW. Pediatric Ophthalmology for Primary care. Elk Grove, Illinois: AAP, 2008