Definição e importância do problema
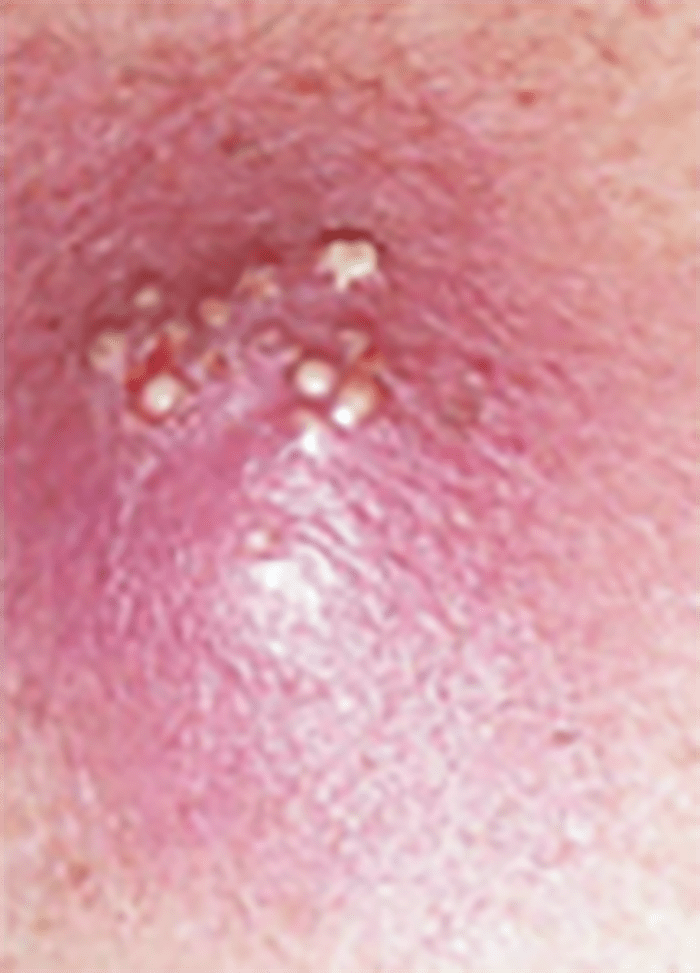
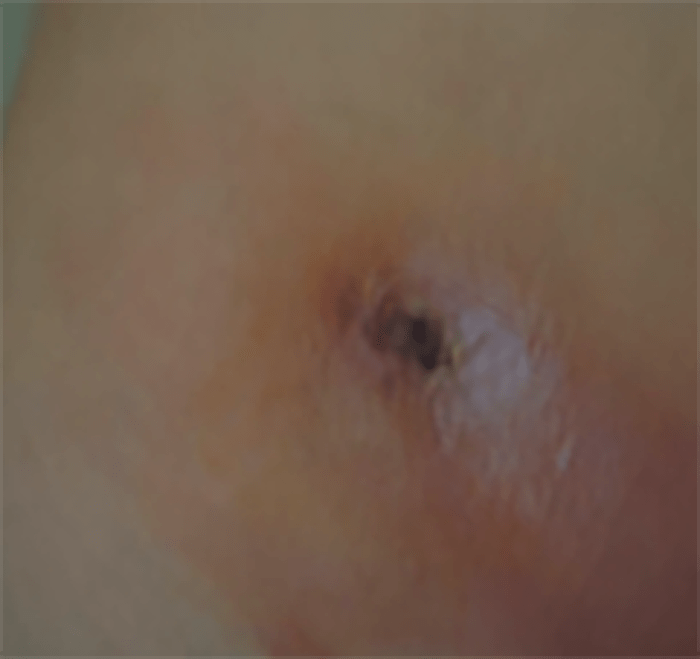
A designação de celulite periorbitária corresponde a um processo inflamatório da hipoderme e do tecido conjuntivo subcutâneo, com ligeiro compromisso da derme, ao nível da pálpebra e tecidos periorbitários, sem proptose ou limitação do movimento ocular.
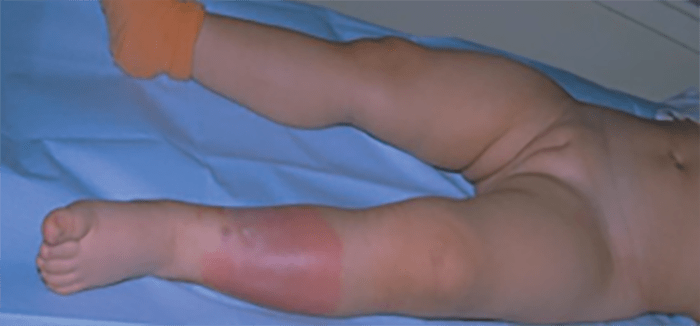
A celulite orbitária corresponde a um processo inflamatório dos tecidos da órbita com proptose, limitação dos movimentos do globo ocular, associado a edema da conjuntiva com rebordo saliente avermelhado em torno da córnea (quemose).
À primeira também se chama pré-septal (ou anterior ao septo orbitário), e à segunda, pós-septal (ou posterior ao septo orbitário), considerando-se anatomicamente o septo orbitário (folheto fibroso) como uma barreira entre os dois referidos espaços.
Na pálpebra superior, o septo tem origem no periósteo do rebordo orbitário superior, ligando-se ao bordo superior do tarso* da pálpebra (zona correspondente à zona de rebatimento da pele (concavidade circundante da respectiva pálpebra).
O septo ao nível da pálpebra inferior origina-se ao nível do periósteo do rebordo orbitário inferior, inserindo-se no bordo inferior do tarso* da pálpebra inferior (correspondente à concavidade inferior circundante da pálpebra inferior).
Estas noções anatómicas têm implicações clínicas importantes; com efeito, como se disse, o septo constitui uma barreira biológica que dificulta (não impedindo, no entanto) a difusão da infecção do espaço pré-septal para o espaço orbitário. Por outro lado, a localização pós-septal não implica necessariamente infecção prévia pré-septal.
* Recorda-se a definição de tarso palpebral: lamela de tecido conjuntivo relativamente denso, com forma semilunar, que constitui o bordo livre da pálpebra superior ou inferior. |
Aspectos epidemiológicos
A celulite periorbitária é mais frequente que a celulite orbitária, sendo a primeira mais comum em crianças mais pequenas (< 5 anos); a segunda predomina em crianças mais velhas, o que é relacionável com o maior desenvolvimento dos seios perinasais nesta última circunstância.
A celulite orbitária ocorre mais frequentemente no sexo masculino (2:1), com maior incidência no final do Outono e início da Primavera, coincidindo com o pico de incidência de sinusite. A idade média na data do diagnóstico é de 7 anos.
Etiopatogénese
Os agentes patogénicos implicados são difíceis de identificar, pois as hemoculturas são maioritariamente negativas e as culturas orbitárias apenas são realizadas se estiverem indicadas intervenção cirúrgica e drenagem; de facto, demonstrou-se que os resultados de tais exames poderão não reflectir a etiologia das celulites orbitárias com precisão.
Antes da introdução da vacina conjugada anti-Haemophilus influenzae tipo b, este era o agente microbiano mais comum nas crianças de idade inferior a 2 anos. Actualmente contam-se como agentes mais frequentemente implicados os seguintes: Streptococcus pneumoniae, Haemophilus influenzae não tipável, Moraxella catarrhalis, Streptococcus pyogenes, Staphylococcus aureus meticilino-sensível, grupo S. anginosus (milleri) e anaeróbios (Bacteroides, Peptostreptococcus, Prevotella, Fusobacterium).
Nas últimas décadas, infecções por S. aureus meticilino-resistente (MRSA) têm tido incidência crescente, sobretudo no continente americano. Outros agentes etiológicos mais raros incluem Pseudomonas aeruginosa (indivíduos imunocomprometidos) e Eikenella corrodens. A infecção polimicrobiana (aeróbios e anaeróbios) surge sobretudo em crianças mais velhas.
A etiologia fúngica é rara, nomeadamente a mucormicose típica do doente diabético; a primeira, juntamente com a aspergilose são típicas nos doentes imunocomprometidos, apresentando uma evolução mais lenta ao longo de meses.
A infecção por micobactérias (sobretudo M. tuberculosis) é rara.
De acordo com o ponto de partida da infecção, podem ser consideradas diferentes etiologias, discriminadas no Quadro 1.
QUADRO 1 – Etiologias mais prováveis de acordo com o ponto de partida da infecção presumível.
| Patologia | Agente mais provável |
| Sinusite / Infecção respiratória | S. pneumoniae, H. influenzae não tipável, M. catarrhalis, Streptococcus spp, S. aureus, Anaeróbios |
| Traumatismo / Picada / Infecção cutânea | S. aureus (SAMS), S. pyogenes |
| Hordéolo | S. aureus |
| Dacriocistite | S. pneumoniae, H. influenzae não tipável, S. pyogenes, S. aureus, P. aeruginosa |
| Abcesso dentário | Polimicrobiano (aeróbios e anaeróbios) |
| Infecção sistémica – via hematogénica | S. pneumoniae, H. influenzae não tipável, S. pyogenes, S. aureus |
A celulite pré-septal surge na sequência de três possíveis mecanismos: lesões traumáticas penetrantes (ferida, picada de insecto, mordedura); inflamações ou infecções perioculares (dacriocistite, dacrioadenite, calázio, conjuntivite, infecção cutânea); ou, menos frequentemente, difusão de microrganismos a partir de infecções dos seios perinasais ou nasofaringe para o espaço pré-septal.
A celulite pós-septal surge maioritariamente (70-90%) como consequência de sinusite, por extensão do processo infeccioso.
O seio etmoidal é o ponto de partida mais frequente; seguem-se, por ordem decrescente quanto ao referido ponto de partida, outras localizações – etmoidal > maxilar > frontal > esfenoidal-, verificando-se disseminação através da lamina papyracea.
A razão pela qual o espaço orbitário está particularmente predisposto à difusão da infecção a partir dos seios perinasais relaciona-se com particularidades anatómicas regionais: deiscências ósseas naturais nas paredes dos seios esfenoidais e etmoidais (lamina papyracea); e veias orbitárias sem válvulas, o que permite comunicação entre os seios e a órbita por via sanguínea.
Pela rapidez da evolução clínica, e pela proximidade das estruturas do SNC, sobretudo nos casos de celulite pós-septal, existe risco de lesão do globo ocular, nervo óptico, assim como de trombose do seio cavernoso, meningite e abcesso cerebral.
Frequentemente verifica-se infecção de dois seios perinasais, sendo a combinação etmoidal-maxilar a mais frequente. Outros mecanismos incluem: infecções odontogénicas; lesões penetrantes com solução de continuidade do septo orbitário (traumatismo, status pós-cirurgia ocular, etc.) ou disseminação hematogénica por bacteriémia que, sendo rara, pode ocorrer por S. pneumoniae, S. pyogenes, S. aureus ou H. influenzae não tipável.
Manifestações clínicas
As manifestações clínicas permitem, na maioria dos casos, estabelecer a diferença entre celulite pré-septal e pós-septal. (Quadro 2)
QUADRO 2 – Diferenças clínicas entre a celulite pré-septal e pós-septal.
| Celulite pré-septal | Celulite pós-septal |
| Edema palpebral com ou sem eritema | |
| Febre | |
| Visão não afectada | Dor ocular marcada |
| Dor com os movimentos oculares | |
| Quemose | |
| Proptose | |
| Oftalmoplegia | |
| Alteração da resposta pupilar | |
| Alterações visuais | |
Podem ser considerados 5 estádios de evolução, salientando-se, e reiterando, que a celulite pré-septal não precede obrigatoriamente a celulite pós-septal. (Quadro 3)
QUADRO 3 – Estádios da doença (adaptado de Chandler et al, 1970).
| Estádio I Celulite pré-septal |
|
| Estádio II Celulite pós-septal |
|
| Estádio III Abcesso subperióstico |
|
| Estádio IV Abcesso da órbita |
|
| Estádio V Trombose do seio cavernoso |
|
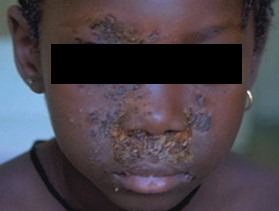
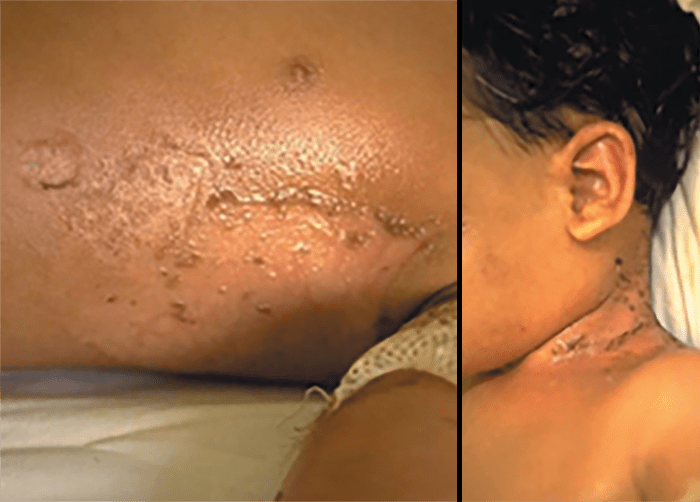
As Figuras 1, 2, 3 e 4 documentam respectivamente os estádios I, II, II e IV.
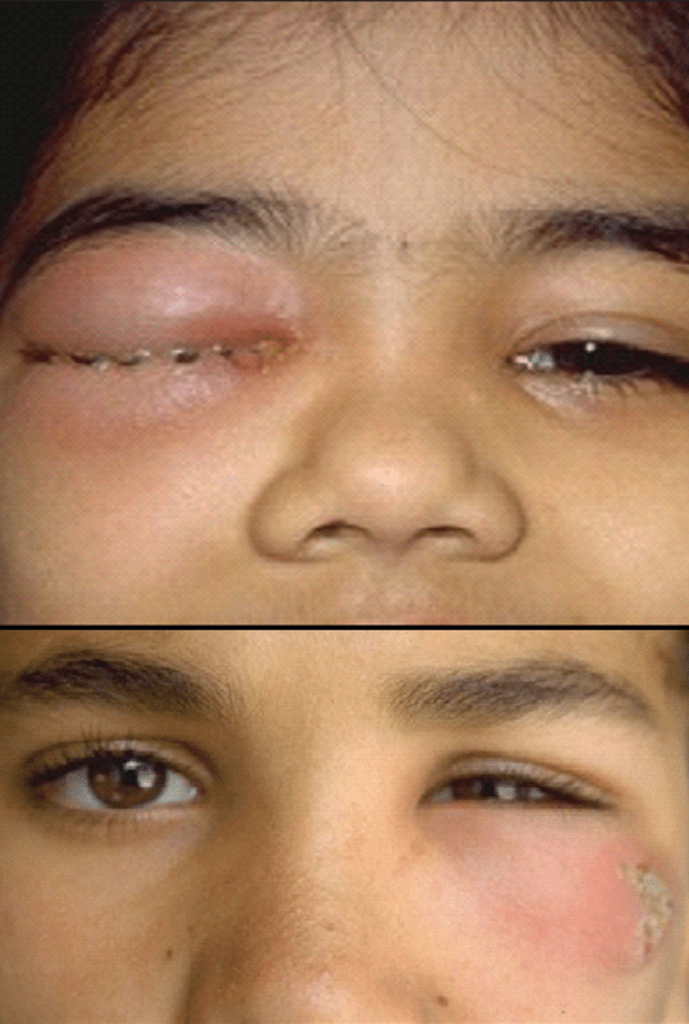
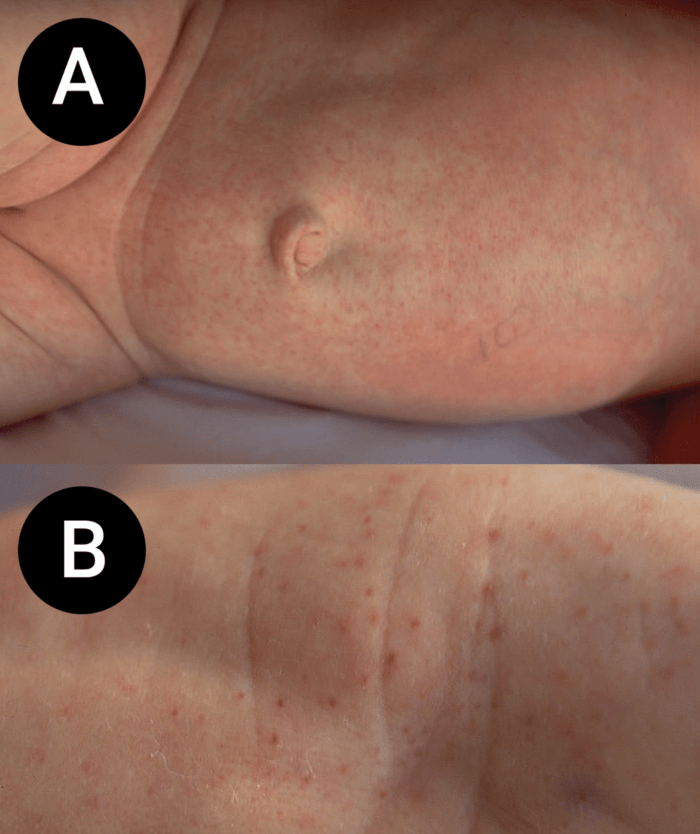
FIGURA 1. Estádio I – celulite pré-septal ou periorbitária.
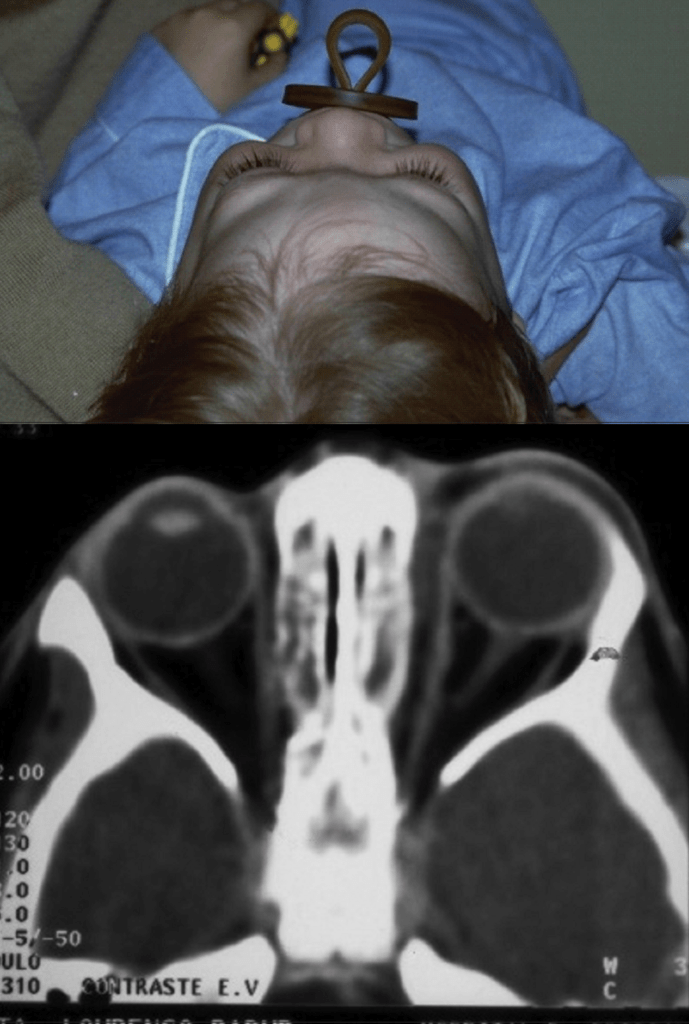
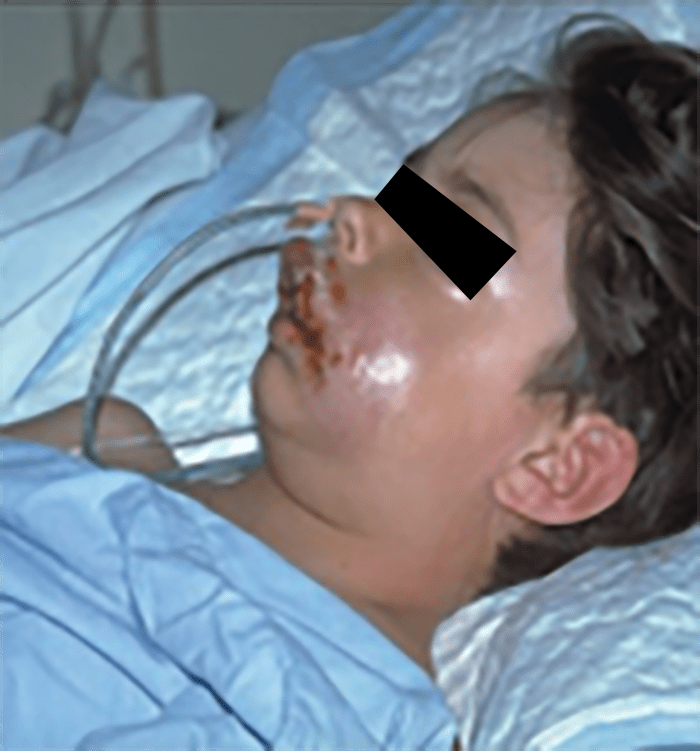
FIGURA 2. Estádio II – celulite pós-septal ou orbitária. Aspecto imagiológico da TAC: assimetria de estruturas/proptose do olho direito.
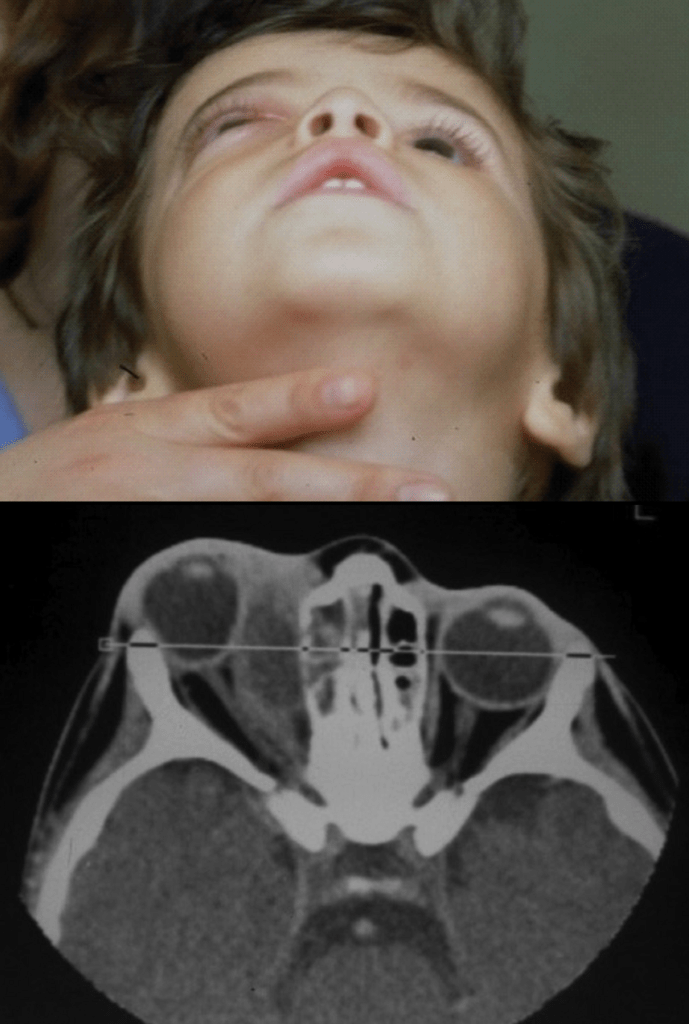
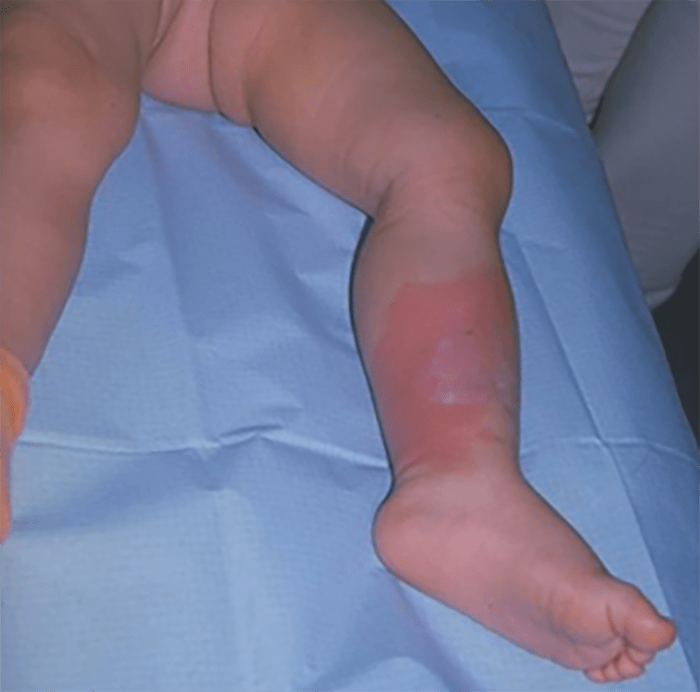
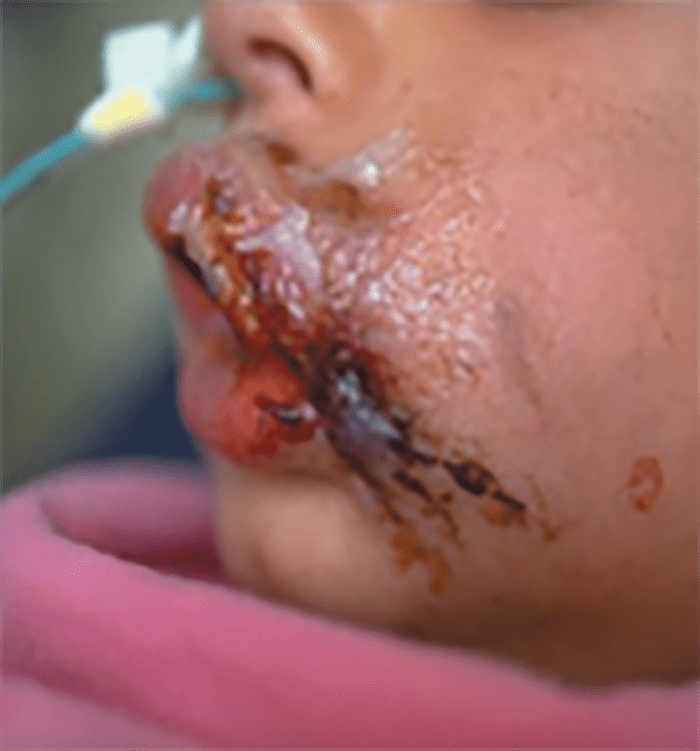
FIGURA 3. Estádio III – celulite pós-septal ou orbitária. Aspecto imagiológico da TAC: espaço orbitário preenchido por imagem “em meia lua” com contorno nítido (abcesso subperióstico secundário a sinusite), correspondendo ao levantamento do periósteo pela colecção purulenta; compressão do nervo óptico e do próprio globo ocular.
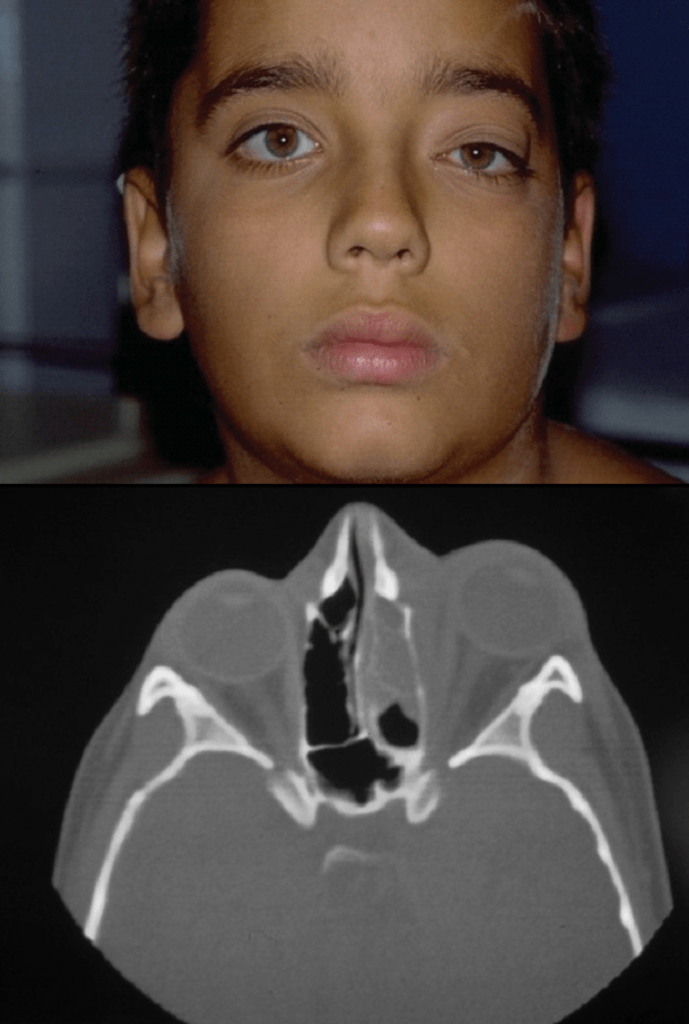
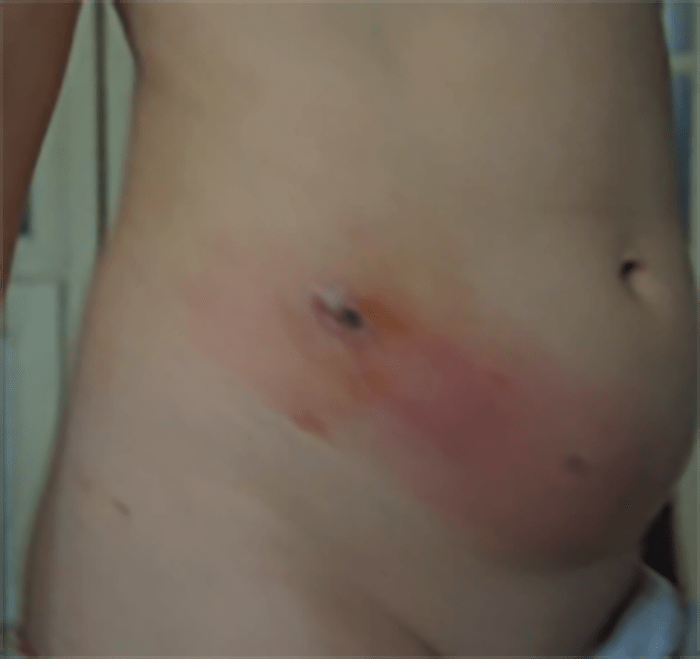
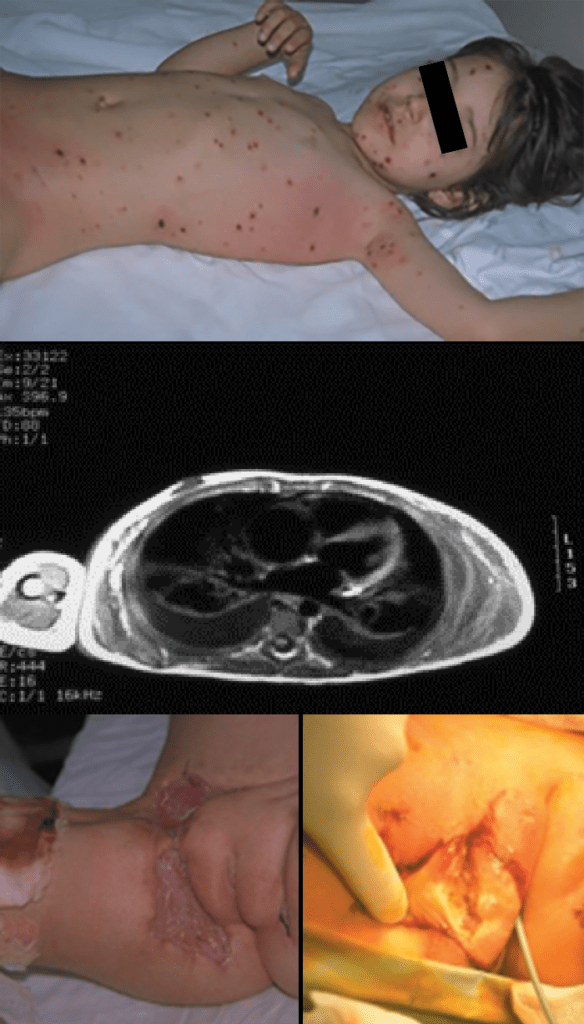
FIGURA 4. Estádio IV – celulite pós-septal ou orbitária. Aspecto imagiológico da TAC: espaço orbitário preenchido por imagem “em meia lua” com contorno denteado, e densidade diferente da anterior, correspondendo ao abcesso do espaço orbitário, comprimindo o nervo óptico e o próprio globo ocular.
Estabelecendo uma relação com aspectos da patogénese já descritos anteriormente, importa salientar sob o ponto de vista clínico que a evolução para abcesso subperióstico e abcesso orbitário, as complicações mais frequentes, pode ser rápida. O abcesso subperióstico surge maioritariamente por extensão de sinusite etmoidal, facilitada através da lamina papyracea.
No abcesso orbitário, o aumento da pressão intraorbitária com consequente oclusão dos vasos da retina, assim como a neurite óptica associada, podem condicionar alteração da visão. Como manifestação clássica cita-se a fixação do olhar “para baixo e para fora”. A ausência de reflexo pupilar aferente é um sinal precoce de complicação, o que implica necessidade da sua detecção com regularidade e em tempo útil. A extensão da infecção para o SNC- traduzida por empiema epidural ou subdural, meningite e abcesso cerebral-, e a trombose do seio cavernoso são as complicações mais temidas.
Exames complementares
Exames laboratoriais
Na celulite pré-septal e pós-septal pode verificar-se a presença de leucocitose, embora seja mais frequente nesta última. A bacteriémia ocorre em cerca de 33% das crianças com idade inferior a 4 anos. Por isso, deve realizar-se hemocultura antes do início da antibioticoterapia, embora o isolamento microbiano a partir do sangue seja raro. Nos casos com necessidade de intervenção cirúrgica deve proceder-se a:
- exame bacteriológico da amostra colhida; e
- exames micológico e para micobactérias em crianças com factores de risco como imunossupressão.
A pesquisa microbiana através de zaragatoa nasal e/ou conjuntival tem pouco interesse para o diagnóstico etiológico.
Exames imagiológicos
A tomografia axial computadorizada (TAC) da órbita e seios perinasais (de preferência com contraste intravenoso) é importante para avaliar a extensão da celulite e as complicações. Deve ser realizada em todos os casos que apresentem sintomas ou sinais sugestivos de celulite da órbita, de envolvimento do SNC (convulsões, alterações do estado de consciência), incerteza quanto ao diagnóstico (menor colaboração no exame objectivo em crianças com <1 ano) e deterioração do estado geral ou intensificação dos sinais inflamatórios locais apesar de tratamento instituído (após 24-48 horas).
A ressonância magnética (RM) é o exame de eleição na suspeita de trombose do seio cavernoso (desenvolvimento de sintomas bilaterais após um período unilateral, ou clínica sugestiva de síndroma do ápex orbitário).
Da mesma forma, na suspeita de complicações intracranianas está indicada a realização de punção lombar, sempre após TAC crânio-encefálica e na asusência de contraindicação.
Diagnóstico diferencial
O edema palpebral presente, quer na celulite pré- como pós-septal, pode ter múltiplas causas, a destacar: reacção alérgica, hipoproteinémia (edema bilateral), enfarte da parede da órbita e hematoma subperióstico (por doença de células falciformes, designadamente).
O diagnóstico diferencial de proptose inclui inúmeras patologias de origem infecciosa e não-infecciosa: trombose do seio cavernoso, pseudotumor da órbita, granulomatose de Wegener, sarcoidose, linfoma, rabdomiossarcoma, retinoblastoma, histiocitose X e doença de Graves (proptose bilateral). A síndroma do apex orbitário, que pode decorrer destas etiologias, pode ser forma de apresentação de mucormicose ou aspergilose em doentes imunocomprometidos.
Tratamento
As celulites pré e pós-septal devem ser rápida e agressivamente tratadas. A escolha de antibioticoterapia deve ser feita de acordo com o ponto de partida de infecção presumível, idade do doente, presença de co-morbilidades e complicações.
Na celulite pré-septal poderá ser considerado o tratamento em regime ambulatório e por via oral nas crianças de idade superior a 1 ano, sem doença subjacente, sem sinais sistémicos, com condições para boa adesão à terapêutica, e garantia de vigilância médica 24 horas após o início do mesmo.
A amoxicilina com ácido clavulânico ou a cefuroxima oral são boas opções terapêuticas nas crianças em que o ponto de partida aparenta ser sinusite, infecção odontogénica, conjuntivite ou mordedura de cão. Na presença de hordéolo, calázio, dacrioadenite, dacriocistite, lesão cutânea ou picada de insecto a escolha é a flucloxacilina.
A celulite pós-septal deve ser sempre tratada em regime de internamento, com vigilância rigorosa dos sinais clínicos sugestivos de extensão ou complicação do processo infeccioso. Nestes casos, as opções terapêuticas devem ser de aplicação intravenosa:
- amoxicilina com ácido clavulânico (50 mg/kg/dose 8/8h de amoxi-) ou,
- cefuroxima (150 mg/kg/dia 8/8h) associada ou não à clindamicina (30-40 mg/kg/dia 6/6h).
Na suspeita de bacteriémia é preferível optar por ceftriaxona (100 mg/kg/dia 24/24h) ou cefotaxima (200 mg/kg/dia 6/6h).
No abcesso subperióstico ou orbitário associa-se habitualmente a clindamicina ou o metronidazol à cefalosporina de terceira geração.
Nos doentes com suspeita de extensão intracraniana, deve optar-se por ceftriaxona ou cefotaxima (200 mg/kg/dia 6/6h) em associação à vancomicina (60 mg/kg/dia 8/8h) e metronidazol (30 mg/kg/dia 8/8h).
Nos doentes com celulite não complicada é possível a transição para terapêutica oral após 24h de apirexia, na condição de se verificar melhoria dos sinais inflamatórios locais, habitualmente após 3 a 5 dias de terapêutica intravenosa. A duração total é de 10 dias, excepto nos casos de sinusite aguda (14 dias), complicações intracranianas (4-8 semanas) e de sinusite etmoidal com destruição óssea (6-8 semanas).
Na suspeita de infecção confirmada por S. aureus meticilino-resistente (MRSA) é recomendado o uso de vancomina.
Nos casos de infecção em doentes imunocomprometidos ou com outros factores de risco (por ex. diabetes mellitus mal controlada), deve ser considerada a etiologia fúngica e ponderar-se a instituição de antifúngico.
A terapêutica adjuvante com descongestionantes nasais, por um período de 7-10 dias e nos casos em que o factor predisponente é sinusite, pode facilitar a drenagem do seio infectado e promover a resolução do quadro. O uso de corticosteróides é controverso.
Salienta-se que a celulite pós-septal implica uma abordagem multidisciplinar, incluindo obrigatoriamente otorrinolaringologista, oftalmologista e neurocirurgião.
As situações que requerem intervenção cirúrgica urgente incluem: diminuição da acuidade visual, oftalmoplegia, sinusite frontal (Pott tuffy tumor, osteíte frontal), abcesso subperióstico de grandes dimensões (>10 mm) ou não-medial, abcesso orbitário, complicações intracranianas e ausência de melhoria ou agravamento clínico após 24-48h de antibioticoterapia adequada.
A abordagem cirúrgica do abcesso subperióstico é controversa. Alguns estudos defendem iniciar antibioticoterapia em crianças pequenas (< 9 anos), seguida de cirurgia na ausência de melhoria ou agravamento, o que requer uma monitorização rigorosa; alguns autores elegem o volume como melhor critério para escolha de abordagem, considerando que um abcesso que corresponda a > 1,25 cm3 deve ser submetido a intervenção cirúrgica.
O tratamento com anticoagulante na trombose do seio cavernoso, para além da terapêutica antibiótica e doutras medidas de suporte vital, é controverso. Alguns autores defendem os seus benefícios quando iniciado precocemente em doentes sem evidência de hemorragia.
Prognóstico
O prognóstico de celulite pré-septal é favorável após instituição de terapêutica adequada.
Raramente há progressão para celulite pós-septal ou complicações. Contrariamente, a celulite pós-septal é uma situação que comporta elevado risco: pode levar a perda visual definitiva, a complicações intracranianas e, até, à morte.
Na maioria dos casos em que a abordagem terapêutica médica e/ou cirúrgica é concretizada de forma urgente e eficaz (conforme é recomendado), não se verificam sequelas.
BIBLIOGRAFIA
Baring DEC, Hilmi OJ. An evidence-based review of orbital cellulitis. Clin Otolaryngol 2011;36:57-64
Briceno C, Douglas RS. Orbital and periorbital infections. Arch Ophtalmol 2012;130:233-234
Brook I. Microbiology and antimicrobial treatment of orbital and intracranial complications of sinusitis in children and their management. International J Pediatr Otorhinolaryngol 2009;73:1183-1186
Cantor LB, Rapuano CJ, Gioffi GA (eds). Fundamentals and Principles of Ophtalmology. San Francisco, CA: American Academy of Ophtalmology, 2016
Gappy C, Archer SM, Barza M. Orbital cellulitis. In: UpToDate, Basow, DS (ed), UpToDate, Waltham, MA, 2016
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Hauser A, Fogarasi S. Periorbital and orbital cellulitis. Pediatr Rev 2010;31:242-250
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Mandell GM, Bennett JE, Dolin R (eds). Mandell, Douglas and Bennette’s Principles and Practice of Infectious Disease. Philadelphia: Churchill Livingstone, 2010
Meara DJ. Sinonasal disease and orbital cellulitis in children. Oral Maxillofacial Surg Clin North Am 2012;24:487-496
Watts P. Preseptal and orbital cellulitis in children. Paediatrics and Child Health 2016;26:1-8
Wylie FP, Kaplan SL, Mason EO, Allen CH. Needle aspiration for the etiologic diagnosis of children with cellulitis in the era of community – acquired methicillin-resistant Staphylococcus aureus. Clin Pediatr (Phila) 2011;50:503-507