Definição e importância do problema
A febre Q é uma doença infecciosa aguda e geralmente autolimitada (embora se possa manifestar sob a forma crónica) tendo Coxiella burnetti como agente etiológico responsável, um cocobacilo Gram-negativo intracelular obrigatório.
A doença foi diagnosticada em 1935 pela primeira vez em Queensland, na Austrália, após um surto de febre de causa desconhecida (“Q” de query) num matadouro. Tendo-se demonstrado que o referido agente é geneticamente distinto dos géneros Rickettsia, Ehrlichia e Anaplasma, actualmente o mesmo já não é englobado na ordem das riquetsioses, mas sim na ordem Legionellales, pertencendo à família Coxiellaceae.
Microrganismo altamente infeccioso em animais e na espécie humana, constitui, por isso, uma arma potencialmente utilizável no bioterrorismo.
As formas crónicas comportam grau mais elevado de morbilidade, designadamente pelo facto de o processo inflamatório poder originar lesões valvulares cardíacas, lesões vasculares persistentes ou osteomielite.
Aspectos epidemiológicos
A febre Q, distribuída por todo o mundo, é uma zoonose, sendo o gado bovino, ovino e caprino os principais reservatórios da doença. Todavia, animais domésticos tais como gatos, cães e pássaros, podem transmitir a doença, que é mais frequente em meio rural; importa acentuar que a carraça poderá (raramente) ser um vector de transmissão inter-reservatórios.
Mais de 60% das infecções são assintomáticas, podendo um pequeno contingente (~5%) requerer hospitalização.
Como o microrganismo C. burnetti é muito resistente ao calor e a produtos químicos, pode sobreviver nos locais infectados durante meses. Por outro lado, este facto permite que microrganismos viáveis sejam levados pelo vento para locais distantes, o que pode dificultar a identificação da origem da infecção.
De realçar que a criança pode ser infectada através do leite materno.
Em inquéritos de seroprevalência em certas regiões da Europa foram comprovados antecedentes de infecção em percentagem muito variável conforme as regiões (6%-70%). Tratando-se duma doença de declaração obrigatória/DDO, em Portugal foram declarados 71 casos entre 2010-2013, mas apenas 2 abaixo dos 15 anos. Estabelecendo comparação com dados epidemiológicos doutro país europeu (França), em que se apurou incidência de 50 casos por 100.000 habitantes, é possível que em Portugal se verifique subnotificação.
Na Holanda, entre 2007 e 2010 verificou-se um surto de febre Q, com identificação de 4026 casos em humanos. De acordo com dados do CDC, nos EUA, em 2010 foram notificados 129 casos, em oposição a 17 casos apenas no ano de 2000; este aumento associa-se provavelmente a um maior número de notificações desde o 11 de Setembro de 2001.
Etiopatogénese
Ao contrário das infecções por Rickettsia, o ser humano adquire infecção por C. burnetti predominantemente através da inalação de partículas infectadas sob a forma de aerossóis, por exposição directa a produtos de animais (secreções genitais no parto, tosquias, matadouros), ou por ingestão de produtos lácteos não pasteurizados.
Após a inoculação das partículas infectantes portadoras de C. burnetti ocorre pneumonite intersticial linfocitária com alta concentração de macrófagos infectados no exsudado alveolar. O microrganismo pode permanecer latente nos macrófagos de tecidos durante anos, o que poderá conduzir a lesões permanentes (valvulopatias, vasculopatia, osteomielite). Também podem ser encontrados granulomas hepáticos na medula óssea, bem como noutros órgãos.
Manifestações clínicas
Forma aguda
Após um período de incubação entre 9 a 39 dias, surge febre durante 7-10 dias com calafrio, associada a cefaleias intensas, mialgias, vómitos e dor abdominal, entre outros sintomas sistémicos inespecíficos.
A perda de peso e a fraqueza muscular podem ser acentuadas. Na criança, pode verificar-se exantema em 50% dos casos, ao contrário do que acontece no adulto; os suores nocturnos, frequentes nos adultos, são raros na idade pediátrica. No adulto, a febre pode durar 2-3 semanas.
Na criança, a doença é habitualmente autolimitada, com resolução espontânea entre uma a três semanas. Em mais de metade dos casos a infecção em causa pode ser assintomática.
A hepatoesplenomegália pode estar presente nalguns doentes, coincidindo com quadro de hepatite na maioria dos casos. É frequente o compromisso do sistema respiratório com tosse não produtiva e dor torácica. Outras manifestações – que podem ser consideradas complicações raras, incluindo miocardite, pericardite, SHU, rabdomiólise, hemofagocitose, meningoencefalite – podem surgir alguns meses após infecção inicial.
Forma crónica
Em cerca de 1% dos casos poderá verificar-se evolução para a cronicidade, em geral relacionável com doença cardíaca ou vascular prévias. A endocardite pode manifestar-se meses a anos após o episódio agudo da doença. A osteomielite crónica também constitui uma manifestação de doença crónica.
Diagnóstico
Trata-se duma doença de difícil diagnóstico se não houver uma forte suspeita clínica e epidemiológica. Haverá que admitir tal hipótese nos seguintes casos:
- em toda a criança com febre de origem desconhecida que viva em meio rural ou que contacte com animais e/ou seus produtos; e igualmente,
- no contexto de pneumonia atípica, endocardite evoluindo com culturas negativas, osteomielite recorrente.
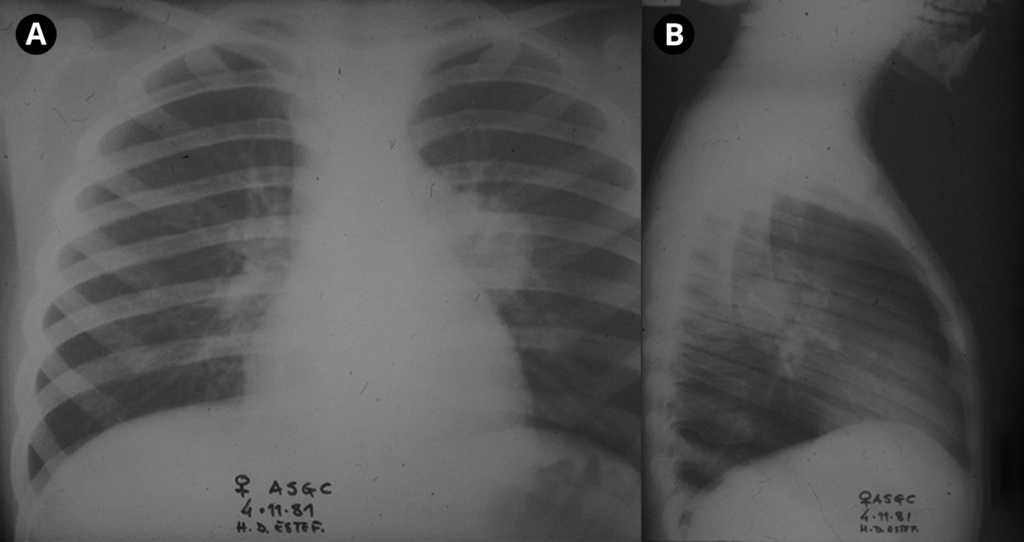
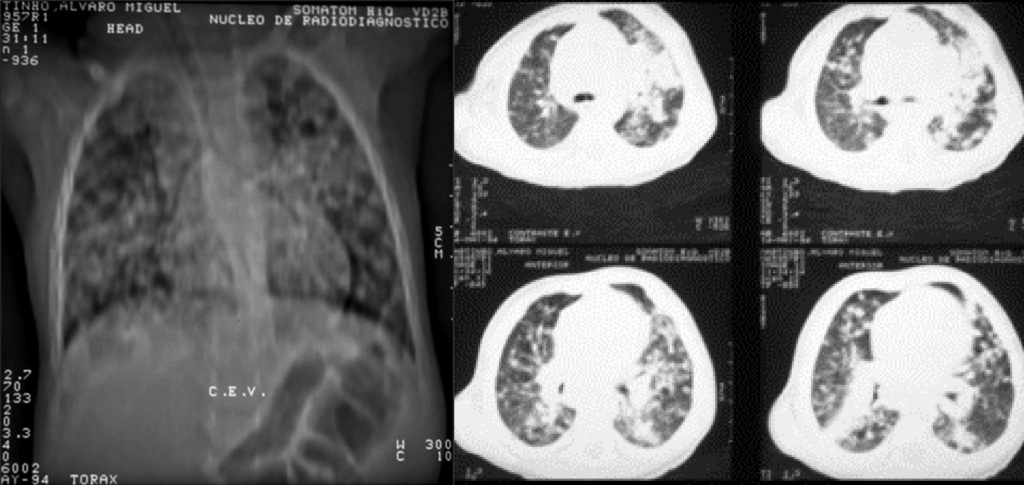
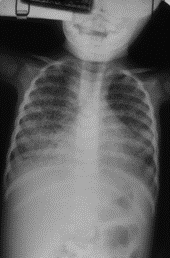
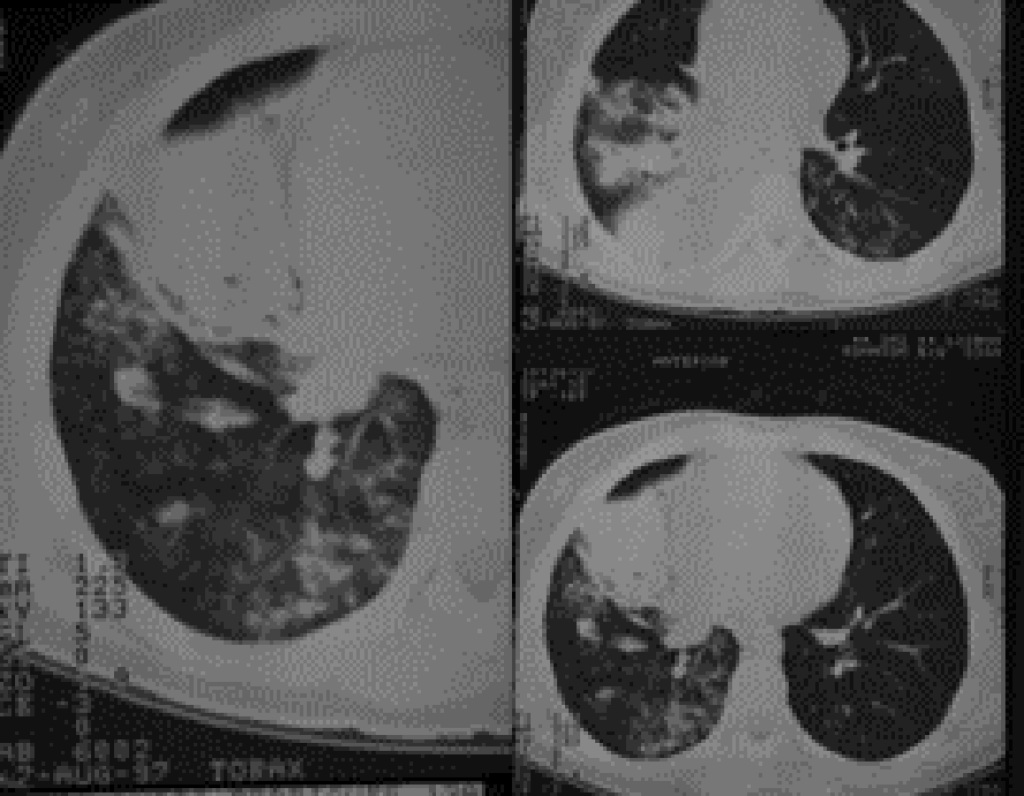
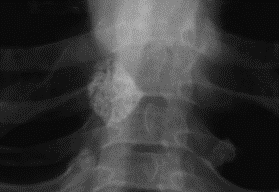
Relativamente aos sinais radiológicos torácicos encontrados, o padrão é semelhante ao verificado nos casos de pneumonia por vírus, Mycoplasma pneumoniae ou por Chlamydophila pneumoniae; de referir que também poderão ser encontradas opacidades arredondadas em doentes clinicamente assintomáticos.
A serologia continua a ser o procedimento diagnóstico mais utilizado, sendo a imunofluorescência indirecta o método mais sensível.
Para confirmar a infecção aguda prévia, deve demonstrar-se um aumento de 4x ou > do título de anticorpos entre a fase aguda e a convalescença, ou título de anticorpos de IgM > 1:50. Título de anticorpos de IgG = ou > 1:128 deve considerar-se como sinal de infecção provável; e de IgG > 1:200 são sugestivos de infecção.
Para o diagnóstico na fase crónica, num paciente com quadro clínico compatível, será suficiente um título de anticorpos IgG = ou > 1:800. Títulos de IgG < 1:200 e de IgM negativos poderão indicar cura.
O microrganismo pode também ser identificado em cultura de tecidos, ou através de estudo molecular/PCR com amostras de sangue ou de tecidos (neste último caso, – designadamente em válvulas cardíacas – evidenciando maior sensibilidade).
Considerando outros exames laboratoriais, cumpre salientar que se pode verificar hipergamaglobulinémia, hiperfibrinogenémia e elevação da proteína C reactiva. Em mais de metade dos doentes há evidência laboratorial de processo autoimune, explicável designadamente pela positividade de: factor reumatóide, anticorpos antiplaquetas, antimúsculo liso, antimitocôndrias e prova de Coombs directa.
Diagnóstico diferencial
O diagnóstico diferencial da febre Q com outras doenças depende da forma de apresentação clínica. Como foi referido anteriormente, o quadro respiratório pode ser confundido com infecções por Mycoplasma pneumoniae, Chlamydophila pneumoniae, mas também infecção por VEB ou Legionella.
No caso de hepatite granulomatosa, tuberculose ou outras infecções por micobactérias, salmonelose, leishmaniose visceral, toxoplasmose, brucelose, doença do arranhão do gato, doença de Hodgkin ou sarcoidose devem ser situações a equacionar.
A presença de endocardite deve levar a admitir hipóteses de infecção por Brucella, Bartonella ou ainda por bactérias do grupo HACEK (Haemophilus, Agregatibacter, Cardiobacterium hominis, Eikenella corrodens, Kingella).
Tratamento
Na forma aguda da doença, a doxiciclina (4 mg/kg/dia até máximo de 200 mg/dia) é o fármaco de primeira escolha acima dos oito anos; esta terapêutica deve ser mantida durante 14 a 21 dias e até se verificar apirexia durante pelo menos 3 dias. Como alternativas poderão ser usados os antimicrobianos azitromicina, sulfametoxazol+trimetoprim/cotrimoxazol, cloranfenicol ou fluoroquinolonas (estas últimas somente acima dos 17 anos de idade). A doxiciclina e as fluoroquinolonas não têm formulação pediátrica em Portugal.
Nos casos de febre Q crónica (endocardite e hepatite) deverá associar-se à doxiciclina: a rifampicina, cotrimoxazol ou fluoroquinolonas. A associação entre rifampicina e hidroxicloroquina, de 18 a 36 meses de duração, é a forma adoptada actualmente, sobretudo em adultos.
Nas formas consideradas refractárias, tem sido utilizado o interferão-gama.
Nota importante: na hipótese de diagnóstico feito retrospectivamente, mesmo que a criança esteja assintomática, o esquema de tratamento é igual, tendo como objectivo erradicar a infecção e evitar a cronicidade.
Prognóstico
A mortalidade da febre Q aguda não complicada é inferior a 1%.
Em caso de endocardite, a doença pode ser fatal em 30%-60% dos doentes.
Prevenção
A prevenção compreende essencialmente medidas de higiene de âmbito veterinário e protecção das pessoas que contactam com animais contaminados e seus produtos (matadouros, laboratórios, etc.).
Existe actualmente uma vacina que confere protecção, pelo menos, durante 5 anos, indicada para as pessoas em risco, designadamente para os trabalhadores em matadouros.
BIBLIOGRAFIA
Bergelson JM, Shah SS, Zaoutis TE. Pediatric Infectious Diseases. The Requisites in Pediatrics. Philadelphia: Mosby Elsevier, 2008
Cherry J, Demmler-Harrison GJ, Kaplan SL, Steinbach WJ, Hotez P (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
Direcção Geral da Saúde (DGS). Doenças de Declaração Obrigatória (2010-2013). Lisboa: DGS, 2015
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Kimberlain D, Brady M, Jackson M, Long S (eds). Red Book. Elk Grove Village, IL: American Academy of Pediatrics, 2015
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
McIntosh N, Helms P, Smyth R, Logan S (eds). Forfar and Arneil’s Textbook of Pediatrics. London: Churchill Livingstone, 2008
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Parker NR, Barralet JH, Bell AM. Q fever. Lancet 2006;367:679-688
Raoult D, Marrie TJ, Mege JL. Natural history and pathophysiology of Q fever. Lancet Infect Dis 2005;5:219-226