Aspetos epidemiológicos e importância do problema
A tuberculose (TB) resulta da infecção por Mycobacterium tuberculosis (Mtb) ou bacilo de Koch (BK), uma micobactéria descoberta por Robert Koch em 1882. Mais de um século depois, a TB continua a ser uma das doenças infecciosas com maior morbimortalidade. Segundo estimativas da OMS, cerca de um terço da população mundial está infectada com Mtb. Desde o ano 2000 que globalmente a taxa de incidência de TB diminuiu, apenas cerca de 1,4% ao ano, mantendo-se como uma das 10 principais causas de morte a nível global.
A importância da TB como doença pode ser avaliada em termos de incidência – número de casos novos e de recidivas durante determinado período de tempo, geralmente um ano; prevalência – número de casos de TB em determinado ponto no tempo; e mortalidade – número de mortes por TB num determinado período de tempo, geralmente um ano. A taxa de letalidade é a relação entre o número de mortes por TB e o número total dos respectivos casos numa dada população.
Em 2015, segundo a OMS, ocorreram cerca de 10,4 (8,7-12,2) milhões de novos casos, o equivalente a 142 novos casos por 100.000 habitantes. Um milhão dos novos casos ocorreu em crianças. O maior número de casos registou-se na Ásia (61%) e em África (26%), enquanto a Europa representou apenas 3% do total de casos. Cerca de 11% (9%-14%) dos novos casos ocorreram em pessoas infectadas com VIH, sendo as taxas de coinfeção mais elevadas (até 50% em algumas regiões) registadas em África. O número de novos casos de tuberculose multirresistente (TBMR), resistente em simultâneo à isoniazida e rifampicina, foi de 480.000, e o de resistentes apenas à rifampicina, de cerca de 100.000. Apesar da diminuição de cerca de 22% do número de mortes entre 2000 e 2015, as estimativas apontam, ainda, para 1,4 milhões de óbitos em indivíduos seronegativos para VIH e de 0,4 milhões em indivíduos coinfetados com VIH.
Em Portugal, as taxas de incidência têm diminuído progressivamente fixando-se, pela primeira vez, abaixo de 20 novos casos por 100.000 habitantes (18,6/100.000), em 2015; neste último ano foram notificados 2.089 casos, número que engloba 1.925 casos novos.
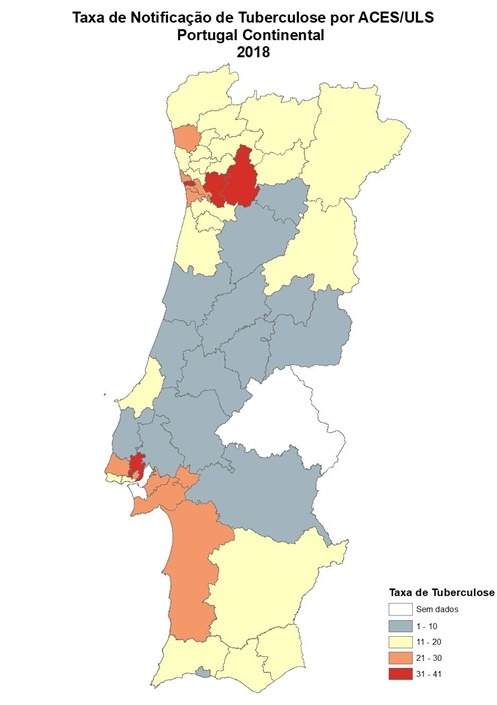
Em 2018, a taxa de notificação foi de 16,6 casos por 100 mil habitantes[i]. Os distritos de Porto e Lisboa são os distritos com mais alta taxa de notificação e os únicos do País que se mantêm acima dos 20 casos por 100 mil habitantes, 25,3 e 23,7 casos por 100 mil habitantes, respetivamente.
Também, em 2018 a idade mediana dos doentes foi de 49 anos. Foram notificados 34 casos de tuberculose em crianças com menos de 6 anos de idade, correspondendo a uma taxa de incidência neste grupo etário de 6,59 casos/100 mil crianças dos 0 aos 5 anos. Foram identificados 4 casos de formas graves de tuberculose, todas em crianças sem BCG e 3 com critérios individuais para vacinação.
Em 2005 tinham sido notificados 3.543 casos. No entanto, a distribuição de casos notificados é bastante assimétrica, sendo os distritos mais afectados os de Lisboa (627), Porto (551), Braga (157), Setúbal (135) e Aveiro (108). O pico de incidência ocorreu no grupo etário dos 45-54 anos (418/2.089; 19,4%) sendo que apenas 22 casos (1%) foram notificados em crianças e adolescentes com menos de 15 anos. O número total de casos de tuberculose multirresistente (TB-MR) tem vindo a diminuir, tendo sido notificados 18 casos em 2015, em comparação com 40 casos em 2000. Os quatro casos de tuberculose extensivamente resistente (TB-XDR) foram todos notificados na região de Lisboa e Vale do Tejo. O “pico” de casos de TB-XDR verificou-se em 2004, com 13 notificações.
A Figura 1 mostra as taxas de notificação de Tuberculose em Portugal, por distrito, em 2018. Como se pode verificar, os distritos de Porto e Lisboa são aqueles com mais alta taxa de notificação e os únicos do País que se mantêm com valores acima dos 20 casos por 100 mil habitantes (25,3 e 23,7 casos por 100 mil habitantes, respectivamente).
De entre as comorbilidades que configuram risco para tuberculose, devemos realçar a infecção por vírus de imunodeficiência humana (VIH). É reconhecida a necessidade de rastreio de todos os doentes com tuberculose para a infecção por VIH, dado o impacte desta comorbilidade no resultado de tratamento da tuberculose. O rastreio de infecção por VIH, foi efectuado em 87,9% dos doentes com tuberculose. Verificou-se que 8,8% dos doentes com tuberculose eram também VIH positivo.
Na população geral, importa referir outros factores de risco com doenças crónicas, nomeadamente diabetes (5,81%), doença neoplásica (6%), doença pulmonar obstrutiva crónica (4,23%).
Fonte: Direcção Geral da Saúde, 2020
FIGURA 1. Taxas de notificação de tuberculose em Portugal, ano 2018.
| Os distritos de Porto e Lisboa são os distritos com mais alta taxa de notificação e os únicos do País que se mantêm acima dos 20 casos por 100 mil habitantes (25,3 e 23,7 casos por 100 mil habitantes, respetivamente. |
Etiopatogénese
As cinco micobactérias que integram o complexo M. tuberculosis são: M. tuberculosis hominis, M. bovis, M. africanum, M. microti e M. canetti. Os agentes patogénicos mais importantes para o Homem são M. tuberculosis e M. tuberculosis bovis. M. tuberculosis é um bacilo não móvel, não formador de esporos, aeróbio, cuja parede celular apresenta um elevado conteúdo de lípidos de alto peso molecular. Cora mal com o método de Gram e, quando corado com o método de Zhiel-Nielsen, resiste à descoloração com álcool e ácido; daí a designação de bacilo ácido-álcool resistente. As micobactérias crescem lentamente (três a seis semanas) em meio de cultura sólido específico, meio de Lowenstein. Os métodos radiométricos culturais (Bactec®, meio líquido) permitem diagnósticos mais precoces, em cerca de sete a 14 dias. Após o crescimento bacteriano em meio sólido ou líquido, a identificação da espécie pode efetuar-se através de provas de hibridização dos ácidos nucleicos. A infecção humana com M. bovis é rara nos países tecnicamente avançados, em que se procede à pasteurização do leite. Embora a transmissão se possa fazer, como no M. tuberculosis hominis por via inalatória, em regra, M. bovis é veiculado por produtos lácteos (via digestiva), podendo invadir os linfáticos da orofaringe ou penetrar na mucosa intestinal.
Tuberculose em idade pediátrica define-se genericamente como o processo mórbido infeccioso originado por micobactérias pertencentes ao complexo Mycobacterium tuberculosis (ver atrás) ocorrendo em indivíduos com menos de 18 anos de idade. A TB pediátrica é um “acontecimento-sentinela” que indicia o contacto da criança com um adulto ou adolescente que elimina e propaga bacilos: a transmissão do bacilo a partir de paciente bacilífero é eficaz se houver convivência estreita e mantida mais de 4 horas/dia no mesmo habitáculo fechado.
A designação de TB primária (ou primoinfecção tuberculosa) refere-se ao conjunto de manifestações biológicas e clínicas, que podem ou não ser demonstradas por imagem radiográfica, aquando da infecção por Mtb num indivíduo até então indemne da infecção.
Reiterando o que foi atrás referido, na maioria dos casos (> 95%) a contaminação faz-se por via respiratória. Com efeito, a transmissão da TB é inter-humana, por inalação de pequenas partículas aerossolizadas, de diâmetro inferior a 5 μm, provenientes de um indivíduo doente.
As partículas contendo Mtb atingem sobretudo alvéolos das áreas mais ventiladas dos pulmões (vértices pulmonares no adulto, porções basais na criança), desencadeando um processo inflamatório parenquimatoso que culmina na formação de granuloma classicamente chamado foco de Ghon. Os bacilos são rapidamente fagocitados pelos macrófagos alveolares continuando, no entanto, a multiplicar-se no interior dos mesmos.
Cerca de 4-8 semanas após a inalação de Mtb, os linfócitos T sensibilizados começam a libertar linfocinas, as quais activam os macrófagos e incrementam a destruição intracelular dos microrganismos inalados.
A resposta inflamatória resulta no recrutamento para o local da infecção de outras células mononucleares como monócitos, macrófagos e linfócitos. Os macrófagos diferenciam-se em macrófagos espumosos, macrófagos epitelióides e células gigantes multinucleadas delimitando o núcleo do granuloma, constituído por macrófagos infectados. Nesta fase, após indução da imunidade adaptativa, o granuloma está rodeado à periferia por uma camada constituída sobretudo por linfócitos T e B. Outras células como neutrófilos, células dendríticas, células natural killer e fibroblastos estão, também, presentes no granuloma.
Este equilíbrio entre a infecção e a resposta do hospedeiro pode persistir indefinidamente, ficando os bacilos confinados apenas ao centro do granuloma, não se desenvolvendo doença (infecção latente).
No entanto, se a infecção progredir, a destruição das células do granuloma origina a necrose caseosa que pode resultar na cavitação do referido granuloma com consequente libertação de bacilos na via aérea.
Macrófagos infectados do granuloma primário podem originar granulomas secundários, no pulmão ou outros órgãos, contribuindo para a disseminação da infecção. Os gânglios linfáticos regionais são atingidos por macrófagos infectados através dos vasos linfáticos, originando uma reação inflamatória local.
O conjunto do granuloma primário e dos gânglios hilares e paratraqueais aumentados de volume é designado por complexo primário tuberculoso. Na infecção primária pode verificar-se compressão brônquica por gânglio, erosão brônquica e disseminação da infeção por via endobrônquica (~ 3-9 meses depois), extensão parenquimatosa para áreas adjacentes do pulmão como a pleura (com derrame pleural; ~ 3-7 meses), disseminação linfática ou hematogénica (~ 1-3 meses a dois anos) com disseminação pulmonar (miliar) ou compromisso de outros órgãos, incluindo meninges, rins, medula óssea, cérebro e tracto gastrintestinal. As manifestações de doença óssea surgem, em regra, mais de um a três anos após a infecção primária e as de doença renal mais de cinco a sete anos depois. De salientar que poderá haver disseminação hematogénica multiorgânica.
Cerca de 8 a 12 semanas após a infecção primária pode detectar-se uma resposta de hipersensibilidade retardada às proteínas de Mtb demonstrável classicamente pela prova tuberculínica ou intradermorreacção de Mantoux evidenciando alergia/prova de Mantoux alérgica (ver adiante). Se anteriormente estava documentada anergia através desta prova, diz-se que ocorreu viragem tuberculínica.
Após a infecção primária, os focos de infecção contendo pequeno número de bacilos e em fase de não replicação (latentes) podem sofrer fibrose. No entanto, pode ocorrer reactivação destes focos, nomeadamente, em situações de: imunossupressão, mesmo que transitória, infecção por VIH, diabetes, insuficiência renal terminal, desnutrição, crianças com menos de cinco anos (especialmente lactentes) e infecção intercorrente (por ex. sarampo). O risco de desenvolvimento de doença após a infecção primária vai decrescendo com a idade, sendo maior nos primeiros dois anos.
Sob o ponto de vista da cronologia de eventos, sintetiza-se a evolução natural da infecção:
- Exposição – a criança teve contacto com um adulto ou adolescente com TB pulmonar bacilífera; a prova tuberculínica é negativa (mais propriamente, anérgica), a radiografia de tórax é normal e a criança não apresenta sinais ou sintomas de doença;
- Tuberculose infecção ou tuberculose latente – na grande maioria dos casos os bacilos mantêm-se em fase latente, não replicativa, sendo o risco de evolução determinado por circunstâncias do meio e do hospedeiro; nesta fase a prova tuberculínica/intradermorreacção de Mantoux(*) evidencia alergia ou é alérgica, ou as provas imunológicas IGRA (Interferon-Gamma Release Assay) são positivas, mas não se observam sinais ou sintomas de doença; (ver adiante)
- Tuberculose doença – as manifestações clínicas ou radiológicas causadas pela infecção por Mtb tornam-se evidentes, o que constitui um “fracasso” imunológico após infecção primária;
- Tuberculose latente não tratada – poderá evoluir para à tuberculose doença em ~ 43% das crianças de idade inferior a um ano, em ~ 24% das crianças entre um e cinco anos, e em ~ 5% a 15% dos adolescentes com idade superior a 15 anos.
(*) Nota: a prova tuberculínica ou intradermorreacção de Mantoux realiza-se do seguinte modo: injecção intradérmica de 0,1 mL de tuberculina PPD (Purified Protein Derivate) no 1/3 médio da região ântero-lateral do antebraço esquerdo, paralelamente ao eixo, com bisel da agulha (25-26G) para cima, até se obter pápula de 5-8 mm, e pele em “casca de laranja”. Verificação do tipo de reacção após 48-72 horas com medição da induração (não do eritema). Se não se verificar qualquer reacção, diz-que a prova foi anérgica. (ver Quadros 3 e 8) |
Factores de risco
Por cada criança com TB há, pelo menos, um adulto a eliminar e propagar bacilos e, por cada adulto nestas condições, poderá haver uma ou mais crianças infectadas. Este é o conceito do binómio adulto-criança. Assim, o factor mais importante de infecção por Mtb na criança é o contacto com um adulto ou adolescente com infecção tuberculosa. A progressão para doença activa após um contacto depende da interacção entre factores do meio e do hospedeiro (Quadros 1 e 2).
QUADRO 1 – Factores do meio: características da fonte infectante e magnitude do inóculo.
|
QUADRO 2 – Factores do hospedeiro: maior probabilidade de infecção e de progressão para doença activa.
|
Manifestações clínicas
Na maioria dos casos de TB, as manifestações consideradas clássicas como febre prolongada, pneumonia de evolução arrastada, anorexia, perda de peso, tosse persistente, hemoptise, etc. relacionam-se com doença de evolução avançada; nas crianças mais jovens existe maior probabilidade de sintomas vagos e inespecíficos, tais como tosse, febre, perda ou não progressão ponderal, mal-estar, adinamia, vómitos, diarreia e, raramente, hipersudorese noturna.
Em 27 doentes com TB internados na Unidade de Infecciologia do Hospital de Dona Estefânia, Lisboa, no período de dois anos (2004-2005) o diagnóstico de TB foi admitido como primeira hipótese em 15, tendo em conta o conhecimento da epidemiologia intrafamiliar. Dos restantes, os motivos de internamento foram diversos, tais como: febre, vómitos, diarreia, astenia, mau estado geral, alterações do estado de consciência, dificuldade respiratória e pneumonia. De salientar que sintomas vagos e persistentes em contexto epidemiológico sugerindo tuberculose, obrigarão à realização de exames complementares no sentido de excluir ou confirmar o diagnóstico.
Duas situações particulares, relacionáveis com fenómeno de hipersensibilidade mediada por células, poderão indiciar TB primária: o eritema nodoso e a ceratoconjuntivite flictenular.
O primeiro traduz-se pelo aparecimento de nódulos e placas de 1-5 cm de diâmetro, dispostos tipicamente e de modo grosseiramente simétrico sobretudo ao nível das regiões pré-tibiais, mas podendo surgir em outras localizações. (ver capítulo na Parte sobre vasculites)
A conjuntivite flictenular caracteriza-se por grupos de pequenos nódulos amarelo-acinzentados no limbo, na córnea ou na conjuntiva bulbar, persistindo por vários dias e, por vezes, com carácter recorrente. Podem causar lacrimejo intenso, fotofobia, dor e sensação de corpo estranho.
Neste capítulo são abordadas duas grandes formas clínicas de TB:
- TB torácica, subdividida, arbitrariamente, em pulmonar e extrapulmonar;
- TB extratorácica, ocorrendo em menos de 5% dos casos pediátricos, sendo que todos os órgãos podem ser atingidos.
1. Tuberculose torácica
Forma adenopática traqueobrônquica
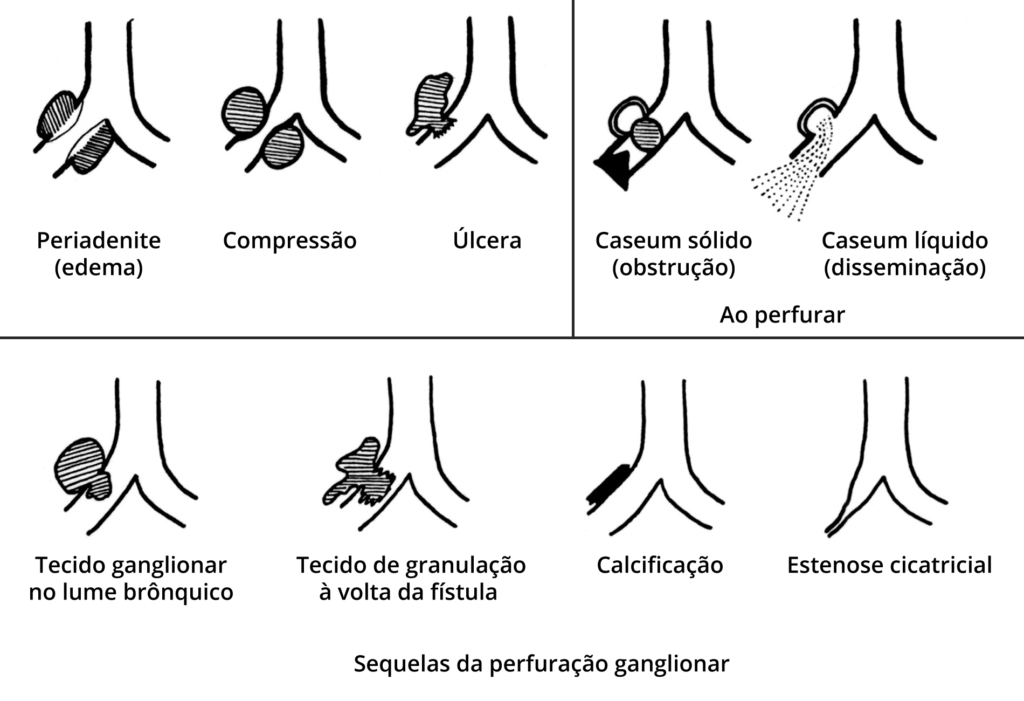
Na idade pediátrica é a forma mais frequente, traduzida por compromisso ganglionar evidenciado em radiografia do tórax e/ou TC. O aumento de volume dos gânglios ao nível da bifurcação brônquica e mediastino poderá levar a compressão brônquica, com atelectasia ou enfisema se se verificar compressão associada a mecanismo valvular com retenção progressiva de ar. Outras possibilidades de evolução natural do componente ganglionar do complexo primário são esquematizadas em desenho na Figura 2. (Segundo Thomé Villar e Ducla Soares)
A Figura 3 mostra aspecto radiográfico da forma adenopática traqueobrônquica (radiografia do tórax PA e perfil): opacidade arredondada de limites bem definidos, confluente com o hilo pulmonar.
Notas importantes:
|
FIGURA 2. Esquema das possibilidades de evolução natural do componente ganglionar do complexo primário (consultar texto).
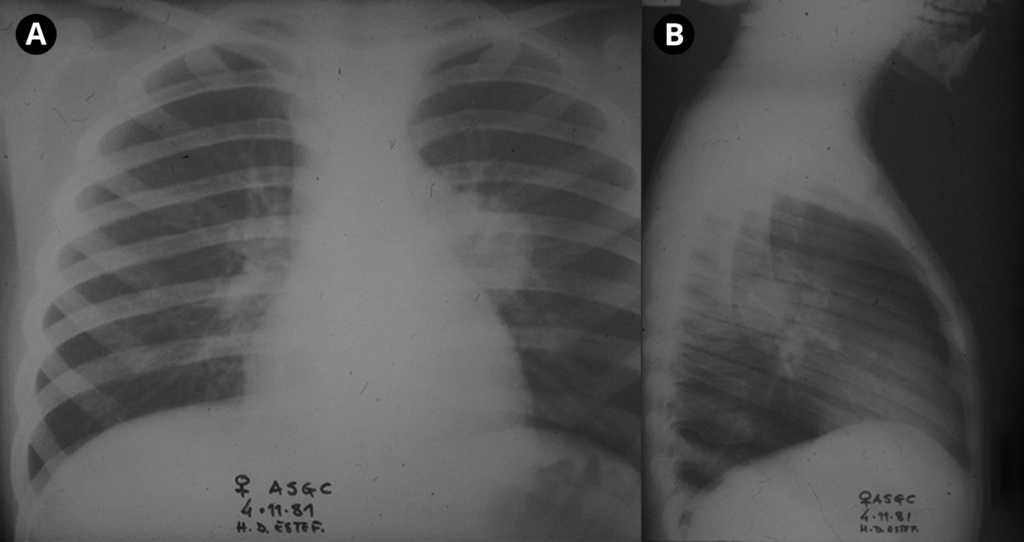
FIGURA 3. Imagem radiográfica de adenopatia traqueobrônquica esquerda: A – Póstero-anterior; B – Perfil. (NIHDE)
Foco primário
Esta forma corresponde às manifestações resultantes da progressão do foco parenquimatoso pulmonar. Clinicamente é traduzida por quadro de bronquite e, radiologicamente, por foco de condensação (opacidade arredondada). As suas dimensões não ultrapassam em geral dois centímetros; poderá ser visualizado na radiografia do tórax concomitantemente com a adenopatia.
Disseminação brônquica
O quadro clínico de disseminação brônquica, quer a partir do gânglio, quer a partir do foco primário, é o de broncopneumonia caseosa de evolução subaguda ou crónica (formação de caseum, Figura 2). Tal situação poderá obrigar ao diagnóstico diferencial com quadro broncopneumónico relacionável com agentes infeciosos que não Mtb; a história clínica e os achados epidemiológicos associados ao resultado da prova tuberculínica ou testes IGRA contribuem para a destrinça. (Figura 4)
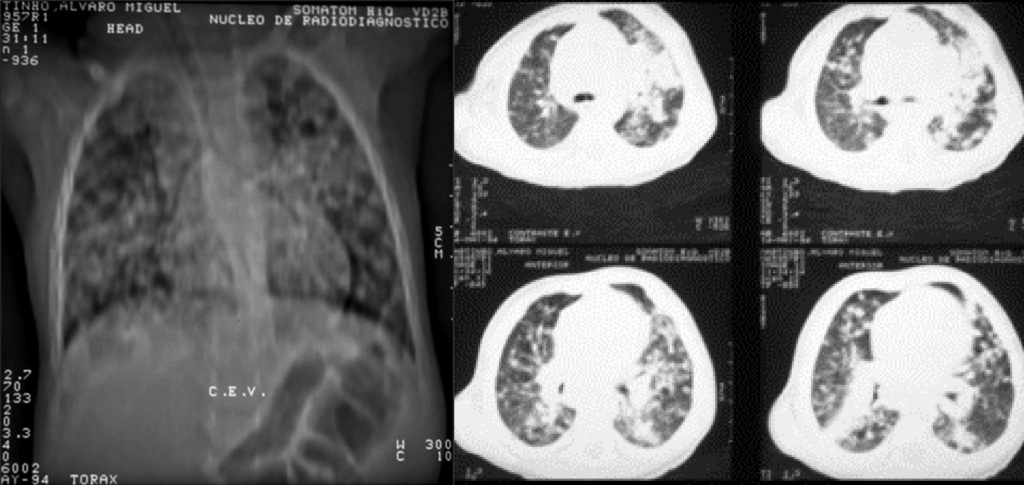
FIGURA 4. Disseminação broncogénica de caseum: imagens radiográficas nodulares dispersas, associadas a adenopatia hilar. (NIHDE) (ver Figura 2)
Tuberculose miliar
Trata-se duma forma grave de disseminação linfo-hematogénica a qual pode atingir qualquer órgão. Em geral, surge em crianças debilitadas e/ou desnutridas e manifesta-se por febre, mau estado geral, perda de peso, suores nocturnos, hepatosplenomegália, podendo associar-se a meningite. Existe um quadro de pneumonite bilateral que se traduz radiologicamente por infiltrados miliares/micronódulos de 1-2 mm, confluentes, dispersos em ambos os campos pulmonares (daí o nome de granúlia) e arredondados como grãos de milho (daí o nome de miliar). É notória a dificuldade respiratória que, nos pequenos lactentes pode partilhar sinais com a bronquiolite. Face ao estado de debilitação da criança, a prova tuberculínica poderá ser anérgica. (Figura 5)
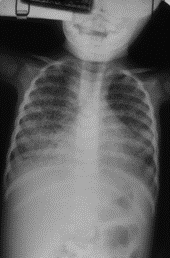
FIGURA 5. Padrão radiográfico de tuberculose miliar. (NIHDE)
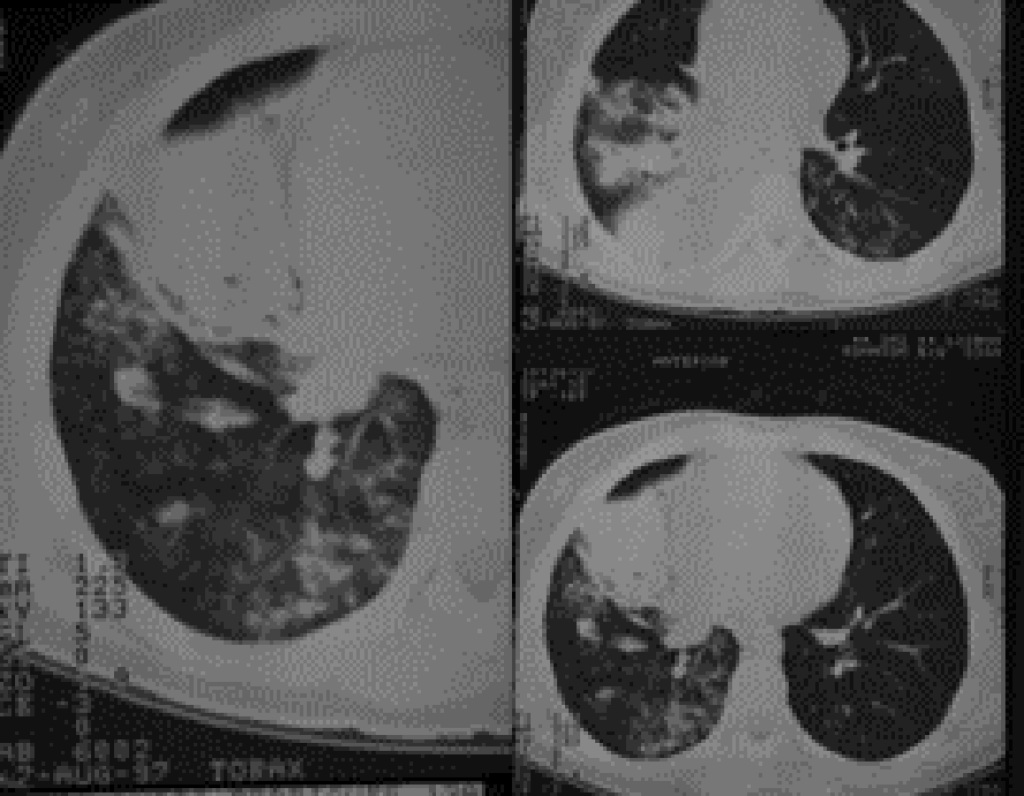
FIGURA 6. TAC torácica: lesões cavitárias de tuberculose. (NIHDE)
Tuberculose pulmonar reactivada
Esta forma, típica dos adolescentes e adultos, é muitas vezes designada por “tuberculose pulmonar tipo adulto”; corresponde à chamada tuberculose pós-primária, epifenómeno de reactivação endógena ou reinfecção exógena. Na forma de doença avançada surgem lesões cavitárias localizadas predominantemente nos segmentos apicais dos lobos superiores, correspondendo a zonas com maior pressão de oxigénio (Figura 6). A partir de tais lesões cavitárias verifica-se disseminação endobrônquica de bacilos, o que contribui para propagação de Mtb junto dos contactos. Os sintomas e sinais gerais são os referidos anteriormente, sendo que a tosse e hemoptise poderão indiciar cavitação e erosão brônquica.
Derrame pleural tuberculoso
O derrame pleural tuberculoso, de tipo serofibrinoso, que pode acompanhar a infecção primária, representa uma resposta imune ao Mtb. A prova tuberculínica é geralmente exuberante, e a resposta ao tratamento é em geral rápida quando coadjuvada por corticóides. Mais frequente na idade escolar e na adolescência tem início agudo com febre, dor torácica ou abdominal, agravando-se com a respiração e a tosse. A análise do líquido pleural evidencia linfócitos e elevado teor em proteínas, não contendo bacilos. A imagem radiológica do derrame pleural é sobreponível à associada a outras etiologias. (Figura 1 do Capítulo sobre Derrame Pleural-Parte XIV)
Pericardite tuberculosa
Esta forma de pericardite surge quando Mtb atinge o pericárdio por via hematogénica ou por contiguidade a partir da pleura ou pulmão. Se o processo inflamatório persistir com esta localização, poderá resultar resposta celular imune com ruptura de granulomas para o espaço pericárdico conduzindo ao desenvolvimento de pericardite constritiva.
2. Tuberculose extratorácica
Linfadenite superficial
A linfadenite superficial extratorácica surge sobretudo nas regiões cervical, supraclavicular e submaxilar, embora outras cadeias ganglionares possam ser atingidas. Trata-se da forma mais comum de TB extratorácica na idade pediátrica. Historicamente é relacionada com a ingestão de leite de vaca não pasteurizado veiculando M. bovis, o que ocorria cerca de seis meses a anos depois. Ao nível das regiões, inguinal, axilar e epitroclear pode associar-se a TB da pele ou sistema esquelético. Na região supraclavicular pode associar-se a extensão de lesão primária de segmentos superiores do pulmão ou abdómen. A tumefacção ganglionar uni ou bilateral, pode atingir grandes dimensões e originar a compressão de estruturas adjacentes. É acompanhada de sinais inflamatórios locais e regionais, com coloração eritematosa e violácea da pele, aderente aos planos profundos e tendência para a fistulização. Como sequela forma-se uma cicatriz quelóide designada habitualmente por escrófula.
Meningite tuberculosa
A meningite tuberculosa corresponde a cerca de 0,3% das infecções tuberculosas não tratadas em idade pediátrica. Manifesta-se na maioria dos casos no período de seis a 24 meses após infecção primária e em crianças com menos de cinco anos. Cerca de 40% a 50% das crianças com meningite tuberculosa têm outros focos de infecção tuberculosa, incluindo TB miliar. O início pode ser insidioso com sintomas vagos e inespecíficos como febrícula, cefaleia e alterações do comportamento, irritabilidade ou sonolência. O diagnóstico precoce é fundamental tendo em vista a redução da morbilidade e mortalidade, exigindo-se do clínico um elevado índice de suspeição. Classicamente, são descritos três estádios evolutivos, ao longo de três a quatro semanas:
- Estádio I – febre, irritabilidade, sonolência;
- Estádio II – alterações do comportamento, por vezes sinais focais; podem surgir sinais meníngeos e ocorrer convulsões;
- Estádio III – delírio e coma; sinais meníngeos francos, sinais neurológicos focais. O processo inflamatório das meninges afecta sobretudo a base do encéfalo (meningite basilar), com repercussão significativa sobre os nervos cranianos, levando a hipertensão intracraniana, deterioração do estado mental e coma. A análise do líquido cefalorraquidiano revela aumento do número de leucócitos (50-500/mm3), sendo que na fase inicial poderão predominar, quer linfócitos, quer neutrófilos; hiperproteinorráquia e hipoglicorráquia. Embora o exame cultural seja o método de excelência para detecção de Mtb, os métodos de biologia molecular/reacção em cadeia da polimerase (PCR) específicos para Mtb são de grande utilidade para o diagnóstico.
Tuberculose osteoarticular
Esta forma clínica de início insidioso pode ocorrer após disseminação hematogénica ou por extensão directa a partir de gânglio regional caseoso. Inclui diversas entidades nosológicas: TB da coluna vertebral (mal de Pott), a forma mais frequente; artrite coxofemoral, com lesão destrutiva da cabeça do fémur e acetábulo; dactilite com compromisso dos dedos das mãos e pés. No mal de Pott os segmentos mais atingidos são, por ordem de frequência, o torácico inferior, o lombar e o cervical. Ocorre destruição da porção anterior do corpo vertebral, com compromisso contíguo de várias vértebras em diferentes fases de destruição e, com frequência, abcesso frio paravertebral extenso. Clinicamente, a criança encontra-se, regra geral, assintomática, com cifose acentuada.
Tuberculose abdominal
A etiopatogénese desta forma clínica relaciona-se, quer com a deglutição de material pulmonar infectado com bacilo humano (forma secundária), quer com a deglutição de produtos alimentares contaminados pelo bacilo bovino (forma primária). Trata-se duma forma relativamente rara nos países industrializados em que as medidas preventivas de medicina humana e veterinária contemplam, designadamente, a detecção da tuberculose bovina e a pasteurização do leite. A deglutição de Mtb origina ulceração da mucosa intestinal com compromisso dos gânglios mesentéricos, e especial predilecção pelos gânglios ao nível do íleo terminal (lesão caseosa com consequente erosão) (Figura 7); esta lesão pode levar a perfuração intestinal originando quadro de peritonite tuberculosa. Para além da ascite, poderá surgir sintomatologia diversa: dor abdominal, síndroma obstrutiva, diarreia crónica inflamatória, massas abdominais palpáveis, etc..
Tuberculose urogenital
Rara na idade pediátrica, ocorre por disseminação hematogénica, correspondendo a reactivação tardia. As manifestações incluem essencialmente piúria (estéril), hematúria e proteinúria. A suspeita implica a detecção específica de Mtb na urina.
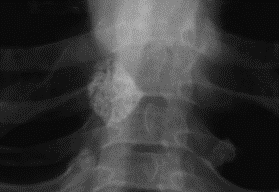
FIGURA 7. Radiografia abdominal simples evidenciando adenopatia abdominal calcificada no contexto de tuberculose abdominal. (NIHDE)
Tuberculose congénita
É uma forma rara cuja etiopatogénese se relaciona, quer com transmissão por via transplacentar, formando-se o complexo primário no fígado, quer com aspiração ou deglutição de material infectado a partir do líquido amniótico ou do canal genital. As manifestações incluem quadros de sépsis, hepatosplenomegália, dificuldade respiratória precoce, com padrões radiográficos diversos (pneumonia de aspiração, simile granúlia, etc.).
Outras formas de tuberculose extratorácica
Sucintamente faz-se referência (por razões didácticas históricas) a outras formas de tuberculose extratorácica, raras:
- Tuberculose cutânea traduzida por tubercúlides papulonecróticas, tuberculose verrucosa cútis, e eritema nodoso (já citado, por hipersensibilidade);
- Tuberculoma cerebral originando sinais focais e de hipertensão intracraniana;
- Laringite tuberculosa por fezes associada a tuberculose pulmonar;
- Tuberculose nasofaríngea resultante de disseminação hematogénica ou secundária a expectoração de material pulmonar estendendo-se à nasofaringe;
- Tuberculose oftálmica, rara, por disseminação hematogénica ou por propagação a partir dos tecidos circundantes; as formas clássicas, com valor histórico, hoje excepcionais, englobam a ceratoconjuntivite flictenular, já citada, a uveítes e a coroidite clássica agregando os chamados tubérculos coroideus, identificáveis por fundoscopia.
Diagnóstico de tuberculose
Aspectos gerais
Ao contrário do adulto, em que o diagnóstico de TB é directo, baseado na história clínica e confirmado por exames culturais, na criança o diagnóstico de TB é geralmente indirecto, baseando-se nas histórias clínica e epidemiológica valorizando o binómio adulto-criança, e na positividade da prova tuberculínica e/ou de uma prova imunológica/de imunodiagnóstico. (ver adiante)
No que respeita a resultados de exames complementares correntes, importa realçar que a fórmula sanguínea é em geral normal, a velocidade de sedimentação está aumentada e a proteína C reactiva evidencia em geral, também valores elevados. Contudo, estes resultados exprimem de modo inespecífico apenas repercussão de um processo inflamatório sobre o estado geral do organismo. O doseamento da adenosinadeaminase (ADA) no LCR ou líquido pleural poderá orientar no sentido de infecção por Mtb se os valores forem superiores a 40 U/L; no entanto, tal achado não é patognomónico, pois poderá verificar-se idêntica alteração, designadamente em casos de artrite reumatóide. Por fim, cita-se a realização de fundoscopia podendo identificar a presença de tubérculos coroideus e confirmar o diagnóstico.
Prova tuberculínica
A prova tuberculínica/intradermorreacção de Mantoux mantém a sua inegável importância no processo diagnóstico da TB; contudo, deverão ser interpretadas no contexto de eventual vacinação anterior e de parâmetros epidemiológicos, clínico-laboratoriais e radiológicos. O Quadro 3 pormenoriza aspectos importantes relacionados com este procedimento. A técnica de realização deste é descrita na caixa a seguir ao quadro.
QUADRO 3 – Interpretação da prova tuberculínica.
O BCG determina, em geral, reacção alérgica após prova tuberculínica evidenciando alergia (zona de induração ≤ 10 mm). No entanto, muitas crianças vacinadas apresentam resultados de provas tuberculínicas com induração de menores dimensões ou até anergia, sem que tal signifique menor protecção em relação às formas graves de TB.*
(*) Além da prova de Mantoux existem outras provas tuberculínicas, hoje em desuso pela fraca sensibilidade e especificidade (por exemplo, com micropunções, adesivo com tuberculina percutânea tipo Volmer, etc.), citados por razões históricas. Segundo alguns autores, a vacinação com BCG poderá dificultar o diagnóstico, por problemas de interpretação das provas tuberculínicas. |
Técnica de realização da prova de Mantoux: – desinfecção da pele com álcool no terço médio do antebraço esquerdo; – seringa descartável de 1 mL (graduada em centésimos de mL) com agulha de calibre 26 e comprimento de 10 mm; – administração de 0,1 mL de tuberculina purificada (PPD RT 23) na localização referida; – injecção intradérmica de modo a criar pápula de 5 mm com bordos bem delimitados desaparecendo em 10-15 minutos. |
Provas de imunodiagnóstico
Como alternativa e/ou complemento à prova tuberculínica recentemente foram desenvolvidas novas provas diagnósticas, como a IGRA, acrónimo do inglês Interferon-Gamma Release Assay, baseadas na detecção da secreção/libertação de interferão/IFN-gama pelos linfócitos T ao entrar em contacto com antigénios de M. Tuberculosis, o que não acontece com os antigénios da estirpe atenuada BCG.
Existem comercializadas duas técnicas IGRA, respectivamente T-SPOT.TB e QuantiFERON-TB Gold.
- utilizando o teste T-SPOT.TB: na presença de tuberculosis (contendo antigénios específicos – ESAT-6, CFP-10 e TB7.7 – não existentes em M. bovis, nem no complexo M. avium) ocorre estimulação de linfócitos T no sangue periférico, permitindo a contagem do número de linfócitos T produtores de IFN-gama.
- utilizando o teste QuantiFERON-TB Gold é medido o teor de IFN-gama.
As principais vantagens dos testes de detecção de IFN-gama relativamente às provas tuberculínicas são a maior especificidade devido à falta de reactividade cruzada com BCG e micobactérias atípicas, e maior sensibilidade para o diagnóstico nos casos de crianças com infecções por VIH e com síndromas de má-nutrição. Um resultado positivo dos testes IGRA confirma apenas um estado de infecção e não necessariamente de doença, mas um resultado negativo não exclui, nem doença, nem infecção. Os resultados dos testes IGRA são, por vezes, bastante discordantes com a prova tuberculínica, pelo que em algumas situações poderão ser usados ambos de forma sequencial. Em crianças com idade inferior a cinco anos os dados disponíveis são escassos e não consensuais, mas os resultados sugerem uma menor sensibilidade que em crianças mais velhas e adultos.
Pesquisa de M. tuberculosis (métodos convencionais)
A pesquisa de Mtb na idade pediátrica deve ser efectuada no suco gástrico, de manhã, em jejum, com a criança em decúbito mantido desde a véspera, e durante três dias (três amostras). Deve introduzir-se 20 a 50 ml de água destilada através de sonda de aspiração, à temperatura ambiente, recolher-se o aspirado e colocá-lo em recipiente estéril. O produto deve ser transportado à temperatura ambiente, devendo a entrega no laboratório e o processamento ser feitos nos 15 minutos seguintes; se tal não for possível dever-se-á congelar (-20ºC). O método mais económico e com maior percentagem de positividade no adulto é a cultura da expectoração, a qual é raramente positiva na criança, dado esta ser habitualmente paucibacilar. A positividade aumenta em crianças de idade superior a sete anos, colaborantes e com tuberculose endobrônquica ou parenquimatosa. Tal como com o suco gástrico, devem ser obtidas três amostras. Em qualquer idade, um exame directo negativo, em qualquer produto, não exclui tuberculose. A colheita de secreções brônquicas, líquido pleural, líquor ou urina deve ser ponderada caso a caso.
De acordo com estudos recentes provenientes da China (por Sun, et al), comprovou-se a vantagem (em termos de sensibilidade e rapidez do diagnóstico bacteriológico), da utilização do líquido de lavagem broncoalveolar, relativamente ao uso da expectoração, através do teste designado Xpert MTB/RIF.
Pesquisa de M. tuberculosis por técnica de amplificação do ácido nucleico
As técnicas de amplificação do ácido nucleico (TAAN) podem identificar directamente Mtb com a vantagem de não ser necessário crescimento em meio de cultura. No entanto, um resultado positivo nas TAAN não excluiu a realização de cultura, pela necessidade de efectuar os testes de sensibilidade aos antibacilares.
Outros exames complementares
Apesar de não haver um padrão radiológico específico da TB pulmonar na criança, a radiografia do tórax em incidências póstero-anterior e perfis é fundamental. A alteração mais frequente é a adenopatia mediastínica (hilar), que poderá ser responsável por atelectasia. Outros sinais radiológicos incluem a pneumonia, o derrame pleural, o padrão de disseminação miliar ou broncogénica e, nos adolescentes, as imagens sugestivas de cavitação (Figuras 2, 3 e 4). Quando são detectadas alterações radiológicas, deve ser efectuada tomografia computadorizada (TC), para melhor definição das características e extensão das lesões. A broncoscopia está indicada em situações específicas. (Quadro 4)
QUADRO 4 – Indicações da broncoscopia.
|
Em casos especiais de derrame pleural poderá estar indicada biópsia pleural para detecção de eventual granuloma. Igualmente, em função do contexto clínico, nalguns casos de tuberculose miliar/granúlia poderá estar indicada biópsia da medula óssea.
Nas formas extratorácicas deverão ser realizados exames de imagem (radiografia, ecografia, TC, RM, conforme indicado) para melhor caracterização das lesões, e biópsia para colheita de produtos, que devem ser sempre enviados para realização de exame directo por microscopia óptica, TANN e cultura.
Na meningite tuberculosa além dos exames de imagem já citados, que poderão evidenciar sinais de edema cerebral, hidrocefalia, ventriculomegália ou tuberculomas, deve ser efectuada punção lombar para colheita e análise do LCR, incluindo cultura (negativa em 30% dos casos), PCR/reacção da polimerase em cadeia, e pesquisa de Mtb por TANN.
Perante a suspeita de meningite ou granúlia, a realização de fundoscopia é fundamental, pois a presença de tubérculos coroideus pode confirmar o diagnóstico.
Diagnóstico diferencial
Apesar de Portugal ser actualmente um país de baixa incidência, o diagnóstico diferencial de TB deve ser efectuado em situações de pneumonia de evolução arrastada, meningoencefalite, síndroma febril prolongada e de origem não determinada; síndromas de etiopatogénese diversa associadas a derrame pleural, doença articular, adenopatia superficial, eritema nodoso, conjuntivite flictenular, etc..
Tratamento
Princípios gerais
O tratamento da TB inclui a administração de fármacos ao doente infectado e medidas de Saúde Pública para controlo da infecção a nível comunitário. As características de cada doente devem ser tidas em conta, designadamente, a idade, o local da infecção, assim como a eventualidade de estado de imunossupressão e de coinfecção com VIH.
Os Quadros 5 e 6 discriminam respectivamente fármacos antibacilares de 1ª e 2ª linhas actualmente utilizados.
QUADRO 5 – Posologia dos antibacilares de primeira linha.
| Rifampicina | 15 mg/kg/dia (10-20 mg/kg/dia); máx. 600 mg |
| Isoniazida | 10 mg/kg/dia (7-15 mg/kg/dia); máx. de 300 mg |
| Pirazinamida | 35 mg/kg/dia (30-40 mg/kg/dia) |
| Etambutol | 20 mg/kg/dia (15-25 mg/kg/dia) |
QUADRO 6 – Posologia de antibacilares de segunda linha.
| Amicacina | 15-22,5 mg/kg/dia (máx. 1000 mg) |
| Canamicina | 15-30 mg/kg/dia (máx. 1000 mg) |
| Capreomicina | 15-30 mg/kg/dia (máx. 1000 mg) |
| Levofloxacina | 15-20 mg/kg/dia (máx. 750 mg) |
| Moxifloxacina | 15-20 mg/kg/dia (máx. 400 mg) |
| Etionamida | 15-20 mg/kg/dia (máx. 1000); 2 tomas |
| Cicloserina | 10-20 mg/kg/dia (máx. 1000 mg); 1-2 tomas |
| PAS (ácido para-amino-salicílico) em carteiras | 150 mg/kg/dia (máx. 12.000 mg); 2-3 tomas |
| Linezolide | 20 mg/kg/dia (máx. 1200 mg); 2 tomas |
Logo após o início da terapêutica antibacilar tornou-se evidente que a emergência de resistência de Mtb se desenvolveria a uma taxa previsível se os sucessivos fármacos fossem usados em monoterapia.
Por conseguinte, uma vez que o tratamento tem por objectivo principal a erradicação de Mtb, dever-se-á usar sempre um esquema de politerapia que inclua fármacos bactericidas. Esta associação de fármacos impedirá o aparecimento de estirpes mutantes e reduzirá o tempo de tratamento; este, deverá, no entanto, ser suficientemente longo para permitir a esterilização das lesões.
Os esquemas-padrão de tratamento para as formas de TB torácica e para a maioria das formas de TB extratorácica, pressupõem seis meses de duração. Em determinadas situações poderão ser mais longos, com excepção das formas multirresistentes e extensivamente resistentes, não excedendo contudo um ano.
O tratamento com fármacos que actuam sobre bacilos em multiplicação activa é bastante eficaz. No entanto, para conseguir a esterilização das lesões na presença de bacilos em estado latente e/ou multiplicação lenta ou intermitente, o tratamento deve ser prolongado.
No adulto, a terapêutica intermitente (duas a três vezes/semana) tem interesse em situações de suspeita de má adesão ao tratamento diário ou em ambientes com dificuldades de acesso aos serviços de saúde, o que implica supervisão/vigilância rigorosas.
Em determinados contextos deverá adoptar-se a estratégia de toma observada direta (TOD), em que o profissional de saúde observa e confirma a toma dos antibacilares pelo doente.
Sendo a multiplicação do bacilo proporcional à pressão de oxigénio no meio, torna-se fácil compreender que as lesões poderão conter três tipos de populações microbianas distintas:
- bacilos em multiplicação activa, nas paredes das lesões caseosas das cavernas;
- população mais reduzida de bacilos, fagocitados pelos macrófagos (em meio ácido, sob o efeito de várias enzimas) com multiplicação lenta e ocasional;
- bacilos extracelulares em focos caseosos sólidos com multiplicação intermitente.
De salientar que as micobactérias podem sobreviver durante anos em estado latente (de quiescência) quando o metabolismo é inibido por baixa pressão de oxigénio ou pH baixo.
Os testes de sensibilidade aos antimicrobianos são habitualmente efectuados em duas fases. Na primeira são testados os fármacos de 1ª linha que incluem isoniazida/INH, rifampicina/RIF, pirazinamida/PZA e etambutol/EMB. Se o microrganismo for multirresistente, são testados numa 2ª fase, os de 2ª linha.
Os testes de sensibilidade (dado o crescimento lento das micobactérias) demoram, em média, duas semanas para os de 1ª linha e duas a quatro semanas para os de 2ª linha.
A propósito do fenómeno das resistências a fármacos, os quais são administrados a pessoas doentes, importa proceder à seguinte sistematização:
*considerando o fármaco
- Monorresistência – resistência apenas a um dos antibacilares de 1ª linha;
- Polirresistência – resistência a mais do que um dos antibacilares de 1ª linha;
- Multirresistência – resistência simultânea à INH e RIF a que se podem associar resistências a outros fármacos antibacilares;
- Resistência extensiva – resistência simultânea a INH, RIF, qualquer quinolona e, no mínimo, a um dos três fármacos injectáveis de segunda linha.
*considerando o doente
- Resistência inicial (primária) – resistência em doentes a submeter a um primeiro tratamento; trata-se dum indicador epidemiológico de excelência, reflectindo o reservatório de bacilos circulantes na comunidade;
- Resistência adquirida (secundária) – resistência demonstrável em doentes já em tratamento (inicialmente sensíveis, tornando-se resistentes); traduz casos de falência terapêutica.
Esquemas de tratamento
Tuberculose infecção ou tuberculose latente
Não existe uniformidade de critérios para a terapêutica da tuberculose-infecção ou tuberculose latente (que, de facto corresponde ao conceito de quimioprofilaxia secundária – ver Glossário geral).
Em Portugal recomenda-se a administração de isoniazida durante seis a nove meses ou, em alternativa, isoniazida e rifampicina por um período de três meses. Se confirmada resistência à isoniazida recomenda-se rifampicina durante quatro meses.
Têm indicação para tratamento da infecção latente, crianças com idade inferior a cinco anos submetidas a terapêutica actual com fármacos imunossupressores, especialmente fármacos biológicos, infecção por VIH, desnutrição grave e doença depauperante.
Estudos recentes apontam, por mecanismo não completamente esclarecido, para uma melhoria do prognóstico da tuberculose nos pacientes com diabetes mellitus associada, submetidos a tratamento com metformina.
Tuberculose doença
Nas formas de TB pulmonar (esquema terapêutico inicial) recomenda-se a utilização de três ou quatro fármacos durante dois meses com pirazinamida, isoniazida, rifampicina e etambutol.
Após este período são mantidas a isoniazida e a rifampicina durante mais quatro meses. Em regiões com elevada resistência à isoniazida, ou no doente com baciloscopias positivas, doença pulmonar extensa, imunodeprimidos (infecção por VIH ou outra) e formas extrapulmonares graves, a terapêutica inicial deverá incluir sempre quatro fármacos.
Nota: A utilização de estreptomicina (citada no quadro) como primeira linha não é recomendada em nenhuma das formas de doença.
Na resistência isolada à isoniazida, esta deve ser substituída por uma quinolona (levofloxacina ou moxifloxacina), mantendo terapêutica durante seis a nove meses. Na resistência isolada à rifampicina recomenda-se um esquema de multirresistência com ou sem isoniazida.
O tratamento da TB-MR, deve ser orientado pelas susceptibilidades encontradas na criança e/ou na fonte infectante. Como regra geral, devem incluir pirazinamida e, no mínimo, quatro fármacos de segunda linha aos quais se julgue não haver resistência.
A duração do tratamento deve ser individualizada em função da resposta clínica e laboratorial.
Como regra geral recomenda-se uma fase inicial intensiva de oito meses e uma fase de consolidação, no mínimo, com três fármacos comprovadamente activos (duração de 12 meses).
O tratamento deve ser administrado, na totalidade, em sistema TOD. Todos os referidos fármacos podem causar reacções adversas importantes as quais poderão obrigar a modificação da terapêutica e/ou suspensão de alguns.
Nos casos de TB-MR e TB-XDR a monitorização bacteriológica deverá ser mensal até final do tratamento e repetida, respectivamente, 6 e 12 meses após suspensão da terapêutica.
Nos casos de TB pulmonar a radiografia de tórax deverá ser realizada de seis em seis meses e no final do tratamento. O doente deve ser observado por médico mensalmente durante o tratamento e, posteriormente, aos 3, 6 e 12 meses, no mínimo.
Outras formas de tuberculose
No tratamento da linfadenite tuberculosa poderá ser necessária a remoção cirúrgica do gânglio e da fístula à pele. A meningite tuberculosa, e a tuberculose osteoarticular obrigam sempre a terapêutica quádrupla inicial (isoniazida, rifampicina, pirazinamida e etambutol) durante dois meses, seguida de dupla (isoniazida e rifampicina) no total de 12 meses.
Situações especiais
- A corticoterapia está indicada em todas as situações em que o processo inflamatório causado pela infecção tuberculosa possa ser factor adjuvante para o estabelecimento de complicações e sequelas. O “desmame” dos corticóides deve ser muito lento, em quatro a seis semanas. O Quadro 7 elucida sobre as indicações universais e a ponderar.
- A coinfecção por VIH, menos frequente na criança do que no adulto, obriga no entanto ao respectivo rastreio em todas as crianças com tuberculose-doença. A terapêutica da criança VIH positiva com TB é semelhante à da criança VIH negativa. Contudo, devem ser ponderados esquemas terapêuticos mais longos se a resposta inicial for lenta.
A introdução dos fármacos antiretrovíricos inibidores da protease (IP; por ex. indinavir e nelfinavir) trouxe problemas adicionais na terapêutica antibacilar destes doentes, nomeadamente em relação à utilização das rifamicinas (rifampicina e rifabutina).
Sendo as rifamicinas indutoras do citocromo P450 hepático, aceleram o metabolismo dos IP (a rifampicina é o indutor mais potente) condicionando concentrações séricas baixas e níveis infraterapêuticos dos referidos antiretrovíricos. Estes, por sua vez, ao retardarem o metabolismo das rifamicinas, elevam os seus níveis séricos com consequente risco de toxicidade. Assim, a rifampicina não deve ser utilizada conjuntamente com os IP actualmente disponíveis; contudo, a rifabutina poderá ser uma alternativa eficaz, desde que se efetcuem ajustes posológicos (redução da dose de rifabutina e aumento da referente aos IP).
QUADRO 7 – Corticoterapia na tuberculose.
| Indicações universais | Indicações a ponderar |
|
|
Prevenção
A prevenção da tuberculose exige uma acção harmónica entre as várias estruturas da Saúde, com detecção precoce dos casos e seu tratamento eficaz, rastreio dos contactos, quimioprofilaxia e vacinação.
Quimioprofilaxia (primária)
Consiste na administração profiláctica de fármacos antibacilares a crianças ainda não infectadas e em contacto com doente que elimina e propaga bacilos, por conseguinte em risco de adquirirem a tuberculose (Quadro 8). Como regra, a quimioprofilaxia primária está indicada em crianças de idade inferior a cinco anos. No entanto, a quimioprofilaxia deverá ser ponderada, caso a caso, em todas as situações de maior risco de evolução para doença activa. Habitualmente, consiste na administração de isoniazida em monoterapia. Quando haja resistência da fonte infectante à isoniazida, alguns autores preconizam a administração de rifampicina, enquanto outros preferem a administração conjunta de isoniazida e rifampicina. Para além da prova tuberculínica e/ou testes IGRA, antes de iniciar a quimioprofilaxia deverá ser efectuada radiografia de tórax, de modo a excluir doença.
QUADRO 8 – Quimioprofilaxia (primária).
| Indicações | Duração | No final |
Contactos intrafamiliares ou muito próximos de doentes bacilíferos com:
|
Enquanto se mantiver o contacto infetante e mais três meses após este terminar | Realizar prova tuberculínica ou teste IGRA
|
Vacinação
A vacinação com BCG segue as recomendações da OMS para países de elevada incidência de tuberculose. Trata-se duma vacina viva atenuada contendo estirpes de M. bovis. Os estudos efetuados sobre a efectividade da vacina não são concludentes; enquanto alguns atestam elevada protecção, outros referem ser escassa ou nenhuma. Algumas particularidades ajudam a explicar estes resultados: 1) não existem critérios universais para o diagnóstico de tuberculose, nomeadamente da tuberculose em idade pediátrica; 2) necessidade de estudos muito longos porque existe geralmente um grande intervalo entre a administração da vacina e a eclosão da doença; 3) grande variedade de estirpes da vacina, de diversos fabricantes; 4) mecanismo de acção não está, ainda, verdadeiramente esclarecido; 5) interferência imunológica por micobactérias não tuberculosas; 6) polimorfismos genéticos das populações.
A vacinação com BCG não determinou, de facto, a eliminação da tuberculose em nenhum país, nem tem tido qualquer efeito na epidemiologia mundial da tuberculose. No entanto, a principal vantagem relaciona-se com a possibilidade de redução de formas mais graves de tuberculose infantil como a meningite e a tuberculose disseminada. Como vacinação universal a vacina foi retirada do PNV português em 2015, passando a ser vacinados, à semelhança de outros países, apenas os grupos de risco conforme Norma 6/2016 da DGS. (Quadro 9)
Quadro 9 – Crianças de idade inferior a seis anos, elegíveis para vacinação com BCG – Grupos de risco.1
1A partir dos 12 meses de idade há indicação para realização de prova tuberculínica ou de IGRA antes da vacinação com BCG. Se houver antecedentes de contacto com caso de tuberculose activa (possível ou confirmada), ou outras circunstâncias que levem a suspeitar que a criança teve ou tem uma probabilidade elevada de ter contraído infecção, deve ser submetida a rastreio em articulação com o PNT. Após prova tuberculínica/IGRA negativo a vacina BCG pode ser administrada nos três meses seguintes. | |
| Crianças sem registo de BCG/sem cicatriz vacinal e: | Situações abrangidas |
| Provenientes de países com elevada incidência de tuberculose | Estadia de, pelo menos, três meses |
| Que terminaram o processo de rastreio de contactos e/ou esquema de profilaxia | A avaliar pelas Unidades de Saúde Pública em articulação com os Coordenadores Regionais do Programa Nacional para a Tuberculose (PNT) e Centros de Diagnóstico Pneumológico (CDP) |
| Cujos pais, outros coabitantes ou conviventes apresentem → |
|
| Pertencentes a comunidades com risco elevado de tuberculose | A avaliar pelas Unidades de Saúde Pública em articulação com os Coordenadores Regionais do Programa Nacional para a Tuberculose e CDP |
| Viajantes para países com elevada incidência de tuberculose2 |
|
As vacinas actualmente incluem diversas modalidades:
- vacinas de subunidades que utilizam proteínas de Mtb;
- vacinas contendo DNA de Mtb usando vectores víricos;
- BCG recombinante; – utilização de estirpes mutantes de Mtb; e
- vacinas inactivadas e atenuadas contendo micobactérias não-tuberculosas.
As novas vacinas deverão ser acessíveis aos países mais pobres, onde o peso da doença é mais significativo e os sistemas de saúde mais débeis.
BIBLIOGRAFIA
Basham CA, Romanowski K, Johnston J. Life after tuberculosis: planning for health. Lancet Respir Med 2019;7:1004-1006
Bhattacharya J, Mohandas S, Goldman DL. Nontuberculous mycobacterial infections in children. Pediatr Rev 2019;40:179-190; DOI: 10.1542/pir.2018-0131
Bianchi L, Galli L, Moriondo M, etal. Interferon-gamma release assay improves the diagnosis of tuberculosis in children. Pediatr Infect Dis J 2009;28:510-514
Carter ER, Lee CM. Interpretation of the tuberculin skin test by pediatric providers. Pediatr Infect Dis J 2002;21:200-203
Carvalho A, Carvalho I, Marques L, et al. Consenso sobre a abordagem da criança exposta a doente com tuberculose. Acta Pediatr Port 2014;45:242-251
Chiang SS, Khan FA, Milstein MB, et al. Treatment outcomes of childhood tuberculous meningitis: a systematic review and meta-analysis. Lancet Infect Dis 2014;14:947-57
Cherry JD, Harrison JG, Kaplan SL, Steinbach WJ, Hotez PJ (eds). Feigin and Cherry Textbook of Pediatric Infectious Diseases. Philadelphia: Saunders, 2014
Cruz AT, Geltemeyer AM, Starke JR, et al. Comparing the tuberculin skin test and T-SPOT.TB blood test in children. Pediatrics 2011;127:e31-e38
Cruz AT, Reichman LB. The case for retiring the tuberculin skin test (Mantoux). Pediatrics 2019;143 (6). e201833327; DOI: 10.1542/peds.2018-3327
Dheda K, Barry CE 3rd, Maartens G. Tuberculosis. Lancet 2016;387:1211-1226
Direcção Geral da Saúde / DGS, Portugal. Infecção por VIH, SIDA e Tuberculose em números – 2015. Lisboa: DGS, 2015.
Direcção Geral da Saúde / DGS. Norma 006/2016 – Estratégia de vacinação contra a tuberculose com a vacina BCG. Lisboa: DGS, 2016.
Ducla-Soares A, Villar TG. Propedêntica Médica (II volume) Lisboa: Fundação Caloustre Gulbenkian, 1999
Eisenhut M. Reduced sensitivity of immunodiagnostic tests for active tuberculosis in children. Eur J Pediatr 2010;169:775
Flash Info. Avis du Haut Conseil de la Santé Publique (HCSP)-France 2018). Tuberculose pédiatrique . J Pédiatrie Puériculture 2018;31:299-305
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gegia M, Winters N, Benedetti A, et al. Treatment of isoniazid-resistant tuberculosis with first-line drugs: a systematic review and meta-analysis. Lancet Infect Dis 2016; pii: S1473-3099 (16) 30407-8
Getahun H, Matteelli A, Chaisson RE, Raviglione M. Latent Mycobacterium tuberculosis infection. NEJM 2015;372:2127-2135
Hatherill M. Prospects for elimination of childhood tuberculosis: the role of new vaccines. Arch Dis Child 2011;96: 851-856
Holmberg PJ, Temesgen Z, Ritu Banerjee R. Tuberculosis in Children Pediatr Rev 2019;40:168-176
Horsburgh CR Jr, Barry CE, Lange C. Treatment of tuberculosis. NEJM 2015;373:2149-2160
Jenkins HE, Tolman AW, Yuen CM, et al. Incidence of multidrug-resistant tuberculosis disease in children: systematic review and global estimates. Lancet. 2014;383:1572-1579
Jenkins HE, Yuen CM, Rodriguez CA, et al. Mortality in children diagnosed with tuberculosis: a systematic review and meta-analysis. Lancet Infect Dis 2016; pii: S1473-3099 (16) 30474 -1
Kaufmann SH, Weiner J, Reyn CF. Novel approaches to TB vaccine development. Int J Infect Dis. 2016; pii: S1201-9712 (16) 31202- 4
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lahey T, von Reyn C. Mycobacterium bovis BCG and new vaccines for the prevention of tuberculosis. Microbiol Spectrum 2016; 4:TNMI7 – 0003-2016
Laurenti P, Raponi M, de Waure C, Marino M, Ricciardi W, Damiani G. Performance of interferon-γ release assays in the diagnosis of confirmed active tuberculosis in immunocompetent children: a new systematic review and meta-analysis. BMC Infect Dis. 2016;16:131
Lewinsohn DM, Leonard MK, LoBue PA, et al. Official American Thoracic Society/Infectious Diseases Society of America / Centers for Disease Control and Prevention Clinical Practice Guidelines: Diagnosis of tuberculosis in adults and children. Clin Infect Dis 2016; Dec 8. pii: ciw694
Locht C, Rouanet C. New antituberculosis vaccines. Archives de Pédiatrie 2011;18:1023-1027
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Macedo R, Silva AS, Simões MJ. Tuberculose multirresistente e extensivamente resistente em Portugal, 2008-2013 – INSA. Boletim Epidemiológico 2014;3:11-14
Mai NT, Thwaites GE. Recent advances in the diagnosis and management of tuberculous meningitis. Curr Opin Infect Dis 2017;30:123-128
Moro M, Málaga S, Madero L (eds). Cruz tratado de Pediatria. Madrid: Panamericana, 2015
Ndlovu H, Marakalala MJ. Granulomas and inflammation: host-directed therapies for tuberculosis. Front Immunol 2016;7:434
Oglesby W, Kara AM, Granados H, Cervantes JL. Metformin in tuberculosis: beyond control of hyperglycemia. Infection 2019;47:697-702
Pereira L, Marques L, Castro C, Vaz L G. Diagnóstico e tratamento da tuberculose em Pediatria. Acta Pediatr Port 2003;34:113-116
Perez-Velez CM, Marais BJ. Tuberculosis in children. NEJM 2012;367:348-361
Starke JR. Interferon-gamma release assays for diagnosis of tuberculosis infection in children. Pediatr Infect Dis J 2006;25:941-942
Starke JR. Tuberculin skin test versus the interferon-g release asays: out with the old, in with the new. Pediatrics 2020;145(1): e20193021
Sun L, Qi X, Liu F, et al. A test for more accurate diagnosis of pulmonary tuberculosis. Pediatrics 2019;144(5):e20190262
Taneja R, Garcia-Prats AJ, Furin J, Maheshwari HK. Paediatric formulations of second-line anti-tuberculosis medications: challenges and considerations. Int J Tuberc Lung Dis 2015;19:S61-S68
Villanueva P, Sudbury E, Song R, et al. Advanced immunodiagnostic tests for paediatric tuberculosis. Lancet Infect Dis 2019;19:467-468
Wang XW, Pappoe F, Huang Y, et al. Xpert MTB/RIF Assay for pulmonary tuberculosis and rifampicin resistance in children: a meta-analysis. Clin Lab 2015;61:1775-1785
WHO. Guidance for national tuberculosis programmes on the management of tuberculosis in children. Geneva: WHO, 2014
WHO. Treatment guidelines for drug-resistant tuberculosis, 2016 update. Geneva: WHO, 2016
WHO. Global tuberculosis report 2016. Geneva: WHO, 2016
Zaheen A, Bloom BR. Tuberculosis in 2020 – New approaches to a continuing global health crisis. N Engl J Med 2020; 382:e26. DOI: 10.1056/NEJMp2000325
Zumla A, Raviglione M, Hafner R, von Reyn CF. Tuberculosis. NEJM 2013;368:745-755