Introdução
A não solubilidade aquosa dos lípidos (colesterol livre, colesterol esterificado e triglicéridos, exceptuando-se os fosfolípidos) implica um sistema de transporte plasmático constituído pela associação daqueles a diversas proteínas específicas (apoproteínas ou simplesmente apo) mediante ligações covalentes, formando-se macromoléculas complexas, designadas lipoproteínas.
As dislipoproteinémias definem-se como afecções caracterizadas essencialmente por valores elevados ou baixos das várias classes de lipoproteínas major adiante sistematizadas (quilomicrons, lipoproteínas de muito baixa densidade (VLDL), de baixa densidade (LDL) e alta densidade (HDL).
O metabolismo das lipoproteínas pode resultar, quer da mutação de um único gene, quer, mais frequentemente, de múltiplos genes, com influência no metabolismo das lipoproteínas.
Importa referir, contudo, a possibilidade da actuação concomitante de diversos factores ambientais (tais como a ingestão excessiva de gordura e o sedentarismo), contribuindo também para o surgimento de dislipoproteinémias.
Nosologia
As doenças hereditárias relacionadas com defeitos do metabolismo dos lípidos integram classicamente os seguintes subgrupos:
- Alterações da β-oxidação mitocondrial dos ácidos gordos;
- Alterações do metabolismo dos ácidos gordos de cadeia muito longa;
- Doenças de armazenamento de lípidos; e
- Doenças por anomalias do metabolismo e transporte das lipoproteínas (dislipoproteinémias).
Tendo os principais tópicos que integram as alíneas 1-, 2-, e 3- sido abordados nos dois capítulos anteriores (incluídos nas doenças dos organelos), o objectivo deste capítulo é proceder a uma descrição sucinta das disliproteinémias (alínea 4-), patologia que por sua vez tem afinidades com a doença aterosclerótica, incluída no 1º volume.
1. GENERALIDADES SOBRE LÍPIDOS
Lípidos e aterosclerose
Os estudos de investigação em lipidologia têm demonstrado a associação entre hipercolesterolémia, doença aterosclerótica e doença cardíaca coronária.
Os progressos realizados em técnicas laboratoriais sofisticadas permitindo identificar e separar subclasses de partículas lipídicas, assim como medir determinados marcadores de inflamação da parede arterial, têm permitido melhor compreensão da aterogénese e da ruptura da placa de ateroma conduzindo à síndroma coronária aguda.
Recorda-se, a propósito, que a aterosclerose afecta as artérias em geral e, com especial ênfase, as artérias coronárias, as artérias carótidas e as dos membros inferiores.
Admite-se que a fase inicial do desenvolvimento da aterosclerose corresponde a um processo de disfunção endotelial com espessamento da íntima e média ocorrendo na fase da pré-adolescência, com maior intensidade se existirem factores de risco como obesidade e hipercolesterolémia familiar.
De acordo com um estudo realizado em estudantes de Medicina de raça caucasiana nos EUA (The Johns Hopkins Precursors Study), verificou-se que a incidência de coronariopatia pelos 30-40 anos de idade era directamente proporcional aos valores de hipercolesterolémia na idade pediátrica.
A propósito dos factores de risco da aterogénese, cabe recordar os resultados de diversos estudos epidemiológicos abordados no capítulo sobre origens fetais de doenças no adulto (volume 1):
- Maior incidência de coronariopatia no adulto com antecedentes de baixo peso de nascimento;
- Maior risco de síndroma metabólica (resistência à insulina, diabetes mellitus de tipo 2, obesidade, coronariopatia) na idade adulta se houver antecedentes de ambiente intrauterino adverso, designadamente relacionável com diabetes e obesidade maternas.
Retomando o que foi referido no capítulo sobre doença aterosclerótica, reitera-se que o processo de penetração lipídica na íntima se pode dever a um conjunto de factores adversos, salientando-se o papel das partículas lipídicas LDL oxidadas e altamente tóxicas (ver adiante).
Linfócitos e monócitos, penetrando no endotélio lesado, evoluem para macrófagos “carregados“ com partículas LDL e, ulteriormente para células espumosas. Tal acumulação poderá, até certo ponto, ser contrabalançada por partículas HDL com capacidade de remoção dos lípidos da parede vascular.
Para a formação das placas fibrosas é fundamental a existência de processo inflamatório (testemunhado por elevação da PCR) em que participam macrófagos. A deposição de lípidos na camada subendotelial da parede arterial traduz-se macroscopicamente pelo aparecimento das estrias gordas que, até certo ponto, poderão ser reversíveis.
Numa fase mais tardia do desenvolvimento da placa, surge ruptura das células musculares lisas da parede arterial, o que é facilitado pela libertação de citocinas teciduais e de factores de crescimento.
A placa de ateroma (estrias gordas e placas fibrosas) é composta por uma parte central ou núcleo de substância gorda separada do lume por colagénio e tecido muscular liso. O crescimento da placa pode conduzir a isquémia dos tecidos cuja vascularização depende da artéria com parede lesada.
A inflamação crónica no interior do ateroma, possivelmente causada por agentes microbianos como Chlamydia pneumoniae, poderá conduzir a instabilidade da placa e a ruptura subsequente; se consequentemente surgir ruptura do endotélio, verifica-se fenómeno de agregação e adesão de plaquetas com formação de coágulo no local da ruptura.
Lipoproteínas
Tipos e estrutura dos lípidos
Os lípidos são ésteres, ou seja, a combinação de um ácido com um álcool; os ácidos constituintes dos lípidos chamam-se ácidos gordos. Os álcoois mais frequentemente encontrados nos lípidos são o glicerol e o colesterol.
Os principais lípidos existentes no organismo são classificados do seguinte modo:
- Triglicéridos: em que as funções álcool do glicerol são esterificadas por três ácidos iguais ou diferentes;
- Fosfolípidos: contendo na sua estrutura uma molécula de ácido fosfórico; são de 2 tipos:
- glicerofosfolípidos e aglicerofosfolípidos ou esfingolípidos; os glicerofosfolípidos mais importantes são as lecitinas e as cefalinas,
- esfingolípidos, lípidos predominantes no sistema nervoso, têm um álcool (a esfingosina), diferente do glicerol;
- Ésteres do colesterol: resultam da esterificação da função álcool do colesterol por um ácido.
Sobre o sistema de transporte plasmático dos lípidos (designadamente do colesterol livre, colesterol esterificado e triglicéridos), importa salientar que os mesmos estão envolvidos por proteínas, com um pólo solúvel nos lípidos, e outro, solúvel na água, orientando-se o pólo solúvel nos lípidos para o interior, e o pólo solúvel na água para o exterior. [não solubilidade aquosa dos lípidos (colesterol livre, colesterol esterificado e triglicéridos, exceptuando-se os fosfolípidos]. Formam-se assim compostos/ partículas designados lipoproteínas.
O centro das referidas partículas contém macromoléculas hidrofóbicas incluindo triglicéridos e ésteres de colesterol, enquanto a superfície é composta de moléculas hidrofílicas como fosfolípidos e colesterol.
As apolipoproteínas (designadamente as Apo B-100, Apo B-48, Apo A-I) são necessárias para a integridade estrutural e servem como ligantes ou co-factores para enzimas específicas.
Com base no princípio de que os lípidos têm baixa densidade, e as proteínas densidade mais elevada, foi possível separar por ultracentrifugação aqueles dois componentes e sistematizar quatro classes de partículas lipoproteicas por ordem decrescente de dimensões, e crescente de densidade (Figura 1):
- As Quilomicron (Qm), cuja apoproteína é a Apo B-48, transportam triglicéridos do intestino para os tecidos periféricos, quer para consumo energético, quer para deposição nas células adiposas; não são aterogénicos.
- As Lipoproteínas segregadas pelo fígado (de densidade muito baixa), o segundo transportador de triglicéridos com a sigla VLDL (do inglês, very low density lipoproteins contendo Apo B-100, C e E), são aterogénicas e precursoras das lipoproteínas de densidade baixa.
- As Lipoproteínas de densidade baixa, o principal transportador de colesterol, com a sigla LDL (do inglês, low density lipoproteins) contendo somente Apo B) são aterogénicas.
- As Lipoproteínas de densidade intermédia (intermediate density lipoproteins/IDL) derivam das VLDL.
- As Lipoproteínas de densidade elevada, com a sigla HDL (do inglês, high density lipoproteins, contendo Apo A, exercem efeito protector no que respeita à formação do ateroma.
FIGURA 1. Separação de lipoproteínas por ultracentrifugação.
Acentua-se que:
- As LDL constituem o principal transportador de colesterol;
- As Qm e as VLDL transportam predominantemente triglicéridos; e
- As HDL transportam predominantemente fosfolípidos;
- A proporção de colesterol associado às HDL é superior à das VLDL e inferior à das LDL.
Uma referência especial merece a chamada lipoproteína (a), abreviadamente Lp(a), a qual partilha características com determinados factores de coagulação: possui elevado conteúdo em hidratos de carbono e integra duas apoproteínas: Apo B-100 e Apo(a), esta última muito semelhante ao plasminogénio.
Metabolismo e transporte das lipoproteínas
Existem dois órgãos com papel crucial na biossíntese e secreção das partículas lipoproteicas: o intestino e o fígado (Figura 2).
O sistema de transporte das lipoproteínas compreende três vias: endógena, exógena e de transporte reverso.
O primeiro passo na biossíntese do colesterol é a formação de 3-hidroxi-3-metilglutaril CoA (HMG-CoA) a partir de acetil-CoA; a HMG-CoA, por acção da HMG-CoA redutase leva à formação de mevalonato e, em passos seguintes, a isoprenóides activados e lanosterol, este último, o principal esteróide precursor de colesterol.
FIGURA 2. Vias metabólicas do colesterol. (consultar texto)
→ Pela via endógena, o colesterol e os triglicéridos, sintetizados no fígado (HDL e VLDL) e noutros tecidos, são transportados a outros territórios, quer para utilização como fonte energética, quer para formação de reservas ou depósitos.
As HDL captam o colesterol das células, esterificando-o, e as VLDL transportam os triglicéridos endógenos formados no hepatócito.
As partículas HDL encontram-se em diferentes subfracções designadas com numeração (por ex. HDL1, HDL 2, HDL 3), sendo geradas principalmente pelo metabolismo dos Qm e pela interacção com VLDL. |
→ Pela via exógena, o colesterol e os triglicéridos absorvidos ao nível do intestino são transportados a outros tecidos, nomeadamente fígado, músculo e tecido adiposo. A mucosa intestinal sintetiza, imediatamente a seguir à ingestão de alimentos, os Qm a partir das gorduras ingeridas e VLDL, quer no período de digestão, quer nos respectivos intervalos (via exógena).
As Qm e as VLDL são formadas nos microssomas das células da mucosa duodenal e hepatócitos, respectivamente. Neste passo do metabolismo desempenha papel importante uma proteína microssómica de transferência de VLDL para o retículo endoplásmico.
A Apo C-II tem um papel importante na cisão das Qm e VLDL como co-factor da lipoproteína-lipase, ou glicoproteína ligada ao endotélio (ver adiante), a qual desdobra o triglicérido em glicerol e ácidos gordos, para ulterior metabolismo na célula. Os remanescentes das Qm são absorvidos pelo fígado (via receptor de Apo E) e metabolizados.
A VLDL evolui para IDL (intermediate density lipoprotein) e, após remoção de todos os lípidos, transforma-se finalmente em partículas LDL ricas em colesterol. Não sendo estas necessárias nos tecidos periféricos, são absorvidas novamente pelo fígado via receptor de LDL.
A LDL é encontrada em diferentes subfracções (LDL àLDL 6); LDL 6 é descrita como uma partícula pequena, densa e altamente aterogénica. As mesmas partículas LDL ligando-se, via Apo B-100, ao receptor de LDL, são captadas por endocitose e cindidas no lisossoma, principalmente através da acção da lipase ácida.
O colesterol, quando libertado, inibe a actividade da HMG-CoA sintetase e é armazenado via acil-CoA colesterol-aciltransferase (ACAT) nas células sob a forma de “gotículas lipídicas”.
→ Pela via de transporte reverso o colesterol não esterificado é transportado dos tecidos extra-hepáticos, de novo, para o fígado com a participação das HDL, o que tem efeito vasoprotector.
Através da Apo A-I e Apo A-IV, as HDL activam a lecitina-colesterol-acil-transferase ou LCAT, induzindo a formação de ésteres de colesterol. Estes podem ser trocados por triglicéridos de outras lipoproteínas através da proteína de transferência CETP ou cholesteryl ester transfer protein.
Por este mecanismo, a maioria do colesterol contido nas HDL é metabolizada através da via das LDL.
O Quadro 1 sintetiza as principais funções das apoproteínas.
QUADRO 1 – Principais funções das apoproteínas.
| Lipoproteína | Apolipoproteína (Apo) | Função |
| Quilomícrons | A-I, A-IV, C-I, C-II, C-III, E, B-48 | Transporte de triglicéridos exógenos, vitaminas solúveis em gordura e drogas |
| VLDL | CI-III, E, B-100 | Transporte de triglicéridos endógenos |
| IDL | C-II, E, B-100 | Produto de remoção de triglicéridos VLDL |
| LDL | B-100 | Produto da remoção de triglicéridos IDL; transporte de colesterol para tecido extra-hepático; regulação da biossíntese de colesterol |
| HDL | A-I, A-II, A-IV, C-I, C-III, D, E | Principalmente modificação de outras lipoproteínas, transporte de colesterol para o fígado |
| Lipoproteína (a) | B-100, Apo (a) | Incerta, possivelmente para reparação vascular; factor de risco de aterosclerose |
Receptores
Para melhor compreensão dos problemas clínicos decorrentes das anomalias hereditárias do metabolismo das lipoproteínas, torna-se útil sintetizar alguns aspectos relacionados com o papel dos receptores a nível ultra-estrutural.
O conceito de receptores para as lipoproteínas deve-se a Goldstein e Brown (Pémio Nobel) ao estudarem o mecanismo de transporte do colesterol dentro das células. Utilizando como modelo os fibroblastos em culturas, demonstraram que, na sua maioria, as LDL só se catabolizavam após fixação a receptores na membrana celular.
Posteriormente, verificou-se que, para lá destes receptores que reconhecem as apoproteínas B e E (receptores BE) e fixam as LDL, há no fígado receptores apenas para as apo E (receptores E). O número de receptores B e E é máximo no RN e diminui com a idade. Existem também receptores para as HDL.
Os receptores cuja estrutura é esquematizada na Figura 3 são glicoproteínas cujos aminoácidos estão distribuídos em 5 domínios. Os seus precursores são sintetizados nos ribossomas, migrando para o aparelho de Golgi; a síntese destes receptores é regulada por gene no cromossoma 19.
O receptor na membrana celular, aparecendo à superfície da membrana cerca de 45 minutos após a sua síntese, capta as LDL formando-se, entretanto, vesículas de endocitose revestidas por clatrina. Estas vesículas perdem rapidamente a clatrina e fundem-se com outras para formar grandes vesículas de contorno irregular, os endossomas ou receptossomas.
FIGURA 3. Representação esquemática da estrutura do receptor BE.
Quando o pH desce a 6,5 as LDL separam-se dos receptores, voltando o receptor à superfície (reciclagem dos receptores). Na fase seguinte as LDL são captadas pelos lisossomas, sendo as proteínas hidrolisadas em aminoácidos por acção de proteases, e os ésteres de colesterol em colesterol livre, por acção de esterases.
A captação do colesterol pelos receptores celulares tem por objectivo fornecer à membrana celular o colesterol de que ela necessita para a sua estabilidade. Compreende-se, assim, que o metabolismo do colesterol seja regulado para que seja fornecida à membrana uma quantidade necessária, mas não excessiva.
Assim, a captação do colesterol provoca:
- Acções sobre a HMG-CoA redutase
- repressão da síntese da enzima como se comprova pela diminuição do seu RNA-m,
- aceleração do seu catabolismo,
- inibição da sua actividade por inibição alostérica pelo colesterol em excesso;
- Aumento da actividade de acil-CoA-colesterol aciltransferase (ACAT), enzima que esterifica o excesso de colesterol que ficará depositado no citoplasma como gotículas;
- Repressão da síntese dos receptores.
As Figuras 4 e 5 sintetizam os mecanismos de captação das LDL e os mecanismos de regulação desencadeados pelo colesterol em excesso.
A actividade dos receptores é regulada por um conjunto de factores, cujos mecanismos de acção (alguns demonstrados apenas em estudos experimentais) poderão, em situações especiais, ser aplicados na prática clínica em várias estratégias de terapêutica das anomalias do metabolismo. Eis alguns exemplos mais relevantes:
- A insulina aumenta o número de receptores nos fibroblastos em cultura;
- A adrenalina diminui a fixação, internalização e degradação das LDL;
- O cortisol diminui a internalização das LDL sem afectar o número de receptores;
- O cálcio é necessário para a interacção LDL- receptores no fibroblasto, sendo a sua acção menos nítida no hepatócito; de referir que os bloqueantes dos canais do cálcio estimulam o catabolismo das LDL;
- Inibidores da HMG-CoA redutase aumentam o número de receptores, do mesmo modo que as resinas catiónicas como a colestiramina e colestipol; certos fibratos, idem.
O órgão com maior número de receptores é o fígado (cerca de 75% relativamente aos restantes órgãos). A actividade específica mais elevada foi encontrada no córtex suprarrenal e corpo amarelo, o que se pode explicar pelo facto de o colesterol ser o precursor das hormonas esteróides.
Um aspecto particular diz respeito às células endoteliais cujos receptores podem captar as LDL, mas não promovendo a sua endocitose, exceptuando nos casos de lesão endotelial.
2. DISLIPOPROTEINÉMIAS
As dislipoproteinémias (de acordo com o que foi referido no início, consideradas como anomalias qualitativas ou quantitativas, por excesso ou por defeito, na repartição das lipoproteínas plasmáticas e/ou apoproteínas), quer primárias ou hereditárias, quer secundárias, têm tendência a prevalecer na idade adulta. Por isso, torna-se imperioso detectar tal patologia tão precocemente quanto possível.
Antes da abordagem das principais dislipoproteinémias primárias ou hereditárias, discriminam-se as principais entidades nosológicas que poderão constituir causas secundárias (Quadro 2).
Em suma, reforça-se a necessidade de atitude preventiva de actuação precoce em ambas as situações pelas implicações práticas importantes na perspectiva de redução do risco de aterogénese.
FIGURA 4. Consequências do excesso de colesterol celular.
FIGURA 5. Visão global do metabolismo dos receptores.
QUADRO 2 – Causas secundárias de dislipoproteinémia.
Hipercolesterolémia |
Hipertrigliceridémia |
Diminuição de colesterol-HDL |
Hipercolesterolémias
Hipercolesterolémia familiar (HF)
A hipercolesterolémia familiar constitui uma das dislipoproteinémias monogénicas primárias mais frequentes com transmissão hereditária de tipo autossómico co-dominante. A HF autossómica dominante é a dislipoproteinémia hereditária mais comum. Descrevem-se formas homozigóticas e heterozigóticas.
Os estudos moleculares identificaram cinco classes de mutações de genes afectando a capacidade de o colesterol-LDL se ligar ao receptor de LDL. Estão descritas mais de 900 mutações; algumas destas resultam em falência da síntese do receptor LDL (a que correspondem fenótipos mais graves – formas homozigóticas, com actividade de receptor LDL < 2%), enquanto outras resultam, quer em deficiência de ligação ou de libertação na interface lipoproteína-receptor, quer em número reduzido de receptores de LDL – formas heterozigóticas, com actividade de receptor de LDL ~ 25%.
A HF monogénica causada por mutações nos genes LDLR, APOB ou PCSK9 está associada a doença cardiovascular aterosclerótica de início precoce/ prematura e a morte antes dos 60 anos por doença cardiovascular.
Importa salientar, contudo, que a introdução das estatinas há cerca de três décadas (ver adiante) alterou significativamente a história natural da HF, conduzindo a redução da mobilidade e mortalidade.
Está indicado o rastreio da doença através de análise de sangue do cordão umbilical nos casos de antecedentes familiares de HF.
Forma homozigótica
Na forma homozigótica, com uma prevalência aproximada de 1/ 160.000 indivíduos, são herdados dois alelos mutantes de receptores de LDL resultando em valores de hipercolesterolémia, em regra, superior a 600 mg/dL. Os níveis de C-HDL estão ligeiramente diminuídos e os de triglicéridos ligeiramente elevados ou normais.
Nos casos de indivíduos de idade inferior a 18 anos com colesterolémia total > 270 mg/dL e/ou C-LDL ~200 mg/dL, existe probabilidade ~90% de HF; e, se existir familiar em 1º grau com a doença, o diagnóstico pode considerar-se muitíssimo provável.
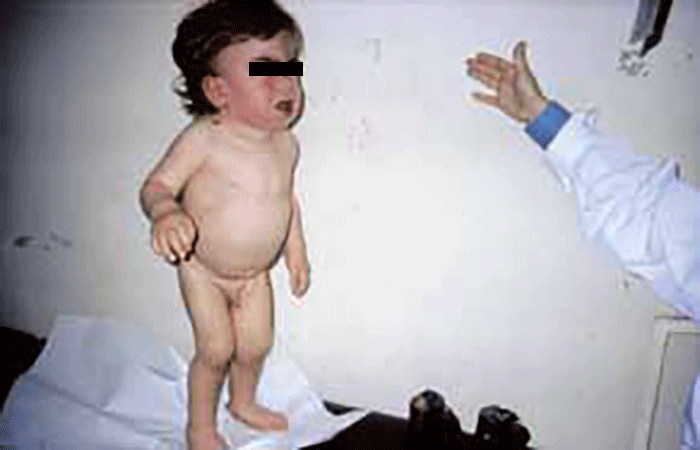
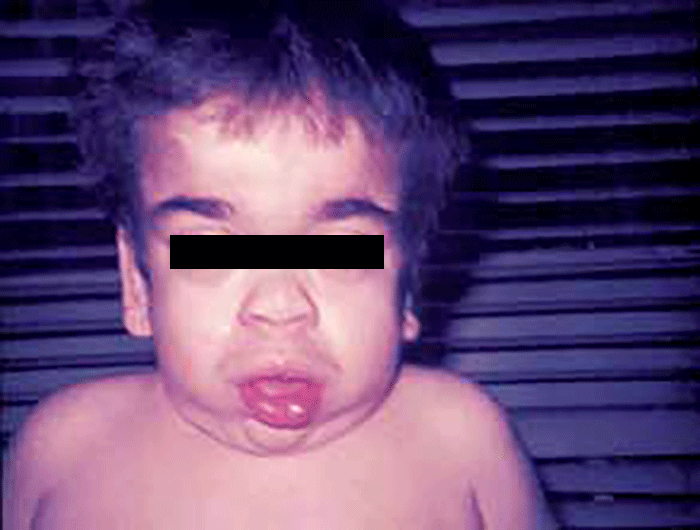
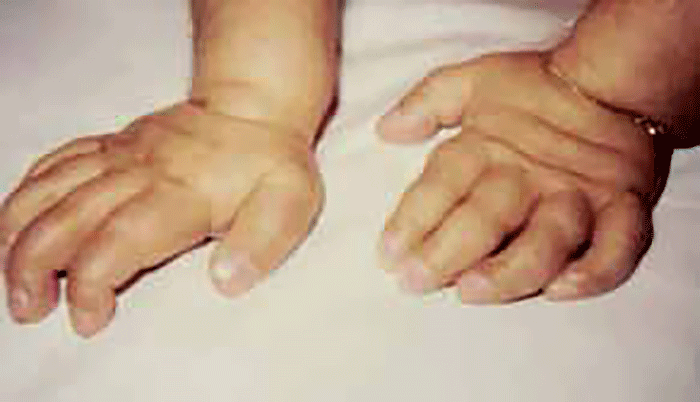
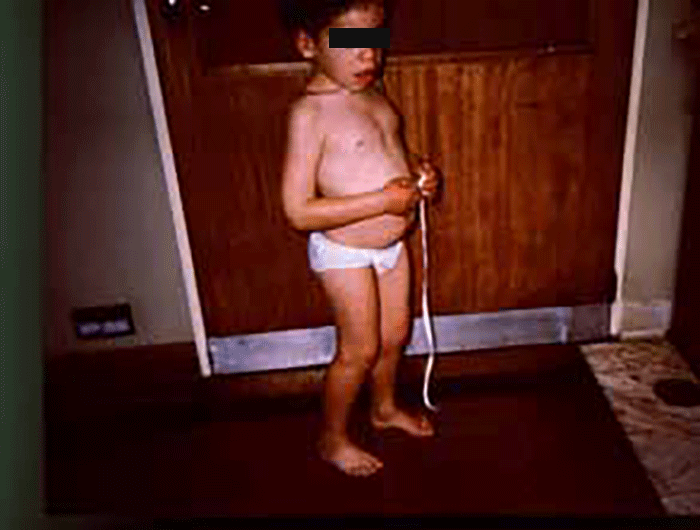
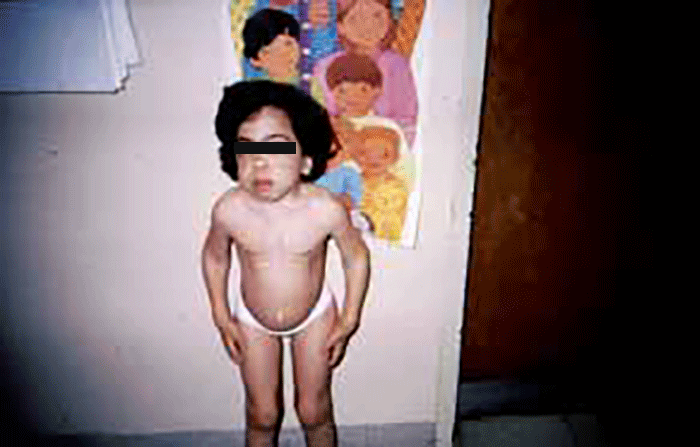
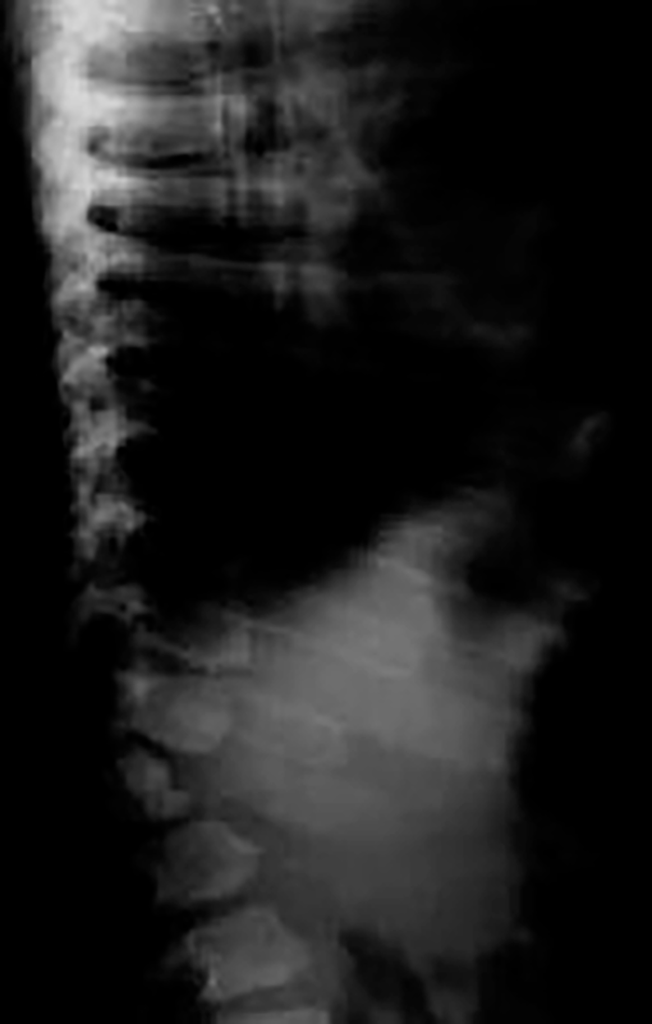
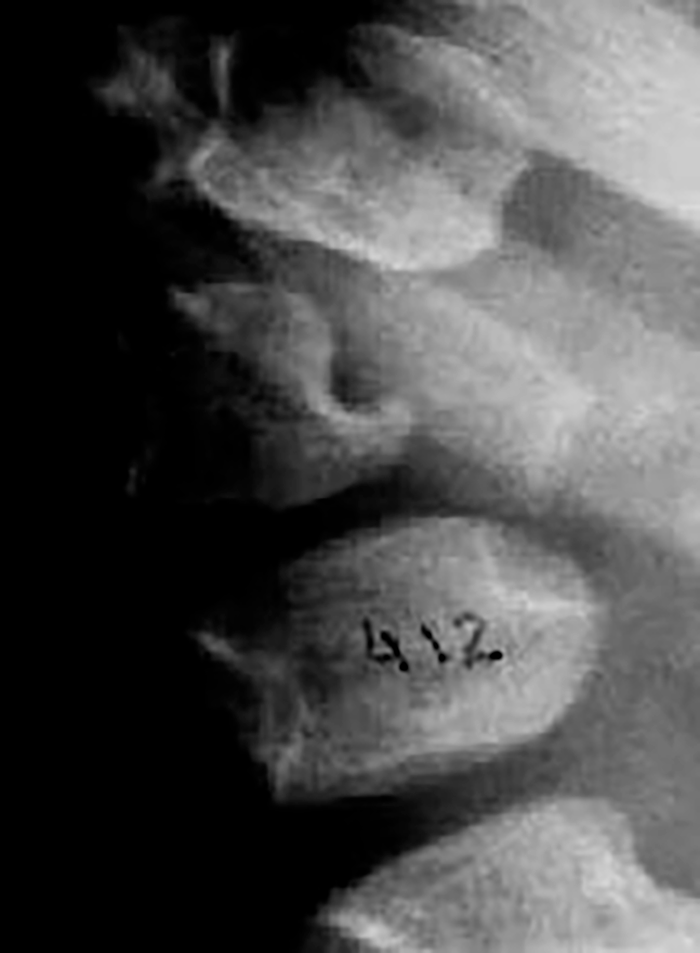
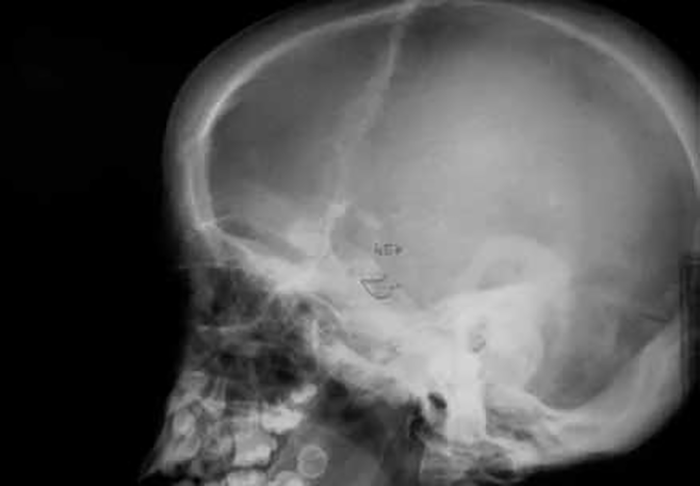
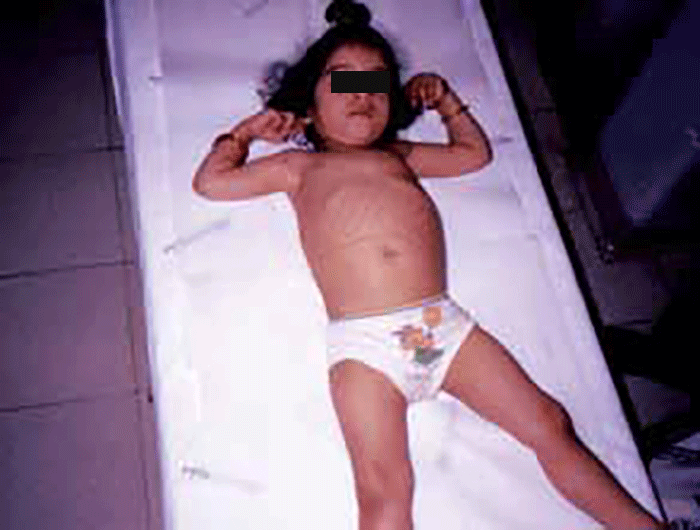
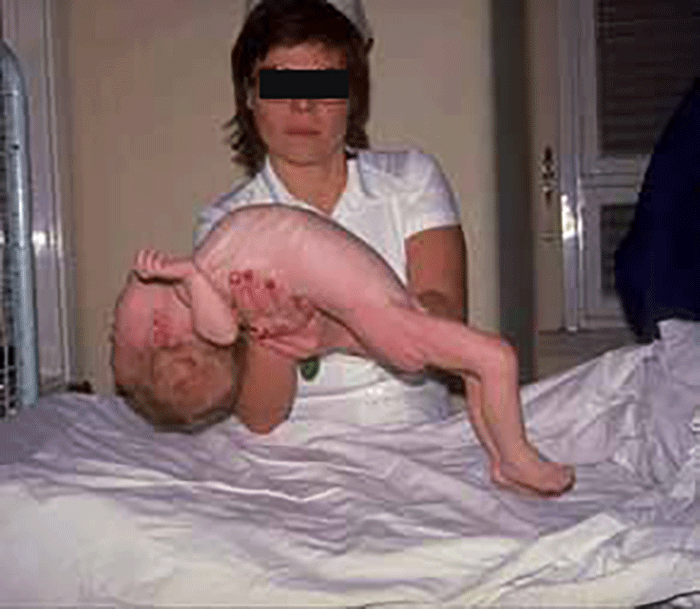
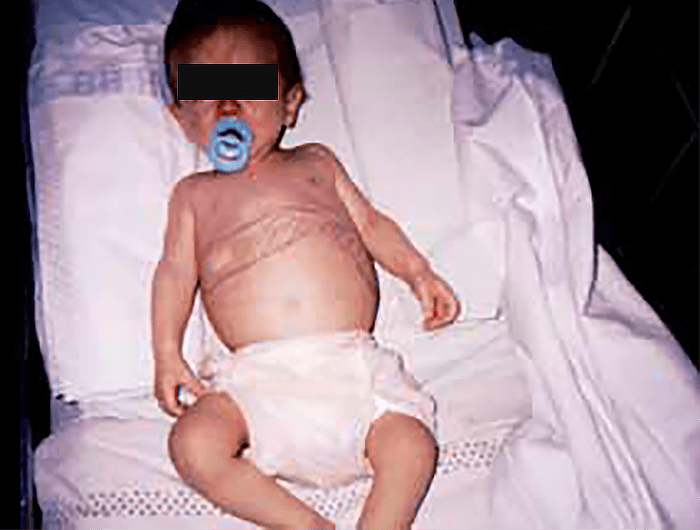
As manifestações clínicas na forma homozigótica, muito precoces, traduzem-se em aterosclerose prematura atingindo a aorta e coronárias desde a infância; outros sinais são xantomatose precoce [essencialmente xantomas tuberosos (Figura 6), não observáveis na forma heterozigótica e que podem ser notórios desde os primeiros anos de vida] nos tendões (designadamente do tendão de Aquiles), nas regiões palmares e na pele da superfície de extensão dos antebraços, pálpebras (xantelasma), etc.. Pode estar presente o arco corneano (gerontoxon), habitualmente antes dos 10 anos.
Há antecedentes de doença cardiovascular familiar prematura, designadamente com coronariopatia e enfarte do miocárdio nos progenitores e familiares jovens, com risco de morte súbita.
A etiopatogénese da doença pode ser determinada pela análise das mutações, e a gravidade, pelo estudo da actividade dos receptores de LDL em linfócitos.
Como se pode depreender, o prognóstico é reservado sem tratamento, o que compromete a sobrevivência até à idade adulta.
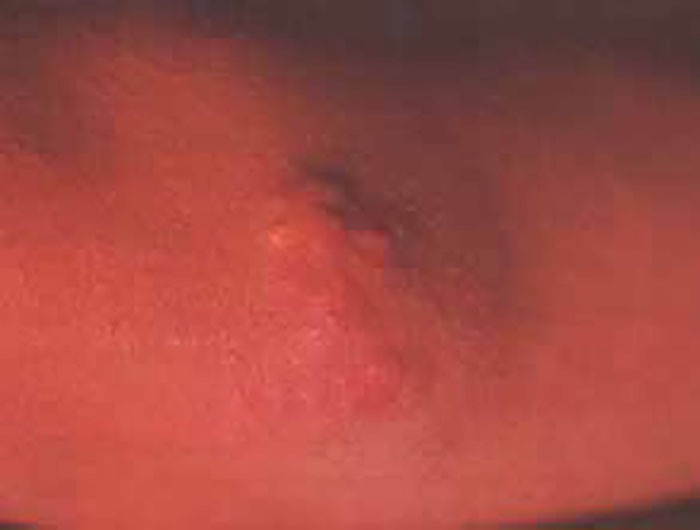
FIGURA 6. Xantomas no contexto de hipercolesterolémia familiar homozigótica. (NIHDE)
Forma heterozigótica
A HF heterozigótica é uma das mais frequentes formas de doença aterosclerótica com coronariopatia associada a mutações de um único gene.
A sua prevalência, oscilando entre 1/250 a 1/300 indivíduos (mais de 10 milhões em todo o mundo), explica mais de metade dos óbitos em indivíduos no Ocidente.
Salienta-se que a HF heterozigótica é um dos defeitos genéticos mais frequentemente observados na idade pediárica; em comparação, a sua frequência é muito superior à doutras afecções do foro genético como a fibrose quística (1/2.500) e doença falciforme (1/700).
Trata-se duma situação de hereditariedade co-dominante, com uma penetrância da ordem de 50% nos familiares em 1º grau de indivíduos afectados, e de 25% nos familiares em 2º grau. Na sua etiopatogénese interagem factores genéticos e ambientais, o que explica a variabilidade de expressão fenotípica entre povos de diferentes regiões do globo, traduzida pelos valores do colesterol-LDL (valor médio na China ~170 mg/dL e, no Canadá, ~290 mg/dL).
Podem verificar-se arco corneano, xantomas tendinosos ou xantelasma, em geral a partir da adolescência. Os sintomas de doença coronária iniciam-se pelos 45 anos no sexo masculino, e uma década mais tarde no sexo feminino.
No desconhecimento de antecedentes familiares/ eventuais casos familiares não diagnosticados e, sem estudo de genética molecular prévio, o diagnóstico provável de HF heterozigótica poderá ser admitido com base nas seguintes noções epidemiológicas: com valores de colesterolémia total ~310 mg/dL, sem antecedentes familiares em 1º grau, existe probabilidade de 4% de HF heterozigótica; havendo antecedentes familiares em 1º grau de HF, a probabilidade será já de 95%.
Nota importante: para confirmação do diagnóstico de HF, os valores de colesterol-LDL devem ser determinados pelo menos duas vezes no intervalo de 3 meses. |
Os aspectos fundamentais do tratamento das HF são abordados na parte final do capítulo, em alínea especial, integrando as entidades clínicas descritas.
Deficiência de Apo B-100 familiar
A deficiência de Apo B-100 familiar, com uma frequência aproximada de 1/700 nos indivíduos de cultura ocidental, é uma doença autossómica dominante, com características muito semelhantes às da HF heterozigótica, por vezes indistinguível desta.
Trata-se dum defeito estrutural em que a mutação de um gene leva a substituição de um aminoácido (glutamina por arginina) no codão 3500 da Apo B-100. De tal resulta redução da capacidade de ligação das LDL ao receptor, e elevação do colesterol-LDL, estando os triglicéridos em nível normal.
Somente foram descritas formas heterozigóticas a que correspondem situações clínicas de expressão semelhante à da HF heterozigótica: xantomas tendinosos e coronariopatia prematura.
Como na prática o perfil clínico e bioquímico, e atitude terapêutica semelhantes aos da HF heterozigótica, somente em estudos de investigação está indicada a destrinça por biologia molecular.
Sitosterolémia (ou fitosterolémia)
Esta dislipoproteinémia rara, autossómica recessiva, resulta de absorção excessiva de esteróis de plantas (sito ou fitosteróis) por mutações de genes responsáveis pelo respectivo sistema de transporte dependente de ATP (que limita a absorção no intestino delgado e promove a excreção biliar da parcela absorvida). O resultado é a elevação de colesterolémia, aparecimento de xantomas e aterosclerose prematura.
O diagnóstico faz-se pela determinação da colesterolémia e sitosterolémia, que são elevadas.
Hipercolesterolémia autossómica recessiva
Esta forma é muito rara, salientando-se a maior prevalência na ilha da Sardenha e no Líbano. A etiopatogénese relaciona-se com defeito do processo de internalização/ endocitose das LDL nos lisossomas, sem que a captação das LDL pelos receptores esteja comprometida; a consequência é a elevação sanguínea de LDL (níveis intermédios entre HF homo e heterozigótica).
A coronariopatia surge menos precocemente do que na HF homozigótica.
Hipercolesterolémia poligénica
A maioria dos casos de hipercolesterolémia (cerca de 85%) resulta de elevação primária de colesterol-LDL de causa poligénica, sendo que o papel de muitos genes com escassa influência no fenótipo é fortemente influenciado pelo ambiente (regime de sobrecarga alimentar).
Este tipo de hipercolesterolémia verifica-se em famílias que partilham estilos de vida comuns sem obedecerem ao padrão hereditário segundo o qual “ao defeito de um gene corresponde um defeito de lipoproteína”.
Hipercolesterolémia associada a hipertrigliceridémia
Compreende duas formas:
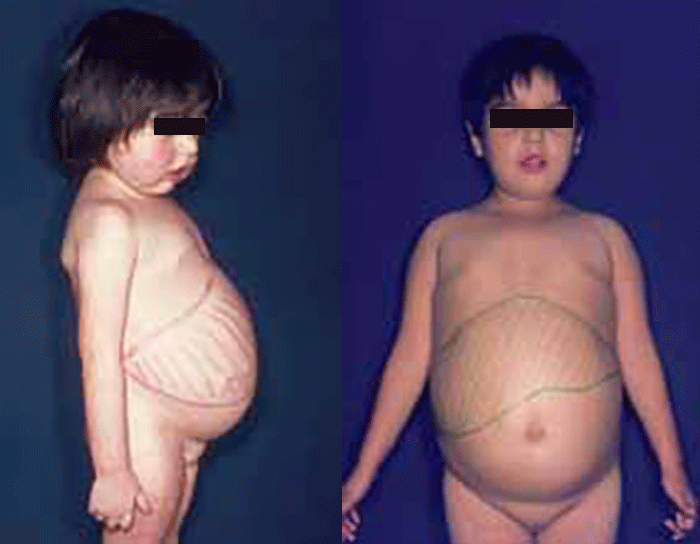
Hiperlipémia familiar combinada (HFC)
Trata-se duma situação AD – a mais frequente dislipoproteinémia surgindo na proporção ~1/200 – caracterizada por elevação moderada de colesterol-LDL e de triglicéridos, com diminuição do nível de colesterol-HDL. Embora não tenha sido descrito qualquer processo específico de aterogénese relacionado com esta forma clínica, em cerca de 20% dos indivíduos com doença coronária pelos 60 anos de idade verifica-se HFC.
O perfil clínico e bioquímico desta afecção pode traduzir-se do seguinte modo:
- História familiar de doença cardíaca prematura;
- C-LDL > percentil 90;
- C-LDL e trigliceridémia > percentil 90;
- Triglicéridos > percentil 90.
O diagnóstico de HFC implica que, em pelo menos dois familiares em 1º grau do caso a investigar, se verifique, no mínimo, 1 dos 3 parâmetros laboratoriais. Uma das características é a variação do fenótipo ao longo do tempo (dislipoproteinémia variável). Não surgem xantomas. A elevação de Apo B associada à detecção de pequenas partículas densas LDL suporta o diagnóstico.
Do quadro clínico da HFC em crianças e adultos faz parte a chamada síndroma metabólica que é sugerida pela verificação de adiposidade, hipertensão e hiperinsulinémia.
De acordo com o NCEP (National Cholesterol Education Program), a referida síndroma integra como componentes principais: obesidade abdominal, dislipidémia aterogénica, hipertensão arterial, resistência à insulina, com ou sem intolerância à glucose, evidência de inflamação vascular e hipercoagulabilidade. Estima-se que cerca de 30% dos indivíduos adultos com excesso de peso preenchem os critérios de diagnóstico de síndroma metabólica, incluindo 2/3 dos casos de HFC.
O mecanismo pelo qual a adiposidade visceral se associa a síndroma metabólica e a DM2 não está completamente esclarecido. Admite-se que a obesidade origina estresse ao nível do retículo endoplásmico, levando a supressão do receptor da insulina e resistência a esta.
Por outro lado, na HFC, a associação de hipertrigliceridémia a hipercolesterolémia confere risco aterogénico. Tal como foi referido a propósito da doença aterosclerótica, a acumulação de gordura intra-abdominal avaliada por RM (em investigação) constitui seguramente o marcador mais importante da adiposidade com risco aterogénico.
Disbetalipoproteinémia familiar (DBLF)/ Hiperlipoproteinémia tipo III
Esta doença rara, que surge com uma frequência ~1/10.000 indivíduos, é causada por mutações no gene da apo E; traduz-se por elevação de colesterol e triglicéridos com valor normal de HDL na sequência de exposição a factores ambientais tais como regime hipercalórico com elevado teor em gorduras e ingestão de álcool.
A expressão da doença é facilitada em presença de diabetes, obesidade, doença renal e hipotiroidismo.
Há uma acumulação de IDL evidenciada na electroforese pela existência de uma banda β e pré-β beta (broad beta). Recorda-se que os remanescentes são captados no fígado pelos receptores E e que o gene da Apo E polimórfica se expressa em 3 isoformas: Apo E3, Apo E2, e Apo E4; este último é o alelo “normal” presente na maioria da população.
Assim, as alterações moleculares da Apo E impedem a captação dos remanescentes. É o que se passa com a Apo E2 com uma capacidade de ligação ao receptor deficiente, ao contrário das Apo E3 e E4. Em cerca de 1% da população existe homozigotia para Apo E2/E2; a mutação mais comum é associada a DBLF, mas só se expressa a doença numa minoria de casos. Curiosamente, a homozigotia Apo E4/E4 predispõe para doença de Alzheimer.
Na adolescência e idade adulta, surgem xantomas tuberosos nos joelhos, cotovelos, nádegas, e coloração amarela nas pregas das palmas das mãos. Pela 4ª ou 5º década de vida surge quadro de doença aterosclerótica vascular periférica.
O diagnóstico é confirmado por electroforese – banda broad beta (ver atrás), discriminativa em 50% dos casos; e por determinação das VLDL por ultracentrifugação.
As ratio colesterol/ triglicéridos no soro < 3,0 e colesterol/ triglicéridos nas VLDL < 0,02 são indicações úteis, mas não conclusivas. A verificação do polimorfismo das Apo E constitui critério a favor da doença.
Hipertrigliceridémias
Este tópico inclui diversas dislipoproteinémias de gravidade e frequência diversas.
Quilomicronémia familiar/ Hiperlipoproteinémia tipos I ou V
Trata-se duma situação muito rara, AR (frequência ~1/1 milhão, explicada por mutação de um gene, do que resulta depuração defeituosa das lipoproteínas contendo Apo B. A deficiência ou ausência da lipoproteína lipase (LPL), ou do seu cofactor apoC-II que facilita a lipólise pela LPL, origina: aumento de quilomicron (tipo I) ou; aumento de QM e de triglicéridos/VLDL (tipo V). Os níveis de C-HDL estão diminuídos.
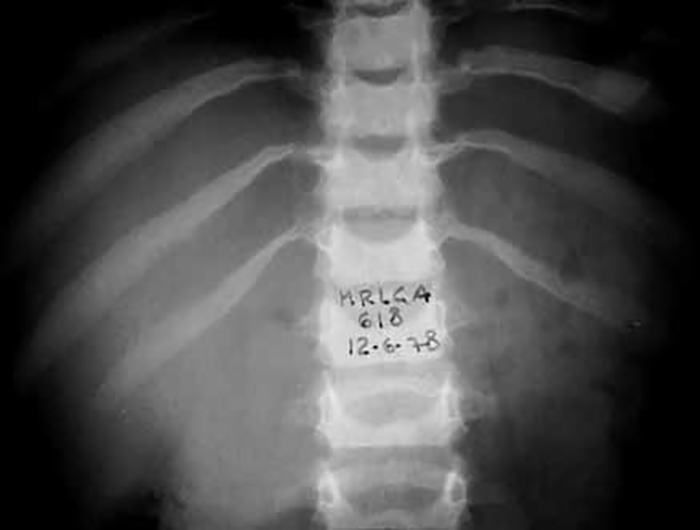
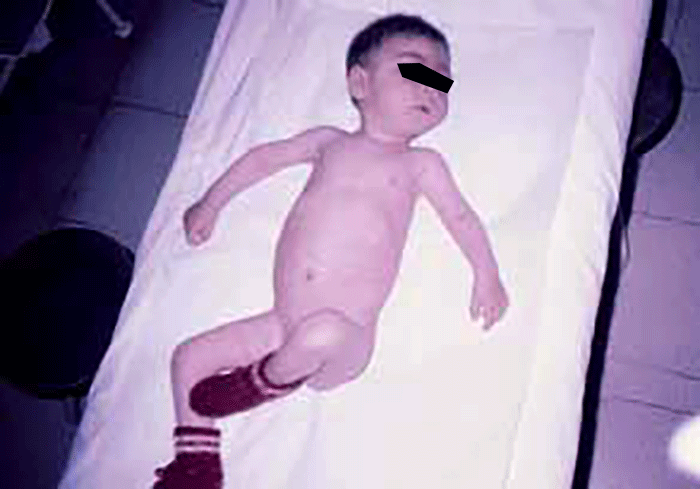
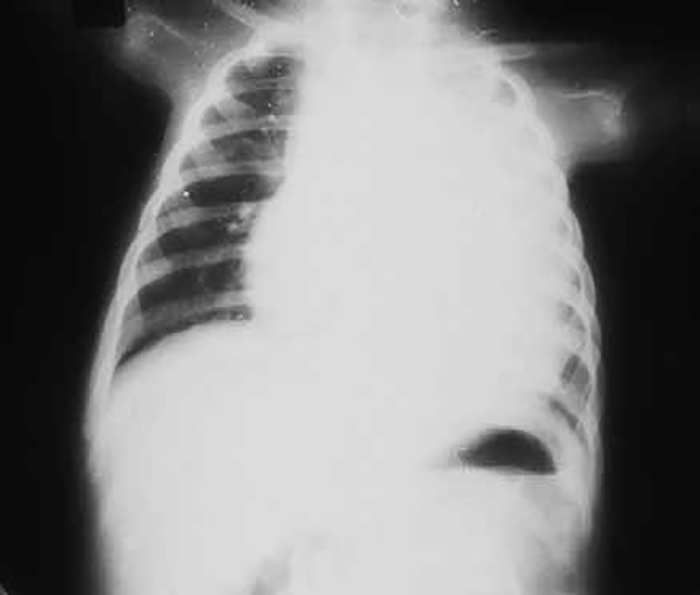
A testemunhar o excesso de Qm por depuração defeituosa (no tipo I) está o aspecto do soro após 24 horas de repouso a +4ºC: sobrenadante leitoso ou cremoso num soro límpido (Figura 7). No tipo V, o aspecto do soro é diverso: sobrenadante cremoso devido aos Qm, e infranadante turvo devido às VLDL.
De salientar que a quilomicronémia causada por deficiência de LPL está associada a hipertrigliceridémia mais modesta do que a relacionada com ausência ou carência de Apo C-II.
Um dos quadros de apresentação clínica é o de dores abdominais recorrentes e de pancreatite aguda. Pode verificar-se hepatosplenomegália e xantomatose eruptiva com as localizações habituais já referidas a propósito doutras dislipoproteinémias. Não existe risco aterogénico.

FIGURA 7. Soro de criança com hiperlipoproteinémia do tipo I.
Hipertrigliceridémia familiar (HTGF)/ Hiperlipoproteinémia tipo IV
A HTGF é uma doença AD de etiologia desconhecida, ocorrendo com uma frequência ~1/500 indivíduos. Traduz-se por elevação dos triglicéridos (> percentil 90, em geral entre 500 e 1.000 mg/dL); pode ser acompanhada por elevação ligeira do colesterol total com C-HDL baixo. De acordo com a experiência de vários centros, somente em cerca de 20% dos casos as manifestações surgem na idade pediátrica; ao contrário da HFC, não parece ser significativamente aterogénica (não se verifica o desenvolvimento de xantomas, nomeadamente).
As suas causas não são uniformes, pelo que não se trata de um grupo homogéneo de dislipoproteinémias. Fundamentalmente, a etiopatogénese pode relacionar-se com:
- Síntese aumentada de VLDL, devida provavelmente a uma resistência periférica à insulina, com hiperinsulinismo secundário; esta modalidade encontra-se associada a síndroma metabólica (ver atrás-HFC);
- Diminuição da destruição das VLDL, provavelmente por carência em Apo C-II, ou pela existência de variantes desta apoproteína.
Para o diagnóstico torna-se essencial que haja, pelo menos, um familiar em 1º grau com hipertrigliceridémia; o diagnóstico diferencial faz-se com a HFC e com a DBLF.
Nota: em geral, os valores de trigliceridémia na hiperlipoproteinémia de tipo V são muito superiores (> 1.000 mg/dL) aos dos verificados na HTGF.
Deficiência de lipase hepática
Esta afecção, muito rara, AR, resultante de défice de lipase hepática (LH) traduz-se por elevação de colesterol e de triglicéridos no plasma, em geral associada a elevação de c-HDL.
Recorda-se, a propósito, que a LH hidrolisa os triglicéridos e fosfolípidos em VLDL remanescentes e IDL, impedindo a conversão em LDL. A confirmação diagnóstica consiste em medir a actividade da LH em plasma heparinizado.
Antes da análise doutras dislipoproteinémias não necessariamente hiperlipémicas ou até normolipémicas, na perspectiva do diagnóstico diferencial, importa para o clínico a lista das principais hiperlipidémias secundárias, não hereditárias, em que deve ser considerado igualmente risco aterogénico (ver atrás- Quadro 2).
Alterações do metabolismo das HDL
Hipoalfalipoproteinémia primária
Esta dislipoproteinémia, a mais comum alteração do metabolismo das HDL e muitas vezes ocorrendo segundo o modo de transmissão AD, pode surgir na ausência de história familiar.
Define-se pelo padrão biológico: colesterolémia-HDL baixa (< percentil 10 para o género e idade) associada a C-LDL e trigliceridémia normais.
A etiopatogénese relaciona-se com diminuição da síntese de Apo A-I e aumento do catabolismo de HDL. Desconhecendo-se, com os dados disponíveis, o papel da doença na aterogénese, impõe-se o diagnóstico diferencial com outras afecções, como deficiência de LCAT, doença de Tangier e síndroma metabólica.
Hiperalfalipoproteinémia familiar
Trata-se duma situação rara que diminui o risco de aterosclerose e de coronariopatia, e probabilidade de sobrevida aumentada. Os níveis de colesterol-HDL excedem 80 mg/dL.
Défice da proteína de transferência colesterol-éster
A etiopatogénese relaciona-se com deficiência da proteína de transferência colesterol-éster (CETP) por mutações no respectivo gene localizado no cromossoma 16Y21. Tal facto traduz-se fundamentalmente numa desregulação do processo de transporte do colesterol para o fígado e ulterior excreção pela bílis. Na forma homozigótica (mais frequente no Japão), os valores de C-HDL poderão ser > 150 mg/dL.
Deficiência familiar de Apo A-I
Surge como resultado de mutações no gene da Apo A-I, determinando valores baixos ou vestigiais de HDL. Como consequência surge um quadro de gravidade variável em função das referidas mutações, caracterizado na maioria dos casos, por aterosclerose prematura, xantomatose, opacidade corneana e, ocasionalmente, associação a amiloidose.
O perfil laboratorial inclui diminuição de C-HDL e de Apo A-I no plasma.
Doença de Tangier
É uma doença autossómica co-dominante em que os valores de C-HDL são inferiores a 5 mg/dL. A etiopatogénese relaciona-se com mutações no gene ABCA1 de uma proteína implicada na ligação do colesterol celular à Apo A-I. A consequência é a acumulação de colesterol livre no SER, traduzida clinicamente pelos seguintes sinais e sintomas: neuropatia periférica intermitente, hepatosplenomegália, hipertrofia amigdalina com coloração alaranjada por acumulação de colesterol nas células de Schwann.
Deficiência de lecitina-colesterol aciltransferase familiar (LCAT)/ Doença fish-eye
A etiopatogénese desta doença rara relaciona-se com mutações nos genes que expressam a LCAT com deficiência total ou parcial desta enzima. Tal interfere com o processo de esterificação do colesterol e impede a formação de partículas de HDL e promove catabolismo de Apo A-I. Clinicamente verifica-se opacificação corneana (dado isolado na forma clínica designada por doença eye fish, em que a deficiência é parcial), anemia hemolítica e insuficiência renal progressiva a partir da adolescência e adultícia. Admite-se que não é aterogénica.
Para confirmação diagnóstica, os exames laboratoriais evidenciam diminuição de c-HDL, de Apo A-I, aumento de triglicéridos e relação colesterol livre/ colesterol total > 0,7.
Hipocolesterolémias
As situações associadas a alterações do metabolismo do colesterol intracelular das lipoproteínas com Apo B acompanham-se de hipocolesterolémia.
Abetalipoproteinémia
Esta anomalia rara, AR, origina-se por mutações no gene que codifica uma proteína microssómica de transporte de triglicéridos para o retículo endoplásmico, a qual é deficiente; como consequência, há produção deficiente de lipoproteínas contendo Apo B, necessárias para a transferência de lípidos no intestino delgado para as Qm nascentes e, no fígado, para as VLDL.
As manifestações clínicas incluem má absorção de gorduras com diarreia, carência de vitamina E, hipocrescimento, e sinais neurológicos (degenerescência espinocelular, hiporreflexia, ataxia, espasticidade na idade adulta, retinite pigmentar). Muitos dos sinais são o resultado de má absorção de vitaminas lipossolúveis. Os sinais neurológicos implicam o diagnóstico diferencial com a ataxia de Friedreich.
O perfil laboratorial inclui: ausência de Qm, VLDL, LDL e Apo B, com valores baixos de colesterol e triglicéridos; e disfunção eritrocitária (acantocitose).
Hipobetalipoproteinémia familiar
Esta doença familiar autossómica co-dominante, relacionada com mutações no gene que codifica a síntese de Apo B-100, na forma homozigótica evidencia sintomatologia semelhante à da abetalipoproteinémia.
Distingue-se da abetalipoproteinémia pelo facto de os progenitores heterozigóticos nos casos da doença em epígrafe evidenciarem diminuição do colesterol-LDL, de triglicéridos e de Apo B.
Doença de Anderson
Esta doença, com fenótipo sobreponível aos da abetalipoproteinémia e hipobetalipoproteinémia homozigótica, deve-se à incapacidade de secreção de Apo B-48 no intestino delgado.
A não absorção de Qm origina esteatorreia e carência de vitaminas lipossolúveis. O perfil bioquímico evidencia valor sanguíneo normal de Apo B-100 como resultado da sua secreção normal pelo hepatócito.
Síndroma de Smith-Lemli-Opitz (SSLO)
A etiopatogénese desta síndroma rara (incidência oscilando entre 1/20.000 – 1/60.000 RN caucasianos) está relacionada com mutações no gene DHCR7, do que resulta deficiência da enzima microssómica DHCR7 (7-di-hidrocolesterol redutase), a qual se traduz em défice da síntese de colesterol na sua fase final.
Desconhece-se até que ponto a síntese deficitária de colesterol poderá contribuir para a patogénese de defeitos congénitos, embora se conheça o papel importante da mielina no neurodesenvolvimento.
Recorda-se que as manifestações clínicas da SSLO integram em mais de metade dos casos anomalias craniofaciais, esqueléticas, genitais e do desenvolvimento; ao nível dos órgãos internos, podem estar afectados o SNC (holoprosencefalia, agenésia do corpo caloso, etc.), o sistema cardiovascular (canal atrioventricular, etc.), o tracto urinário (hipoplasia ou aplasia renal, etc.), tubo digestivo (doença de Hirschprung, etc.), sistema respiratório (hipoplasia pulmonar, anomalia dos lobos), sistema endócrino (insuficiência suprarrenal, etc.) e sindactilia cutânea (2º – 3º dedos do pé > 97%).
Nos casos de colesterolémia inferior a 20 mg/dL, a sobrevivência é improvável. O diagnóstico definitivo pode ser levado a cabo através da identificação de precursores do colesterol através da técnica de cromatografia gasosa e da análise mutacional.
Alterações do metabolismo intracelular do colesterol
Recorda-se que os ácidos biliares, sintetizados no fígado a partir do colesterol, são essenciais para a absorção lipídica no intestino, regulam a síntese do colesterol hepático e são necessários para a produção adequada de bílis.
Xantomatose cerebrotendinosa
Esta doença AR pode manifestar-se no RN como icterícia colestática (hepatite autolimitada). Em geral surge sintomatologia no fim da adolescência: inicialmente insuficiência mental, seguindo-se cataratas e deterioração neurológica progressiva, diarreia e aparecimento de xantomas tendinosos pelos 20-40 casos.
Outro dado clínico é o aparecimento de aterosclerose prematura podendo levar à morte por enfarte do miocárdio.
Segundo alguns autores, incluída no capítulo sobre perturbações da síntese dos ácidos biliares por mutação de gene, a referida xantomatose resulta em défice da enzima esterol-27 hidroxilase, necessário para a síntese mitocondrial de ácidos biliares no fígado. O resultado é a acumulação de colestanol e colesterol, sobretudo no sistema nervoso.
O diagnóstico faz-se pela demonstração de colestanol (e, por vezes, colesterol) elevado no plasma, assim como de álcoois biliares específicos na urina, também elevados. A deficiência enzimática pode demonstrar-se em fibroblastos; em certas populações, a análise de ADN pode ser um método rápido de diagnóstico.
Doença de Wolman
De transmissão AR, deve-se à falta da lipase ácida lisossómica, com consequente acumulação de ésteres de colesterol nas células por falência de hidrólise (doença de armazenamento).
As manifestações clínicas incluem hepatosplenomegália, esteatorreia, hipocrescimento; a morte surge em geral antes do 1 ano. O prognóstico é muito reservado (fatal).
Doença de Niemann-Pick tipo C
Trata-se duma esfingolipidose (doença AR) caracterizada pela acumulação de colesterol e esfingomielina no SNC e SRE. É devida, não a deficiência enzimática do lisossoma ou do seu co-factor, mas a defeito do tráfico de lípidos (perturbação da saída do colesterol do lisossoma, com consequente depósito de esfingomielina).
O prognóstico é reservado, com morte durante a 2ª infância ou adolescência.
Actualmente, é possível o tratamento com miglustat evidenciando resultados promissores.
Nota: os tipos A e B desta doença dos organelos foram tratados no capítulo sobre doenças do metabolismo dos organelos, incluído nesta Parte do livro.
Hiperlipoproteinémia (a) [Lp(a)]
A lipoproteína (a) [Lp(a)] tem constituição lipídica muito semelhante à das LDL. Identificada em 1963, o seu metabolismo não está completamente esclarecido na actualidade.
Contém uma molécula de apolipoproteína B-100 (como todas as LDL) ligada à apoproteína (a). Ou seja, é um tipo de LDL em que há adição doutra molécula, a Apo(a), o que lhe confere diferentes características e funções. Por sua vez, a estrutura molecular da Apo(a) é muito semelhante à do plasminogénio, uma proteína fundamental no processo de fibrinólise. Por outro lado, é mais aterogénica do que a LDL pelas suas propriedades pró- inflamatórias e pró-trombogénicas.
O gene da Apo(a), designado por LPA, localiza-se no cromossoma 6 e apresenta vários polimorfismos que determinam a concentração de Lp(a) no sangue. É reconhecida pelos receptores para Apo B e Apo E (receptores BE).
Demonstrou-se que existe uma relação inversa entre o tamanho da Apo(a) e os níveis sanguíneos ou plasmáticos da Lp(a) avaliados por métodos imunoquímicos.
Admite-se que concentrações de Lp(a) superiores a 50 mg/dL sejam relacionados com factores hereditários e comportem risco elevado de doença cardiovascular aterosclerótica prematura nalgumas famílias. Trata-se dum factor de risco independente.
O Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents da AHA (USA) não recomenda a determinação dos níveis de Lp(a) como rotina nos rastreios em jovens, excepto nos casos de antecedentes AVC isquémico ou hemorrágico não explicável pelos factores de risco clássicos.
A niacina constitui o único tratamento susceptível de promover diminuição dos valores de Lp(a). Desconhece-se se a diminuição dos níveis elevados de Lp(a) contribui para prevenir futura ou recorrente doença cardiovascular.
Avaliação do risco e tratamento das hiperlipidémias
Avaliação do risco associado
Em todas as crianças e jovens com dislipidémia devem ser avaliados os níveis de risco (risco elevado e risco moderado) em função de determinados parâmetros associados, o que tem implicações nas estratégias de actuação:
- Risco elevado: hipertensão arterial/HTA requerendo tratamento com fármacos (PA > percentil 99 + 5 mmHg), hábitos tabágicos, IMC > percentil 97, diabetes mellitus dos tipos 1 ou 2, doença renal crónica, status pós-transplante cardíaco e/ou pós-Kawasaki com aneurismas;
- Risco moderado: HTA não requerendo tratamento com fármacos, IMC entre percentis 95 e 97, colesterol-HDL < 40 mg/dL, status pós-Kawasaki sem aneurismas, doença inflamatória crónica, infecção por VIH, síndroma nefrótica.
A intervenção terapêutica propriamente dita compreende medidas gerais (algumas já referidas a propósito da doença aterosclerótica) dirigidas predominantemente às situações acompanhadas de hipercolesterolémia) e farmacoterapia.
Medidas gerais
- Modificação do estilo de vida e exercício físico mantidos, como prioridade
Este procedimento (idealmente a aplicar em toda e qualquer criança ou jovem saudável, sem dislipidémia), deverá ter lugar, durante pelo menos 6 meses, antes de outras medidas a aplicar eventualmente. - Regime alimentar
Fazendo parte do estilo de vida saudável e considerando o parâmetro percentagem do valor calórico total para a quantificação do suprimento alimentar, nas situações de dislipidémia, tal medida diz respeito:- à redução do suprimento em gorduras: inferior a 30% (sendo gorduras saturadas inferior a 7-10%, poli-insaturadas 10% e mono-insaturadas 10-15 %),
- à ingestão de alimentos com teor de colesterol inferior a 200-300 mg/dia,
- ao incremento da ingestão de hidratos de carbono (50-60%, aumentando o teor em hidratos de carbono complexos e reduzindo o teor de açúcares) e de proteínas (15-20%).
A restrição dietética somente deverá ser posta em prática em crianças com mais de dois anos, exceptuando nos casos de HF homozigótica (e ponderada nas formas heterozigóticas).
O regime deverá igualmente ter suprimento rico em fibras, frutos e vegetais.
Relativamente ao suprimento em fibras solúveis, o mesmo deve ser calculado em gramas (gramas a administrar = idade em anos + 5 a 10 até à idade de 15 anos) até máximo de 25 gramas por dia). Com esta estratégia é possível a diminuição da colesterolémia em cerca de 10-15%. - Exames clínicos planeados
A avaliação clínica global periódica, incluindo a do peso e altura para determinação do IMC (índice de massa corporal) é fundamental, designadamente nos casos associados a hipertrigliceridémia, com tendência para obesidade.
Farmacoterapia
De acordo com as recomendações gerais do NCEP/USA (National Cholesterol Education Program) o tratamento farmacológico das hiperlipémias está indicado nas crianças com idade de 10 anos ou superior, após período mínimo de 6 meses de regime alimentar dietético e de mudança para estilo de vida mais saudável sem terem sido atingidos os objectivos terapêuticos.
Assim, para além das medidas gerais – que deverão continuar – deve ser considerada a administração de fármacos nas seguintes circunstâncias:
- manutenção do colesterol-LDL > 190 mg/dL;
- manutenção do colesterol-LDL > 160 mg/dL associado a 1 ou mais factores de risco elevado e/ou a 2 ou mais factores de risco moderado;
- manutenção do colesterol-LDL > 130 mg/dL associado a 2 ou mais factores de risco elevado; ou a 1 factor de risco elevado + 2 ou mais factores de risco moderado, ou evidência de coronariopatia.
Estas normas, que têm vigorado ao longo de mais de 20 anos com algumas modificações, baseiam-se na probabilidade estatística de o caso em questão poder corresponder a uma forma hereditária de dislipoproteinémia, tal como HF. A idade de 10 anos foi seleccionada por corresponder à idade em que se tem verificado, em estudos, a formação das estrias gordas nas artérias coronárias e aorta.
De acordo com os peritos do NCEP, está previsto que, em casos específicos, correspondendo a valores muito elevados de colesterol, a terapêutica com fármacos possa ser antecipada.
Assim, por exemplo, a partir dos 3-4 anos poderão utilizar-se resinas fixadoras de ácidos biliares, como a colestiramina (entre 4-32 gramas/dia) em duas tomas ou o colestipol (5-40 gramas/dia), associados ao ácido fólico (5 mg 1 vez por semana).
Com a utilização de fármacos, é possível redução dos valores da colesterolémia cerca de 30%.
Não está indicada a intervenção farmacológica nos casos de hipertrigliceridémia isolada, devendo ser ponderada se os valores de triglicéridos ultrapassarem > 1.000 mg/dL no período pós-prandial pelo risco de pancreatite.
Os principais fármacos a utilizar no contexto das dislipoproteinémias em geral distribuem-se pelos seguintes grupos (Quadro 3):
QUADRO 3 – Farmacoterapia nas dislipoproteinémias.
| Estatinas (Inibidores da HMG-CoA redutase): diminuem a síntese do colesterol e de VLDL; indicadas perante elevação das LDL; dose iniciais entre 5 e 80 mg/dia |
| Resinas fixadoras de ácidos biliares (colestiramina e colestipol): estimulam a função dos receptores hepáticos de LDL e a excreção biliar; indicadas perante elevação de LDL; doses iniciais entre 4 e 40 mg/dia |
| Ácido nicotínico/Niacina: diminui a síntese das VLDL hepáticas; indicado perante elevação de TG e LDL; diminuição de Lp(a); doses iniciais – 100-2000 mg 3x/dia |
| Fibratos/Gemfibroxil: estimulam a LPL e diminuem as VLDL; indicados perante elevação de TG; doses iniciais de 600 mg 2x/dia |
| Óleos de peixe: diminuem a produção de VLDL; indicados perante elevação de TG; doses iniciais entre 3 e 10 g/dia |
| Inibidores da absorção do colesterol/Exetimibe: diminuem a absorção do colesterol; indicados perante elevação das LDL; doses iniciais de 10 mg/dia |
| Inibidores da PCSK9/Inclisiran: promovem maior captação de LDL pelos seus respectivos receptores nos hepatócitos, com redução dos níveis de LDL. (*) |
(*) A PCSK9 é uma proteína que promove a degradação de receptores hepáticos de LDL, levando à hipercolesterolémia. Os inibidores dessa proteína (anticorpos monoclonais) aumentam a disponibilidade dos receptores de LDL. Quando a PCSK9 é inibida, ocorre uma maior captação de LDL pelos respectivos receptores presentes nos hepatócitos, com redução de níveis séricos e plasmáticos de LDL. |
Medidas específicas
Para além das medidas gerais explanadas antes e a aplicar em todas as situações de dislipoproteinémias em geral, são especificadas outras medidas a aplicar nas doenças descritas.
Hipercolesterolémia familiar homozigótica
- Aférese das LDL.
- Inibição da HMG CoA redutase com estatinas, eventualmente associadas a ezetimibe como forma de bloqueio da absorção intestinal do colesterol ou a resinas fixadoras de ácidos biliares como a colestiramina ou o colestipol.
- Transplante hepático, ponderando as complicações associadas.
- Terapêutica génica.
Hipercolesterolémia familiar heterozigótica e deficiência de Apo B-100 familiar
- Inibição da HMG CoA redutase com estatinas, eventualmente associadas a ezetimibe como forma de bloqueio da absorção intestinal do colesterol, ou a resinas fixadoras de ácidos biliares como a colestiramina ou o colestipol.
Na idade pediátrica há estudos que demonstram maior eficácia da colestiramina e colestipol em comparação com ezetmibe.
- Inibição da PCSK9 (pró-proteína convertase subtilisina/kexina tipo 9) como forma de promover uma maior captação de LDL pelos respectivos receptores presentes nos hepatócitos, com redução de níveis séricos e plasmáticos de LDL. Com os inibidores de PCSK9 (PCSK9i) consegue-se promover uma redução adicional podendo atingir 60% nos níveis de LDL em comparação com as estatinas.
Hipercolesterolémia autossómica recessiva
- Inibição da HMG CoA redutase com estatinas, com resposta escassa.
Sitosterolémia
- Ezetimibe ou resinas fixadoras de ácidos biliares (colestiramina ou colestipol)
Nota: as estatinas são ineficazes.
Hipercolesterolémia poligénica
- Têm cabimento as medidas gerais, eficazes. A farmacoterapia é raramente necessária.
Hiperlipémia familiar combinada (HFC)
- Nos casos de C-LDL > 160 mg/dL, deverá ser considerada a farmacoterapia.
Disbetalipoproteinémia familiar (DBLF)
- Embora as medidas gerais sejam suficientemente eficazes, a alternativa é a associação a farmacoterapia (estatinas, ácido nicotínico e fibratos).
Quilomicronémia familiar
- Reforçando-se a noção de as medidas gerais incluírem suplemento de vitaminas lipossolúveis, nesta doença estão indicados óleos de peixe ou TCM, estes últimos absorvidos directamente para o sistema venoso porta. Há que evitar administração hormonal (esteróides, estrogénios), a qual é agravante.
Hipertrigliceridémia familiar (HTGF)
- Tal como foi referido em Medidas Gerais, apenas está indicada farmacoterapia (fibratos, nicotinamida, óleo de peixe) se os valores de TG ultrapassarem 1.000 mg/dL, pelo risco de pancreatite.
Alterações do metabolismo das HDL
- O tratamento é sintomático, devendo evitar-se outros factores de risco de aterosclerose.
Hipocolesterolémias
- Na abetalipoproteinémia está indicado o suplemento precoce com vitamina E (100 mg/kg/dia), assim como com outras vitaminas lipossolúveis A, D e K por via IM.
- Na síndroma de Smith-Lemli-Opitz (SSLO), para além do tratamento sintomático geral, está indicada alimentação com elevado teor em colesterol (por ex. incluindo colesterol liofilizado e gema de ovo) e a administração de estatinas para prevenir a síntese de precursores tóxicos formados a montante do bloqueio enzimático; nesta circunstância, os resultados são contraditórios.
Alterações do metabolismo intracelular do colesterol
- Na xantomatose cerebrotendinosa, o tratamento precoce com ácido chenodeoxicólico reduz os níveis de colesterol e previne o surgimento de sintomas.
Hiperlipoproteinémia (a)
- Perante antecedentes de AVC na criança e jovem e elevação do teor em Lp(a) está indicada a niacina/ácido nicotínico (ver atrás).
BIBLIOGRAFIA
Austin MA, Hutter CH, Zimmern RL, e tal. Familial hypercholesterolemia and coronary heart disease: a huge association review. Am J Epidemiol 2004;160:421-429
Barlow SE, Turer CB. Lipid screening and treatment practices conflict with conflicting recommendations: where do we go from here? J Pediatr 2017;185:16-18
Chang Y, Robidoux J. Dyslipidemia management update. Curr Opin Pharmacol 2017;33:47-55
Crombez E, Koch R, Cederbaum S. Pitfalls in newborn screening. J Pediatr 2007;147:119-120
De Ferranti SD, Rodday AM, Parsons SK, et al. Cholesterol screening and treatment practices and preferences: a survey of United States practices. J Pediatr 2017;185:16-18
Eissa MA, Mihalopoulos NL, Holubkov R, et al. Changes in fasting lipids during puberty. J Pediatr 2016;170:199-205
El-Hattab AW, AlmannAi M, Sutton VR. Newborn screening, current status and future directions. Pediatr Clin N Am 2018;65:389-392
Ghosh A, Morris AAM. Acute presentations of inherited metabolic disorders: investigation and initial management. Paediatr Child Health 2019;29:99-104
Girardet JP, Chouraqui JP, Darmaun D, et al. Hypercholesterolemia in children: why and how to screen for it? Arch Pediatr 2018;25:175-176
Haas D, Kelley RI, Hoffman GF. Inherited disorders of choleterol biosynthesis. Neuropediatrics 2001;32:113-122
Kavey R-EW, Daniels SR, Lauer RM, Atkins DL, Hayman LL, Taubert K. American Heart Association for primary prevention of atherosclerotic cardiovascular disease beginning in childhood. Circulation 2003;107:1562-1566
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Korenev S, Lemonde H, Cleary M, et al. Newborn screening for inborn errors of metabolism. Paediatr Child Health 2019;29:105-110
Kostner KM, Marz W, Kostner GM. When should we measure lipoprotein (a)? Eur Heart J 2013;34:3268-3276. doi: 10.1093/eurheartj/eht053.Epub 2013 Jun 4
Kwiterovich PO. Diagnosis and management of familial dyslipoproteinemia in children and adolescents. Pediatr Clin North Am 1990;37:1489-1523
Lee PJ. The management of familial hypercholesterolaemia in childhood. Current Paediatrics 2002;12:104-109
Leren T. Cascade genetic screening for familial hypercholesterolemia. Clin Genet 2004;66:483-487
Lozano P, Henrikson NB, Morrison CC, et al. Lipid screening in childhood and adolescence for detection of multifactorial dyslipidemia: evidence report and systematic review for the US Preventive Services Task Force. JAMA 2016;316:634-644
Macchiaiolo M, Gagliardi MG, Toscano A, et al. Homozygous familial hypercholesterolaemia. Lancet 2012;379:1330-1333
McCrindle BW, Ose L, Marais D. Efficacity and safety of atorvastain in chlidren and adolescents with familial hypercholesterolemia or severe hyperlipidemia: a multicenter, randomized, placebo-controlled trial. J Pediatr 2003;142:74-80
McNeal CJ. Lipoprotein(a): Its relevance to the pediatric population. J Clin Lipidol 2015;9(5 Suppl):S57-66. doi: 10.1016/j.jacl.2015.07.006.Epub 2015 Jul 21
McNeal CJ, Peterson AL. Lipoprotein(a) in youth. Endotext [Internet]. South Dartmouth/MA, USA, 2020. www.endotext. org
Michos ED, McEvoy JW, Blumenthal RS. Lipid management for the prevention of atherosclerotic cardiovascular disease. NEJM 2019;381:1557-1567. DOI: 10.1056/NEJMra1806939
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Newnham JP, Ross MG (eds). Early Life Origins of Human Health and Disease. Basel: Karger, 2009
Padeira GL, Ferreira AC. Hipercolesterolémia familiar em crianças e adolescentes. Resumo do consenso da European Atherosclerosis Society (2015). Notas de Pediatria 2019;(4):59- 63. Hospital de Dona Estefânia, Lisboa
Pang J, Martin AC, Mori TA, et al. Prevalence of familial hypercholesterolemia in adolescents: potential value of universal screening? J Pediatr 2016;170:315-316
Raal FJ, Kallend D, Ray KK, et al. Inclisiran for the treatment of heterozygous familial hypercholesterolemia. NEJM 2020;382:1521-1530
Raitakari OT. Arterial abnormalities in children with familial hypercholesterolemia. Lancet 2004;363:342- 343
Ramaswami U, Humphries SE. Familial hypercholesterolaemia: what’s new? Paediatr Child Health 2019;29:127-136
Ramaswami U, Humphries SE. Management of familial hypercholesterolaemia in childhood. Curr Opin Pediatr 2020;32:633-640. DOI: 10.1097/MOP.0000000000000943
Sabatie MS, Giugliano RP, Keech AC, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. NEJM 2017;376:1713-1722
Saudubray JM, Garcia – Cazorla A. Inborn errors of metabolism overview: pathophysiology, manifestations, evaluation and management. Pediatr Clin N Am 2018;65:179-208
Stewart J, McCallin T, Martinez J, et al. Hyperlipidemia. Pediatr Rev 2020;41:393-402
Therrell BL, Padilla CD. Newborn screening in the developing countries. Curr Opin Pediatr 2018;30:734-739
Urbina EM, de Ferranti SD. Lipid screening in children and adolescents. JAMA 2016;316:589-591
Vaz FM, Pras-Raves M, Bootsman AH, et al. Principles and practice of lipidomics. J Inherit Metab Dis 2015;38:41-52
Villoria JG, Pajares S, Lopez RM, et al. Neonatal screening for inherited metabolic diseases in 2016. Semin Pediatr Neurol 2016;23:257-272
Wald DS, Bestwick JP, Morris JK, et al. Child-parent familial hypercholesterolemia screening in primary care. N Engl J Med 2016;375:1628-1637
Wechsler LR. Statins and stroke – It’s complicated. NEJM 2020;382:81-82.
Wilson DP, Jacobson TA, Jones PH, et al. Use of Lipoprotein(a) in clinical practice: A biomarker whose time has come. A scientific statement from the National Lipid Association. J Clin Lipidol 2019; 13: 374-392. doi: 10.1016/j.jacl.2019.04.010. Epub 2019 May 17
Wong B, Kruse G, Kutikova L, et al. Cardiovascular disease risk associated with familial hypercholesterolemia. Clin Ther 2016;38:1696-1709