Tratamento
Apesar dos recentes avanços, o tratamento definitivo ou curativo na maioria das afecções que atingem o cérebro ainda não é possível. Para além do tratamento sintomático, salienta-se a importância de certas medidas que poderão retardar a progressão da doença:
- Terapêutica enzimática de substituição (TES), disponível para alguns tipos de MPS (I, II, IV-A e VI -perfusão IV semanal de enzima recombinante);
- Transplante de células estaminais/ stem-cells hematopoiéticas (TSCH) eventualmente associada a terapêutica enzimática; como a enzima administrada por via IV não atravessa a barreira hematoencefálica, a terapia de eleição na MPS I severa é o tratamento combinado com terapia enzimática de substituição (TES);
- Transplante de medula óssea: nalguns casos de MPS tipos I (especialmente), II e VI tem sido realizado este procedimento com resultados variáveis, menos notórios quanto às alterações esqueléticas e oculares.
Seguimento
Dada a natureza progressiva das MPS, torna-se necessária uma avaliação clínica seriada e rigorosa abrangendo várias funções: audição, visão, cardiovascular, pulmonar, articular, neurológica, qualidade do sono, etc.. Nesta perspectiva, impõe-se a colaboração de equipas multidisciplinares para a actuação específica em determinadas situações como hidrocefalia comunicante, opacidade da córnea, degenerescência da retina, surdez, rigidez articular, síndroma do canal cárpico, profilaxia da endocardite bacteriana, da compressão medular, etc.. Há também que ter a maior atenção à anestesia a realizar nos casos de doença de Mórquio A.
2. OLIGOSSACARIDOSES
Definição e etiopatogénese
As oligossacaridoses são doenças de armazenamento lisossomial, autossómicas recessivas, resultantes da deficiência de enzimas que fazem a degradação das cadeias oligossacarídicas das glicoproteínas; daí serem também chamadas glicoproteinoses. A deficiência enzimática específica origina acumulação intracelular de glicoproteínas e/ou de oligossacáridos, parcialmente degradados, com consequente excreção aumentada na urina.
A sua frequência, inferior à das MPS, é elevada contudo em certas regiões do mundo, como é o caso da fucosidose em Itália, e da aspartilglicosaminúria na Finlândia.
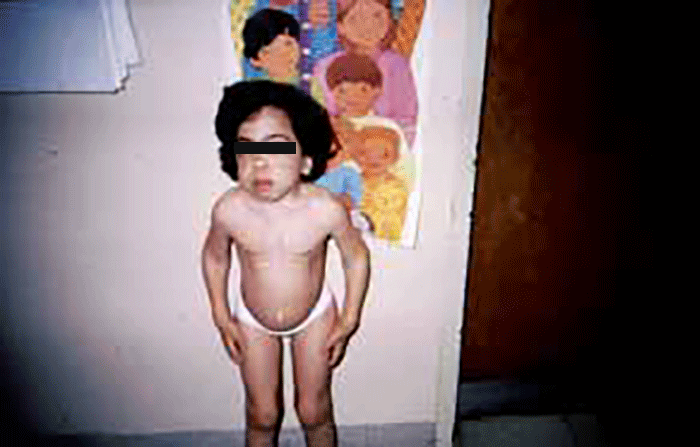
Existe grande heterogeneidade clínica, em parte explicada pela vasta heterogeneidade alélica. O mesmo defeito enzimático pode dar origem a formas clínicas diferentes, com idade de início, gravidade e envolvimento de órgãos, muito variáveis, sendo responsável tanto pelas formas precoces como pelas de começo tardio. Partilham muitos aspectos clínicos com as mucolipidoses (ML), e outras doenças lisossomais, mas em particular com as mucopolissacaridoses (MPS), designadamente no que respeita a alterações esqueléticas e fácies grosseira. Dum modo geral as manifestações das oligossacaridoses surgem mais precocemente do que as das MPS (RN ou primeira infância).
Nosologia
As oligossacaridoses integram as seguintes entidades clínicas:
- Manosidoses
- Fucosidoses
- Doença de Schindler
- Aspartilglicosaminúria
- Sialidoses e
- Galactossialidoses, descritas de modo sucinto a seguir.
Alfa-Manosidose (McKusick 248500)
Esta doença é devida à deficiência da alfa-manosidase que causa acumulação de oligossacáridos e glicoproteínas ligadas a resíduos de manose em vários tecidos e tipos de células, incluindo neurónios. Existem mais de 60 mutações, sendo a R750W a mais comum.
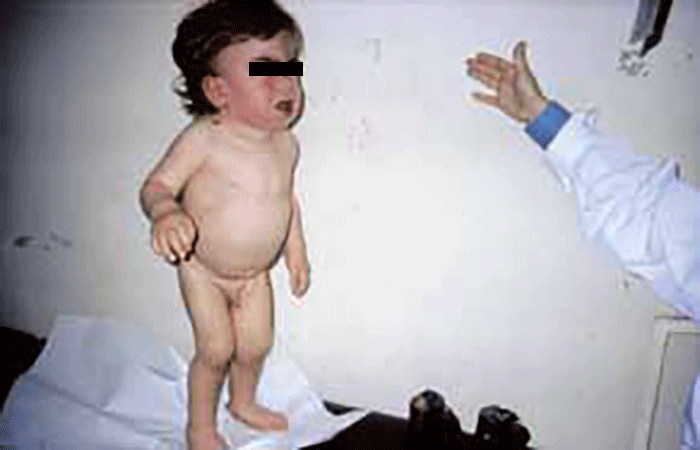
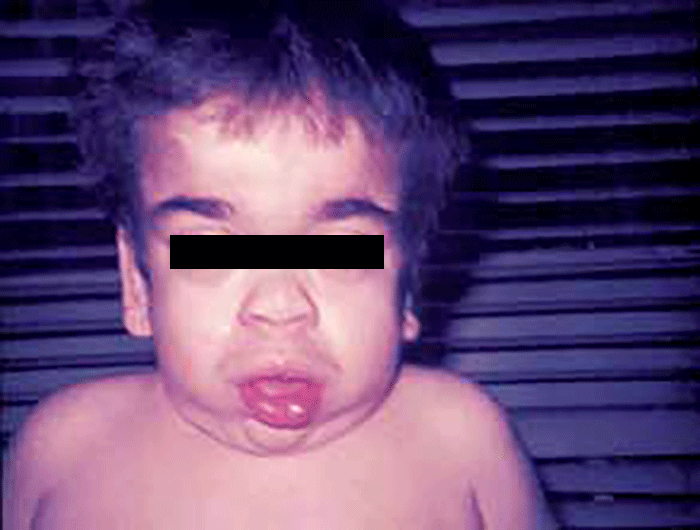
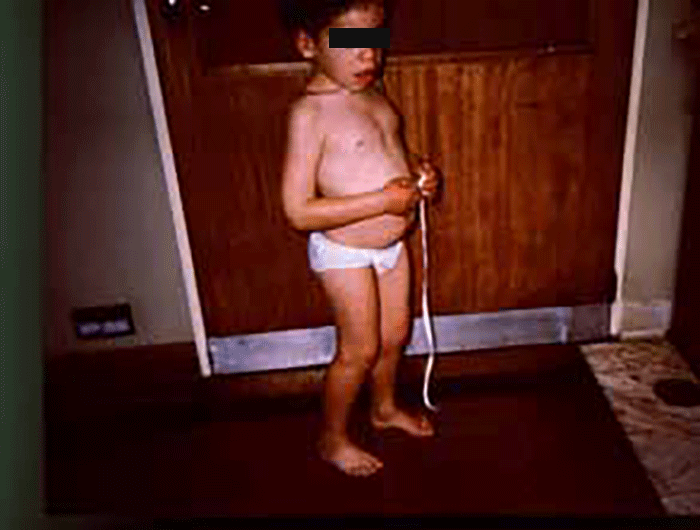
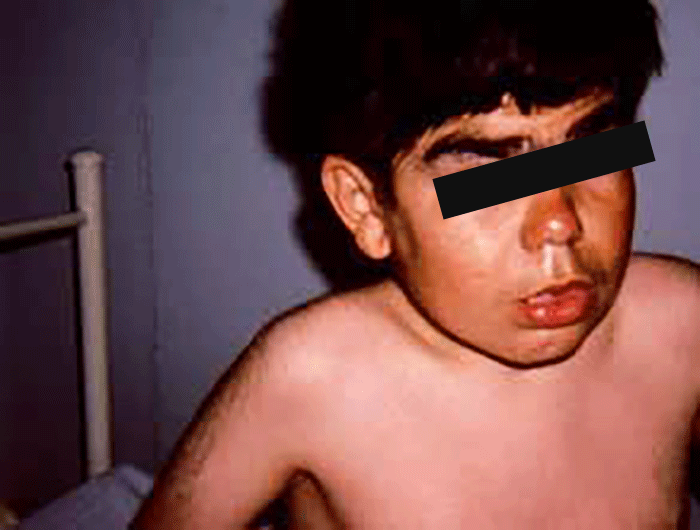
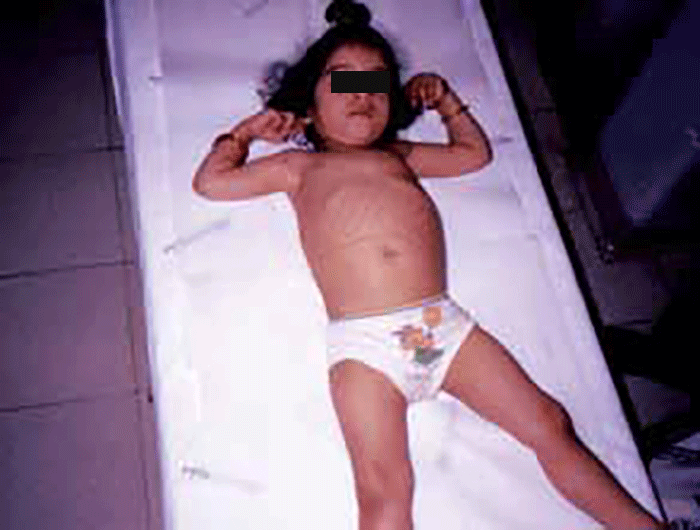
As manifestações clínicas são de largo espectro, desde formas perinatais, geralmente fatais, a formas oligossintomáticas, na idade adulta. São frequentes: fácies grosseiro (simile-Hurler), disostose múltipla, atraso psicomotor, surdez, cataratas, opacidade da córnea, hepatosplenomegália e hérnias. As infecções bacterianas são comuns, possivelmente em relação com deficiência imunitária. Por vezes surgem: ataxia progressiva e hidrocefalia comunicante. A pesquisa de linfócitos com vacúolos é habitualmente positiva.
São descritos dois tipos:
- Tipo 1 (Infantil), ocorrendo antes do 1 ano de idade com: fácies grosseira, hipertrofia gengival, macroglossia, organomegália, surdez, atraso psicomotor evoluindo para atraso mental grave. A morte ocorre entre 3-10 anos de idade;
- Tipo 2 (Juvenil/ Adulto), mais moderado, com início mais tardio, da infância à idade adulta, com disostose múltipla, atraso mental moderado, surdez progressiva e sintomas psiquiátricos. Os angioqueratomas são raros.
O tratamento, requerendo apoio multidisciplinar, é de suporte e preventivo das complicações. O transplante de medula óssea (TMO) ou TMO/TSCH, se efectuados precocemente, poderão estabilizar a deterioração neurológica. Em estudos experimentais de investigação animal verificou-se melhoria da ataxia com TES.
Beta-Manosidose (McKusick 248510)
Devida à deficiência da beta-manosidase, é muito menos frequente do que a doença anterior.
Como manifestações clínicas descrevem-se: graves dificuldades de aprendizagem, alterações graves de comportamento, surdez e infecções frequentes.
O fenótipo simile-Hurler tem menor incidência. A disostose múltipla é mais rara e a organomegália é inconstante. Por vezes surgem angioqueratomas.
Mais frequentemente surgem: atraso mental que pode estar associado a neuropatia periférica, convulsões, surdez e atraso de crescimento. O início surge por volta dos 1-2 anos, podendo alguns doentes viver até à idade adulta.
Fucosidose (McKusick 230000)
É devida à deficiência da alfa-L-fucosidase, com consequente acumulação de glicoesfingolípidos, glicolípidos e glicoproteínas contendo fucose em vários tecidos, originando grave doença neurodegenerativa, convulsões frequentes, e moderada disostose múltipla. Estão descritas mais de 20 mutações.
As manifestações clínicas iniciam-se-se em geral entre as idades de 1-2 anos, podendo verificar-se sobrevivência até à idade adulta. No geral verifica-se: fácies grosseira, atraso mental, infecções respiratórias frequentes, deterioração neurológica, alterações esqueléticas, hepatosplenomegália. Alguns doentes apresentam angioqueratomas proeminentes.
Estão descritos dois tipos:
- Tipo 1, de início precoce (3-18 meses) com compromisso do SNC e medula espinal, deterioração progressiva com convulsões, rigidez de descerebração terminal, atraso mental, atraso de crescimento, disostose múltipla, alterações vertebrais, cardiomegália, hepatosplenomegália, hérnias, destacando-se o prognóstico muito reservado e morte na primeira década de vida; neste tipo 1 os doentes apresentam concentração de NaCl elevada no suor;
- Tipo 2, de início mais tardio e curso mais lento, com angioqueratomas (aspecto típico), sendo a concentração de NaCl no suor normal.
Em ambos os tipos podem observar-se linfócitos no sangue periférico, com vacúolos.
O tratamento é de suporte, verificando-se melhoria se o TMO for efectuado precocemente.
Doença de Schindler (McKusick 104170)
Trata-se de doença muito rara resultante de deficiência de α-N-acetilgalactosaminidase que provoca acumulação anormal de glicoesfingolípidos, glicopéptidos e oligossacáridos em vários tecidos. Descrevem-se dois tipos:
- Tipo 1 (Infantil), de início por volta do 1 ano de idade, em crianças até aí aparentemente normais; depois verifica-se deterioração neurológica com convulsões, hipotonia axial, espasticidade, atrofia óptica, nistagmo, surdez e atraso psicomotor grave.
Tipicamente há pois um quadro de distrofia neuroaxonal e crises mioclónicas sem alterações viscerais, as quais são típicas noutras doenças dos lisossomas. Outros doentes apresentam síndroma piramidal e cerebelosa; alguns têm hiperacúsia, oftalmoplegia e estrabismo.
Nas fases terminais: cegueira, espasticidade, mioclonias, postura de descorticação, atraso psicomotor profundo, contracturas em flexão e imobilidade.
Através da neuroimagem demonstra-se atrofia do córtex cerebral, cerebelo e tronco: a electromiografia evidencia sinais de degenerescência axonal e o electrorretinograma é normal. O EEG evidencia sinais de compromisso cerebral difuso, e de irritabilidade multifocal, especialmente nas regiões central, parietal e occipital.
A mutação E25K é a mais comum nesta forma grave, especialmente em homozigotia.
A marca anátomo-patológica evidencia axónios terminais e pré-terminais esferóides:
- Tipo 2 (Adulto), ou doença de Kansaki; todos os doentes apresentam telangiectasias, angioqueratomas, vasos sanguíneos tortuosos nas conjuntivas, atraso mental ligeiro e degenerescência axonal periférica; por vezes, fácies grosseira e lábios grossos. Os sinais clínicos mais chamativos são a ausência da fala e de interactividade com o ambiente, o que leva muitas vezes ao diagnóstico de autismo.
Pela neuroimagem comprovam-se sinais de enfartes lacunares sem atrofia cortical. O electromiograma permite evidenciar redução de amplitude e velocidade de condução normal. Não ocorre degenerescência progressiva. Estão descritos quadros intermédios sem organomegália ou alterações ósseas. Existe discrepância genótipo-fenótipo admitindo-se que outros factores contribuam para o quadro neurológico tão grave das formas precoces.
Aspartilglicosaminúria (McKusick 208400)
Trata-se duma doença causada pela deficiência da aspartilglicosaminidase que leva ao armazenamento de aspartilglicosamina nos tecidos, e à sua excreção elevada na urina. É frequente na Finlândia (1/17.000), e rara noutras regiões.
Como manifestações clínicas destacam-se: atraso do neurodesenvolvimento, diminuição da coordenação dos movimentos finos, atraso da linguagem (dado fundamental), alterações psiquiátricas, hiperactividade, infecções recorrentes nos primeiros anos de vida, diarreia e hérnias.
Salientam-se atraso da linguagem, alterações do comportamento, dismorfias, cifose, baixa estatura, fraqueza ligamentar, macroglossia, voz rouca, acne, fotossensibilidade, angioqueratomas e telangiectasias.
O desenvolvimento motor é menos afectado do que a fala e as capacidades intelectuais.
Contudo, estas últimas vão-se deteriorando com a idade.
A hepatomegália é rara, excepto nos doentes finlandeses. No adolescente pode surgir macrorquidismo. A disostose é ligeira e não há alterações visuais (excepto, por vezes, um ponteado semelhante a cristal na córnea).
Alguns autores referem um aspecto facial característico: hipertelorismo, nariz pequeno e grosseiro, pavilhões auriculares com lobos pequenos ou ausentes e lábios grossos. A morte pode ocorrer na terceira década, fase em que o adulto emite já poucas palavras, tem marcha atáxica e incoordenação motora.
Alguns doentes podem apresentar microcefalia, opacidade da córnea, espasticidade, hipotonia, hipertrofia das válvulas cardíacas e sinais de artrite inflamatória.
A marca anátomo-patológica é a extensa vacuolização celular em vários órgãos como o cérebro; no sangue periférico podem ser observados linfócitos com vacúolos. Na Finlândia a mutação mais frequente é a C163S.
O tratamento com o TMO permite normalização bioquímica e ligeira melhoria da capacidade intelectual; contudo, poderão surgir complicações; para o tratamento das convulsões utiliza-se a carbamazepina.
Sialidoses (McKusick 256550)
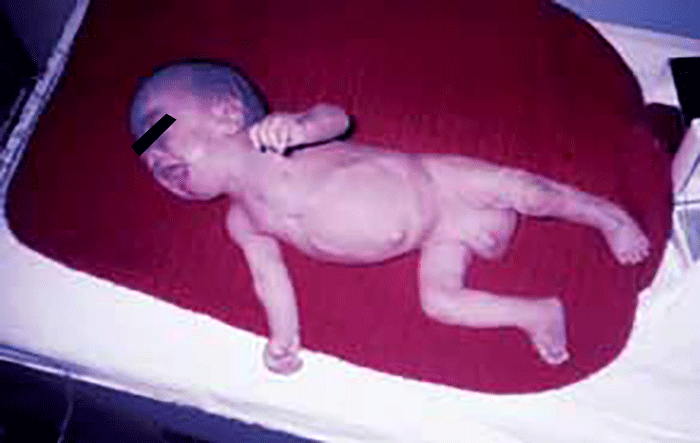
As sialidoses são devidas à deficiência da α-neuraminidase responsável pela remoção dos resíduos de ácido siálico dos sialoconjugados, com consequente excreção urinária elevada de sialoligossacáridos. O espectro clínico é amplo, desde formas precoces com hidropisia fetal, até formas de progressão lenta de síndroma mioclónica e mancha cor de cereja ou cherry-red spot detectável por fundoscopia.
Descrevem-se dois tipos principais:
- Tipo 1, de início na infância/ adolescência, com perda visual progressiva, cherry-red spot na mácula (constante), convulsões, mioclonias de difícil controlo, que se agravam com os estímulos emocionais/ sensoriais e ataxia. Mais tarde: atrofia óptica, opacidade punctiforme da córnea e cegueira. Não ocorrem: dismorfias, alterações esqueléticas nem atraso mental significativo.
Em geral, nas 2-3 primeiras décadas de vida, os doentes podem apresentar desenvolvimento e aspecto físico normais, embora com marcha anómala.
Pela neuroimagem detecta-se atrofia cerebral e do cerebelo. Por vezes são observados linfócitos vacuolizados no sangue periférico.
- Tipo 2, de início muito mais precoce, com fácies grosseira, disostose múltipla e hepatosplenomegália.
Este tipo integra duas formas:
- Congénita, com hidropisia fetal, ascite, hérnias, displasia óssea, opacidade da córnea e telangiectasias; a morte é precoce (pré-natal ou nas primeiras semanas de vida); e
- Infantil, com grave atraso do desenvolvimento neurológico, hepatosplenomegália; edema; a ascite pode observar-se ao nascer ou mais tarde; o fenótipo like-Hurler vai-se acentuando; são comuns: cherry-red spot na mácula, opacidade punctiforme na córnea e cristalino, surdez, convulsões, atraso de crescimento e disfunção motora; pode verificar-se macrocefalia nalguns casos.
Os doentes podem sobreviver até à segunda década, mas, geralmente a morte ocorre na infância (1-7 anos). Como achados radiológicos destacam-se: disostose múltipla que pode ser grave e sinis de condrodisplasia puntacta epifisária.
Verifica-se intensa vacuolização dos leucócitos em diferentes tecidos e órgãos, incluindo fígado e cérebro. O diagnóstico pode ser difícil: por defeito isolado da neuraminidase, ou por defeito combinado com a deficiência da β- galactosidase.
Para confirmação, devem ser usados de preferência tecidos frescos (fibroblastos, amniócitos, vilosidades coriónicas); leucócitos ou tecidos congelados não devem ser usados.
Galactossialidoses (McKusick 256540)
Trata-se de doenças devidas a defeito combinado da neuraminidase e da β-galactosidase, o qual é causado por falta duma proteína protectora, a catepsina A, responsável pela estabilidade do complexo enzimático dentro dos lisossomas.
Há vários sialoligossacáridos excretados pela urina.
As manifestações clínicas são dominadas por fácies grosseira, cherry-red spot na mácula, e alterações ósseas. O exame do esfregaço do sangue periférico evidencia linfócitos vacuolizados.
Distinguem-se três tipos:
- Tipo infantil precoce, com as seguintes manifestações, já no RN: hidropisia fetal, ou edema, ascite, hérnia inguinal, fácies grosseira, fígado e baço aumentados, insuficiência renal com proteinúria maciça, cardiomegália, e telangiectasias. A morte é precoce por insuficiência cardíaca e renal;
- Tipo infantil tardio, manifestando-se até aos 2 anos por fácies grosseira, hepatosplenomegália, hérnia inguinal, disostose múltipla, cherry-red spot e opacidade da córnea e, por vezes, convulsões. Como complicações descreve-se insuficiência cardíaca devida ao encerramento das válvulas aórtica e mitral. Nalguns doentes verificam-se macrocefalia e surdez neurossensorial;
- Tipo juvenil/ adulto, ocorrendo com maior incidência no Japão e em idade média de início aos 15 anos. Neste tipo são evidentes: fácies grosseira, opacidade da córnea, angioqueratomas, envolvimento cardíaco e alterações da coluna vertebral (platispondilia); nalguns casos são verificados: deterioração neurológica progressiva com ataxia, mioclonias, convulsões, sinais piramidais, insuficiência mental e ausência de visceromegália.
Estão descritos quadros atípicos em que se verificam crises de dor neuropática e ausência de sialoligossacaridúria.
Para confirmar o diagnóstico procede-se:
- À execução de cromatografia da urina em camada fina a qual evidenciará excreção elevada de sialoligossacáridos;
- À determinação da actividade enzimática da neuraminidase e da beta-glucosidase.
Como complemento destes exames pode dosear-se a catepsina A e proceder-se à análise mutacional.
Não existe tratamento específico; apenas é possível executar medidas de suporte.
O transplante renal, a fazer-se em caso de insuficiência renal, não impede a progressão da doença. O TMO nesta patologia está em fase de investigação experimental.
Diagnóstico diferencial, definitivo e pré-natal
Do ponto de vista clínico, as oligossacaridoses partilham muitos sinais e sintomas, não só com as mucolipidoses (ML) II e III como, principalmente, com as mucopolissacaridoses (MPS). Os pacientes portadores destas últimas, contudo, excretam na urina GAG (mucopolissacáridos) e não oligossacáridos.
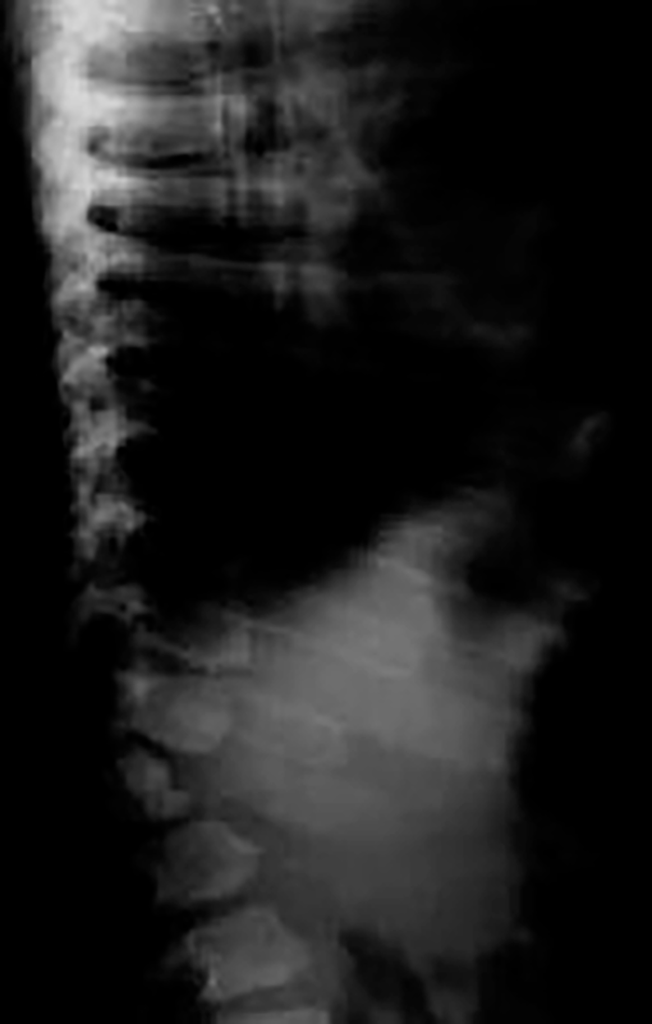
Assim, perante um doente com fácies grosseira (semelhante à da síndroma de Hurler), alterações esqueléticas, com (ou sem) atraso mental, torna-se fundamental proceder, de imediato, a cromatografia em camada fina em urina de 24 horas (a única prova de rastreio útil e fiável para pesquisa de oligossacáridos e mucopolissacáridos).
Se se comprovar mucopolissacaridúria, tal apontará, em princípio, para MPS; se se verificar oligossacaridúria, há que admitir a possibilidade de oligossacaridose, ou de doenças relacionadas, como ML, ou ainda doutras doenças lisossomais que apresentam oligossacaridúria como: GM1, GM2, e doença de armazenamento de ácido siálico infantil.
Chama-se a atenção para o facto de outras doenças, não metabólicas poderem apresentar alteração na excreção de oligossacáridos, tais como: síndromas de: Coffin-Lowry, Coffin-Siris, displasia frontometafisária, Sotos, Williams, Costello, e outras, não esquecendo o hipotiroidismo congénito.
Será importante dosear, no plasma, a quitotriosidase, que está elevada não só na doença de Gaucher, mas também nas doenças: GM1, Krabbe, MPS IV-B, NP-B, NP-C, doença de armazenamento de ésteres do colesterol, Wolman, fucosidose, galactosialidose e glicogenose IV.
A pesquisa de linfócitos vacuolizados no sangue periférico, quando positiva, constitui um elemento adjuvante da suspeição clínica.
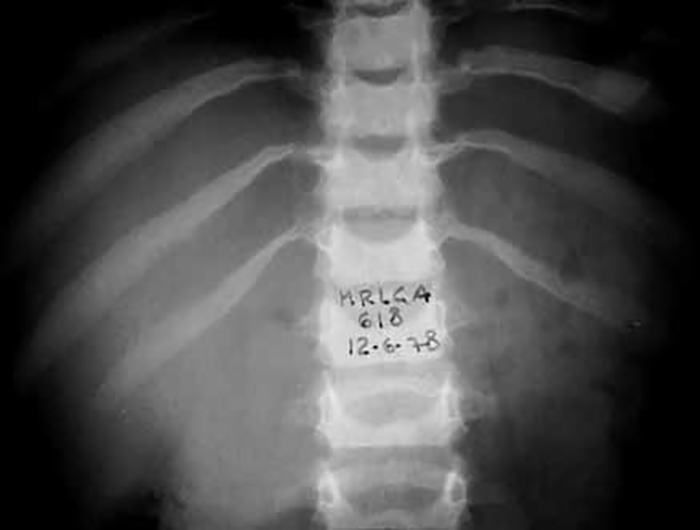
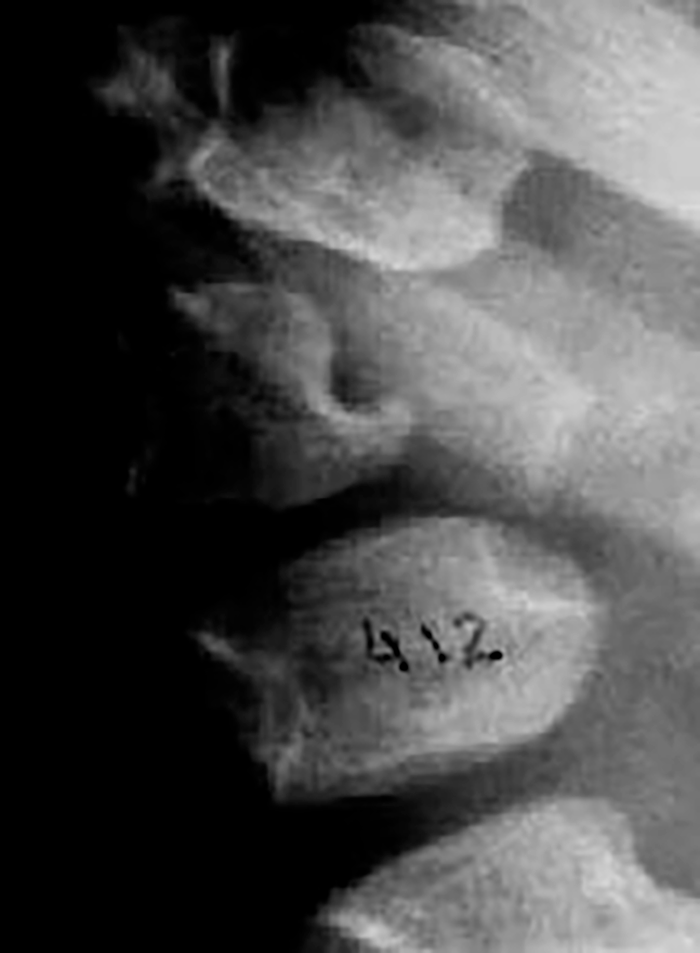
O exame radiológico dos ossos, particularmente da coluna vertebral, em dois planos, é fundamental para provar (ou não) a existência de disostose múltipla.
A confirmação diagnóstica faz-se pela determinação da actividade das enzimas lisossómicas específicas nos leucócitos, fibroblastos, linfoblastos, amniócitos, vilosidades coriónicas, e raramente no plasma. Nas sialidoses e galactosialidoses não devem ser usados, para esse fim, os leucócitos, sendo preferível a cultura de células. Na galactossialidose é possível determinar a actividade da catepsina A nos fibroblastos.
A análise do DNA está disponível para todas estas patologias.
Para o diagnóstico pré-natal podem ser usadas as vilosidades coriónicas em todas as doenças, excepto na sialidose e galactossialidose (para as quais se dá preferência, respectivamente, ao líquido amniótico e à cultura de células).
Tratamento e prognóstico das oligossacaridoses
Para o tratamento das oligossacaridoses, como já foi referido, torna-se fundamental o apoio multidisciplinar de centros especializados em doenças hereditárias do metabolismo.
Deve ser dada atenção às possíveis perturbações do sono e do comportamento, assim como às situações que necessitem de anestesia. A dismorfia facial, a displasia esquelética, a obstrução das vias aéreas superiores podem dificultar grandemente as manobras de anestesia.
O transplante de células estaminais hematopoiéticas (TSCH), a terapêutica enzimática de substituição (TES), e de redução do substrato estão em evolução.
O transplante de medula óssea (TMO) tem sido realizado em número reduzido de casos, não sendo a sua eficácia definida com exactidão: na alfa– manosidose parece favorável quando realizado muito precocemente; na fucosidose os resultados têm sido inconclusivos, referindo-se que alguns doentes finlandeses com aspartilglicosaminúria tiveram importantes complicações após o referido TMO.
O êxito da TES na doença de Gaucher, na doença de Fabry e nalgumas MPS, faz prever que as oligossacaridoses possam vir a beneficiar dessa terapêutica, assim como da terapia génica.
3. MUCOLIPIDOSES (ML)
As mucolipidoses (ML), outro tipo de doenças lisossómicas, partilham características clínicas e bioquímicas das MPS e das esfingolipidoses.
Nosologia
As ML integram os seguintes tipos: ML I (sialidose do tipo II), ML II (doença da célula-I ou I-cell disease), ML III (distrofia pseudo-Hurler), e a ML IV.
A ML I, considerada por alguns como oligossacaridose, é devida a deficiência da enzima lisossómica alfa-neuraminidase. As manifestações clínicas são variáveis: hidropisia fetal, défice visual, convulsões mioclónicas, alterações da marcha, fundoscopia evidenciando mancha cor de cereja e disostose múltipla.
As ML II e ML III são devidas a deficiência da enzima: N-acetilglicosamil fosfotransferase.
A ML II, por defeito completo da enzima N-acetilglicosamil fosfotransferase é semelhante à doença de Hurler, mas com início muito precoce e com evolução grave: dismorfia facial, macroglossia, cifoscoliose, gibosidade lombar, visceromegália, cardiomiopatia, coronariopatia, rigidez articular, hipertrofia gengival, atraso psicomotor em geral grave e morte precoce (2-8 anos). É frequente a ocorrência de hidropisia fetal.
A ML III, por defeito parcial da mesma enzima – N-acetilglicosamil fosfotransferase-, comportando maior sobrevivência, evidencia quadro clínico menos exuberante, embora alguns doentes evidenciem displasia óssea progressivamente incapacitante; outras manifestações: escassos ou nenhuns problemas de aprendizagem, dores articulares por vezes intensas, e limitação motora semelhante à verificada na artrite reumatóide juvenil; compromisso das vávulas cardíacas; e sobrevivência até à idade adulta.