Importância do problema
Como é referido no capítulo 1, o desenvolvimento em Portugal dum plano de assistência perinatal levado a cabo nos últimos trinta anos englobando, entre outras medidas, a regionalização de cuidados e a criação dum sistema nacional de transporte neonatal inter-hospitalar, contribuiram decisivamente para francos progressos que se traduziram em melhoria das taxas de mortalidade infantil e perinatal.
Do plano de cuidados pré-natais faz parte a avaliação do risco e a transferência atempada da grávida para um centro de referência, quer por causas maternas, quer por causas fetais; o objectivo é proporcionar um nível de cuidados mais adequados à situação clínica, em obediência a um conceito clássico validado por estudos científicos.
Trata-se do conceito de “transporte in utero” segundo o qual “a melhor incubadora de transporte é o útero materno”.
Porém, em cerca de 10 a 20% dos RN sem antecedentes de risco pré-natal poderão surgir problemas clínicos graves com indicação de transferência. Daí a importância da existência dum sistema organizado de transporte permitindo que os RN doentes beneficiem de cuidados especializados prestados por neonatologista/intensivista pediátrico e enfermeira especialista, antes e durante a transferência para uma unidade de nível de cuidados mais diferenciado ou terciária (UCIN), onde existam recursos técnicos e humanos adequados à gravidade e especificidade da respectiva situação clínica.
Em Portugal, o modelo em funcionamento há mais de três décadas tem recebido reconhecimento internacional face aos resultados obtidos.
Princípios gerais
No âmbito do sistema de transporte do RN – que pressupõe organização, estruturas próprias e esquema coordenado – há que atender a um conjunto de princípios gerais tendo em vista a eficácia, eficiência e efectividade dos cuidados a prestar.
Assim, torna-se fundamental:
- Preferir, sempre que possível, o transporte pré-natal (já mencionado);
- Transferir o RN de modo seguro;
- Garantir que durante o transporte as condições assistenciais técnológicas e humanas sejam semelhantes ou melhores do que as praticadas na instituição que solicita a transferência; tal pressupõe a utilização de ambulância de tipo “medicalizado” (com médico e enfermeiro com competências diferenciadas em medicina intensiva), equipada com diverso material para reanimação, designadamente, incubadora, ventilador e equipamento portátil de monitorização;
- Assegurar que os benefícios da transferência ultrapassem os riscos inerentes à mesma;
- Diminuir a morbilidade e mortalidade neonatais através dos cuidados prestados pela equipa de saúde responsável pelo transporte;
- Haver boa relação custo-benefício, equacionando a decisão;
- Comunicar prévia e bidireccionalmente utilizando diversos meios tais como, via telefónica, videotelefónica, correio electrónico ou outro; tal pressupõe o funcionamento pleno e coordenado de três polos de comunicação, em obediência à ponderação sobre a alínea 6 (ver atrás):
- equipa da instituição que decide sobre a transferência,
- equipa móvel, de transporte,
- equipa da instituição receptora de modo a ponderar e decidir a necessidade e benefícios da transferência, a qual deve ser comunicada e explicada aos pais;
- Actuar de modo humanizado, o que implica, entre outras atitudes, promover o contacto prévio mãe/pai – filho RN; em condições ideais: a mãe deve acompanhar o filho e à mesma (ou aos pais) devem ser entregues folha informativa com contactos da instituição de saúde que vai receber a criança e, sempre que possível, também uma fotografia do RN;
- Promover sempre a estabilização clínica do RN no hospital de origem antes do início do transporte.
Indicações
As principais indicações de transferência de RN para unidades com nível mais diferenciado de cuidados são:
- RN de peso < 1.500 gramas e/ou idade gestacional < 32 semanas;
- RN com dificuldade respiratória e/ou crises de apneia, estando indicada ventilação mecânica;
- RN com defeitos congénitos graves, estando indicada intervenção cirúrgica e terapia intensiva;
- RN em estado crítico com patologia diversa (metabólica, infecciosa, neurológica, hematológica, etc.);
- RN com encefalopatia hipóxico-isquémica com indicação de tratamento atendendo à eventual necessidade de terapia por hipotermia induzida.
Requisitos durante o transporte
A manutenção dos cuidados durante o transporte obriga a um conjunto de requisitos:
- Manuseamento cuidadoso (com especial relevância nos casos de imaturidade) evitando lesões traumáticas;
- Colocação de rolos e ninhos de contenção para melhor posicionamento e conforto;
- Colocação de cintos de segurança;
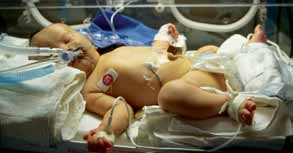
- Temperatura adequada, evitando, quer a hipotermia, quer a hipertermia (RN em incubadora de transporte ou berço aquecido) (Figura 1);
- Oxigenação adequada, evitando, quer a hiperóxia, quer a hipóxia (importância do oxímetro de pulso);
- Suprimento energético e hidroelectrolítico adequados (fluidos, electrólitos, alimentação parentérica, etc.);
- Assépsia rigorosa tentando evitar a colonização microbiana e a infecção.
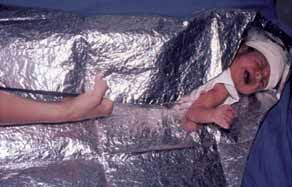
FIGURA 1. RN com capuz e envolvido em saco à base de estanho (material isolador) para evitar o arrefecimento.
Organização
Em Portugal continental existem três centros de coordenação dependentes de hospitais centrais em rotatividade por períodos variáveis, respectivamente: Lisboa (apoio à zona sul), Coimbra (apoio à zona centro), e Porto (apoio à zona norte). Efectua-se, na grande maioria das vezes, transporte por via terrestre utilizando a ambulância devidamente equipada para o grupo etário neonatal/pediátrico. (ver adiante)
Nas regiões autónomas (Açores e Madeira), e em situações especiais no continente, é possível utilizar a via aérea (helicóptero ou avião) quando a distância ou a situação clínica assim o exigirem.
A equipa (constituída por médico neonatologista/intensivista, enfermeira especializada, e técnico de ambulância de emergência/TAE) é recrutada de diversos hospitais e maternidades, em geral de zonas próximas do centro de coordenação, ou do próprio centro, segundo escala pré-determinada, garantindo apoio permanente 24 horas/dia, durante todo o ano.
Na zona sul, adaptando o sistema já existente na zona norte e centro, passou a haver desde Janeiro de 2012 apenas uma equipa e uma ambulância para efectuar transporte simultaneamente neonatal e pediátrico, designada por TIP – transporte inter-hospitalar pediátrico (pertencente ao INEM – Instituto Nacional de Emergência Médica), adaptada, possuindo incubadora com ventilador (geminado), para recém-nascidos, e maca com ventilador pediátrico (portátil) para crianças em idade pediátrica.
A decisão sobre a instituição receptora depende das vagas existentes nas unidades da região e do tipo de patologia do RN que é transportado. O esclarecimento sobre as referidas vagas pode ser obtido permanentemente através de contacto por telefone móvel entre os hospitais e a equipa da ambulância que procede à evacuação.
A gestão e manutenção de todo o material da ambulância, incluindo consumíveis, assim como a organização de escalas rotativas de médicos e enfermeiros está a cargo do centro de coordenação do hospital/maternidade da respectiva região.
Trata-se, pois, dum modelo organizativo de parceria entre o INEM (cedendo ambulância equipada e TAE) e hospitais centrais do Serviço Nacional de Saúde (cedendo serviço organizativo e recursos humanos).
Noutros países existem outros modelos (por ex. organização de toda a logística a partir duma única instituição dando apoio à respectiva zona de influência).
Equipamento
Não cabendo, no âmbito desta obra, especificações técnicas sobre ambulâncias para o transporte de RN, é feita apenas uma resenha do material existente na ambulância de transporte neonatal e dos principais medicamentos indispensáveis.
Material
- Estetoscópio e termómetro convencional;
- Incubadora de transporte com sistema de aquecimento por convecção, com fonte de luz e bateria recarregável, e ainda sistema de regulação de temperatura servocontrolado;
- Monitores electrónicos (de temperatura, cardiorrespiratório, de pressão arterial, oxímetro de ambiente/FiO2, oxímetro de pulso, etc.);
- Sonda temperatura rectal (monitorização da temperatura central no transporte de doentes com indicação para hipotermia induzida);
- Sistema de aspiração de secreções com sondas de aspiração estéreis, de calibres CH 5, 6, 8, 10;
- Fonte de oxigénio e ar comprimido (cilindros com capacidade para 1.000 litros);
- Balão tipo Ambu para ventilação manual com IPPB ou balão auto-insuflável;
- Sistema para CPAP nasal;
- “Máscaras” para ventilação, aplicáveis a RN de termo e pré-termo;
- Material para entubação traqueal/tubos traqueais de diversos diâmetros → 2,5 (RN < 1.000 gramas); → 3 (RN com 1.000-1999 gramas); → 3,5 (RN com 2.000-2999 gramas); → 3,5 a 4 (RN > 3.000 gramas); laringoscópio de lâmina recta para RN com pilhas carregadas e sobresselentes;
- Máscara laríngea;
- Material para drenagem torácica;
- Ventilador geminado com a incubadora permitindo ventilação por volume, por pressão ou ventilação de alta frequência oscilatória;
- Sistema para administração de NO (óxido nítrico inalado);
- Material para canalização arterial e venosa – artério e venoclise (cânulas, conjunto de agulhas tipo “borboleta”, agulha para injecção intraóssea, agulhas 18, 19, 20, seringas (tipo insulina de 1 mL, de 5 e 10 mL), material para cateterismo umbilical;cateteres venosos e arteriais umbilicais de diferentes calibres;
- Sistemas de torneira de três vias;
- Bomba de perfusão com seringa;
- Material de pequena cirurgia;
- Fitas reactivas para micrométodos (determinações no sangue capilar e urina, por ex. glicémia e glicosúria);
- Sistema portátil para gasometria.
Fármacos
Soro fisiológico, glucose em água a 5% e 10%, bicarbonato de sódio molar (1 mL<>1 mEq), cloreto de potássio, cloreto de sódio a 10% e 20%, gluconato de cálcio a 10%, adrenalina a 1/1.000, diazepam, vitamina K1 (ampolas de 0,5 e 1 mg), fenobarbital, difenil-hidantoína, furosemido, dopamina, dobutamina, prostaglandina E1, gentamicina, ampicilina, lidocaína, surfactante, etc..
Miscelânea
Bata, máscaras, avental de plástico, óculos de protecção, luvas esterilizadas, sacos colectores de urina, etc..
Procedimentos
Antes do transporte
Aspectos gerais
Ao ser solicitado o transporte, a equipa do hospital de origem deverá transmitir previamente à equipa de transporte todos os dados da história clínica (eventualmente por via electrónica), sem prejuízo da informação clínica convencional, como resultados de exames complementares de diagnóstico que deverão acompanhar sempre o doente.
Eis alguns aspectos práticos:
- Há que informar sobre o estado clínico do RN, o peso, dados fundamentais para o cálculo de doses de fármacos e fluidos a administrar;
- É obrigatório discutir, aconselhar e programar o plano de transferência do RN;
- Há que coordenar com o hospital emissor a hora aproximada de chegada;
- Há que contactar o hospital receptor, confirmar a vaga, e transmitir dados clínicos do doente;
- Há que mostrar disponibilidade por parte da equipa de transporte para aconselhar/orientar a equipa do hospital de origem.
Em suma, os bons resultados do paciente em relação ao transporte inter-hospitalar dependem fundamentalmente das medidas a tomar antes do início da viagem com o objectivo de garantir a estabilização clínica – estabilizar antes de transportar. O transporte deve ser seguro, quer para o RN, quer para a equipa.
É essencial a correção prioritária de determinadas situações a cargo da equipa médica do hospital de origem (implicando formação básica em cuidados especiais e em ventilação mecânica de curta duração), até à chegada da ambulância com a equipa de transporte.
As medidas essenciais de estabilização prévia dizem respeito a:
- Acesso vascular para suprimento de fluidos, electrólitos, glucose e fármacos (garantia de normovolémia, normoglicémia, normopressão arterial, equilíbrio hidroelectrolítico, etc.;
- Correcção da acidose;
- Sedação e analgesia em função do contexto clínico;
- Manutenção da normotermia corporal (~ 36,5ºC) monitorizando a temperatura rectal, e/ou cutânea, com sensor electrónico ao nível do hipocôndrio direito (RN sob fonte de calor, envolvimento do RN em saco de PVC exceptuando a face, etc.); para atingir tal temperatura cutânea (~ 36,5ºC), deverá providenciar-se ambiente de termoneutralidade na incubadora (garantindo a temperatura central do organismo com menor consumo de oxigénio);
Se o RN estiver vestido e/ou ou no interior de concentrador de calor (“túnel” de perspex), por sua vez dentro da incubadora, a temperatura do ambiente desta pode ser inferior à referida atrás: peso ~ 1.000 gramas → 32ºC; peso ~ 2.000 gramas → 28ºC; peso ~ 3.000 gramas → 27ºC.
- Administração de prostaglandinas (medicamento armazenado a 4ºC) a iniciar se houver suspeita de cardiopatia cianótica, pressupondo indicações dadas pela equipa de cardiologia pediátrica após contacto prévio, ou experiência do pediatra neonatologista.
A dose de prostaglandina E1 (Prostin®) é:
- inicial → 0,05-0,1 mcg/kg/minuto IV,
- de manutenção → 0,01-0,05 mcg/kg/minuto IV,
- devido ao risco de apneia, está indicada nestes casos a entubação traqueal para início de ventilação mecânica, monitorizando a saturação transcutânea em O2 (SpO2);
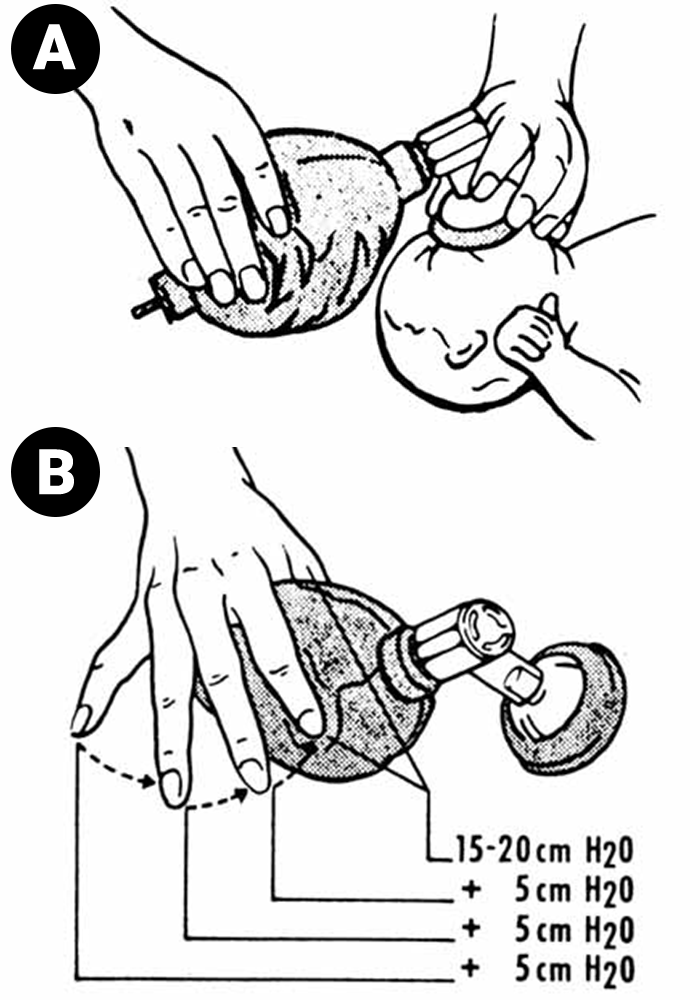
- Ventilação artificial de apoio com ventilador por pressão, utilizando os seguintes parâmetros:
- PIP: 20 cm H2O,
- PEEP: 3 cm H2O,
- Relação I/E : 1/1,
- FiO2: 50-60%,
- Tempo inspiratório: 0,4 segundos;
- Administração de surfactante se comprovada SDR por imaturidade pulmonar;
- Ventilação por volume garantido ou ventilação de alta frequência consoante a situação clínica de base do RN;
- Assistência ventilatória não invasiva – CPAP (ver adiante capítulo sobre “problemas respiratórios do RN”).
Situação especial
Indução da hipotermia em casos de encefalopatia hipóxico-isquémica (EHI)
Desde que os RN preencham critérios de selecção para efectuar esta terapêutica, a iniciar no hospital de origem segundo directivas do hospital receptor, idealmente a criança deverá chegar ao hospital receptor até 6 horas após o início do quadro de EHI (período designado “janela terapêutica” para tentar garantir a eficácia da medida e o melhor prognóstico.
A hipotermia passiva deve manter-se durante o transporte com o objectivo de se atingir a temperatura considerada neuroprotetora de 34,5ºC rectal o mais rapidamente possível.
Situações do foro cirúrgico
Onfalocele e gastrosquise
- Colocação de sonda orogástrica em drenagem livre;
- Não administrar alimentação per os;
- Prescrição de antibioticoterapia nos casos de gastrosquise e de onfalocelo rota;
- Fluidoterapia IV com suprimento duplo ou triplo correspondente às necessidades de manutenção;
- Protecção das vísceras expostas (gastrosquise ou onfalocelo rota);
Atrésia do esófago e obstrução intestinal
(atrésia duodenal, atrésia jejuno-ileal, anomalia anorrectal, íleo meconial, doença de Hirschprung, enterocolite necrosante)
- Colocação de sonda orogástrica em drenagem livre (aspiração contínua com pressão negativa ~ 10-20 cm H2O nos casos de atrésia do esófago);
- Não administrar alimentação per os;
- Fluidoterapia IV em todas as situações. Como particularidade, nos casos de enterocolite necrosante, suprimento duplo ou triplo das necessidades de manutenção, e suporte inotrópico para incrementar a perfusão mesentérica.
Anomalias congénitas das vias aéreas inferiores
(hérnia diafragmática de Bochdalek, enfisema lobar congénito, sequestro pulmonar, anomalia adenomatóide quística)
- Colocação de sonda orogástrica em drenagem livre;
- Entubação traqueal para início de ventilação mecânica;
- Sedação e analgesia;
- Detecção de possível quadro de hipertensão pulmonar (aplicação de dois oxímetros de pulso para avaliação da SpO2, num dos membros inferiores e no membro superior direito, respectivamente pós e pré-ductal.
Obstrução das vias aéreas superiores
(atrésia dos coanos, sequência de Pierre Robin, etc.)
- Na atrésia dos coanos: colocação de tubo de Guedel (tamanho 0 ou 00) por via oral, fixando-o;
- Na sequência de Pierre Robin, colocação do RN em decúbito ventral e, eventualmente, entubação traqueal.
Teratoma sacrococígeo
- Manipulação cuidadosa evitando a compressão da região sacrococígea;
- Colocação de sonda orogástrica em drenagem livre;
- Antibioticoterapia de largo espectro abrangendo nomeadamente anaeróbios e Gram-negativos;
- Decúbito ventral ou lateral envolvendo o tumor em compressas esterilizadas e secas.
Defeitos do tubo neural
- Protecção da região afectada colocando o RN em decúbito ventral e imobilizando-o pela região axilar e coxas;
- Não manipulação da área medular eventualmente exposta, humidificando-a e aplicando gotas de soro fisiológico frequentemente;
- Não utilização de luvas com látex.
Notas:
|
Durante o transporte
O RN somente deverá ser colocado na incubadora de transporte (previamente aquecida e ligada à corrente eléctrica do hospital) uma vez verificada a estabilização clínica.
Antes de iniciar viagem, a incubadora passará a estar ligada à bateria, e o RN à fonte de gases da ambulância.
Durante o transporte, com a equipa à cabeceira do doente, deverá proceder-se a:
- Verificação da permeabilidade das vias aéreas, da permeabilidade da venoclise, da expansão da caixa torácica, do funcionamento da bomba de perfusão;
- Monitorização da temperatura, das frequências respiratória e cardíaca, da SpO2, e da pressão arterial.
Na eventualidade de intercorrências durante a viagem (por ex. paragem cardiorrespiratória, obstrução das vias aéreas, extubação traqueal, pneumotórax, etc.) a ambulância deve efectuar paragem para facilitar a actuação emergente.
No caso de suspeita de pneumotórax, deve proceder-se, em condições de assépsia e após desinfecção da pele com solução antisséptica, a punção diagnóstica de emergência com seringa de 20 mL e agulha 21G, intercalando torneira de 3 vias; a punção deve fazer-se ao nível do IIº espaço intercostal na linha médio-clavicular do lado afectado, aspirando a seguir (seringa contendo soro fisiológico quando se efectua a operação pela primeira vez após punção; havendo ar ectópico no espaço pleural, observa-se “o borbulhar”). O ar aspirado é esvaziado em operações sucessivas rodando de cada vez a torneira para as posições de aspirar e esvaziar.
Este procedimento de emergência implica ulteriormente (na ambulância ou na UCIN) a eventual aplicação de drenagem permanente subaquática com dreno apropriado (II-IIIº espaço intercostal-linha axilar anterior ou Vº-VIº na linha axilar posterior) ligado a tubo de vidro passando através de tampa de frasco com líquido/soro fisiológico ou água estéreis, colocado em plano inferior ao doente; o comprimento do tubo em cm mergulhado abaixo do “nível de água” dá o valor da pressão negativa criada, em cm de H2O.
No caso de paragem cardiorrespiratória, há que proceder a manobras de reanimação neonatal (como no bloco de partos) implicando eventual re-entubação e ventilação manual com balão Ambu ou balão auto-insuflável, massagem cardíaca e administração de fármacos. (ver capítulo sobre “reanimação do RN”)
Admissão na UCIN
Trata-se do momento de “passagem de testemunho” da equipa de transporte à equipa do hospital receptor, havendo, em tal circunstância, oportunidade para:
- Relatar todos os eventos ocorridos durante o transporte, entregar a nota de transferência e resultados dos exames complementares de diagnóstico, caso existam e;
- Comentar aspectos relatados no relatório informativo de transferência que acompanha o doente.
BIBLIOGRAFIA
American Academy of Pediatrics.Task Force on Interhospital Transport. Guidelines for air and ground transport of neonatal and pediatric patients. Elk Grove Village /IL: American Academy of Pediatrics, 2000
American Academy of Pediatrics. Section on Transport Medicine. Guidelines for air and ground transport of neonatal and pediatric patients. Elk Grove Village /IL: American Academy of Pediatrics edition, 2007
Azzopardi DV, Strohm B, Edwards AD, et al. Moderate hypothermia to treat perinatal asphyxial encephalopathy. N Engl J Med 2009; 361: 1349-1358
Calheiros – Lobo JM, Pinho A, Fernandes MC, Laranjeira F. O transporte do recém-nascido. O Médico 1985; 117: 67-70
Cloherty JP, Eichenwald EC, Stark AR. Manual of Neonatal Care. Philadelphia: Lippincott Williamas & Wilkins, 2008
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Halliday H, McClure G, Reid M. Handbook of Neonatal Intensive Care. London: Baillère Tindall, 2004
Kattwinkel J(ed). Textbook of Neonatal Resuscitation. Dallas: American Academy of Pediatrics and American Heart Association, 2006
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lavaud J, Chabernaud JL, Barbier ML, et al. Réanimation et Transport Pédiatriques. Paris: Masson, 2001
Marba STM. Recomendações do Departamento de Neonatologia da Sociedade Brasileira de Pediatria. Transporte de recém-nascido de alto risco. Rio de Janeiro: edição da Sociedade Brasileira de Pediatria, 2011
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Neto MT. Perinatal care in Portugal: effects of 15 years of a regionalized system. Acta Paediatrica 2006; 95: 1349-1352
O’Reilly KM, Tooley J, Winterbottom S. Therapeutic hypothermia during neonatal transport. Acta Paediatr 2011; 100: 1084-1086
Silva L J. Aspectos do transporte do recém-nascido. Medicina 1981; 11: 45-52
Wyllie J. Recent changes to UK newborn resuscitation guidelines. Arch Dis Child Fetal Neonatal Ed 2012; 97: F4-F7