Definição e importância do problema
Descrito pela primeira vez em 1976, o vírus Ébola é altamente contagioso, patogénico e associado a elevada taxa de letalidade. Esta última, combinada com a ausência de tratamento e vacinação específicos, tornam-no uma ameaça para a saúde pública; por outro lado, tal agente microbiano constitui uma potencial arma de bioterrorismo.
Aspectos epidemiológicos
O vírus Ébola foi descoberto em 1976 em doentes com quadro de febre hemorrágica em dois locais próximos: inicialmente, no sul do Sudão e, depois, no norte do Zaire (actual República Democrática do Congo). O agente identificado foi nomeado de acordo com um rio no norte da República Democrática do Congo, o rio Ébola.
A posteriori foi reconhecido que as epidemias haviam sido provocadas por estirpes diferentes, a estirpe Sudão e Zaire, respectivamente.
Em 1994 foi identificada pela primeira vez a terceira espécie de vírus Ébola, a estirpe Côte d’Ivoire ou Tai Forest, isolada num etnólogo. Este tinha trabalhado na floresta Tai, na Costa do Marfim e realizado a autópsia de um chimpanzé originário de região onde tinham falecido vários pacientes afectados por febre hemorrágica.
A quarta espécie, a espécie Bundibugyo, isolada no Uganda em 2007, é geneticamente semelhante à estirpe Côte d’Ivoire. Por último, a espécie Reston, foi descrita em 1989 em Reston, nos Estados Unidos da América do Norte, em macacos importados das Filipinas; relativamente à mesma, não são conhecidos, até à data, casos de doença em seres humanos.
Desde a sua descoberta em 1976 até 2012, foram registados 2.387 casos de infecção por vírus Ébola e 1.590 mortes (taxa de letalidade 66,6%), designadamente, na África equatorial (Gabão, Sudão, República Democrática do Congo e Uganda), em que o vírus Ébola é endémico.
No final de 2013 a doença pela estirpe Zaire ebolavirus foi identificada pela primeira vez na África ocidental, mais precisamente na Guiné-Conacri, tendo sido confirmada pela Organização Mundial da Saúde (OMS) em Março de 2014.
Atingindo posteriormente os países vizinhos (Libéria, Serra Leoa, Nigéria, Senegal e Mali), segundo dados da OMS a infecção por vírus Ébola passou a ser considerada a maior epidemia da história da doença, tendo-se contabilizado, até Março de 2016, 28.608 casos confirmados, suspeitos e prováveis, incluindo 11.305 mortes.
O aparecimento da doença pela primeira vez numa zona urbana, a elevada densidade populacional dos países atingidos, o vasto movimento de pessoas entre estes, os rituais religiosos praticados e os precários cuidados de saúde são apontados como os principais factores causais da elevada magnitude da epidemia.
Na idade pediátrica registaram-se mais de 5.000 casos, com uma mortalidade de 80% em crianças abaixo dos 5 anos (e 95% abaixo de um ano de idade); estes valores são superiores aos registados nos adultos (faixa etária 15-44 anos, com mortalidade de 70,8%). De salientar que mais de 16.000 crianças ficaram órfãs.
Curiosamente, é baixa a proporção de crianças doentes (17%), não sendo conhecido o motivo pelo qual as crianças são menos atingidas do que os adultos. Equaciona-se que a incidência referida esteja relacionada, não só com uma menor susceptibilidade à infecção, mas também, e sobretudo, com uma menor exposição à doença.
Etiopatogénese
O género Ebolavirus é composto por vírus RNA de cadeia única, não segmentado, com 80 nm de diâmetro e comprimento variável que pode atingir 14.000 nm. Juntamente com o género Marburgvirus, constitui a família Filoviridae (do latim “filum”, filamentoso). (Figura 1)
Trata-se de vírus citoplasmáticos intracelulares que atingem principalmente as células endoteliais e os macrófagos (target cells). Sendo resistentes ao frio, e susceptíveis à radiação solar, à luz artificial, ao calor e a químicos como sabão, álcool e outros antissépticos, a sua sobrevivência depende do hospedeiro.
Vírus Ébola e Marburgo, embora antigenicamente distintos, causam doença semelhante, anteriormente classificada como “Febre hemorrágica”. Contudo, esta designação actualmente é considerada incorrecta para a Doença por Vírus Ébola (DVE), uma vez que, apenas numa baixa percentagem de doentes se desenvolve hemorragia significativa, habitualmente já na fase terminal.
Como referido anteriormente, são conhecidas cinco estirpes de vírus Ébola, apelidadas de acordo com a região onde foram identificadas pela primeira vez: Zaire, Sudão, Costa do Marfim (Tai forest ebolavirus), Bundibugyo e Reston.
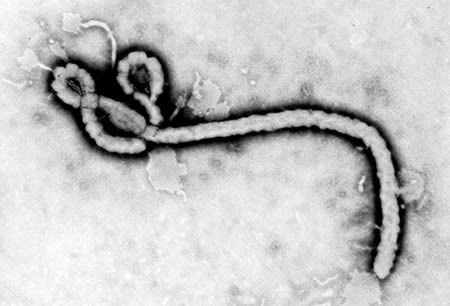
FIGURA 1. Estrutura do vírus Ébola (In Center for Disease Control and Prevention).
Destas, apenas a estirpe Reston não provoca doença conhecida no humano. A mais virulenta é a estirpe Zaire, com taxas de mortalidade 55%-85%, seguindo-se a estirpe Sudão, com taxas de 50%, e a Bundibugyo, com 30%. A estirpe Côte d’ Ivoire infectou apenas uma pessoa, que sobreviveu.
O vírus Ébola infecta apenas mamíferos, sendo a doença considerada uma zoonose. O principal reservatório animal é o morcego, cuja infecção é assintomática, ao contrário do que acontece nos restantes mamíferos. Sequências do genoma de Ebolavirus foram encontradas em três espécies de morcegos: Myonycteris torquata, morcego da fruta, implicado no surto de Ébola da África Ocidental, e dois morcegos da fruta, mais raros, o Hepomops franquetti e o Hypsignathus monstrosus, habitando na floresta da África central.
O vírus é transmitido ao Homem através do contacto com animais infectados, como morcegos, macacos e várias espécies de roedores. Por sua vez, o caso index transmite facilmente o vírus, atendendo à sua rápida replicação celular e elevada carga vírica no sangue e fluídos corporais.
O contágio faz-se através do contacto com órgãos, sangue ou outros fluidos corporais (saliva, urina, vómito) de doentes infectados, cadáveres ou materiais contaminados, não estando ainda esclarecidas outras possíveis vias de contágio em que o vírus foi identificado (leite materno e aerossóis).
Manifestações clínicas
Após um período de incubação, em média, de quatro a sete dias (limites ~ 2-21 dias), a doença manifesta-se de forma abrupta e inespecífica através de febre, astenia, mialgias, cefaleia frontal intensa e odinofagia (fase prodrómica com duração média de 10 dias).
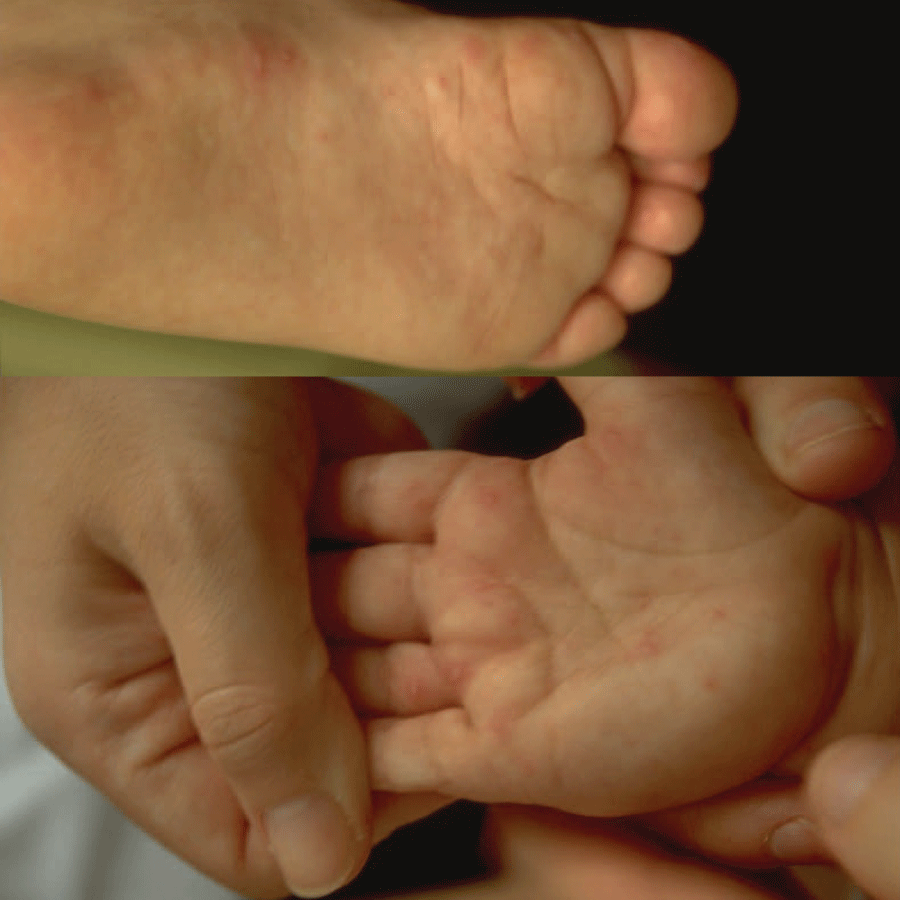
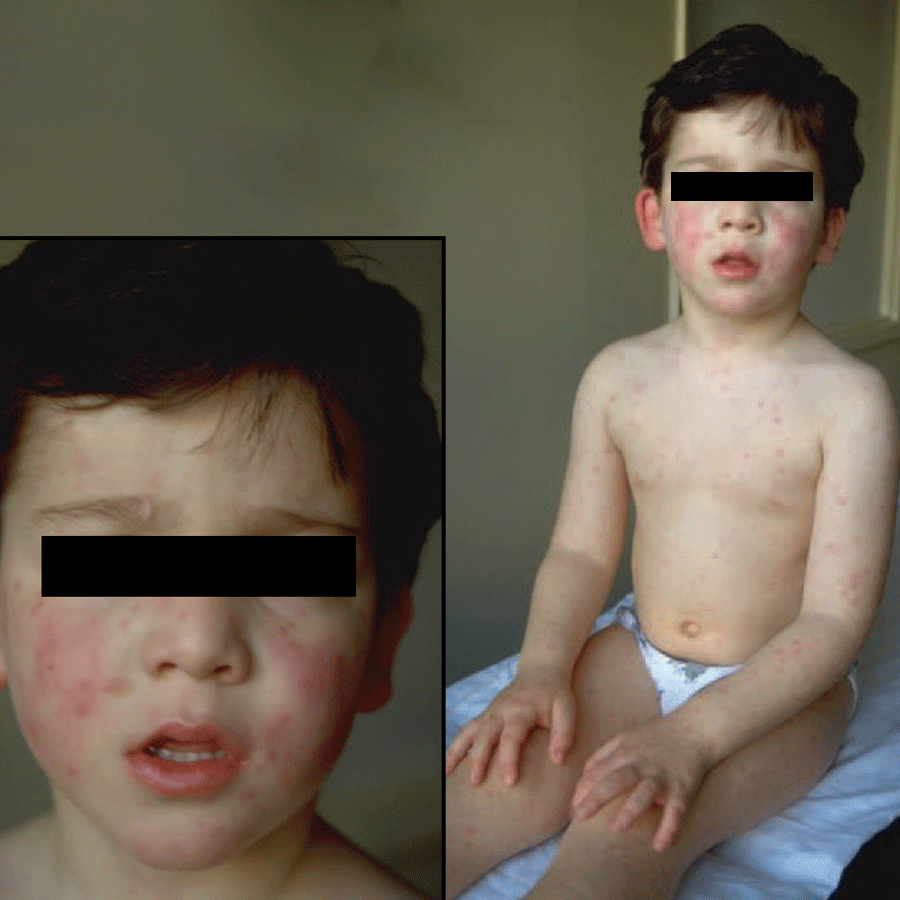
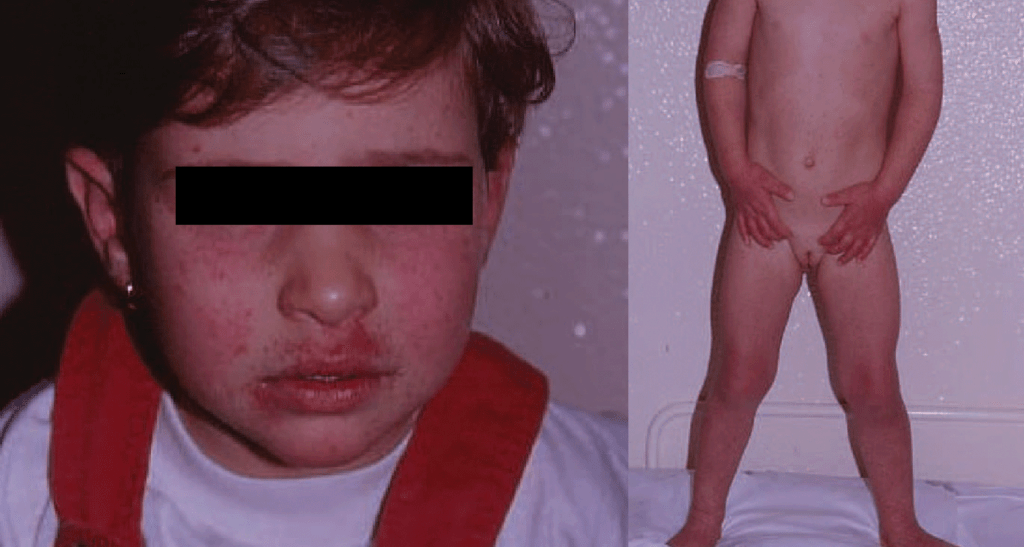
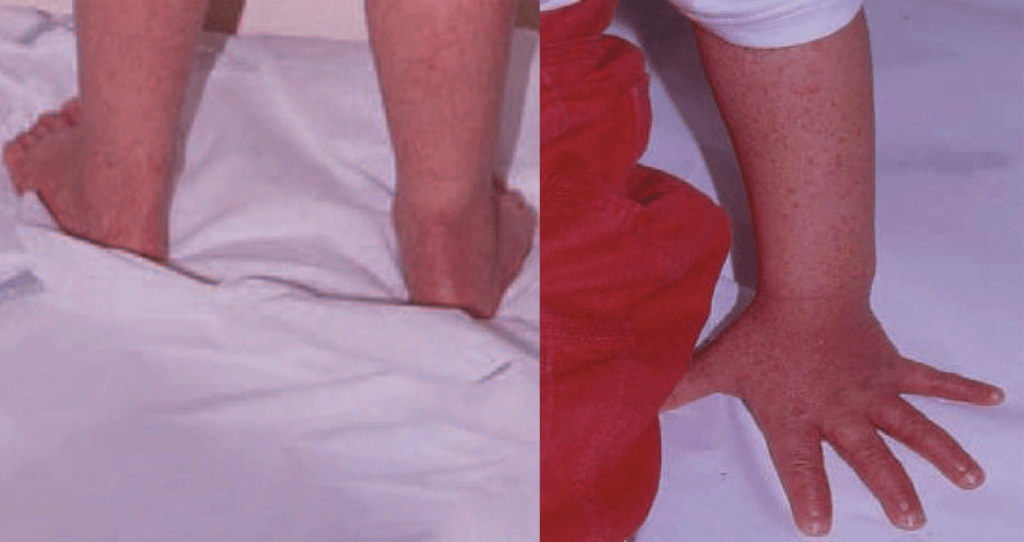
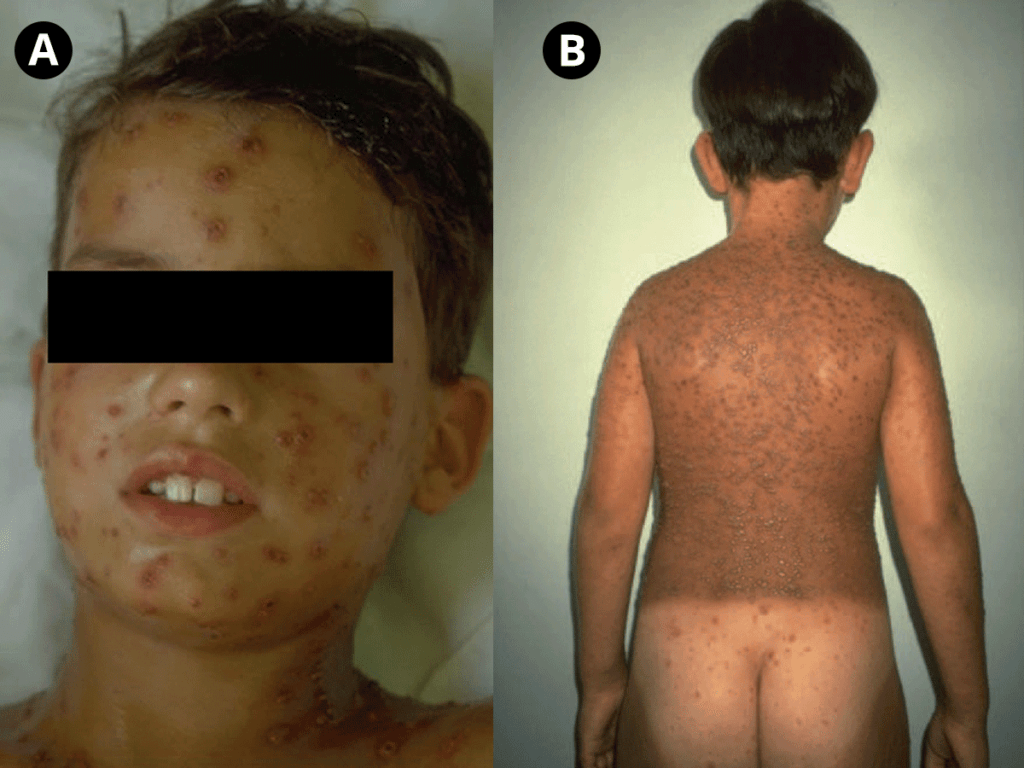
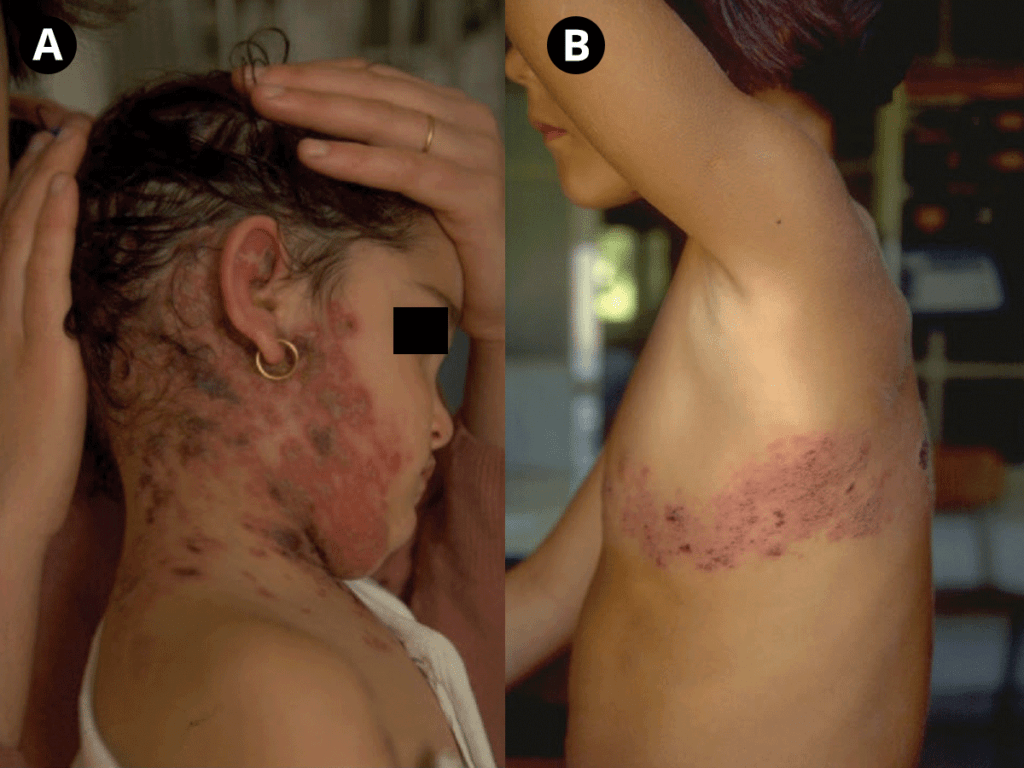
Cinco a sete dias após o início dos sintomas, surge exantema maculopapular não pruriginoso no tronco e membros superiores, que se generaliza, tornando-se frequentemente hemorrágico e, posteriormente, descamativo. O exantema é acompanhado de enantema do palato duro, conjuntivite e edema das mucosas.
Na segunda fase da doença surge envolvimento gastrintestinal traduzido por anorexia, náuseas, dor abdominal, vómitos e diarreia, que poderão provocar desidratação, hipotensão e choque. Pode ocorrer ainda envolvimento neurológico, incluindo meningoencefalite ao 10º dia (alteração do estado de consciência, convulsões, rigidez da nuca), e envolvimento ocular com uveíte ao 14º dia (fotofobia e visão “turva”).
Em mais de metade dos casos surgem sinais e sintomas de discrasia hemorrágica prolongada (sobretudo, diarreia com sangue, epistaxe, hematemese, petéquias, equimoses), traduzindo habitualmente a fase final de doença, com falência multiorgânica, coma e morte.
Diagnóstico
Caso suspeito
A OMS define como caso suspeito o que preenche os critérios descritos no Quadro 1
FONTE: Orientação da OMS nº 012/2014, actualizada a 13/11/2015, pela DGS: Doença por vírus Ébola. Definição de Caso e Procedimentos Gerais | ||
| Critérios clínicos | e | Critérios epidemiológicos |
Febre associada ou não aos seguintes sintomas/sinais:
Em estádios mais avançados da doença poderá ocorrer insuficiência renal e hepática, distúrbios da coagulação, entre os quais coagulação intravascular disseminada (CIVD) e evolução para falência multiorgânica. | Estadia (viagem ou residência) em área afectada num período de 21 dias antes do início dos sintomas. ou Contacto de proximidade com doente nos últimos 21 dias. | |
Caso provável
- Doente preenchendo os critérios de caso suspeito e tenha sido validado por profissional de saúde;
- Caso suspeito falecido no qual não tenha sido possível recolher produtos biológicos para análise, mas que tenha tido ligação epidemiológica comprovada com um caso confirmado, ou ligação epidemiológica a uma área afectada e sintomatologia compatível com doença por vírus Ébola.
Caso confirmado
Caso provável com confirmação laboratorial.
Exames complementares
Os resultados dos exames laboratoriais evidenciam: leucopénia (linfopénia e, posteriormente, neutrofilia; granulócitos imaturos e linfócitos anormais); trombocitopénia; elevação das transaminases; coagulopatia (tempo de protrombina e tempo parcial de tromboplastina prolongados, D-dímeros aumentados); insuficiência renal aguda (creatinina e ureia séricas aumentadas); proteinúria; distúrbios hidro-electrolíticos (hiponatrémia, hipocaliémia, hipomagnesiémia e hipocalcémia).
O diagnóstico é confirmado pela detecção de ARN, no sangue ou noutros fluidos corporais, por ensaio imunoenzimático, ou por teste de ácidos nucleicos (polymerase chain reaction ou PCR). Esta última técnica, com sensibilidade e especificidade elevadas, permite diagnóstico com rapidez; contudo, é dispendiosa.
Durante a epidemia de 2014-2015, foram usados testes rápidos para diagnóstico, através da identificação de sequências específicas de ARN no sangue do doente pela técnica de PCR (Rapid Test PCR). Na maioria dos casos, a infecção é detectada por este método, o qual permite identificar ARN do vírus três dias depois do início dos sintomas. A repetição do teste poderá ser necessária quando o mesmo tiver sido efectuado antes deste período de tempo. A doença é excluída se o resultado da PCR for negativo, passadas mais de 72 horas após o início dos sintomas.
Diagnóstico diferencial
O diagnóstico diferencial da DVE faz-se com gripe, malária, febre tifóide, sarampo, dengue, febre de Lassa, doença meningocócica e doença de Marburgo.
Actuação perante caso suspeito
Na presença de um doente que tenha estado até 21 dias antes em país atingido pelo surto de Ébola, e que apresente febre ou outra sintomatologia sugestiva (caso suspeito), deve: – evitar-se o contacto físico com outras pessoas; – manter-se uma distância mínima de dois metros; e – permanecer em área de isolamento com máscara cirúrgica. Cabe ao profissional de saúde calçar luvas e validar o caso suspeito através de linhas de apoio da DGS.
Caso se confirme que se trata, de facto, de um caso suspeito, este deve ser transferido para um dos hospitais de referência, onde ficará internado em quarto de isolamento com pressão negativa.
Somente os profissionais com formação específica e treinados podem ter contacto directo com o doente, e todo o material (de equipamento e de terapêutica) deve ser guardado no quarto. Todos os procedimentos, limitados ao necessário de forma a minorar a exposição à doença, devem ser efectuados utilizando o Equipamento de Protecção Individual (EPI).
Os produtos biológicos são posteriormente enviados em condições de segurança para o Instituto Nacional de Saúde Dr. Ricardo Jorge (INSA) para realização de PCR, habitualmente entre o 3º-10º dias após o início dos sintomas.
Deve ser realizado em simultâneo diagnóstico diferencial com infecção por vírus Marburgo e Lassa, e por Plasmodium sp.
Tratamento
Medidas gerais
Todos os doentes devem ser internados em isolamento para monitorização cardiorrespiratória, balanço hidroelectrolítico e tratamento de suporte. Este deve ser iniciado o mais precocemente, com o objectivo de evitar a depleção de volume intravascular, corrigir distúrbios como hiponatrémia, hipocaliémia, hipomagnesiémia e hipocalcémia) e evitar complicações do choque.
Volumes maciços de solutos cristalóides (soro fisiológico ou lactato de Ringer) poderão ser necessários. Outras medidas sintomáticas incluem analgésicos e antipiréticos, antieméticos, e derivados de sangue, em caso de coagulopatia ou hemorragia.
Sendo o vírus transmitido através do contacto directo ou indirecto com sangue ou outros fluidos corporais (incluindo urina, fezes, vómito, suor, lágrimas, sémen, leite materno e saliva), gotículas ou órgãos de doentes, reitera-se que todos os profissionais de saúde devem usar material de protecção adequado (EPI) e cumprir protocolos de prevenção da infecção no âmbito da assistência a estes doentes. A colocação e remoção correctas do EPI tem elevada importância. Salientando que o momento de remoção está associado a maior risco de contaminação, conclui-se que o mesmo deverá ser supervisionado por outro profissional treinado.
O EPI deve cobrir toda a pele e mucosas, deve ser impermeável, de uso único, e composto por: fato de bloco operatório, fato de protecção integral, bata, cogula, touca, óculos de protecção, viseira de protecção facial total, protecção respiratória (máscara FFP3), luvas e protecção de calçado.
Tratamento específico
Até à data, não estão aprovados fármacos específicos, quer para o tratamento de doentes infectados, quer para profilaxia pós-exposição. Importa referir que estão em estudo o favipiravir (análogo nucleósido que inibe a replicação de vírus ARN, disponível para crianças com idade superior a 1 ano) e o frincidofovir (análogo acíclico nucleósido em fase III de investigação, usado no tratamento de infecções porcitomegalovírus, poxvírus e outros vírus ADN).
Plasma e sangue de doentes convalescentes foram amplamente usados durante o surto da África ocidental. Porém, o seu benefício continua controverso dada a escassez de estudos aleatorizados duplamente cegos e de estudos que avaliem a sua eficácia enquanto tratamento isolado. Trata-se de uma terapêutica segura, sem efeitos secundários a curto prazo, prática, e com a vantagem de conferir anticorpos contra a estirpe do vírus em circulação durante um surto. Contudo, de acordo com os resultados dos estudos realizados nesta área, não se verificou diminuição da mortalidade com a sua utilização, excepto em crianças com menos de 5 anos e em grávidas. Por outro lado, existe a possibilidade de o plasma e o sangue administrados ter proveniência de convalescentes com coinfecções, eventualmente não detectadas quando a técnica não é realizada em condições adequadas, ou quando os dadores não são correctamente seleccionados. De salientar que este possível “cenário” poderá verificar-se em países em desenvolvimento durante um surto.
Vários estudos têm comprovado protecção contra o vírus em mamíferos não-humanos com a utilização de anticorpos monoclonais, em especial com ZMapp; este composto, resultando de uma combinação de três diferentes anticorpos monoclonais específicos do vírus Ébola, deve ser administrado em 3 doses (dias 0, 3 e 6). Tendo sido demonstrada a eficácia de tal terapêutica nas seguintes circunstâncias:
- No tratamento de macacos infectados sintomáticos; e
- Em dois profissionais de saúde que contraíram a doença durante o surto de 2015, poderá concluir-se que a mesma tem vantagens em relação à administração de plasma e sangue de doentes convalescentes. Contudo, não está disponível.
Prognóstico
Os doentes que sobrevivem, habitualmente mostram sinais de melhoria entre o 6º e 10º dias de doença, altura em que a virémia diminui e os resultados das serologias específicas evidenciam positividade (IgM e IgG). Nestes casos, a OMS recomenda a alta hospitalar dos doentes assintomáticos com dois testes negativos pela técnica PCR, com intervalo de 48 horas.
São considerados factores de mau prognóstico: idade superior a 45 anos; presença de manifestações gastrintestinais (diarreia), hipoxémia, hipotensão e choque; e carga vírica ≥ 10 milhões de cópias/mL.
Durante o surto da África Ocidental, foram identificadas várias sequelas de início precoce durante a recrudescência, admitindo-se estarem relacionadas com uma elevada carga vírica durante a infecção. As manifestações mais frequentes são: articulares (artralgia em 76% dos casos, sobretudo oligoarticular e bilateral), oftalmológicas em 60% (visão “turva” 38%, uveíte 18%) e auditivas (24%, sendo mais frequentes os acufenos e diminuição subjectiva da acuidade auditiva).
Nas crianças e adolescentes, a prevalência de sequelas precoces é mais baixa, de acordo com estudo realizado na Serra Leoa: uveíte – 20%, e restantes manifestações oculares – 22%; sequelas auditivas – 22%, e artralgias – 20%.
Recorrência e reactivação
O vírus pode persistir em locais imunologicamente protegidos, como leite humano, sémen, fluidos vaginais, urina, suor e humor aquoso, levando ao reaparecimento de sintomas em sobreviventes, isto é, à recorrência. O potencial de infecção é confirmado através de exame cultural, e não por PCR, esta última negativando mais tardiamente. A persistência do vírus nestes locais tem como risco a transmissão do mesmo a partir de indivíduos assintomáticos ou em recrudescência, bem como o risco de reactivação da DVE.
O fenómeno de reactivação foi pela primeira vez comprovado numa médica, na qual se desenvolveu uveíte nove semanas após DVE (situação clínica associada a vírus viável no humor aquoso). Posteriormente, o fenómeno de reactivação verificou-se também: – em doentes com meningite e vírus Ébola viável no LCR; e – em grávidas com virémia negativa, mas com carga vírica persistente no líquido amniótico, placenta e no feto. Esta última situação tem como implicações práticas a necessidade de protecção durante o parto.
A transmissão da DVE através de fluidos de doentes assintomáticos que recuperaram da DVE ainda não é certa, tendo sido comprovada apenas num caso em que houve contágio por via sexual, 6 meses depois, verificando-se similitude do perfil genético da estirpe identificada nos dois doentes. O reconhecimento desta via de transmissão é de elevada importância para a Pediatria, pelo risco de transmissão vertical e pelas opções relativamente ao aleitamento materno.
Para além da persistência crónica do vírus, há também risco de reinfecção, ou seja, de susceptibilidade para novas infecções por vírus Ébola em sobreviventes. Este aspecto é controverso pois, apesar de se considerar imune um doente que tenha tido DVE, na verdade sabe-se que perante elevada carga vírica, pode haver reinfecção. Este risco é muito variável, mas alerta para a necessidade de indivíduos, que tenham tido DVE, continuarem a usar meios de protecção ao contactar com doentes, especialmente profissionais de saúde.
Notas importantes:
1 – O nível de anticorpos necessário para conferir protecção ainda não está determinado; 2 – A carga vírica necessária para haver reinfecção também ainda não está determinada.
Prevenção
- O cumprimento de medidas de prevenção e controlo da doença, bem como o uso de equipamentos de protecção pessoal pelos profissionais de saúde, são essenciais para o controlo do surto.
- Por outro lado, todos os indivíduos assintomáticos, que tenham sido expostos ao vírus, devem ser vigiados durante 21 dias após o último contacto com o doente de forma a identificar precocemente sinais e sintomas da doença.
- A transmissão assintomática por outros fluidos, nomeadamente leite materno e por via sexual, continua controversa, obrigando a medidas de protecção após recuperação clínica por um período de tempo ainda indeterminado.
- O vírus Ébola permanece no leite materno até 15 dias após o início dos sintomas; todavia, até à data, não está comprovado que o aleitamento com leite humano seja uma via de transmissão.
- Ainda assim, mães com suspeita de infecção não devem amamentar até exclusão da doença. Contudo, a OMS alerta para o risco-benefício desta medida em países em desenvolvimento, uma vez que o risco de desnutrição e de infecções é superior ao risco de contágio.
- Relativamente à via sexual, devem ser usados métodos barreira durante 12 meses após a cura, uma vez que o vírus permanece em fluidos corporais (no sémen até nove meses e em secreções vaginais até um mês), mesmo na ausência de virémia.
- Tal como já referido anteriormente, devem ser usados meios de protecção durante o parto de grávidas que tenham tido DVE.
- Por fim, apesar de não ter sido provado cientificamente em oito estudos publicados que o vírus está presente na saliva, vómito e expectoração durante a fase de convalescença, são necessários mais estudos para confirmar este facto.
- Várias vacinas encontram-se em fase experimental, não tendo sido aprovada nenhuma até à actualidade.
- Demonstrou-se que duas das referidas vacinas são seguras e imunogénicas:
- uma, incluindo adenovírus tipo 3 de chimpanzé (ChAd3) com glicoproteínas de superfície da estirpe Zaire ebolavirus; e
- outra, que usa o vírus da estomatite vesicular (VSV) com glicoproteínas
- Relativamente a esta última (em fase III de estudo), admite-se que possa prevenir a doença quando administrada após exposição.
BIBLIOGRAFIA
Bouazza N. Favipiravir for children with Ebola. Lancet 2015;14:603-604
Bray M. Epidemiology and pathogenesis of Ebola virus disease. Up to Date. Waltham MA: Wolters Kluwer, 2019
Bray M, Chertow D. Treatment and prevention of Ebola virus disease. Up to Date. Waltham MA: Wolters Kluwer, 2019
Bray M, Chertow D. Clinical manifestations and diagnosis of Ebola virus disease. Up to Date. Waltham MA: Wolters Kluwer, 2019
Burki T. Ebola virus vaccine receives prequalification. Lancet 2019;394:1893. www.thelancet.com
Cherry J, Demmler-Harrison GJ, Kaplan SL, Steinbach WJ, Hotez P (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
Chughtai AA, Barnes M, Macintyre CR. Persistence of Ebola virus in various body fluids during convalescence: evidence and implications for disease transmission and control. Epidemiol Infect 2016;1:9-11
Feldmann H, Sprecher A, Geisbert TW. Ebola. NEJM 2020;382:1832-1842
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gavotto A, Muanza B, Delion F, et al. Chikungunya disease among infants in French West Indies during the 2014 outbreak. Arch Pédiatr 2019;26:259-262
Goldman L, Schafer AI (eds). Goldman – Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Gostin L, Phelan A, Coutinho AG, et al. Ebola in the Democratic Republic of the Congo: time to sound a global alert? Lancet 2019;393:617-620
Henwood PC. Imaging an outbreak-ultrasound in an Ebola treatment unit. NEJM 2019;381:6-9
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: McGraw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Kourtis AP. Ebola Virus Disease – Focus on Children. Pediatr Infect Dis J 2015;34:893-897
Lamontagne F, Clément C, Kojan R, et al. The evolution of supportive care for Ebola virus disease. Lancet 2019;393:620-621
MacIntyre CR, Chughtai AA. Recurrence and reinfection- a new paradigm for the management of Ebola virus disease. Int J Infect Dis 2016;43:58-61
Mattia JG, Vandy MJ, Chang JC, et al. Early clinical sequelae of Ebola virus disease in Sierra Leone: a cross-sectional study. Lancet Infect Dis 2016;16:331-338
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nina J. Ebolavirosis: a 2014 Review for clinicians. Acta Med Port 2014;27:625-633
Olupot-Olupot P. Ebola in children. Epidemiology, clinical features, diagnosis and outcomes. Pediatr Infect Dis J 2015;34:314-316
Regules JA, Beigel JH, Paolino KM, et al. A Recombinant vesicular stomatitis virus Ebola vaccine-preliminary report. N Engl J Med 2015. online. DOI: 10.1056/NEJMoa1414216.
Trapido J. Ebola: public trust, intermediaries, and rumour in the DR Congo. Lancet Infect Dis 2019;19:457-458
Uyeki TM, Mehta AK, Davey RT, et al. Clinical management of Ebola virus disease in the United States and Europe. N Engl J Med 2016;374:636-646
van Griensven J, Edwards T, de Lamballerie X, et al. Evaluation of convalescent plasma for Ebola virus disease in Guinea. N Engl J Med 2016;374:33-42
van Griensven J, De Weiggheleire A, Delamou A, et al. The use of Ebola convalescent plasma to treat Ebola virus disease in resource-constrained settings: a perspective from the field. Clin Infect Dis 2016;62:69-74
World Health Organization, Ebola Data and Statistics, March 2016. Geneva: WHO ed, 2016
World Health Organization Ebola Response Team, Agua-Agum J, Ariyarajah A, et al. Ebola virus disease among children in West Africa. N Engl J Med 2015;372:1274-1277