Nomenclatura e importância do problema
Os Enterovírus (EV) pertencem à família Picornaviridae e englobam grande número de patogénios responsáveis por um espectro alargado de doenças. São constituídos por RNA de cadeia simples, rodeado por uma cápside que compreende 60 cópias de 4 proteínas víricas designadas respectivamente por VP1, VP2, VP3 e VP4, sem invólucro lipídico.
Anteriormente, a sua classificação era baseada no potencial patogénico observado em humanos e ratos, integrando 5 grupos diferentes: Poliovirus (serótipos 1-3), Coxsackievirus A (serótipos 1-22 e 24), Coxsackievirus B (serótipos 1-6), Echovirus (serótipos 1-9, 11-21, 24-27, 29-33) e Enterovirus (serótipos 68-71).
Actualmente, a classificação dos EV tem em conta as propriedades moleculares, antigénicas e biológicas dos vírus, resultando assim respectivamente em 5 diferentes espécies de EV Humanos: Poliovirus, Human Enterovirus-A (HEV-A), HEV-B, HEV-C e HEV-D. De referir que os primeiros Para-Echovirus Humanos (HPeV) foram descritos anteriormente como Echovirus 22 e 23, pertencendo ao género EV. Na actualidade estão descritos mais de 10 HPev, pertencentes a um género próprio.
Os tipos dos enterovírus distinguem-se por diferenças quanto a antigénios e quanto a sequências genéticas. Embora tenham sido identificados mais de 100, a maioria dos casos de doença é explicada por 10-15 dos mesmos. Diferentes tipos de EV estão associados a determinadas manifestações clínicas.
Algumas das suas mais importantes características físicas e biológicas incluem a capacidade de actuar perante um grande espectro de pH (3 a 10), resistência ao éter e etanol, e inactivação a temperaturas superiores a 50ºC.
As infecções por EV, muito frequentes na idade pediátrica, são habitualmente responsáveis por sintomas ligeiros, como doença das vias respiratórias superiores ou exantema febril.
No entanto, podem também ser responsáveis por um quadro clínico com gravidade, principalmente no período neonatal.
Surtos de infecção por EV têm sido descritos, tais como:
- O surto de EV-D68, que causou um elevado número de casos de insuficiência respiratória em crianças nos Estados Unidos em 2014; e
- O surto de EV-71, que tem vindo a causar inúmeras mortes por rombencefalite e disfunção multiorgânica no Sueste Asiático nos últimos 40 anos.
Aspectos epidemiológicos
Os enterovírus têm uma distribuição mundial. Nos climas temperados ocorrem surtos de infecções sobretudo no Verão e início do Outono. Nos trópicos não se verifica incidência sazonal.
As respectivas infecções são responsáveis por cerca de 30%-60% das doenças febris agudas, e por cerca de 50% dos casos hospitalizados com suspeita de sépsis, de acordo com dados estatísticos de países americanos e europeus.
São considerados factores de risco: idades mais baixas, deficientes condições de higiene e saneamento, baixo nível socioeconómico e aglomerados de pessoas e crianças em infantários, escolas, e deficientes condições de habitação em geral.
A transmissão dos EV ocorre predominantemente por via directa ou indirecta de contacto fecal-oral com pessoas infectadas com o vírus.
Por exemplo, o contacto directo com fezes ocorre em actividades simples como mudar a fralda.
A transmissão indirecta pode ocorrer por más condições sanitárias e inclui água contaminada e superfícies. Pode também haver transmissão através de secreções respiratórias, mais frequente em alguns serótipos, nomeadamente Coxsackievirus A21.
O período de incubação é difícil de determinar com precisão, podendo variar de acordo com a apresentação clínica e com o vírus. Nos casos de doença febril aguda, é geralmente de 3 a 5 dias, exceptuam-se os casos de conjuntivite hemorrágica, de 24-72 horas.
A excreção do vírus pelo tracto respiratório superior em doentes infectados permanece durante cerca de 1 a 3 semanas e, pelas fezes, durante cerca de 3 a 8 semanas.
O período de maior contágio verifica-se provavelmente nas primeiras duas semanas após infecção aguda.
Etiopatogénese
Muito do que se sabe da etiopatogénese dos enterovírus foi extrapolado de estudos da infecção por poliovírus. Após a aquisição do vírus, a replicação inicial ocorre na faringe e íleo terminal. A ausência de invólucro lipídico favorece a sobrevivência no tracto gastrintestinal.
Por outro lado, diversas macromoléculas da superfície celular funcionam como receptores para o vírus: receptor para Adenovirus-Coxsackievirus, molécula intercelular de adesão 1 (ICAM-1), antigénio VLA-2 e proteína DAF/CD55.
A replicação inicial na faringe e intestino é seguida por uma virémia minor que possibilita a disseminação do vírus por via hematogénica para os tecidos linfóides (amígdalas, placas de Peyer e gânglios regionais).
A resposta imune do hospedeiro poderá limitar a replicação e progressão para além do sistema retículo-endotelial, do que resultará infecção subclínica.
Nos casos em que não se verifica o processo de limitação da replicação, a multiplicação subsequente faz com que haja uma virémia major, coincidente com o início da sintomatologia, sendo atingidos o SNC, coração e pele (forma sintomática).
De salientar que o tropismo para determinados órgãos-alvo é determinado em parte pelo serótipo.
Uma vez atingidos os órgãos-alvo (SNC, coração, fígado, pulmões, pâncreas, rins, músculo, pele), os mesmos são lesados em função de processo de necrose local (citólise) e de resposta inflamatória imunomediada, sendo que a resposta inflamatória poderá passar à cronicidade, sem a presença do vírus, após a sua eliminação. Como resultado da persistência possível de certos Enterovirus (por ex. Coxsackie B) poderá surgir cardiomiopatia dilatada.
A resposta imune ao EV é específica para cada um dos seus diferentes serótipos e, como tal, a reinfecção por um determinado serótipo é, em regra, assintomática.
A imunidade humoral tem um papel fundamental, não só na resposta à infecção aguda, mas também na prevenção da reinfecção; contudo, isoladamente, não é suficiente para bloquear a replicação in vitro.
A proteína da cápside VP1 é o alvo preferencial do anticorpo neutralizante, o qual confere imunidade duradoura para a doença provocada pelo mesmo serótipo.
O papel dos macrófagos na infecção por EV é essencial para a depuração do vírus, ao contrário da resposta celular mediada por linfócitos T, que não parece contribuir significativamente para a eliminação do vírus.
Certos hospedeiros são mais susceptíveis a infecções graves, nomeadamente:
- No período neonatal: recém-nascidos infectados pelas suas mães no período perinatal, ou ainda;
- Portadores de imunodeficiências congénitas ou adquiridas que poderão originar situações de infecção crónica;
- Pacientes padecendo de agamaglobulinémia: possibilidade de a infecção por EV poder cursar com meningoencefalite crónica devastadora.
Manifestações clínicas
Em cerca de 90% dos casos as infecções são subclínicas; quando sintomáticas, cursam geralmente com síndroma febril ou doença respiratória inespecífica. Nos pacientes sintomáticos, o espectro e a gravidade da doença dependem do serótipo de EV assim como de factores do hospedeiro, como a idade, o sexo e o respectivo tipo de resposta imunológica, a ausência ou presença de memória imunológica. A probabilidade de doença sintomática é tanto maior quanto menor a idade da criança.
Apenas numa pequena proporção de casos se verificam manifestações clínicas graves como miocardite, meningoencefalite, rombencefalite ou sépsis. No que respeita à gravidade, ela será provavelmente maior nos extremos da faixa etária pediátrica (RN e adolescentes).
De referir contudo que, mesmo nos casos ligeiros ou assintomáticos se pode verificar excreção do vírus, o que constitui fonte de disseminação da infecção.
Tendo sido referido antes que este capítulo não incluía o Poliovirus, como complemento, sugere-se a leitura do capítulo sobre doenças neuromusculares, o qual aborda, de modo sucinto, aspectos clínicos da poliomielite na alínea relacionada com o diagnóstico diferencial.
Seguidamente são sistematizadas as principais formas clínicas das infecções por enterovírus. (Quadro 1)
QUADRO 1 – Manifestações clínicas associadas à infecção por Enterovírus.
| Quadro clínico | Particularidades |
| S. febril inespecífica | Todos os serótipos de enterovírus |
| Paralisia | Mais comum com poliovírus, mas também enterovírus, especialmente enterovírus 71 |
| Meningite | Todos os enterovírus, sobretudo antes dos 5 anos de idade |
| Encefalite/meningoencefalite Rombencefalite | Generalizada ou focal, associada a meningite (na maioria dos casos, recuperação sem défice neurológico) |
| Doença mão-pé-boca | Coxsackie A16, A5, A7, A9, A10, e B2, B5, e enterovírus 71 (formas mais graves) |
| Herpangina | Geralmente por coxsackie A; por vezes enterovírus 71 |
| Pleurodinia epidémica (doença de Bornholm) | Por coxsackie B3, B5, B1, B2, ECHO vírus 1 e 6, e enterovírus 71 (formas mais graves) |
| Miocardite | Sobretudo por coxsackie B. Pode surgir no período neonatal com elevada taxa de mortalidade. No adulto raramente é fatal |
| Exantema | Por diversos tipos de coxsackie A, B, e ECHO vírus |
| Infecção neonatal | Alguns serótipos de coxsackie B e ECHO vírus. A transmissão ocorre durante o parto e os sinais são variáveis (desde intercorrência febril até doença multissistémica fulminante e morte) |
| Conjuntivite hemorrágica | Vários serótipos de enterovírus (sobretudo coxsackie A24 e enterovírus 11, 19 e 70) |
| Pancreatite/diabetes | Por coxsackie B |
Doença “mão-pé-boca” (hand-foot-mouth)
Muito comum em idade pediátrica (especialmente crianças com menos de 5 anos), caracteriza-se por febre, vesículas na cavidade oral (Figura 1), mucosa bucal, palato, língua e lábios. Nas mãos e pés predominam vesículas (de 3-7 mm), sobretudo na palma e planta. Após ulceração das vesículas, observa-se pequena “cratera” amarelada (de 4-8 mm) com orla vermelha. (Figura 2)
Nas nádegas predominam as lesões exantemáticas maculopapulosas (não incluem vesículas), progredindo para as coxas e podendo originar confusão, por vezes com o padrão morfológico encontrado na púrpura de Henoch-Schonlein.
A Figura 3 mostra aspecto de exantema por enterovírus, ao nível da face, tronco, membros e dorso das mãos.
O período de incubação é, geralmente, de 3 a 5 dias e a doença habitualmente resolve-se em 2 a 3 dias sem outras complicações. Coxsackievirus A (nomeadamente A16, na Europa) são responsáveis pela maior parte dos casos descritos.
A doença é moderadamente contagiosa e o vírus pode persistir no organismo durante várias semanas após a fase aguda, permitindo que o vírus se continue a transmitir.
Nos últimos anos têm sido descritos casos de “doença mão-pé-boca” atípica: febre mais elevada, maior duração, envolvimento cutâneo mais extenso, com lesões vesículo-bolhosas atingindo também a face dorsal das mãos e pés, e superfícies extensoras dos membros e períneo.
Nas crianças com eczema atópico pode haver atingimento preferencial das zonas de eczema (eczema coxsackium). Em muitos casos ocorre descamação palmo-plantar e onicomadese (separação da unha a nível proximal do leito ungueal) 2-6 semanas após o quadro agudo. Na sua maioria, tal forma clínica é associada ao vírus Coxsackievirus A6.
Herpangina
Nesta forma clínica verifica-se início súbito de febre elevada, odinofagia e lesões na faringe posterior acompanhadas de anorexia; nas crianças mais velhas há queixas de cefaleias, cervicalgias, vómitos, dor abdominal e disfagia.
No exame objectivo destacam-se lesões papulovesiculares na orofaringe, nomeadamente pilares anteriores das amígdalas, véu do paladar e úvula. Estas pequenas vesículas (1-2 mm) ulceram em 2-3 dias, ampliando-se as lesões ulcerosas para 3-4 mm; rapidamente, as úlceras podem atingir 10 mm de diâmetro com halo vermelho circundante. A herpangina é, em regra, uma doença benigna.
Meningite
A meningite asséptica afecta frequentemente crianças com idades inferiores a um ano de idade. Em mais de 90% dos casos, os enterovírus são o agente responsável, sendo que a grande maioria pertence ao Coxsackievirus B e Echovirus.
As manifestações clínicas dependem do grupo etário. Nos recém-nascidos, manifesta-se habitualmente com febre acompanhada de outros sinais inespecíficos (diminuição da ingesta alimentar, vómitos, diarreia) e fontanela abaulada. Em crianças mais velhas predomina febre, irritabilidade, cefaleias, náuseas, vómitos, fotofobia e rigidez da nuca.
A doença é autolimitada, observando-se recuperação entre 3 a 7 dias após o início da sintomatologia.
Encefalite
Os enterovírus são agentes pouco frequentes de encefalite aguda (responsáveis por cerca de 5% de todos os casos). Vários serótipos já foram implicados na etiologia desta doença, sendo que os Coxsackievirus dos tipos A9, B2 e B5 e os Echovirus dos tipos 6 e 9 correspondem aos serótipos mais frequentemente associados. A encefalite por enterovírus ocorre em todas as idades mas tem maior incidência em crianças e jovens adultos; o seu prognóstico é mais favorável do que o da encefalite causada por outros agentes (HSV, arbovirus).
A meningoencefalite por vírus foi abordada anteriormente, em capítulo próprio, no grupo “Síndromas infecciosas”.
Pleurodinia (Doença de Bornholm)
Esta forma de apresentação de infecção por enterovírus, podendo ocorrer tanto de modo esporádico como epidémico, caracteriza-se por dor tóraco-abdominal paroxística devida a miosite, atingindo os músculos da parede torácica e abdominal.
Nas crianças pequenas as dores abdominais assemelham-se a cólicas. Acompanhada de mal-estar, cefaleia e febre, a doença agrava-se com a tosse, movimentos respiratórios, expiração forçada ou outros movimentos. Em geral evoluindo durante 3-6 dias, pode manifestar-se de modo intermitente (padrão bifásico) durante semanas, pode estar associada a miocardite, pericardite, orquite e meningite.
O serótipo mais frequentemente envolvido nesta apresentação é o Coxsackievirus grupo B, sendo também descritos outros serótipos de forma esporádica como o Echovirus 1, 6, 9 e 19, e ainda, Coxsackievirus A 4, 6, 9 e 10.
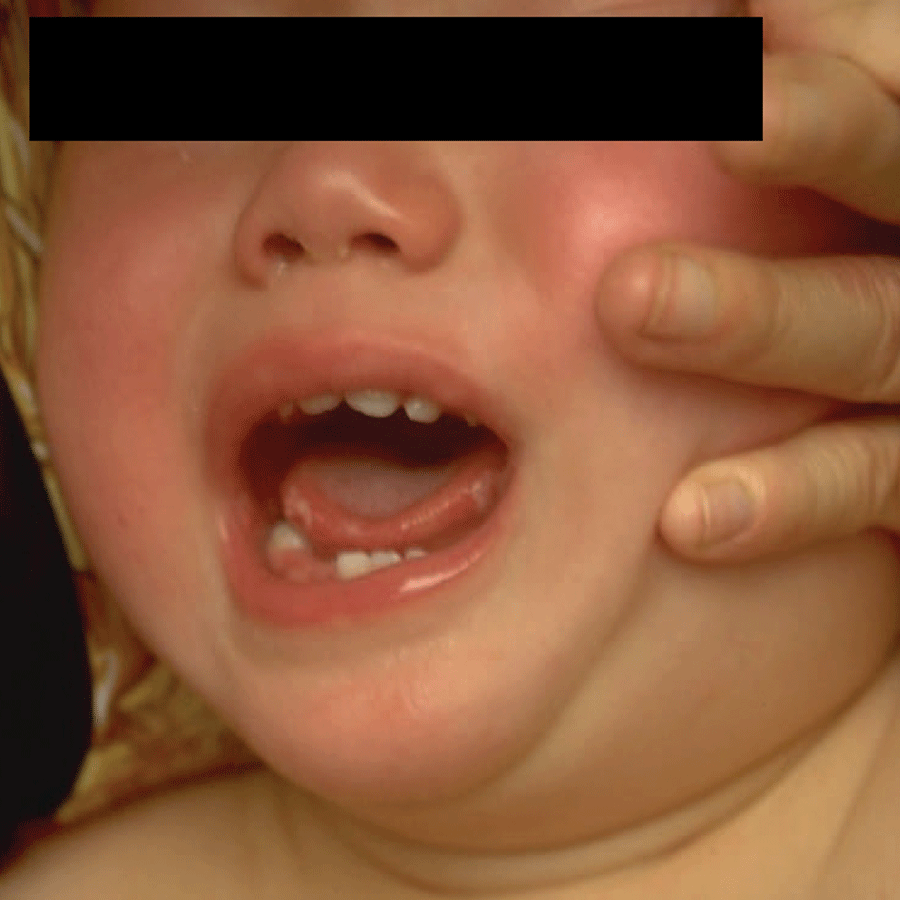
FIGURA 1. Estomatite. (NIHDE)
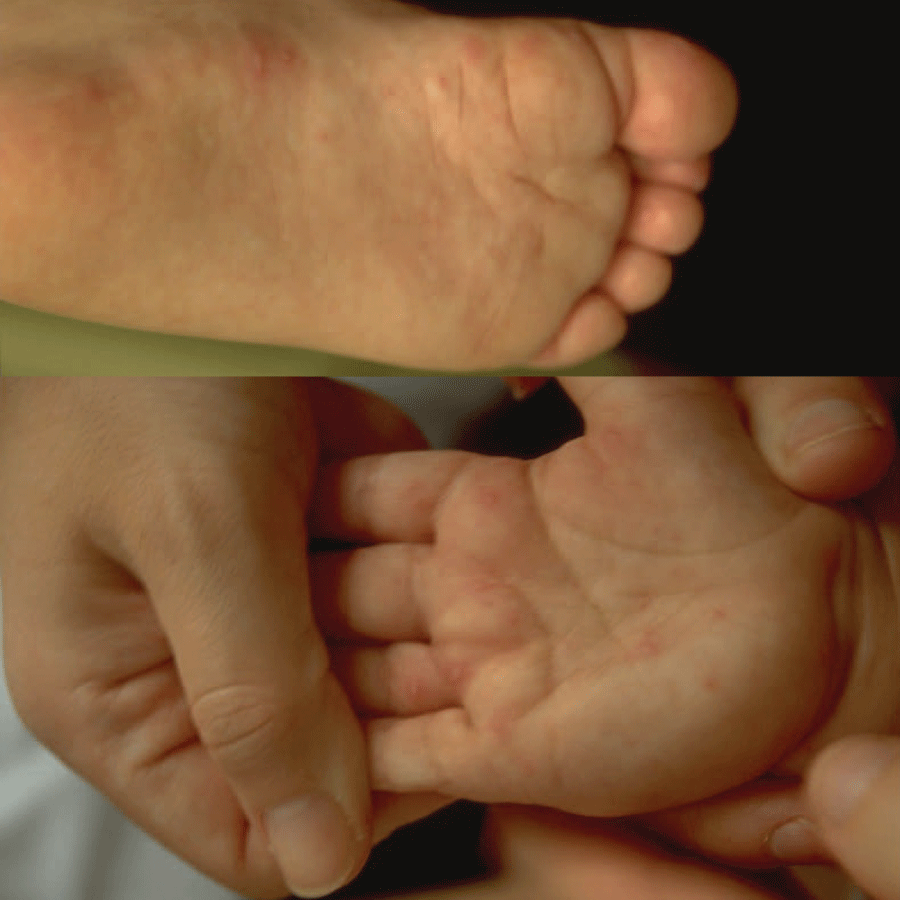
FIGURA 2. Lesões maculopapulosas nas palmas das mãos e plantas dos pés. (NIHDE)
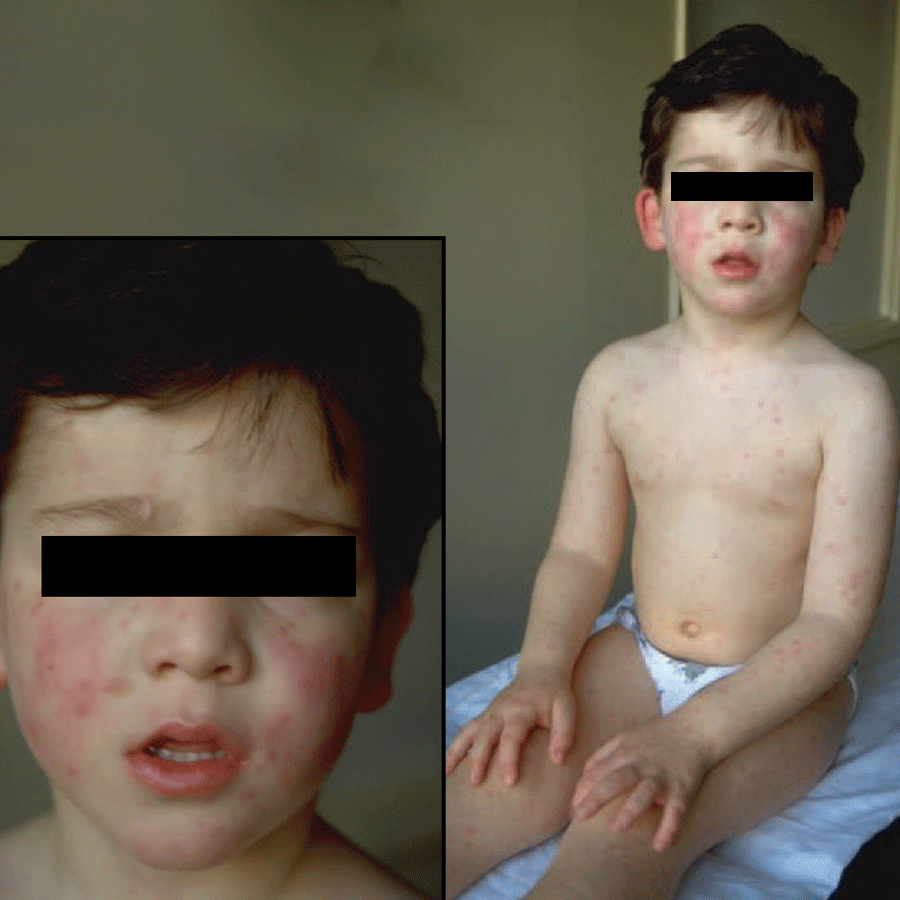
FIGURA 3. Exantema da face, tronco e membros. (NIHDE)
Conjuntivite hemorrágica
A conjuntivite hemorrágica aguda é outra forma de manifestação de infecção por EV, que consiste em dor ocular, edema palpebral e hemorragia subconjuntival. Surge depois exsudado, inicialmente seroso, passando a mucopurulento por sobreinfecção bacteriana.
A febre é rara, mas pode verificar-se associação a faringite (a chamada febre faringoconjuntival, também presente nas infecções por Adenovírus).
O processo na sua evolução natural dura cerca de 10 dias. Apesar de exuberante, tal evolução é geralmente autolimitada e com percurso benigno.
Em casos mais graves, pode persistir ceratite por várias semanas e, se o agente etiológico for o Enterovirus D70, podem existir complicações intracranianas. As formas associadas a Enterovírus 11 e 19 comportam maior risco de complicações: ceratite, coriorretinite, uveíte, retinite ou glaucoma.
Miopericardite
Esta doença é mais frequente no pequeno lactente, nomeadamente no recém-nascido. A sua gravidade varia desde casos assintomáticos até a insuficiência cardíaca fulminante e morte. Os EV mais frequentemente responsáveis são os Coxsackievirus grupo B.
Rombencefalite
Esta forma clínica (encefalite do tronco cerebral associada ao enterovírus/ EV-A71) é considerada actualmente um problema emergente de saúde pública, sobretudo na Ásia, onde é responsável por epidemias recorrentes. Pode surgir na sequência de herpangina ou de “doença mão-pé-boca”, seguindo-se o atingimento do tronco cerebral e instalação por fases de um quadro clínico grave:
- Abalos mioclónicos associados a tremor e/ou ataxia;
- Mioclonias transitórias associadas a compromisso dos nervos cranianos, seguindo-se dificuldade respiratória por edema pulmonar neurogénico, cianose, choque, coma e apneia;
- Forma mais grave comportando mortalidade ~ 70% com sintomatologia semelhante à descrita em I e II, mas associada a diplegia facial, ataxia, disartria, oftalmoplegia internuclear e apneia de causa central e sequelas graves tais como tetraplegia espástica.
O prognóstico da rombencefalite é extremamente reservado. Nos últimos anos foram já descritos inúmeros casos de síndroma mão-pé-boca por EV-A71 na Europa e recentemente já houve casos de rombencefalite por este agente nalguns países Europeus (incluindo Portugal).
Pneumonia e paralisia flácida
No Verão de 2014 houve nos Estados Unidos da América um surto de pneumonia com insuficiência respiratória aguda que atingiu todos os estados. Este surto, causado pelo Enterovirus D68, partilha muitas das características dos Rhinovirus (sobrevivência a temperaturas de 33ºC, intolerância a ambientes ácidos); assim, não se estranha que apresente tropismo especial pelo aparelho respiratório.
No decorrer deste surto, foi identificado um aumento exponencial do número de casos de crianças com quadro agudo de paralisia flácida e disfunção de pares cranianos. Apesar de não se ter identificado Enterovírus D68 no SNC, foi estabelecida uma relação causal.
De referir que a paralisia flácida aguda devida a enterovírus não pólio é mais ligeira do que a provocada pela infecção por poliovírus.
Exames complementares e diagnóstico
Apesar de o diagnóstico ser, em regra, clínico, o diagnóstico laboratorial de uma infecção por EV pode ser obtido por isolamento e identificação do vírus em cultura celular, detecção do RNA do vírus por PCR (reacção em cadeia da polimerase), ou por métodos serológicos.
- A identificação do EV em cultura celular é conseguida com base no efeito citopatogénico directo produzido pelo vírus em células cultivadas; tal identificação pode ser efectuada em diversos produtos biológicos (sangue, LCR, fezes, secreções respiratórias).
Trata-se dum método relativamente sensível, permitindo a realização de serotipagem para estudos clínicos e epidemiológicos; contudo, é demorado (3-8 dias), dispendioso e não se encontra disponível em todos os centros.
Actualmente, a cultura celular não se justifica para diagnóstico clínico; por outro lado tem interesse para determinação de serótipos de enterovírus identificados previamente em amostras de produtos biológicos pelo método molecular PCR. - No âmbito das técnicas de amplificação genómica, cabe salientar que a PCR constitui a técnica mais útil sob o ponto de vista clínico, designadamente por permitir maior rapidez na obtenção do resultado, estando disponível na maioria dos laboratórios.
Podendo aplicar-se a uma grande variedade de amostras (LCR, soro, urina, fezes e exsudado e secreções da nasofaringe ou conjuntiva), obtém-se positividade quanto à identificação do vírus com sensibilidade entre 92% e 100%, e especificidade entre 97% e 100%. Tem como limitação o facto de não permitir a identificação dos serótipos. - Quanto às provas serológicas importa referir que a microneutralização é a técnica mais utilizada para identificação de anticorpos anti-enterovírus. Ao tratar-se duma técnica específica de serótipo, a sua utilidade na prática clínica é limitada, sobretudo tendo em conta a grande variedade de serótipos existentes. Outra limitação diz respeito à baixa sensibilidade e ao tempo requerido para se obter o resultado final por ser necessário obter amostras de soro na fase aguda e na fase de convalescença.
Complicações e prognóstico
O prognóstico na maioria das formas clínicas é bom. Como regra, pode estabelecer-se que a morbilidade e mortalidade se associam a formas clínicas acompanhadas de miocardite, doença neurológica e infecção perinatal.
Tratamento
Sendo em geral as infecções por EV autolimitadas, está indicado apenas o tratamento sintomático.
No entanto, nas formas clínicas de maior gravidade, apresentando-se com quadros de miocardite, meningite, em recém-nascidos e em doentes imunocomprometidos, poderá estar indicada terapêutica específica.
A administração de imunoglobulina endovenosa poderá constituir uma opção para estes doentes, nomeadamente nos recém-nascidos com miocardite.
O pleconaril oral (antivírico eficaz in vitro dirigido a Enterovírus) nos casos de infecção grave com miocardite associada, foi recentemente suspenso pelas acções secundárias. Presentemente está em estudo um fármaco a administrar por via nasal.
Prevenção
Medidas de higiene simples, tais como lavagem cuidadosa das mãos (prevenção da transmissão oral-fecal) e outras medidas clássicas universais de higiene básica (desinfecção de objectos contaminados, higiene de lugares públicos como piscinas, de locais de confecção de alimentos, etc.) são de extrema importância para a prevenção da transmissão de EV.
As mulheres grávidas, principalmente no terceiro trimestre, devem ser informadas que se deverão manter afastadas de qualquer doente com provável infecção por EV.
Inúmeros esforços têm sido feitos para se encontrar um antivírico ou uma vacina eficazes contra o Enterovirus 71. Inúmeras vacinas inactivas contra o genótipo C4 do Enterovírus 71 parecem ser promissoras, seguras e sem efeitos adversos graves. No entanto, não conferem protecção para outros genótipos, o que limita a sua utilização.
BIBLIOGRAFIA
Bergelson JM, Shah SS, Zaoutis TE. Pediatric Infectious Diseases. The Requisites in Pediatrics. Philadelphia: Mosby Elsevier, 2008
Chang LY, Huang LM, Gau SSF, et al. Neurodevelopment and cognition in children after enterovirus 71 infection. NEJM 2007;356:1226-1234
Chang LY, Tsao K, Hsia S, et al. Transmission and clinical features of enterovirus 71 infections in household contacts in Taiwan. JAMA 2004;291:222-227
Cherry J, Demmler-Harrison GJ, Kaplan SL, Steinbach WJ, Hotez P (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
Fowlkes AL, Honarmand S, Glaser C, et al. Enterovirus-associated encephalitis in the California encephalitis project, 1998-2005. J Infect Dis 2008;198:1685-1688
Freund MW, Kleinveld G, Krediet TG, et al. Prognosis for neonates with enterovirus myocarditis. Arch Dis Child Fetal Neonatal Ed 2010;95:F206-F208
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Goldman L, Schafer AI (eds). Goldman – Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Greninger AL, Naccache SN, Messacar K, et al. A novel outbreak enterovirus D68 strain associated with acute flaccid myelitis cases in the USA (2012-14): a retrospective cohort study. Lancet Infect Dis 2015;15:671-674
Holm-Hansen CC, Midgley SE, Fischer TK. Global emergence of enterovirus D68; a systematic review. Lancet Infect Dis 2016;16:e64-e75
Kao SJ, Yang FL, Hsu YH, Chen HI. Mechanism of fulminant pulmonary edema caused by enterovirus 71. Clin Infect Dis 2004;38:1784-1788
Khan F. Enterovirus D68: acute respiratory illness and the 2014 outbreak. Emerg Med Clin North Am 2015;33:e19-e32
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: McGraw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Messacar K, Schreiner TL, Maloney JA, et al. A cluster of acute flaccid paralysis and cranial nerve dysfunction temporally associated with an outbreak of enterovirus D68 in children in Colorado, USA. Lancet 2015;385:1662-1664
Modlin JF. Enterovirus déjà vu. NEJM 2007;356:1204-1205
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Noor A, Krilov LR. Enterovirus infections. Pediatr Rev 2016;37:505-513
Pevear DC, Tull TM, Seipel ME, Groarke JM. Activity of pleconaril against enteroviruses. Antimicrob Agents Chemother 1999;43:2109-2112
Ventarola D, Bordone L, Silverberg N. Update on hand-foot-and-mouth disease. Clin Dermatol 2015:340-346