Importância do problema
O microrganismo Parvovírus B19 (PVB19), vírus ADN e de cadeia única, pertence, como único membro, à família Parvoviridae e ao género Erythrovirus. A designação deste microrganismo deriva do facto de o mesmo se replicar unicamente nos precursores hematopoiéticos.
Foi inicialmente descoberto em 1975 no soro de dadores de sangue saudáveis. Durante muitos anos após a sua descoberta, admitiu-se que a infecção por PVB19 era assintomática ou associada a doença febril inespecífica.
Em 1980 chamou-se a atenção para o papel central do referido vírus na patogénese das crises aplásticas no contexto de anemia hemolítica crónica. Ulteriormente, concluiu-se que a entidade clínica denominada muitos anos antes Eritema Infeccioso (ou 5ª doença dos antigos) era a manifestação mais comum de infecção pelo mesmo vírus. Mais tarde associou-se o PVB19 a patologia diversa durante a gravidez, sendo a hidropisia fetal de causa não imune a mais conhecida.
As infecções por este vírus estão associadas a um espectro amplo de manifestações clínicas. Outros parvovírus são patogénicos para animais como o cão e o gato.
Aspectos epidemiológicos
As infecções por PVB19, distribuídas em todo o mundo, são mais prevalentes na idade escolar (~ 70% dos casos entre os 5 e 15 anos), com picos sazonais na transição do Inverno para a Primavera. Trata-se do único membro da família Parvoviridae que causa doença na espécie humana.
A seroprevalência aumenta com a idade, tendo sido provado, em estudos epidemiológicos, que cerca de 40%-60% dos adultos já tiveram a infecção.
A transmissão de pessoa a pessoa faz-se sobretudo por via respiratória através das gotículas de secreções nasofaríngeas; contudo, pode fazer-se igualmente através do sangue ou derivados, facto documentado em doentes com hemofilia.
Poderão surgir infecções pelo PVB19 associadas aos cuidados de saúde/nosocomiais, com possibilidade de afectar os profissionais de saúde.
Por outro lado, pode verificar-se segundo episódio de doença no mesmo indivíduo, com probabilidade entre 10% e 60%.
Etiopatogénese
A infecção experimental com PVB19 em voluntários saudáveis revelou que a mesma constitui uma doença bifásica.
- Cerca de 7-11 dias após a inoculação surge virémia acompanhada de febre, mal-estar, rinorreia e eliminação do vírus pelas secreções nasofarígeas. Concomitantemente, verificou-se que havia diminuição muito acentuada dos reticulócitos, atingindo-se níveis indetectáveis, a par de discreta diminuição da hemoglobina sérica. Com o surgimento de anticorpos específicos, a sintomatologia regrediu e a hemoglobina sérica voltou ao normal.
- Cerca de 17-18 dias após a inoculação, nalguns indivíduos surge exantema associado a artralgia.
Nesta perspectiva, concluiu-se que na patogénese da doença infecciosa por PVB19 estão implicados dois mecanismos correspondentes a duas fases da mesma:
- A primeira fase (infecciosa), resultante da acção directa do vírus (citotoxicidade com efeito sobre as células susceptíveis em divisão); e
- A segunda fase (pós-infecciosa), relacionada com a resposta imune.
Pormenorizando:
1ª Fase (infecciosa) – Citotoxicidade directa sobre as células precursoras eritróides, (fase infecciosa).
O alvo primário do PVB19 é a linha celular eritróide, particularmente pronormoblastos e normoblastos em divisão. A infecção vírica (e replicação) produz lise celular com consequente depleção progressiva dos precursores eritróides e a inibição transitória da eritropoiese. O vírus não tem efeito aparente sobre a linha celular mielóide.
O tropismo para as células eritróides é explicado pela existência do chamado antigénio P (Ag P) dos grupos de sangue nas células eritróides, o qual constitui o receptor celular primário para o vírus; importa salientar:
- Que tal receptor também se encontra ao nível das células endoteliais, renais, placentárias e miocárdicas fetais; e
- Que indivíduos sem a proteína P são resistentes à infecção.
Importa especificar que a patogénese de anomalias muitas vezes observadas também, tais como trombopénia e neutropénia, não têm explicação na base dos conhecimentos actuais. Somente se comprovou in vitro que as proteínas do PVB19 têm acção citotóxica sobre os megacariócitos.(#)
|
Ocasionalmente o vírus pode infectar os leucócitos (especialmente os neutrófilos), sendo que in vitro as proteínas do PVB19 têm acção citotóxica sobre os megacariócitos. Muito embora a infecção se possa manifestar como um quadro de pancitopénia, o vírus não constitui factor etiológico desencadeante de verdadeira anemia aplástica. |
2ª Fase (pós-infecciosa) – Resposta imune do hospedeiro. Nesta fase (pós-infecciosa), em que se verifica a formação de imunocomplexos, o quadro clínico é variável, em função de diversos factores: estado geral anterior do paciente infectado por PVB19, idade, eventual verificação de imunocompetência, de alteração da imunidade humoral e/ou de doença hematológica (designadamente anemia hemolítica crónica).
- Nas situações imunocompetência ou normalidade dos mecanismos do sistema imune, verifica-se que 25% dos infectados estão assintomáticos, 50% evidenciam sintomatologia inespecífica (febre, mialgia, cefaleia), e 25% apresentam manifestações cutâneas do tipo exantema (mais frequentes até aos 10 anos), e articulares (sobretudo em adolescentes e adultos). Os indivíduos imunocompetentes produzem anticorpos específicos (IgG e IgM contra o vírus).
- Nos indivíduos padecendo de anemia hemolítica crónica e doutras doenças hematológicas caracterizadas por turnover elevado de eritrócitos existe especial vulnerabilidade face a perturbações, mesmo ligeiras, da eritropoiese. A infecção por PVB19, levando a inibição transitória da eritropoiese, provoca diminuição significativa da hemoglobina (Hb), requerendo muitas vezes transfusão. Em tal circunstância verifica-se igualmente diminuição acentuada dos reticulócitos, traduzindo lise dos precursores eritróides infectados.
Neste contexto, a normalidade da imunidade humoral é crucial para controlo da infecção (como mecanismo natural de resposta). Assim, como resultado do mecanismo de compensação funcionante/normal, surge imunoglobulina específica (Ig)M dentro de 1-2 dias após a infecção, seguindo-se elevação de IgG anti-PVB19, conduzindo a controlo da infecção, restauração da reticulocitose e a elevação da Hb. - Nos indivíduos com alteração da imunidade humoral existe risco aumentado de infecções por PVB19 mais graves e persistentes, traduzindo-se por aplasia eritrocitária crónica, por vezes acompanhada de neutropénia, trombocitopénia e insuficiência medular. Nas crianças submetidas a quimioterapia no contexto de leucemia ou outras formas de cancro, submetidas a transplantes, assim como em situações de imunodeficiência congénita ou adquirida (incluindo SIDA) verifica-se risco elevado de infecções crónicas por PVB19.
O papel da imunidade celular na recuperação da doença não é conhecido, muito embora alguns doentes em que se desenvolve infecção persistente evidenciem défice de células T bem como outras alterações do sistema imune.
Notas importantes: |
Manifestações clínicas
O período de incubação deste tipo de infecção varia entre 4 e 14 dias, podendo atingir 20 dias.
As manifestações clínicas são muito variadas, desde quadros específicos exantemáticos (eritema infeccioso) até apresentações graves (crises aplásicas) em doentes com factores de risco imunológicos e hematológicos.
No indivíduo aparentemente saudável, a infecção pode ser assintomática, salientando-se que a manifestação mais comum é o já referido eritema infeccioso.
Nos casos de imunodepressão (em regime de quimioterapia ou de tratamento com drogas imunossupressoras, síndromas de imunodeficiência congénita ou adquirida) poderá desenvolver-se infecção persistente, causa frequente de anemia crónica.
A hidropisia fetal e a morte fetal são complicações da infecção fetal.
Outras manifestações menos comuns de infecção por PVB19 incluem: púrpura trombocitopénica idiopática, miocardite, vasculite, glomerulonefrite, meningoencefalite, dermatomiosite juvenil e pseudoapendicite; tal sintomatologia pode surgir isoladamente ou como complicação do eritema infeccioso.
Seguidamente procede-se à descrição das formas clínicas mais típicas.
Eritema infeccioso (Quinta doença ou megaleritema epidémico)
É mais comum nas crianças entre os 4-10 anos. O curso clássico do eritema infeccioso pode ser dividido em três estádios distintos (Figuras 1 e 2):
Estádio 1
- Período de transmissão possível (precedendo o exantema).
- Doença prodrómica leve (mal-estar, rinorreia, cefaleia, mialgia).
- Virémia (início cerca de 7 dias após a infecção).
- Depleção das células progenitoras eritróides.
- Desenvolvimento de Ac IgM específicos.
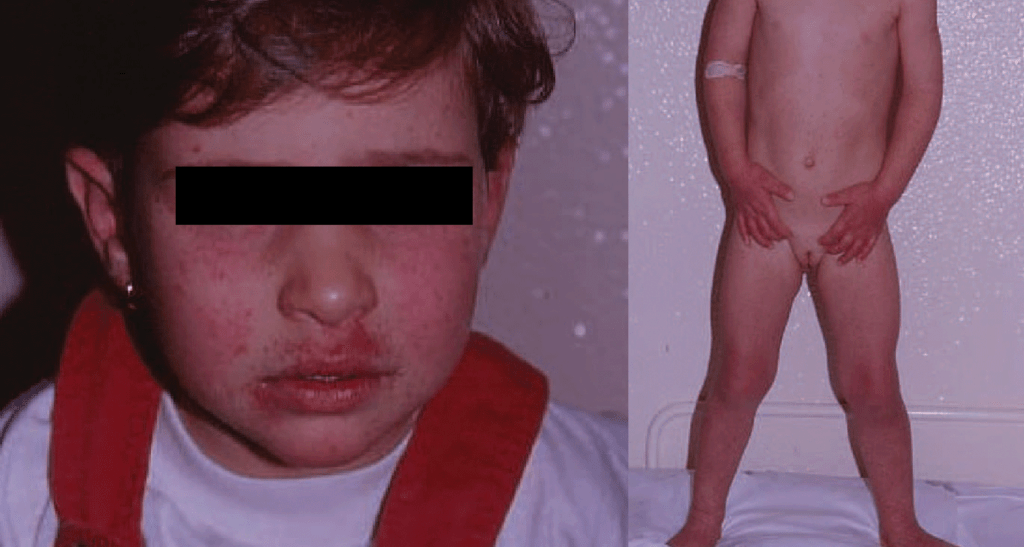
FIGURA 1. Criança de 4 anos, hospitalizada com quadro febril, queilite, erupção tipo “face esbofeteada” e erupção maculopapulosa difusa. Detecção de Ac IgM específicos para PVB19 e sinais laboratoriais de compromisso renal.
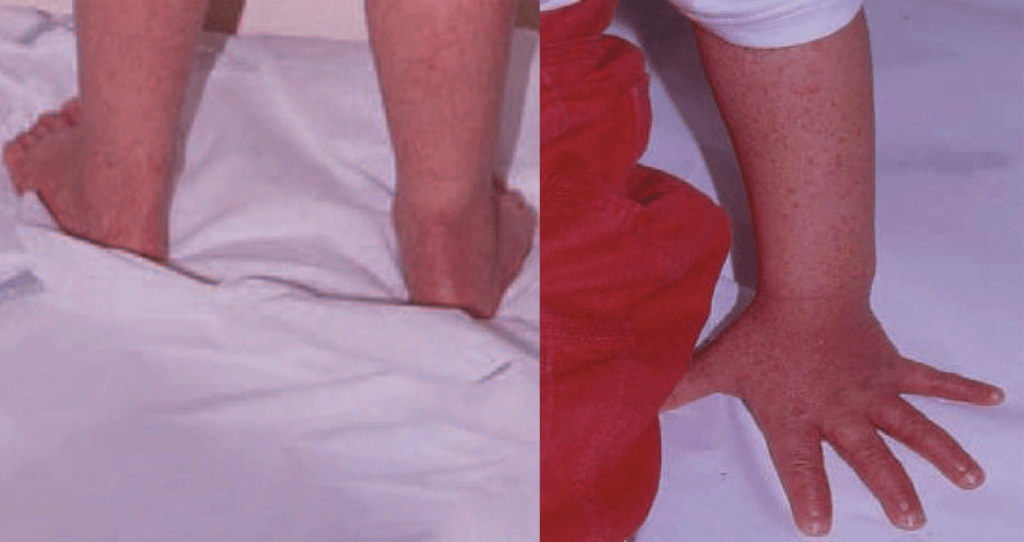
FIGURA 2. A mesma criança da Figura 1 evidenciando quadro morfológico cutâneo compatível com PPGSS (papular-purpuric gloves and socks syndrome).
Estádio 2
- Exantema facial semelhante a “cara esbofeteada”.
- Desaparecimento da virémia.
- Desenvolvimento de Ac IgG específicos (anti-PVB19).
Estádio 3
- Exantema eritematoso maculopapuloso das extremidades e tronco. Mais proeminente nas superfícies de extensão, poupando as palmas das mãos e plantas dos pés.
- Curso evanescente do exantema em 1-3 semanas.
- Artropatia.
O exantema, um dos mais comuns da infância, é muito típico, evoluindo em três fases.
Após 5-7 dias do início da doença, surge erupção cutânea avermelhada, brilhante, nas bochechas (face como que esbofeteada), seguida de erupção de tipo “rendilhado ou reticulado difuso” do tronco, por vezes purpúrica, estendendo-se gradualmente para as extremidades. Por vezes surge eritema multiforme, ou prurido na planta dos pés. Outras vezes ainda: eritema purpúrico com lesões papulares e distribuição em luva (glove) e meia (sock) originando a sigla em inglês: PPGSS (papular-purpuric gloves and socks syndrome).
Esta síndroma, relacionada sempre com infecção por PVB19, é rara no adulto, e mesmo, na criança. Um exantema residual associado ao PVB19 pode reaparecer até várias semanas ou meses após a infecção inicial, podendo ser exacerbado por alterações térmica (banho quente) e luz solar.
Infecção por PVB19 durante a gravidez e infecção fetal
Na mulher grávida, a infecção materna primária por PVB19 pode resultar em hydrops foetalis, aborto e morte fetal, particularmente quando se verifica antes das 20 semanas de gestação (em 10% dos fetos cujas mães se infectam durante a gravidez).
A hidropisia fetal gera-se no contexto de anemia e miocardite fetais, levando a insuficiência cardíaca congestiva. A este respeito, importa salientar o efeito citopático/citotóxico do PVB19 quer sobre a hematopoiese extramedular (hepática e esplénica em fase precoce da gravidez, desde a 6ª semana), quer sobre a medular, a partir do 4º mês.
Nos Estados Unidos a etiologia mais comum da hidropisia fetal é precisamente a infecção por PVB19.
Há resultados controversos de estudos relativamente à possibilidade (ou não) de anomalias congénitas atribuíveis à infecção in utero.
No decurso da gravidez importa avaliar o hematócrito fetal através de colheita de sangue do cordão por via percutânea. Poderá estar indicada transfusão eritrocitária intrauterina.
Na data do parto está indicado o estudo do sangue do cordão ou do sangue do RN para a detecção de vírus e IgM.
O diagnóstico diferencial da anemia congénita causada por este tipo de infecção faz-se fundamentalmente com a anemia hipoplástica congénita (síndroma de Diamond-Blackfan).
Artropatia
Desde há alguns anos que se tornou clara a associação de PVB19 com artrite e artralgias. É mais comum nos adultos, particularmente na mulher; este tipo de patologia afecta principalmente as pequenas articulações das mãos e dos pés, joelhos, tornozelos e punhos, com distribuição simétrica.
Em cerca de 50% dos casos poderá verificar-se a presença de sinais gerais associados (astenia, adinamia, mialgias, cefaleias, febre, etc.), sendo que em apenas 1/3 se verifica exantema concomitantemente.
A relação entre infecção por PVB19 e artrite reumática juvenil, artrite reumatóide e doença de Still tem sido estudada exaustivamente.
Crise aplástica transitória
Em doentes com anemia hemolítica crónica, nos quais a duração da sobrevida eritrocitária está diminuída, a acentuada reticulocitopénia resultante da infecção por PVB19 conduz a diminuição da concentração de hemoglobina a níveis críticos (crise hipoplástica).
Nos doentes com drepanocitose pode haver associação da crise aplástica (compromisso de todas as séries precursoras) com síndroma torácica aguda, crises vasoclusivas e sequestração esplénica.
A infecção por PVB19 não resulta invariavelmente em crise aplástica no doente hemolítico crónico; com efeito, nalgumas situações, tal complicação poderá não surgir se tiver havido transfusão recente, o que se explica:
- pelo efeito protector dos anticorpos anti-PVB19 transfundidos (~ 40%-60% dos dadores são imunes);
- pela substituição dos eritrócitos do dador, de vida média normal, por eritrócitos de vida média encurtada; ou
- pelos dois mecanismos.
Nesta forma clínica de infecção por PVB19, ao contrário do que acontece nos doentes com eritema infeccioso, existe febre, mal-estar geral, letargia e sinais e sintomas associados a anemia de gravidade variável (palidez, taquicárdia, taquipneia, etc.).
Síndromas de imunodeficiência
Os doentes com alterações diversas da imunidade humoral têm maior risco de infecção crónica por PVB19, manifestada predominantemente por anemia crónica, em geral associada a neutropénia, trombocitopénia e aplasia medular. Outras situações de risco de infecção incluem patologia em que está indicada terapia imunossupressora ou quimioterapia (tumores sólidos, leucemia linfocítica aguda, etc.).
Uma das complicações neste contexto é a síndroma hemofagocitária.
Miocardite
As infecções por PVB19 podem originar miocardite em fetos, RN, crianças, adolescentes e adultos. A este propósito, cabe referir que as células do miocárdio exprimem o antigénio P, o que já foi referido antes.
O diagnóstico etiológico pode ser realizado através do estudo do ADN.
Diagnóstico
Os Ac IgM específicos anti-PVB19, desenvolvendo-se rapidamente após o início da virémia (entre 4-10 dias após a infecção) com pico pelas 2-3 semanas, persistem durante tempo superior a 6-8 semanas. Podendo desaparecer pelos 3-6 meses, constituem o melhor marcador de infecção aguda/recente.
Os Ac IgG específicos surgem a partir do 14º dia ou terceira semana após a infecção; são marcadores de infecção passada ou de imunidade, detectáveis durante toda a vida.
A seroconversão de IgG anti-PVB19 também serve de marcador de infecção recente (aumento do título 4 vezes em duas amostras de soro com duas semanas de intervalo). De salientar que a demonstração de IgG, mesmo com títulos elevados, na ausência de IgM, não é diagnóstica de infecção recente.
A detecção do vírus no sangue ou tecidos realiza-se pela técnica da reacção em cadeia da polimerase (PCR). Este método será reservado para situações de imunodeficiência em que a resposta de anticorpos, por ser deficiente (com baixo nível de ADN no soro), não é identificada por métodos convencionais.
Com efeito, o vírus pode ser detectado mediante PCR até vários meses após a fase aguda da infecção ainda que, nos pacientes imunocompetentes, os níveis caiam rapidamente depois da fase aguda. Nos pacientes imunodeprimidos ou nos diagnosticados de crise aplásica antes do desenvolvimento da resposta imunológica, esta prova é crucial para o diagnóstico.
O método de hibridação de ácidos nucleicos permite identificar positividade somente durante 2-4 dias após o início da doença.
Diagnóstico diferencial
O diagnóstico diferencial das infecções por PVB19 com exantema faz-se com outras doenças exantemáticas. Nos casos de exantema e artropatia há que admitir patologia do foro da Reumatologia.
Tratamento
Não existe terapêutica específica antivírica.
Nas situações de aplasia medular induzida por PVB19, nas formas persistentes e nas formas graves nos pacientes imunodeprimidos, está indicada IGIV na dose de 200 mg/kg/dia durante 5 dias; ou 1 g/kg/dia durante 3 dias. A IGIV não está indicada nas formas acompanhadas de artropatia.
Quando se suspeita de anemia, com base na ecografia, é fundamental a monitorização fetal incluindo a determinação do hematócrito através de colheita de amostra de sangue da veia umbilical por via percutânea. Poderá estar indicada a transfusão intrauterina para prevenção da morte fetal por anemia.
Em medicina materno-fetal, o diagnóstico de hidropisia e anemia fetais implica transferência da grávida para centro especializado perante a provável indicação de transfusão fetal.
Nos quadros febris e dolorosos estão indicados antipiréticos e analgésicos como paracetamol ou ibuprofeno.
Qualquer mulher grávida não imunizada e exposta ao PVB19 deve ser observada em consulta de obstetrícia. Havendo antecedentes de hidropisia fetal, independentemente do tratamento pré-natal efectuado, a criança deve ser submetida a vigilância rigorosa no sentido de detectar qualquer anomalia e ou sequelas.
Prevenção
Não existe vacina disponível para PVB19. Está a ser investigada uma vacina composta por proteínas da cápside do vírus.
A prevenção é difícil uma vez que o vírus é transmitido antes do aparecimento de sintomas no caso índice. Por isso, não se torna necessário isolamento nem evicção escolar.
Nos casos de aplasia medular estão indicadas medidas de isolamento do doente, dado o risco de sobreinfecção.
Nota: As fotos incluídas neste capítulo fazem parte da iconografia do Departamento de Pediatria do Hospital Fernando Fonseca, Amadora-Sintra.
BIBLIOGRAFIA
American Academy of Pediatrics (AAP). Red Book 2006. Report of the Committee on Infectious Diseases: Parvovirus, erythema infectiosum, and pregnancy. Elk Grove Village, IL: AAP, 2006.
Barah F, Vallely PJ, Chiswick ML et al. Association of human parvovirus B19 infection with acute meningoencephalitis. Lancet 2001;358:729-730
Bassols AC. Parvovirus B 19 and the new century. Clin Infect Dis 2008;46:537-539
Bock CT, Klingel K, Kandolf R. Human Parvovirus B19 – associated myocarditis. NEJM 2010;362:1248-1249
Cherry J, Demmler-Harrison GJ, Kaplan SL, Steinbach WJ, Hotez P (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
De Jong EP, Walther FJ, Kroes ACM, et al. Parvovirus B19 infection in pregnancy: new insights and management. Prenat Diagn 2011;31:419-425
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Heegaard ED, Brown KE. Human parvovirus B19. Clin Microbiol Rev 2002;15:485-505
Hsieh MY, Huang PH. The juvenile variant of papular-purpuric gloves and socks syndrome and its association with viral infections. Br J Dermatol 2004;15:201-206
Kimberlain D, Brady M, Jackson M, Long S (eds). Red Book. Elk Grove Village, IL: American Academy of Pediatrics, 2015
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: McGraw Hill Education, 2018
Lindblom A, Isa A, Norbeck O. Et al. Slow clearance of human parvovirus B19 viremia following acute infection. Clin Infect Dis 2005;41:1201-1203
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Smith-Whitley K, Zhao H, Hodinka RL, et al. Epidemiology of human parvovirus B19 in children with sickle cell disease. Blood 2004;103:422-427
Whitley KS, Zhao H, et al. Epidemiology of human parvovirus B19 in children with sickle cell disease. Blood 2004;103:422-427
Young NS, Brown KE. Parvovirus B19. NEJM 2004;350:586-597