Bartoneloses e importância do problema
As bartoneloses são doenças reemergentes em todo o mundo. No que respeita às espécies patogénicas para o homem do género Bartonella (> 60), citam-se como principais, B. henselae, B. bacilliformis, B. quintana, B. elizabethae e B. clarridgeiae.
As manifestações clínicas e a gravidade da infecção dependem da espécie do agente microbiano, do estado imune e da idade do paciente.
A chamada doença do arranhão do gato é uma doença infecciosa autolimitada e benigna provocada por Bartonella henselae (bacilo Gram-negativo aeróbio, comportando-se como intracelular facultativo), surgindo após contacto com gato e escoriação provocada pelo mesmo. Trata-se duma afecção que atinge principalmente crianças e adultos jovens e é a causa mais frequente de linfadenopatia crónica (de duração igual ou superior a 3 semanas).
Na primeira bartonelose descrita na espécie humana (provocada por B. bacilliformis) no Perú/América do Sul verificou-se, para além da febre e anemia hemolítica (febre Oroya), erupção cutânea semelhante a hemangioma (verruga peruana).
À B. quintana estão associados casos em doentes com imunodeficiência, sintomatologia de compromisso do SRE, bacteriémia e endocardite, para além de outros quadros clínicos.
Neste capítulo é dada ênfase à doença do arranhão do gato, a que surge com expressão mais significativa no nosso meio.
Aspectos epidemiológicos
A doença do arranhão do gato é uma doença universal, em geral esporádica, que afecta todas as etnias e géneros em proporções semelhantes. Há uma maior incidência da doença no Outono e no Inverno, quer devido ao ciclo reprodutivo da pulga do gato, quer porque nestas estações os animais são mantidos mais tempo em casa. Nos EUA é estimada uma incidência anual de 9/100.000 casos em doentes ambulatórios. Não há referência a dados de incidência da doença em Portugal. Foram descritos surtos afectando membros da mesma família.
Etiopatogénese
O agente Bartonella henselae tem um crescimento em cultura muito insidioso (cerca de 5 semanas). O seu principal reservatório é o gato, portador assintomático, em particular com menos de seis meses de idade, o qual infecta o ser humano por inoculação cutânea; com efeito, a bacteriémia (assintomática) nos gatos de menor idade envolve maior carga bacteriana do que a verificada nos gatos com > 6 meses de idade. A infecção é transmitida entre os gatos pela acção dum vector – a pulga Ctenocephalides felis.
Após a lesão na pele provocada pelo arranhão do gato, do qual resulta a inoculação do microrganismo no ser humano, verifica-se o aparecimento de uma pápula ou nódulo e necrose da derme. Posteriormente, há alterações nos gânglios linfáticos locorregionais. O aspecto histológico característico do gânglio linfático consiste em hiperplasia folicular, com necrose cortical e formação de granuloma necrótico com microabcessos centrais.
Granulomas idênticos podem ser encontrados no fígado, baço e sistema ósseo provocando, nesta última localização, lesões osteolíticas.
Importa referir que em cerca de 1% dos casos o microrganismo pode ser transmitido pela saliva do gato inoculado em zona de pele ou mucosa lesada. Nalguns casos, o agente etiológico é B. clarridgeiae. Cães e macacos podem ser reservatório. Não se provou a transmissão de pessoa a pessoa.
Manifestações clínicas
Após um período de incubação compreendido entre 7 e 12 dias, surge no local da inoculação, em cerca de 60% dos doentes, uma pápula ou nódulo avermelhado de 3-5 mm (Figura 1). Todavia, esta lesão poderá não ser valorizada pelas suas pequenas dimensões. Uma a quatro semanas depois, na maioria dos casos, verifica-se o aumento de volume dos gânglios satélites, com sinais inflamatórios na pele adjacente (Figura 2). As manifestações de adenite verificam-se mais frequentemente na zona da cabeça e pescoço, seguindo-se as extremidades. Em cerca de 10% a 20% dos casos os gânglios linfáticos atingidos supuram espontaneamente. A presença concomitante de sinais e sintomas sistémicos tais como febre, cefaleia e prostração, é frequente.
Ocasionalmente, a doença pode cursar com conjuntivite granulomatosa e adenopatia pré-auricular, constituindo-se a chamada síndroma oculoglandular de Parinaud.
Raramente, podem ocorrer outras alterações como exantema maculopapular, eritema nodoso e púrpura não trombocitopénica. (Figura 3)
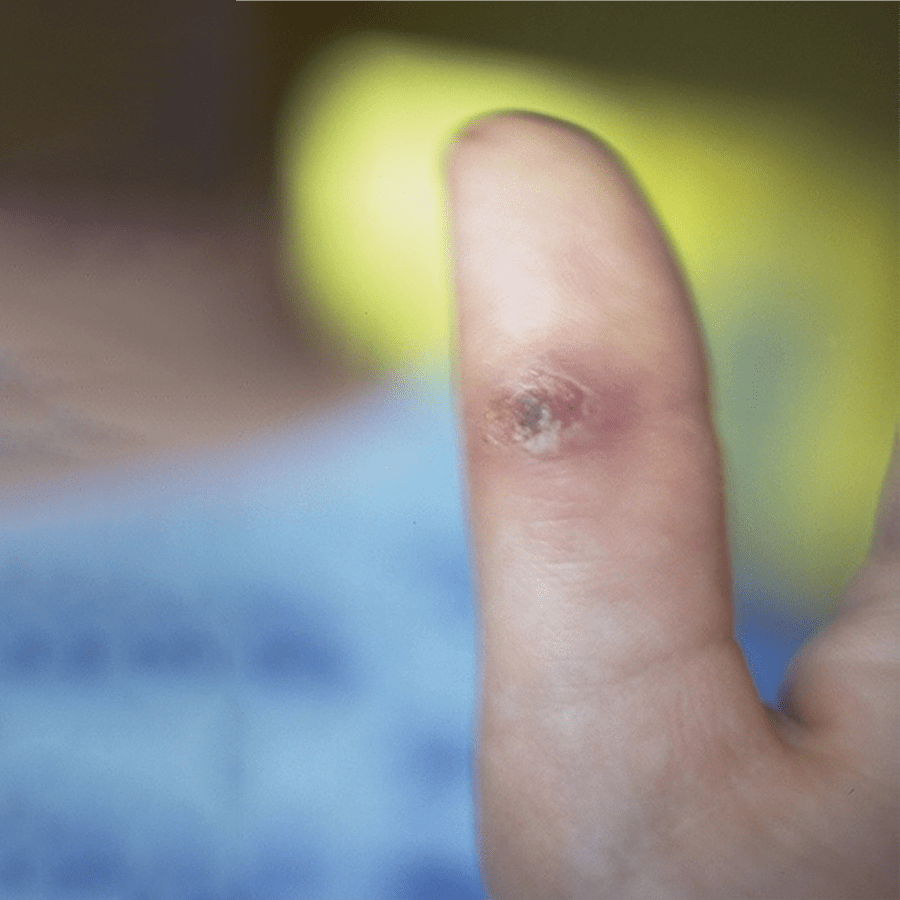
FIGURA 1. Nódulo ulcerado com crosta no dorso do polegar após arranhão. (NIHDE)
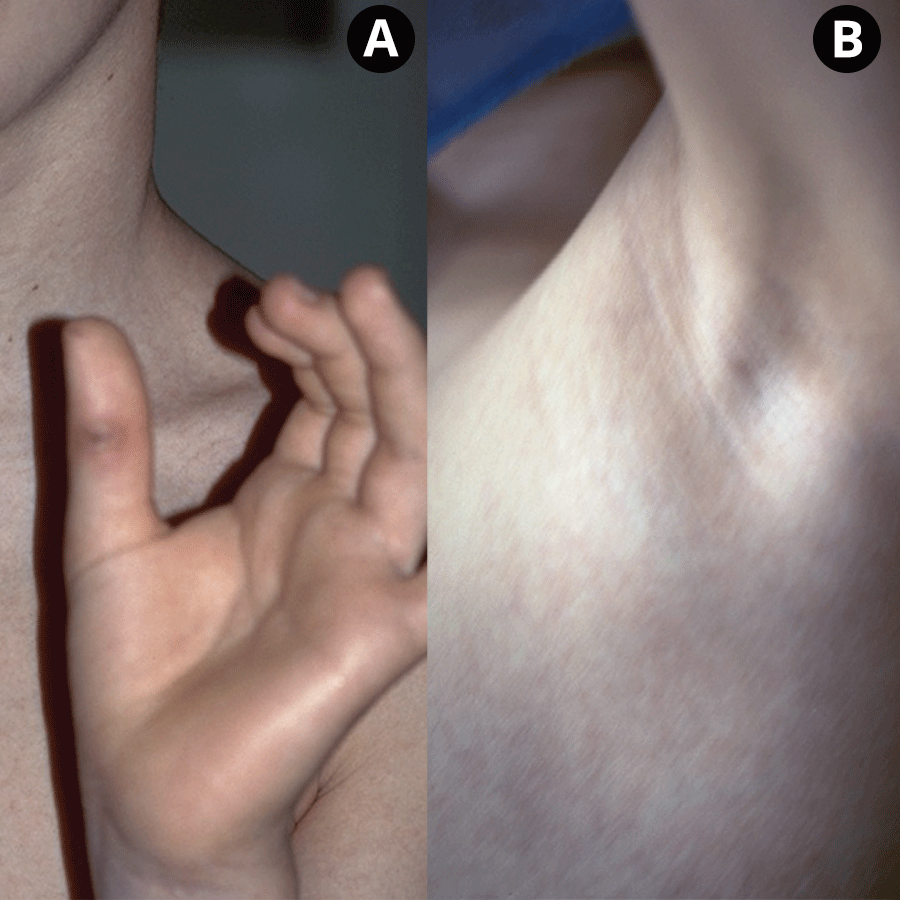
FIGURA 2. A – Arranhão no polegar esquerdo; B – Adenopatia axilar esquerda. (NIHDE)
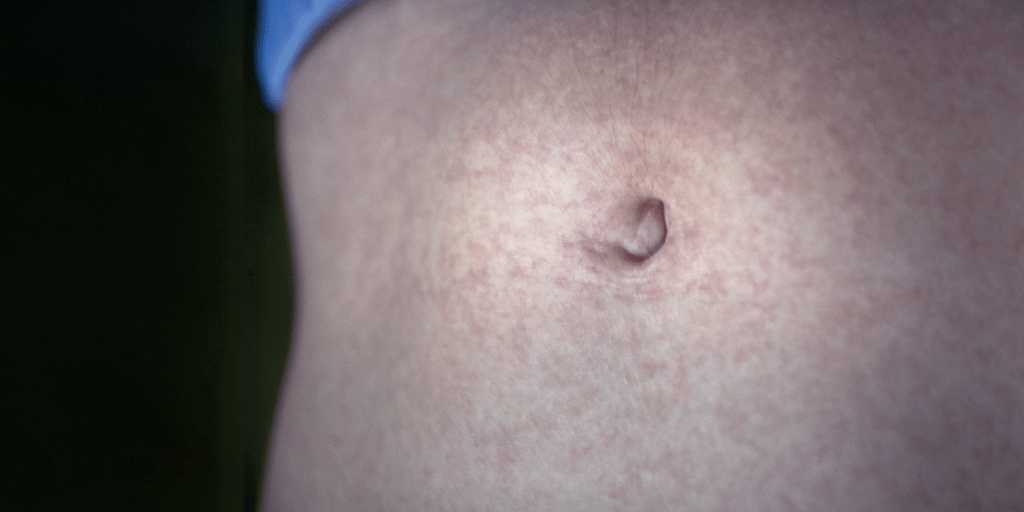
FIGURA 3. Exantema maculopapular notório no abdómen. (NIHDE)
Complicações
As complicações neurológicas, em regra com evolução favorável, surgem em cerca de 2%-5% dos doentes, geralmente 6 semanas após o aparecimento da adenite. A complicação mais frequente é a encefalopatia; na sua forma de apresentação clássica podem surgir convulsões, comportamento bizarro e alterações do estado de consciência.
Outras manifestações neurológicas incluem paralisia periférica do nervo facial, mielite, radiculite e ataxia cerebelosa.
As complicações hematológicas incluem anemia hemolítica, púrpura trombocitopénica e não trombocitopénica, assim como, eosinofilia.
A vasculite leucocitoclástica, semelhante à púrpura de Henoch-Schonlein, é rara.
As complicações sistémicas, surgindo com maior probabilidade em doentes imunodeprimidos, constam de quadros clínicos diversos, mais graves tais como: hepatite, anemia hemolítica, pneumonia atípica, retinopatia macular estelar, hepatosplenomegália (por alterações granulomatosas), endocardite, lesões osteolíticas granulomatosas ósseas, eritema nodoso, etc..
Exames complementares e diagnóstico
Existe suspeita desta doença quando, pela anamnese, se comprova contacto com gatos, e pelo exame objectivo se verifica lesão cutânea primária associada a adenopatia satélite.
As provas de serologia permitem a confirmação do diagnóstico utilizando a técnica de imunofluorescência indirecta, sendo a subida do título de anticorpos (IgG e IgM) detectada desde o início dos sintomas. De salientar que existe reactividade cruzada entre as espécies de Bartonella, especialmente entre B. henselae e B. quintana.
Através de exames de biologia molecular/PCR, utilizando como material de estudo amostras obtidas por escarificação da pele lesada, é possível evidenciar a sequência de ácidos nucleicos da Bartonella.
Os exames imagiológicos como a ecografia ou a TAC permitem detectar numerosos nódulos granulomatosos no fígado e baço.
Os resultados anómalos de determinados exames laboratoriais correntes, tais como velocidade de sedimentação elevada, leucocitose ligeira a moderada, ou elevação do valor das aminotransferases em casos de doença sistémica não têm, na maior parte das vezes, grande utilidade, excepto no que respeita à avaliação mais objectiva da repercussão da doença sobre o estado geral do doente.
| Nota importante: é desaconselhada a prova cutânea empregando antigénios obtidos de aspirado purulento de lesões ganglionares pela falta de padronização e pelo risco de transmissão da infecção. |
Diagnóstico diferencial
A verificação de adenopatias impõe o diagnóstico diferencial com outras situações:
- de etiologia infecciosa, tais como infecções por Streptococcus Beta-hemolítico do grupo A, S. aureus, espécies de Brucella, citomegalovírus, vírus de Epstein-Barr, VIH, Toxoplasma, fungos; e
- de etiologia não infecciosa como por ex. lesões tumorais.
A síndroma oculoglandular pode, por sua vez, estar associada a outras afecções tais como sífilis, tuberculose, infecções por Chlamydia, entre outras.
Os nódulos e pápulas cutâneos associados a adenopatia locorregional podem impor o diagnóstico diferencial com infecções por micobactérias atípicas, tuberculose, fungos e leishmaníase.
Tratamento
Sendo na maioria dos casos uma doença autolimitada, com resolução espontânea, o tratamento pode ser apenas sintomático. Todavia, diversos autores referem que a antibioticoterapia contribui para encurtar o tempo de resolução da doença, advogando a sua instituição após o diagnóstico. Nas formas sistémicas e nos doentes imunodeprimidos, tal tipo de tratamento é obrigatório.
A escolha dos antimicrobianos recai na azitromicina PO (10 mg/kg/dia no primeiro dia, 5 mg/kg/dia nos 4 dias seguintes), ou claritromicina PO (15 mg/kg/dia, em 2 doses diárias), 7 a 10 dias.
Nos doentes com repercussões sistémicas verifica-se em geral boa resposta à rifampicina PO (20 mg/kg/dia, de 12/12 horas), isolada ou associada a cotrimoxazol PO (40-100 mg/kg/dia de sulfametoxazol, de 12/12 horas) durante 14 dias. As fluoroquinolonas, em idades > 17 anos, são uma alternativa.
Nota importante: a duração ideal da terapêutica não está estabelecida; os esquemas referidos são os recomendados habitualmente. Os beta-lactâmicos, tetraciclinas e a eritromicina não são eficazes. Em circunstâncias especiais, poderá estar indicada a drenagem cirúrgica dos gânglios linfáticos atingidos. |
Prognóstico
O prognóstico é, dum modo geral, excelente, com recuperação em semanas ou meses. Em regra, as manifestações sistémicas surgem em doentes portadores de síndromas de imunodeficiência.
Prevenção
As crianças, em especial as imunocomprometidas, devem evitar contactos íntimos com gatos com menos de 6 meses de idade. Se o indivíduo fôr arranhado pelo gato, a ferida deve ser imediatamente bem lavada. Devem igualmente ser promovidas medidas de controlo da pulga do gato.
BIBLIOGRAFIA
Angelakis E, Raoult D. Pathogenicity and treatment of Bartonella infections. Int J Antimicrob Agents 2014;44:16-25
Aoki Y, Kitazawa K, Sugawara D. Femoral bone lesions accompanying cat-scratch disease. Arch Dis Child 2019;104:11
Breitschwerdt EB. Bartonellosis: health perspectives for an emerging infectious disease. ILAR J 2014;55:46-58
Cherry J, Demmler-Harrison GJ, Kaplan SL, Steinbach WJ, Hotez P (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Kimberlain D, Brady M, Jackson M, Long S (eds). Red Book. Elk Grove Village, IL: American Academy of Pediatrics, 2015
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Vermeulen MJ, Rutten GJ, Verhagen I, et al. Transient paresis associated with cat-scratch disease. Case report and literature review of vertebral osteomyelitis caused by Bartonella henselae. Pediatr Infect Dis J 2006;25:1177-1181