Definição e importância do problema
A amebíase é uma doença parasitária provocada por diferentes espécies do género Entamoeba, com elevada prevalência a nível mundial. Trata-se dum protozoário flagelado não móvel, correspondendo a espécie E. histolytica o principal agente implicado.
Tal afecção constitui a terceira causa mundial de morte por infecções parasitárias.
Aspectos epidemiológicos
A E. histolytica é responsável a nível mundial por cerca de 50 milhões de infecções sintomáticas e de 100.000 mortes /ano.
As zonas do globo mais atingidas, com baixo nível socioeconómico e sanitário e prevalência superior a 50%, correspondem ao Sueste Asiático, Índia, América Central, América do Sul e África.
Etiopatogénese
O tracto intestinal é colonizado por diferentes espécies do género Entamoeba. Embora se considere classicamente que a E. histolytica é a única espécie patogénica, em estudos recentes foi admitida a possível comparticipação doutras como E. dispar e E. moshkowskii.
A infecção produz-se pela ingestão de quistos presentes na água, alimentos ou mãos contaminadas, ou por contacto fecal-oral. Na mucosa intestinal, a ruptura dos quistos leva à libertação de trofozoítos (formas intraluminais de trofozoítos). Não estão descritos casos de transmissão vertical.
Numa pequena proporção, pela lesão da mucosa intestinal, poderá verificar-se disseminação de trofozoítos por via hematogénica, atingindo o fígado e outros órgãos, ocasionando quadro de doença invasiva (formas invasoras de trofozoítos). A gravidade da situação depende sobretudo da susceptibilidade do hóspede e da virulência do parasita.
Manifestações clínicas
Salientando que, na sua maioria, as infecções amebianas são assintomáticas, a sintomatologia mais habitual é a de diarreia de intensidade moderada e de dor abdominal. Com base no esquema etiopatogénico atrás descrito, são descritas duas formas clínicas: amebíase intestinal e amebíase extraintestinal.
Amebíase intestinal
Após um período de incubação de 2 a 4 semanas, surge febre, tenesmo, dor abdominal e diarreia ligeira a grave, com muco e sangue, durando entre 1 e 3 semanas e levando a perda de peso. A desnutrição e a corticoterapia contribuem para incrementar a susceptibilidade.
Poderão surgir raramente complicações, descrevendo-se perfuração intestinal, colite fulminante e peritonite. No caso de surgir diarreia crónica, as características do quadro clínico aproximam-se das de doença inflamatória intestinal.
Amebíase extraintestinal
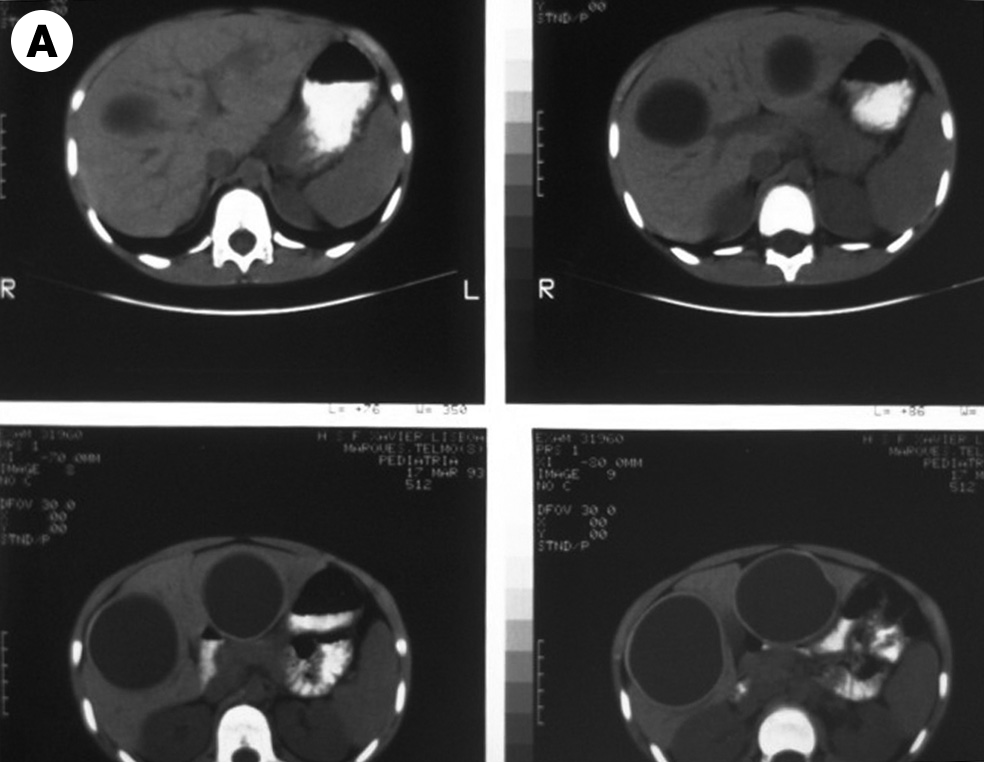
Forma clínica mais rara, as respectivas manifestações decorrem sobretudo de patologia hepática, pulmonar, cardíaca ou do SNC.
Exames complementares
Fundamentalmente, os métodos de diagnóstico incluem exame microscópico das fezes para detecção de quistos e trofozoítos, detecção antigénica para diferenciação morfológica das diversas espécies com especificidade > 90%, serologia para detecção de anticorpos e técnicas moleculares para detecção de ADN por PCR.
A colonoscopia tem indicação em situações selecionadas.
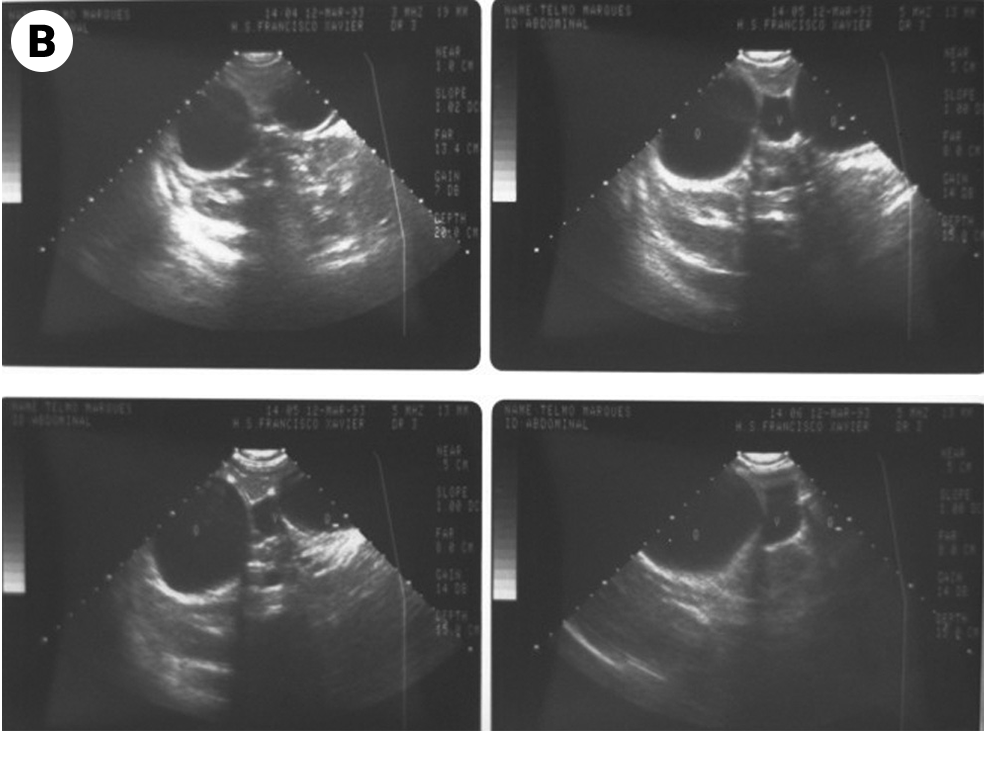
Os exames de imagem estão indicados no âmbito da amebíase extraintestinal. A ecografia tem grande utilidade para avaliar a resposta ao tratamento do abcesso amebiano.
Tratamento
Com o tratamento pretende-se a eliminação das formas invasoras de trofozoítos e das formas intraluminais intestinais.
Como regras gerais, importa salientar:
- o metronidazol, o tratamento de primeira linha, deve associar-se sempre a fármaco amebicida com actividade intraluminal;
- o regime terapêutico poderá variar em função da sintomatologia e não em função da espécie;
- a infecção por E. histolytica deve tratar-se independentemente da sintomatologia.
Situações específicas
Infecção assintomática
O metronidazol não é efectivo contra os quistos de Entamoeba. Neste contexto, deve administrar-se um amebicida com actividade intraluminal como a paramomicina (25-35 mg/kg/dia em três doses, durante 7 dias) e o iodoquinol (30-40 mg/kg/dia em três doses, durante 20 dias) ou, em alternativa, o furoato de diloxanida (20 mg/kg/dia em três doses, durante 10 dias).
Amebíase invasiva (intestinal e extraintestinal)
O tratamento de eleição é o metronidazol (35-50 mg/kg/dia em três doses, durante 7-10 dias). Como alternativas, citam-se: o tinidazol, o ornidazol, o secnidazol, a cloroquina e a nitazoxanida. Como foi referido, ao metronidazol deve associar-se sempre um fármaco amebicida com actividade intraluminal.
O tratamento cruento/cirúrgico poderá estar indicado nos casos de ausência de resposta ao tratamento e nos casos de complicações. Verificando-se abcesso amebiano, está indicada punção e drenagem com o apoio ecográfico.
Prevenção
Não existindo ainda vacinas, são reforçadas as medidas gerais de higiene pessoal, de saneamento básico e de boa qualidade da água para consumo público.
Salienta-se que os quistos são resistentes às concentrações de cloro para o tratamento da água potável.
Os viajantes para zonas endémicas devem evitar o consumo de água não tratada, de comida não cozinhada e de verduras e frutos lavados com água não tratada.
BIBLIOGRAFIA
Gilchrist CA. Entamoeba bangladeshi: an insight. Trop Parasitol 2014; 4: 96-98
Heredia RD, Fonseca JÁ, Lopez MC. Entamoeba moshkovskii perspectives of a new agent to be considered in the diagnosis of amebiasis. Acta Trop 2012; 123: 139-145
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Remington J, Klein J, Wilson C, Baker C (eds). Infectious Diseases of the Fetus and Newborn Infant. Philadelphia: Saunders, 2006
Ximenes C, Cerritos R, Rojas L, et al. Human amebiasis: breaking the paradigm? Int J Environ Public Health 2010; 7: 1105-1120