Definição e importância do problema
A malária (palavra sinónima de paludismo ou sazonismo) é uma doença potencialmente fatal, causada pelo parasita protozoário Plasmodium spp. e transmitida ao ser humano pela picada de algumas espécies de mosquitos do género Anopheles. Existem cinco espécies de Plasmodium que infectam o ser humano: P. falciparum, P. vivax, P. ovale, P. malariae e P. knowlesi. Esta última espécie, causadora de malária em macacos, foi descrita como sendo causa de doença em humanos no Sueste Asiático.
A afecção que faz parte deste capítulo caracteriza-se fundamentalmente por paroxismos de febre, sudação, fadiga, anemia e esplenomegália. Pelo facto de anualmente ocorrerem em todo o mundo cerca de 216 milhões de casos com 445.000 mortes, e por ser endémica em aproximadamente 100 países, é considerada a doença parasitária com maior impacte a nível global.
Por fim, salientando que a África subsaariana continua a ser a região com mais casos de malária (88% dos casos), sendo responsável por 90% das mortes, e que cerca de 70% das mortes em termos globais ocorreu em crianças com menos de cinco anos de idade, é legítimo concluir que metade da população mundial vive exposta ao risco de a contrair.
Aspectos epidemiológicos
As principais áreas de transmissão correspondem a África, Ásia e América do Sul, entre latitudes de 40ºN e 30ºS.
A quase totalidade dos casos de malária grave relaciona-se com a espécie P. falciparum, a qual predomina na África ao sul do Saara; contudo, também é a espécie predominante no Bangladesh, Camboja, Filipinas, Haiti, Índia, Indonésia, Laos, Myanmar, Papua Nova Guiné e Timor-Leste.
Nas regiões temperadas, nomeadamente na América Central, Afeganistão e Paquistão predomina a espécie P. vivax. Em conjunto, P. vivax e P. falciparum predominam no Sueste da Ásia, América do Sul e Oceania. P. ovale, a espécie menos comum, ocorre quase exclusivamente em África. A transmissão é mais propícia durante a estação das chuvas nos climas tropicais; contudo, na região equatorial ocorre durante todo o ano.
A transmissão da malária foi praticamente eliminada nos EUA e Canadá, Europa, Austrália, Chile, Japão, Coreia, Israel, Líbano e Taiwan. (Figura 1)
Nos países ocidentais a doença tem surgido sobretudo em viajantes ou imigrantes de áreas endémicas. Em Portugal, a doença é de declaração obrigatória; de acordo com as estatísticas (que se referem a “malária importada”), no quadriénio 2009-2012 foram notificados 217 casos (média anual de 54,2), correspondendo quatro a idades < 14 anos, e doze a idades entre 15-24 anos. No Hospital de Dona Estefânia, Lisboa, foram observados 79 casos no decénio 1998- 2007, sem ocorrência de óbitos.
Etiopatogénese
O parasita é transmitido ao homem pela picada da fêmea do mosquito do género Anopheles. Na África subsaariana, o vector mais importante na transmissão pertence à espécie Anopheles gambiae. A malária pode também ser transmitida através da transfusão de sangue ou derivados, transplantes, agulhas de seringas com sangue contaminado, e de modo vertical, durante a gravidez via transplacentar mãe-feto (pré-natal), ou intraparto (perinatal).
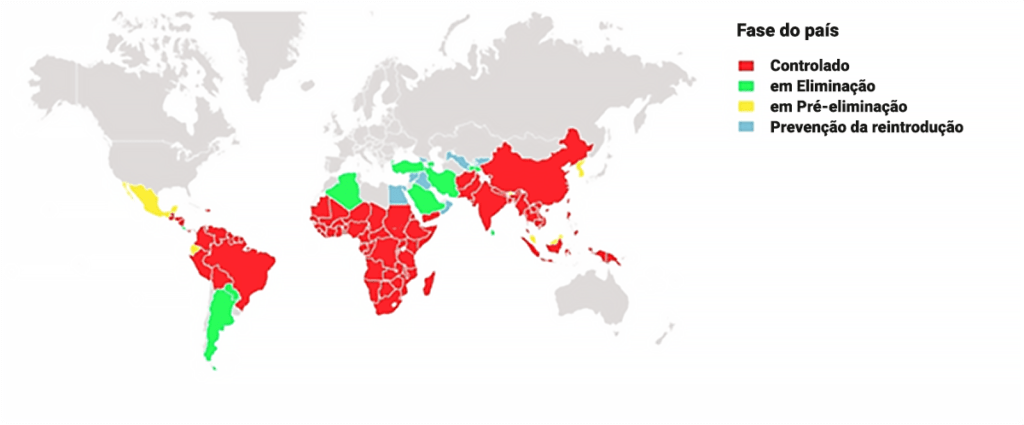
FIGURA 1. Distribuição geográfica da malária e estádios evolutivos. (Tirada de OMS, Global Malaria Mapper, 2016)
O ciclo de vida do protozoário em análise é complexo, estando adaptado à sobrevivência em diferentes meios celulares, quer no hospedeiro humano (na fase assexuada), quer no mosquito vector (na fase sexuada, com produção de gâmetas). Em termos quantitativos, a reprodução traduz-se no incremento de número de protozoários no organismo humano, da ordem de ~102 para ~1014, em duas fases (1ª fase, nas células parenquimatosas hepáticas – fase exoeritrocitária; e 2ª fase, nos eritrócitos – fase eritrocitária).
A fase exoeritrocitária começa com a picada do mosquito (entre o anoitecer e amanhecer), o qual injecta pequena quantidade de saliva contendo esporozoítos. Em minutos, os esporozoítos veiculados pelo sangue entram nos hepatócitos, onde se multiplicam assexuadamente (esquizontes ou esporozoítos em fase de multiplicação assexuada); cerca de 1-2 semanas depois os esporozoítos, transformando-se em merozoítos, provocam rupturas nos hepatócitos, libertam-se e entram na circulação sanguínea. A invasão dos eritrócitos ocorre através de receptores de superfície dos eritrócitos, específicos para cada uma das espécies de Plasmodium.
A fase eritrocitária inicia-se com a entrada nos eritrócitos de merozoítos, provenientes do fígado. O crescimento dos parasitas nos eritrócitos leva ao consumo do conteúdo eritrocitário, fundamentalmente a hemoglobina. No caso de P. falciparum, este começa a exibir após algumas horas nos eritrócitos, a proteína Plasmodium falciparum erythrocyte membrane protein 1 (PfEMP1), no exterior da superfície dos eritrócitos infectados, que medeia a ligação dos eritrócitos ao endotélio vascular; este mecanismo está associado às formas mais graves.
Uma vez no interior dos eritrócitos, os parasitas assumem a forma em anel, o qual aumenta de dimensões – é a evolução para trofozoítos (trofozoítos em fase precoce). Por sua vez, os trofozoítos multiplicam-se assexuadamente nos eritrócitos para produzirem um pequeno número de merozoítos eritrocitários os quais são libertados para a corrente sanguínea com a ruptura da membrana eritrocitária; esta invasão do sangue é acompanhada de febre.
Com o tempo, alguns merozoítos libertados dos eritrócitos diferenciam-se sexualmente, com formação de microgâmetas (gametócitos macho/M) e macrogâmetas (gametócitos fêmea/F), que são ingeridos durante uma refeição de sangue, através da picada do hospedeiro humano pela fêmea do mosquito Anopheles. No estômago do mosquito os microgâmetas penetram os macrogâmetas, dando origem ao zigoto que, após transformações sucessivas, origina os esporozoítos que migram para as glândulas salivares. O mosquito está agora em condições de inocular esporozoítos no próximo hospedeiro aquando da picada para se alimentar de sangue deste, completando o ciclo de vida de Plasmodium spp. Como particularidades deste ciclo há a referir que algumas formas de P. vivax e P. ovale – os hipnozoítos – poderão permanecer no fígado durante longos períodos e provocar recidivas, meses ou anos mais tarde.
Este processo biológico complexo gera alterações patológicas (febre, anemia, distúrbios imunopatológicos e hipóxia tecidual), as quais permitem compreender as manifestações clínicas.
A febre – como atrás foi dito – surge quando se verifica ruptura eritrocitária e libertação de merozoítos na circulação. A anemia explica-se pela hemólise, sequestração de eritrócitos no baço e outros órgãos, assim como pela repercussão sobre as células progenitoras eritropoiéticas da medula óssea dos mediadores libertados inflamatórios. Os distúrbios imunopatológicos associados à malária incluem essencialmente activação policlonal com diversas consequências: hipergamaglobulinémia, formação de imunocomplexos, imunodepressão, e excessiva formação de citocinas pró-inflamatórias (especialmente o factor de necrose tumoral alfa (TNF-α), interferão gama (IFN-γ) e interleucina-1 (IL-1)) com efeito patogénico multiorgânico incluindo hipóxia tecidual.
A adesão dos eritrócitos infectados ao endotélio vascular – ocorrendo mais frequentemente com P. falciparum – pode levar a obstrução do lume vascular e diminuição do débito sanguíneo, assim como a ruptura capilar com extravasão de sangue/plasma, fuga proteica e hipóxia tecidual. Como resultado da hipóxia, o metabolismo em anaerobiose origina hipoglicémia e acidose láctica.
Em suma, o conjunto destas alterações fisiopatológicas repercute-se em vários territórios com risco elevado de disfunção multiorgânica (designadamente ao nível do cérebro, coração, intestino e fígado).
A imunidade para a malária pode ser inata (isto é, geneticamente determinada), ou adquirida. A imunidade inata contribui para a destruição dos parasitas, através do baço, dos macrófagos e monócitos, principalmente os macrófagos da zona marginal do baço, através:
- de receptores de reconhecimento de padrões (PRR), como os Toll-like receptors (TLR) e NOD-like receptors (NLR), que reconhecem padrões moleculares associados ao patogénio altamente conservados;
- do papel activo do sistema complemento.
A imunidade adquirida pode ser passiva ou activa; a passiva pode ser devida à passagem transplacentar (mãe-feto) de anticorpos IgG anti-plasmódio; a activa desenvolve-se lentamente como resposta à infecção por plasmódios.
Nos mecanismos de imunidade contra plasmódios intracelulares têm papel fundamental os mediados por células (linfócitos T, macrófagos, polimorfonuclares, sistema reticuloendotelial do baço, etc.), enquanto os relacionados com anticorpos IgM, IgG e IgA (imunidade humoral) actuam fundamentalmente nos plasmódios extracelulares.
A imunidade após infecção por Plasmodium é incompleta, possibilitando ao hospedeiro evitar, até certo ponto, formas graves de doença, mas não a eliminação do parasita ou prevenir futuras infecções. Nalguns casos, a circulação de parasitas em pequeno número, na ausência de multiplicação rápida durante tempo prolongado, poderá originar formas clínicas não graves. No entanto, é possível que surjam episódios repetidos de doença, quando o parasita cria respostas imunes invasivas, tais como replicação intracelular, adesão eritrocitária ao endotélio vascular impedindo a sua passagem pelo baço, rápida variação antigénica e supressão ou depressão da resposta imune do hospedeiro.
Os eritrócitos contendo Hb S, Hb F, os que não têm antigénios do sistema Duffy, assim como os ovalócitos, são mais resistentes à malária.
Manifestações clínicas
O período médio de incubação da malária, considerando as várias espécies, é respectivamente: P. falciparum: 9-14 dias; P. knowlesi: 1-12 dias; P. vivax: 12-17 dias; P. ovale: 16-18 dias; P. malariae: 18-40 dias. Contudo, estes períodos podem ser mais longos, por vezes meses ou mesmo anos. Os grupos populacionais de maior risco são: crianças com idade inferior a cinco anos, grávidas e viajantes provenientes de áreas não endémicas.
Nalguns doentes ocorre um período prodrómico de 2-3 dias antes de os parasitas serem detectados no sangue, constituído por cefaleias, mialgias, febre ligeira, dor torácica e abdominal, artralgias e mal-estar geral. As manifestações clínicas da malária não grave, comuns nas cinco espécies, dependem do estado imunitário prévio dos pacientes e da idade. A maioria dos casos graves de malária ocorre em crianças entre os seis meses e os três anos de idade. Os sintomas mais leves ocorrem em crianças mais velhas e adultos, cuja parasitémia é geralmente mais baixa.
Na sua forma clássica, a malária tem um quadro de apresentação que raramente é observado noutras doenças infecciosas: paroxismos (com febre alta, arrepios, sudação intensa, cefaleias, dificuldade respiratória, mialgias, dores lombares e abdominais, anorexia, náuseas, vómitos, diarreia, palidez e icterícia), alternando com períodos de relativo bem-estar, embora com certo grau de fadiga.
Os referidos paroxismos coincidem com a ruptura dos esquizontes que ocorre com intervalos de 48 horas nos casos de P. vivax e P. ovale, e de que resultam “picos febris” em dias alternados; nos casos de P. malariae a referida ruptura ocorre com intervalos de 72 horas, com consequentes “picos febris” de 3-3 ou de 4-4 dias. A periodicidade torna-se menos aparente com P. falciparum, P. knowlesi e infecções mistas.
Os doentes com infecção primária, tais como viajantes provenientes de regiões não endémicas, podem também ter episódios sintomáticos irregulares durante 2-3 dias antes do início dos paroxismos regulares. Nas crianças com mais de dois meses não imunes, as manifestações clínicas de malária podem variar muito, entre febrícula e cefaleia, e febre alta associada a vómitos, diarreia, palidez, cianose, anemia, hepatoesplenomegália, trombocitopénia, leucopénia, por vezes em combinação.
As manifestações mais frequentes de malária grave (em geral associadas a P. falciparum) são alterações do estado de consciência que podem culminar no coma, dificuldade respiratória e anemia. Outras manifestações de gravidade incluem acidose metabólica, desidratação e sinais neurológicos (convulsões focais, rigidez de descerebração ou de descorticação, opistótono, reflexos plantares anormais, reflexos abdominais ausentes, etc.).
Quando a alteração do estado de consciência nos casos de malária por P. falciparum não pode ser explicada por hipoglicémia, convulsões ou qualquer outra causa, utiliza-se o termo de malária cerebral.
Descreve-se hoje um quadro de retinopatia da malária, não observável noutras infecções: áreas discretas de “branqueamento” da retina e aspecto de pequenos vasos de cor prateada, alaranjada ou esbranquiçada, em pequenos focos dispersos.
Outro aspecto particular ligado à malária por P. falciparum é a chamada esplenomegália hiperreactiva (associada a elevação de IgM, títulos elevados de anticorpos antimaláricos e a linfocitose sinusal hepática).
O Quadro 1 descreve a frequência relativa das manifestações clínicas e laboratoriais associadas a valor prognóstico, segundo critérios da OMS.
A recrudescência após ataque primário pode ocorrer devido à sobrevivência de formas eritrocitárias na corrente sanguínea. A recaída a longo prazo é provocada pela libertação de merozoítos a partir de fonte exoeritrocitária no fígado (P. vivax e P. ovale), ou persistência eritrocitária (P. malariae). A verificação de sintomatologia típica várias semanas após retorno de viajante de zona endémica é a favor de infecção por P. vivax, P. ovale ou P. malariae.
A malária por P. falciparum associada a mais intensa parasitémia corresponde, como foi referido, à forma mais grave, implicando medidas médicas de emergência. Com efeito, nesta forma a parasitémia em termos quantitativos relativos pode ser > 60% (explicável por infectar eritrócitos maturos e imaturos); em comparação, a parasitémia considerando em conjunto P. ovale e P. vivax (infectando somente eritrócitos imaturos), e P. malariae, (infectando somente eritrócitos maturos), é muito menor: < 2%.
Quadro 1 – Frequência relativa das principais manifestações de malária grave em crianças e adultos (valor prognóstico).
| Fonte: OMS 2000; *Escala de relevância; +→++→+++;+/- = achado pouco frequente | ||||
| Valor prognóstico* |
Manifestações clínicas e laboratoriais | Frequência* | ||
| crianças | adultos | crianças | adultos | |
| + | ? | prostração | +++ | +++ |
| +++ | ++ | alteração da consciência | +++ | ++ |
| +++ | +++ | dificuldade respiratória | +++ | + |
| + | ++ | convulsões | +++ | + |
| +++ | +++ | colapso circulatório | + | + |
| +++ | +++ | edema pulmonar | +/- | + |
| +++ | ++ | hemorragia | +/- | + |
| ++ | + | icterícia | + | +++ |
| + | + | hemoglobinúria | +/- | + |
| + | + | anemia grave | +++ | + |
| +++ | +++ | hipoglicémia | +++ | + |
| +++ | +++ | acidose | +++ | ++ |
| +++ | +++ | hiperlactacidémia | +++ | ++ |
| +/- | ++ | hiperparasitémia | ++ | + |
| ++ | ++ | alteração da função renal | + | +++ |
De salientar, ainda, as particularidades seguintes:
- A malária por P. vivax, embora menos grave do que a malária por P. falciparum, comporta maior risco de ruptura do baço;
- A malária por P. malariae tem como características fundamentais a maior benignidade, e também a maior tendência para a cronicidade, estando descritas formas com recrudescimento vários anos após ataque agudo;
- A malária por P. ovale é a forma mais rara, mais frequentemente associada a P. falciparum, e evidenciando-se de modo semelhante à provocada por P. vivax.
A passagem transplacentar de Plasmodium spp, com taxas de transmissão entre 10% e 54%, é comum em áreas endémicas.
Em mães não imunes, a malária congénita, mais comum, pode ser relacionada com qualquer espécie de Plasmodium. Os sinais surgem em geral entre os 10 e 30 dias de vida (com ampla variação entre 14 horas e vários meses): irritabilidade, febre, vómitos, dificuldade alimentar, diarreia, cianose e hepatoesplenomegália.
Surgindo a malária durante a gravidez, o quadro mórbido verificado na grávida poderá ter repercussões sobre o feto ou RN pela infecção da placenta, independentemente de haver, ou não, transmissão mãe🡪filho.
Diagnóstico
Como regra, pode presumir-se que qualquer caso de criança ou adolescente com febre e sinais de doença sistémica, e que tenha viajado para ou residido em zonas endémicas de malária há menos de um ano, possa estar afectada por malária, mesmo que tenha sido submetida a quimioprofilaxia. (ver adiante)
Nos casos com uma ou mais das seguintes condições, existe elevada probabilidade de etiologia pela espécie P. falciparum:
- Os sintomas ocorrendo < 1 mês após o regresso;
- Parasitémia > 2%;
- Parasitas em forma de anel (trofozoítos precoces);
- Eritrócitos infectados com mais de um parasita.
Para que haja maior probabilidade de detectar os parasitas, deve colher-se o sangue durante os ataques febris e antes da administração de qualquer agente terapêutico. Devem ser examinadas as preparações de sangue em gota espessa, em três ocasiões diferentes (por vezes, é necessário repetir o procedimento cada 4 horas/dia, sendo que o diagnóstico só deve ser excluído após um mínimo de três pesquisas negativas, com intervalo de 12 horas), procedendo-se à coloração pelo método de Giemsa (superior ao de Wright ou de Leishman). Os parasitas da malária apresentam-se como corpos corados de vermelho (material nuclear) e de azul (citoplasma) com grânulos negros ou castanhos, nas últimas fases de desenvolvimento, que ocorrem no interior dos eritrócitos.
Outros métodos (não dispensando o descrito exame microscópico, de primeira linha) que podem ser utilizados são:
- Detecção de anticorpos da malária através da imunofluorescência indirecta (IFA) e do imunoensaio enzimático (ELISA);
- Prova com anticorpo monoclonal;
- Estudo molecular por PCR (reacção em cadeia da polimerase);
- Detecção de antigénios da malária, sendo o mais significativo a imunocromatografia, que é a base dos testes de diagnóstico rápido comerciais disponíveis actualmente.
Diagnóstico diferencial
O diagnóstico diferencial da malária faz-se com larga série de doenças víricas ou bacterianas (sépsis, meningite, encefalite, endocardite, brucelose, febre recorrente, febre tifóide, etc.), doença de Hodgkin, colagenoses, entre outras.
Tratamento
O tratamento da malária consiste fundamentalmente em:
- Medidas gerais de suporte;
- Medidas específicas (farmacoterapia antimalárica); e
- Tratamento das complicações, descritas adiante.
A base do tratamento da malária simples ou não complicada por P. falciparum, recomendada pela OMS, são as combinações dos derivados da artemisinina (ACT). Como alternativa, poderá ser utilizada a combinação atovoaquona/proguanil, a mefloquina ou o quinino. A cloroquina é o fármaco indicado para malária não falciparum. (Quadros 2 e 3)
O fármaco recomendado pela OMS no tratamento inicial da malária grave é o artesunato endovenoso ou intramuscular durante, pelo menos, 24 horas, até que haja tolerância oral.
As alternativas existentes são o artemeter e o quinino em associação à doxiciclina ou clindamicina, por via endovenosa, durante sete dias. O quinino, por via parentérica deve ser substituído, logo que possível, pela via oral. A doxiciclina não deverá ser utilizada em crianças com menos de oito anos de idade.
QUADRO 2 – Fármacos recomendados pela OMS para o tratamento da malária não complicada, 2015.
| Fármaco | Dose e número de tomas |
| 1ª linha | |
| Arteméter + lumefantrina | (1 comprimido <> 20 mg de arteméter + 120 mg de lumefantrina) Via oral: 5 e 15 kg – 1cp 12/12h, 3 dias; 15 e 25 kg – 2 cp 12/12h, 3 dias; 25 e 35 Kg – 3 cp 12/12h, 3 dias; > 35 kg – 4cp 12/12h 3 dias. Nota: existem esquemas alternativos para administração em 60 h |
| Artesunato + amodiaquina | 4 mg/kg/dia de artesunato e 10 mg/kg/dia de amodiaquina, 1id, 3 dias |
| Artesunato + mefloquina | 4 mg/kg/dia de artesunato, 1id, 3 dias e 25 mg/kg de mefloquina, que poderá ser divido em 2 dias em 15 mg/kg e 10 mg/kg ou em 3 dias com 8,3 mg/kg/dia, 1id, 3 dias |
| Artesunato + sulfadoxina-pirimetamina | 4 mg/kg/dia de artesunato, 1id, 3 dias e uma administração única de 25/1,25 mg/kg sulfadoxina-pirimetamina em D1 |
| Artenimol + piperaquina | 5 e 7 kg: 10 mg de artenimol + 80 mg de piperaquina; 7 e 13 kg: 20 mg de artenimol + 160 mg de piperaquina; 13 e 24 kg: 1 comprimido (1 comprimido <> 40 mg de artenimol + 320 mg de piperaquina); 24 e 36 kg: 2 cp (1 cp <> 40 mg de artenimol + 320 mg de piperaquina); Administrar durante 3 dias consecutivos num total de 3 doses |
| 2ª linha | |
| Artesunato + tetraciclina ou doxiciclina ou clindamicina | artesunato (2 mg/kg, 1id ) tetraciclina (4 mg/kg, 6/6h) doxiciclina (3,5 mg/kg, 1id) clindamicina (10 mg/kg, 2id) tempo de tratamento: 7 dias |
| Quinino + tetraciclina ou doxiciclina ou clindamicina | tetraciclina (4 mg/kg, 6/6h) doxiciclina (3,5 mg/kg, 1id) clindamicina (10 mg/kg, 2id) tempo de tratamento: 7 dias |
QUADRO 3 – Fármacos recomendados pela OMS para o tratamento da malária grave, 2015.
| Fármaco | Dose e número de tomas |
| Artesunato | 2,4 mg/kg por via endovenosa ou intramuscular na admissão e depois às 12h e às 24h após a admissão, seguido de uma dose diária nos restantes dias de tratamento |
| Artemeter | 3,2 mg/kg por via intramuscular na admissão e depois 1,6 mg/kg/dia |
| Quinino (associado à Clindamicina ou Doxiciclina) | 20 mg do sal/kg na admissão por via endovenosa ou dividido em duas doses por via intramuscular, seguido de 10 mg/kg cada 8h |
Complicações
Para além da referência já feita à malária cerebral, cabe referir de modo sucinto outras complicações, em geral sistematizadas como manifestações clínicas de malária grave:
- Anemia, complicação frequente da malária grave em crianças, sendo a etiopatogénese de natureza multifactorial: – 1. destruição de eritrócitos parasitados e não parasitados e da redução da sua deformabilidade; – 2. diminuição de reticulocitose por disfunção da resposta da medula óssea por uma eritropoiese ineficaz e produção inadequada de eritropoietina; – 3. efeitos sistémicos da inflamação na eritropoiese; – 4. infecções bacterianas concomitants; e – anormalidades nutricionais prévias;
- Insuficiência renal, complicação frequente no contexto de malária por falciparum, surge por hemoglobinúria maciça no contexto de hemólise grave com deposição de Hb nos túbulos renais, associada a diminuição do débito sanguíneo renal;
- Edema pulmonar, complicação associada à doença (pelo aumento da permeabilidade capilar) e também iatrogénica em relação com fluidoterapia excessiva; no entanto, é mais comum nos adultos do que nas crianças;
- Hipoglicémia, frequentemente associada à doença e ao tratamento com quinino;
- Trombocitopénia, por vezes integrada no contexto de CIVD;
- Ruptura esplénica, já referida; por vezes iatrogénica ao proceder-se a palpação intempestiva num quadro de esplenomegália importante;
- Choque e síndroma de disfunção multiorgânica.
Prevenção
Os aspectos gerais da prevenção, incluindo os relacionados com a quimioprofilaxia e protecção contra insectos foram descritos no capítulo sobre Viagens, sugerindo-se a respectiva consulta. A este respeito é importante reforçar: 1 – o papel protector da roupa contra o mosquito, cobrindo a totalidade do corpo; 2 – a utilização, sempre que viável, de ambiente com ar condicionado, de mosquiteiros impregnados com permetrina durante a dormida, assim como de repelentes cujo composto padrão é DEET (N-N- dietil-m-toluamida), sendo considerados equivalentes os produtos contendo picaridina (icaridina) ou IR3535.
O desenvolvimento duma vacina eficaz é o grande desafio para o controlo da doença. Como dificuldade na sua fabricação cita-se designadamente a grande variedade antigénica do parasita nas fases eritrocitária e exoeritrocitária.
De salientar a investigação levada a cabo no CISM (Centro de Investigação em Saúde de Manhiça, com o patrocínio da Fundação Bill Gates) em Moçambique (Vacina RTS.S/ASO2A). Com o composto, utilizando um antigénio da fase pré-eritrocitária – a proteína CSP – demonstrou-se um efeito protector de 35% contra a malária clínica em crianças entre 1 e 4 anos, prevendo-se uma redução em 40% das formas mais graves e em 65% da incidência em recém-nascidos.
Considerando os casos de mães que amamentam e submetidas a medicação com antimaláricos, cabe referir que o teor do fármaco transferido mãe-filho por esta via não envolve risco para o bébé, mas não permite neste último a profilaxia da malária.
BIBLIOGRAFIA
Bergelson JM, Shah SS, Zaoutis TE. Pediatric Infectious Diseases. The Requisites in Pediatrics. Philadelphia: Mosby Elsevier, 2008
Brejt JA, Golightly LM. Severe malaria: update on pathophysiology and treatment. Curr Opin Infect Dis 2019;32:413-418
Chandramohan D, A. Dicko A, Zongo I, et al. Effect of adding azithromycin to seasonal malaria chemoprevention. NEJM 2019;380:2197-2206
Chen LH, Wilson ME, Schlagenhauf P. Prevention of malaria in long-term travelers. JAMA 2006; 296: 2234-2244
Cherry J, Demmler- Harrison GJ, Kaplan SL, et al (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Canada, 2018
Cook GC, Zumla AI (eds). Manson’s Tropical Diseases. London: Saunders, 2002
Cox FE. History of human parasitology. Clin Microbiol Rev 2002;15:595-612
Crawley J, Chu C, Mtove G, Nosten F. Malaria in children. Lancet 2010;375:1468-1481
Desai M, Kuile FO, Nosten F, et al. Epidemiology and burden of malaria in pregnancy. Lancet Infect Dis 2007;7:93-104
Direcção Geral da Saúde, Doenças de Declaração Obrigatória, 2009-2012 – Volume I. http://www.dgs.pt/?cr=25699 (acesso em Março, 2017)
Fanella ST, Lipkin H, Crockett ME. Presentation of pediatric malaria to a canadian children’s hospital. J Travel Med 2012;19:391-394
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Ghebreyesus TA. The malaria eradication challenge. Lancet 2019;394:990-991
Goldman L, Schafer AI (eds). Goldman – Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Guerin PJ, Olliaro P, Nosten F, Druilhe P, et al. Malaria: current status of control, diagnosis, treatment, and a proposed agenda for research and development. Lancet Infect Dis 2002;2:564-573
John CC. Drug treatment of malaria in children. Pediatr Infect Dis J 2003;22:649-651
Kantele A, Siikamaki H, Hannila-Handelberg T, et al. Plasmodium falciparum – malaria in pregnant african immigrants often goes unrecognized. J Travel Med 2012;19:380-382
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: McGraw Hill Education, 2018
Krause, Schoneberg I, Altman D, et al. Chemoprophylaxis and malaria death rates. Emerg Infect Dis 2006;12:447-451
Langfitt JT, McDermott MP, Brim R, et al. Neurodevelopmental impairments 1 year after cerebral malaria. Pediatrics 2019;143:(2) e20181026; DOI: 10.1542/peds.2018-1026
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Maitland K. Management of severe paediatric malaria in resource-limited settings. BMC Med 2015;13(1):42. doi:10.1186/s12916-014-0263-6.
Oliveira IC, Rosendo MT, Lucas I, et al. Malária em Portugal. Memórias de uma Luta no Vale do Rio Sado. Lisboa: INSA, IP 2014. http://www.insa.pt (acesso em Dezembro, 2019)
Rajagopalan A, Christelle M. Ilboudo CM. Malaria. Pediatr Rev 2019;40:151-153; DOI: 10.1542/pir.2017-0225
Remington J, Klein J, Wilson C, Baker C (eds). Infectious Diseases of the Fetus and Newborn Infant. Philadelphia: Saunders, 2006
Selent M, de Rochars VM, Stanek D, et al. Malaria prevention knowledge, attitudes, and practices (KAP) among international flying pilots. J Travel Med 2012;19:366-372
Suh KN, Kain KC, Keystone JS. Malaria. CMAJ 2004;170:1693-1702
Varandas L. Viajar com Crianças para Regiões Tropicais. Lisboa: GSK, 2007
White NJ, Pukrittayakamee S, Hien TT, et al. Seminar Malaria. Lancet 2013 (August 15) http://dx.doi.org/10.1016 S0140-6736(13)60024-0
World Health Organization /WHO. World Malaria Report 2015. Geneva/Switzerland: World Health Organization, 2015
World Health Organization /WHO. 2015 Guidelines for the Treatment of Malaria, Geneva, Switzerland World Health Organization, 2015