Definições
Considera-se parasita o organismo que, durante uma parte ou a totalidade da sua existência, se nutre permanente ou temporariamente com substâncias produzidas por outro ser vivo, excepto nos casos relativamente raros em que os parasitas são excessivamente numerosos. Parasitismo pode definir-se genericamente de três modos: 1) condição de um organismo que vive como parasita de outro organismo; 2) estado de um organismo infestado por parasitas; 3) presença de parasitas num ser vivo ou em certos órgãos (parasitismo intestinal, hepático, sanguíneo, etc.).
Noutra perspectiva, mais específica, surge o termo de simbiose, ligado à relação íntima e obrigatória entre dois organismos. Esta associação pode ser benéfica para ambos (mutualismo), benéfica para um e quase indiferente para o outro (comensalismo) ou benéfica para um em detrimento do outro (parasitismo). O organismo em que o parasita vive chama-se hospedeiro (definitivo ou intermediário), sendo o parasita, habitualmente, dependente deste. Por vezes, para manter o ciclo de vida do parasita, é necessária a acção de um vector (transportando o parasita de um hospedeiro para outro).
Parasitose é, pois, qualquer afecção devida a parasitas e o conjunto de manifestações patológicas que aqueles provocam. Na natureza, praticamente todos os animais estão parasitados.
A este respeito convém uma referência ao termo infestação por contraposição a infecção. Infestação corresponde a parasitose externa (pele e faneras), enquanto no termo infecção estão abrangidas as parasitoses internas (por ex. ascaridiose, filariose, esquistossomose, etc.).
Os parasitas constituem uma enorme variedade de organismos, com ciclos de vida mais ou menos complexos e com tamanhos que podem variar entre 5 μm a mais de 20 metros. Ao longo dos séculos, adaptando-se a todos os tipos de ambientes e de hospedeiros, podem viver fora das células do hospedeiro como no intestino, sangue, linfa ou no seu interior, como glóbulos vermelhos, músculo, etc..
Aspectos epidemiológicos e importância do problema
A distribuição geográfica das parasitoses é muito heterogénea salientando-se que as regiões mais afectadas são as tropicais e subtropicais. Globalmente, a mais importante é a malária que será descrita noutro capítulo. As estimativas para outras parasitoses não são, no entanto, mais optimistas. No mundo deverão existir 230 milhões de pessoas infestadas com Schistosoma, 120 milhões com filariose linfática, seis milhões com tripanossomose americana e dois biliões com nemátodos intestinais. No ocidente, ao longo dos últimos anos, a prevalência de parasitoses na população pediátrica diminuiu de forma muito acentuada.
Em Portugal, apesar da ausência de estudos epidemiológicos recentes em larga escala, as parasitoses mais frequentes são devidas ao protozoário Giardia lamblia e aos helmintas Enterobius vermicularis, Ascaris lumbricoides e Trichuris trichiura. Mais raramente poderão ser encontrados Strongyloides stercoralis, Ancylostoma duodenale, Taenia solium e Taenia saginata. Num estudo datado de 2001 na região de Lisboa, num grupo de crianças entre os 5 e 14 anos foi encontrada uma taxa de parasitismo intestinal por helmintas de 5,1%, excluindo Enterobius vermicularis. Os helmintas identificados foram: Trichuris trichiura (3,3%), Ascaris lumbricoides (1,9%), ancilostomídeos (1,4%), Strongyloides stercoralis (0,9%) e céstodes (0,5%); a taxa de poliparasitismo foi de 2,8%. As crianças filhas de emigrantes foram a população mais afectada.
Na região de Coimbra, mais recentemente (2008), excluindo também Enterobius vermicularis, a taxa de parasitismo intestinal em idade pediátrica foi inferior a 4%, exclusivamente por Giardia lamblia.
No entanto, a prevalência das parasitoses poderá ser muito diferente de umas regiões para outras, podendo existir focos endémicos e/ou epidémicos em determinadas zonas do país. Por outro lado, o incremento das viagens transcontinentais poderá levar à importação de parasitoses próprias de outras regiões do mundo e, eventualmente, à (re)introdução de algumas delas no País.
Em Portugal, apenas duas parasitoses são doenças de declaração obrigatória: leishmaniose visceral (provocada por protozoário) e equinococose (provocada por helminta). No período de 2008 a 2012, foram registados em Portugal até aos 15 anos de idade, 17 casos de leishmaniose visceral e nenhum caso de equinococose.
O objectivo deste capítulo é abordar, de modo integrado e sucinto, aspectos clínicos de doenças provocadas por protozoários e helmintas.
1. PROTOZOÁRIOS
Nomenclatura e características biológicas
Os protozoários são um tipo muito heterogéneo de organismos unicelulares, com morfologia mais diversificada do que as bactérias, com formas de replicação sexuada ou assexuada, possuindo organelos destinados a funções determinadas; citam-se como exemplos: os pseudópodos, flagelos, cílios ou membranas ondulantes para a locomoção; e pseudópodos ou sistemas pinocitóticos para a ingestão de alimentos. Podem apresentar duas formas: trofozoíto (forma adulta) e latente (quisto). Compreendem seis classes, havendo em todas elas membros que são patogénicos para o Homem. Muitos são saprófitas e, por vezes isolados das fezes humanas (por ex. Entamoeba coli, Endolimax nana). No Quadro 1 são descritas as classes de protozoários patogénicos, com exemplos.
QUADRO 1 – Classificação dos protozoários patogénicos (Classe: alguns exemplos).
|
Amebae: Entamoeba histolytica, Naegleria, Acanthamoeba, Blastocystis hominis Ciliados: Balantidium coli Flagelados: Giardia lamblia, Chilomastix mesnili, Leishmania spp, Trypanosoma spp, Trichomonas vaginalis Coccidia: Cryptosporidium, Cyclospora, Isospora, Toxoplasma gondii Sporozoa: Plasmodium spp, Babesia spp Microsporidia: Enterocytozoon bieneusi, Encephalitozoon spp |
Etiopatogénese, síntese clínica e tratamento
No que respeita à localização no organismo, são considerados dois grupos: os protozoários intestinais e os protozoários sanguíneos e teciduais. Nos primeiros, a transmissão faz-se pela via fecal-oral, e nos segundos, através da picada de um insecto vector. A excepção é a tripanossomose americana, cuja transmissão ocorre pela exposição a fezes contaminadas do insecto vector.
Os protozoários mais importantes para a espécie humana estão sistematizados no Quadro 2. A leishmaniose visceral (calazar), a malária, a giardiose, a tripanossomose americana (doença de Chagas) e a pneumocistose são descritas com mais pormenor em capítulos próprios.
QUADRO 2 – Protozoários que parasitam o Homem.
| Doença/Parasita | Distribuição | Transmissão | Clínica | Tratamento |
| Amebiose E. histolytica | Mundial (endémica em África, América Latina e Índia) | Fecal-oral | Intestinal: assintomática, diarreia com muco e sangue, tenesmo. Hepática: febre, dor abdominal, hepatomegália dolorosa. | Paromomicina, furoato de diloxanida, metronidazol, tinidazol. |
| Meningoencefalite amebiana Naegleria, Acanthamoeba, Balamuthia | Mundial | Inalação/aspiração | Aguda: cefaleias, náuseas, vómitos, meningite e encefalite. Granulomatosa: défices focais, convulsões, alteração de comportamento e do estado de consciência. | Anfotericina B. pentamidina, cetoconazol, flucitosina. |
| Criptosporidiose Cryptosporidium spp. | Mundial | Fecal-oral, interpessoal, animal-homem | Assintomática, diarreia aquosa, cólicas, fadiga, anorexia, perda de peso. Diarreia crónica em imunodeprimidos. | Nitazoxanida, paromomicina com azitromicina. |
| Giardiose G. lamblia | Mundial | Fecal-oral | Assintomática, diarreia aguda ou crónica, dor abdominal, anorexia, malabsorção, perda de peso, atraso de crescimento. | Metronidazol, tinidazol, albendazol, paromomicina. |
| Leishmaniose visceral Leishmania donovani, Leishmania spp. | Regiões tropicais, subtropicais e temperadas | Phlebotumus | Febre, anorexia, perda de peso, hepatoesplenomegália, anemia, leucopénia, trombocitopénia, hipergamaglobulinémia. | Anfotericina B lipossómica, antimoniais pentavalentes, miltefosina. |
| Leishmaniose cutânea Leishmania spp. | Bacia mediterrânica, América do Sul | Phlebotumus | Mácula, nódulo, úlcera indolor em áreas expostas da pele. Leishmaniose cutânea difusa: rara. | |
| Leishmaniose mucosa Leishmania spp. | América do Sul | Lutzomya | Eritema, edema, epistaxe, úlcera com mutilação do septo nasal, palato, lábios, faringe e laringe. | |
| Malária Plasmodium spp. | Região intertropical | Anopheles spp. | Febre, anemia, disfunção respiratória, alterações do estado de consciência. | Derivados da artemisinina, quinino, atovaquona-proguanil cloroquina, primaquina. |
| Pneumocistose Pneumocystis | Mundial | Respiratória | Febre, tosse, taquipneia, dispneia, hipóxia. | TMP-SMX, primaquina + clindamicina. |
| Toxoplasmose Toxoplasma gondii | Mundial | Oral | Assintomática. Febre, adenopatias, exantema, hepatomegália, coriorretinite. Infecção congénita: assintomática, SGA, prematuridade, icterícia exantema, adenopatias, hepatoesplenomegália, trombocitopénia, convulsões, microcefalia, hidrocefalia, coriorretinite, calcificações cerebrais. | Pirimetamina-sulfadiazina, espiramicina, leucovirina. |
| Tripanossomose africana (Doença do sono) T. b. gambiense T. b. rhodesiense | África ocidental | Glossina palpalis | Cancro de inoculação. Fase hemolinfática: febre, cefaleias, adenopatia cervical posterior, exantema. Fase neurológica: irritabilidade, sonolência e insónia, alterações de comportamento, alucinações, tremor, rigidez, ataxia, caquexia. | Pentamidina, suramina, eflornitina, melarsoprol. |
| África oriental | Glossina morsitans | |||
| Tripanossomose americana (Doença de Chagas) T. cruzi | América do Sul e Central | Triatoma, Rhodnius, Panstrongylus | Doença aguda: cancro de inoculação (chagoma), febre, adenopatias, hepatoesplenomegália, miocardite, meningoencefalite. Doença crónica: cardiomiopatia, megaesófago, megacólon. | Benznidazol, nifurtimox. |
2. HELMINTAS
Nomenclatura e características biológicas
A palavra helminta (derivada do Grego helmins significando verme) representa uma classe de parasitas muito complexos. Os helmintas são organismos cujo tamanho varia, de menos de um milímetro (Taenia canis) a vários metros (T. saginata).
Os dois principais grupos de helmintas são: nemátodos (vermes cilíndricos) e platelmintas (vermes achatados). Os nemátodos são parasitas que possuem aparelho digestivo completo e cujos sexos são separados. Na sua maioria, parasitam vertebrados e, alguns deles, o Homem. Como exemplos de nemátodos parasitas de animais (cão, gato, etc.) que acidentalmente infectam o Homem, citam-se Ancylostoma braziliense, Toxocara canis, Toxocara cati. Os platelmintas compreendem duas classes: 1) céstodes; com a forma de fita, são segmentados (segmentos ou proglótides) no estado adulto, desprovidos de tubo digestivo e munidos de órgãos de fixação (ventosas e ganchos) na sua extremidade cefálica (escólex). Cada segmento ou anel é hermafrodita e contém órgãos genitais dos dois sexos. 2) tremátodos; com corpo não segmentado, provido de tubo digestivo sem ânus, têm uma ou mais ventosas. Incluem-se nesta ordem os distómios (fascíolas).
Etiopatogénese, síntese clínica e aspectos gerais do diagnóstico
Os nemátodos, céstodes e tremátodos mais importantes para o Homem estão sistematizados nos Quadros 3, 4, 5, 6 e 7, com referência a aspectos essenciais da etiopatogénese, clínica e tratamento. Duma forma geral não se reproduzem no hospedeiro e a sua transmissão pode ser por via oral, penetração através da pele ou pela picada de um vector.
Sendo os nemátodos os parasitas que mais frequentemente infectam a espécie humana, designadamente os intestinais, é dada ênfase nesta alínea ao referido grupo, descrevendo nas alíneas seguintes aspectos específicos do diagnóstico e tratamento de algumas parasitoses referidas em quadros anteriores.
O verme adulto localiza-se no intestino; no seu ciclo de vida, alguns deles limitam-se ao tubo digestivo (Enterobius vermicularis, Trichuris trichiura), enquanto outros migram através do pulmão (Ascaris lumbricoides, Toxocara), ou através da pele (Ancylostoma duodenale, Necator americanus, Strongyloides stercoralis).
QUADRO 3 – Nemátodos cujo verme adulto reside no intestino.
| Doença/Parasita | Distribuição | Transmissão | Clínica | Tratamento |
| Ascaridiose A. lumbricoides | Mundial | Fecal-oral | Assintomática. Pneumonite, febre e eosinofilia (Síndroma de Loffler), obstrução intestinal. | Albendazol, mebendazol, pamoato de pirantel. |
| Ancilostomose A. duodenale, N. americanus | Ásia, África, América, Sul da Europa | Larva penetra a pele sã | Dor e prurido no local da penetração pela pele, dor abdominal, diarreia, anemia, malnutrição. | |
| Enterobiose E. vermicularis | Mundial | Fecal-oral | Assintomática. Prurido anal. | |
| Strongiloidose S. stercoralis | Regiões tropicais e subtropicais | Fecal-oral, autoinfecção | Pápulas pruriginosas, pneumonite, dor abdominal, diarreia, malabsorção, perda de peso, lesões perianais, eosinofilia. Pode ocorrer disseminação em imunodeprimidos. | Ivermectina, albendazol, tiabendazol. |
| Trichuris Trichuris thrichiura | Mundial | Fecal-oral | Dor abdominal, tenesmo, diarreia sanguinolenta, prolapso rectal, anemia, má progressão ponderal. | Albendazol, mebendazol, ivermectina. |
As filárias são nemátodos que sobrevivem no Homem durante muitos anos produzindo uma enorme quantidade de microfilárias que infectam o mosquito vector aquando da picada. As horas do dia em que estas se encontram no sangue ou em determinadas áreas da pele é diferente nas várias regiões, denotando uma adaptação positiva aos hábitos de picada do vector. O verme adulto não se multiplica no Homem.
Dracunculus medinensis transmite-se pela ingestão do hospedeiro intermediário; a sua erradicação seria possível se fosse utilizada água potável. O Quadro 4 refere-se aos nemátodos cujo verme adulto reside no sangue, sistema linfático ou tecido subcutâneo.
QUADRO 4 – Nemátodos cujo verme adulto reside no sangue, sistema linfático ou tecido celular subcutâneo.
| Doença/Parasita | Distribuição | Transmissão | Clínica | Tratamento |
| Filariose linfática Wuchereria bancrofti Brugia malayi Brugia timori | Regiões tropicais e subtropicais | Culex, Aedes, Anopheles | Febre, cefaleias, mialgias, linfadenite recorrente, linfadenopatias, edema progressivo dos membros e genitais (elefantíase). Síndroma da hipereosinofilia pulmonar tropical. | Dietilcarbamazina. |
| Sudoeste da Ásia e Índia | ||||
| Indonésia, Timor | ||||
| Loose Loa loa | África Central e Ocidental | Chrysops spp. | Edema migratório (Edema de Calabar), doloroso e pruriginoso, conjuntivite com edema palpebral. | Dietilcarbamazina |
| Oncocercose Onchcerca volvulus | África e América | Simulium | Nódulos subcutâneos, dermatite pruriginosa crónica e generalizada, ceratite, uveíte, coriorretinite e cegueira. | Ivermectina |
| Dracunculose Dracunculus medinensis | África Central e Ocidental e subcontinente Indiano | Oral (água contaminada com Cyclops) | Úlcera dolorosa no pé ou perna provocada pela saída do verme adulto. | Extracção do verme, metronidazol, mebendazol. |
Nalguns casos são as larvas, e não os parasitas adultos, que causam doença no Homem. Este é hospedeiro intermediário e a sua infestação não interfere com o ciclo de vida do parasita. (Quadro 5)
QUADRO 5 – Formas larvares de nemátodos que causam doença no Homem.
| Doença/Parasita | Distribuição | Transmissão | Clínica | Tratamento |
| Toxocarose Toxocara canis, Toxocara catis |
Mundial | Fecal-oral | Assintomática. Larva migrans visceral: febre, pieira, hepatomegália, anemia, leucocitose, eosinofilia. Larva migrans ocular: perda de visão unilateral, dor ocular, estrabismo, endoftalmite, leucocoria. | Albendazol, mebendazol. |
| Triquinose Trichinella spiralis |
Ásia, África e América | Oral (carne crua ou mal cozida) | Diarreia, dor abdominal, febre, edema periorbitário, urticária, mialgias, fadiga, dispneia, miocardite. | Albendazol, mebendazol. |
| Larva migrans cutânea Ancylostoma braziliense, Ancylostoma caninum |
Regiões tropicais e subtropicais | Larva penetra na pele sã | Pápula no local da penetração e erupção pruriginosa causada pela migração do parasita. | Tiabendazol, Mebendazol. |
A Figura 1 mostra aspecto de Ascaris lumbricoides eliminada por via rectal.
A Figura 2 mostra um aspecto de dermatite pruriginosa ao nível da nádega numa criança de 6 anos contactando com cães – lesão cutânea de larva migrans provocada por Ancylostoma caninum – edema, rubor e lesão filiforme e serpiginosa provocada pelo avanço subcutâneo da respectiva larva penetrando na pele, proveniente do intestino.
Os tremátodos necessitam dum caracol específico (hospedeiro intermediário) para o seu desenvolvimento, sendo este a principal condicionante da sua distribuição geográfica. As larvas penetram através da pele ou são ingeridas com alimentos migrando até aos locais onde se encontram os parasitas adultos (sangue venoso, intestino, sistema biliar e pulmão). (Quadro 6)
QUADRO 6 – Tremátodos mais importantes que parasitam o Homem.
| Doença/Parasita | Distribuição | Transmissão | Clínica | Tratamento |
| Esquistossomose ou Bilharziose Schistosoma mansoni, S. intercalatum, S. japonicum, S. mekongi, S. hematobium | Regiões tropicais | Larva penetra através da pele sã | Dermatite pruriginosa. Forma aguda: febre, arrepios, adenopatias, hepatoesplenomegália, eosinofilia. Forma crónica: disúria, hematúria, uropatia obstrutiva (S. hematobium), dor abdominal, diarreia, hepatoesplenomegália, fibrose hepática com hipertensão portal, hematemeses. | Praziquantel, oxamniquina. |
| Fasciolose Fasciola hepatica | Mundial | Oral | Febre, dor no hipocôndrio direito, icterícia, eosinofilia, hepatomegália, fibrose e cirrose. | Triclabendazol. |
| Paragonimiose Paragonimus spp. | Ásia, África, América Central e do Sul | Oral | Tosse, dispneia, dor torácica, suores nocturnos, hemoptises, fibrose pulmonar. | Praziquantel, triclabendazol. |
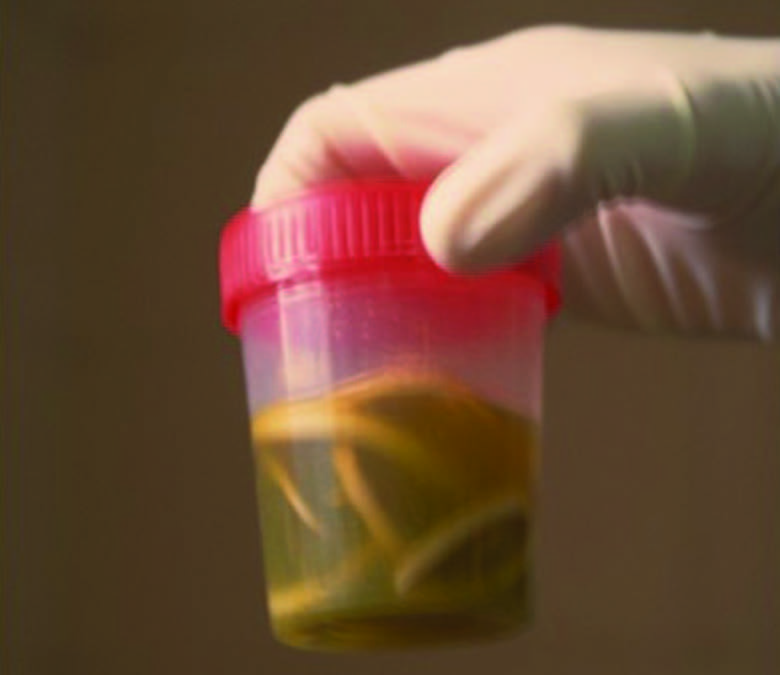
FIGURA 1. Ascaris lumbricoides. (NIHDE)
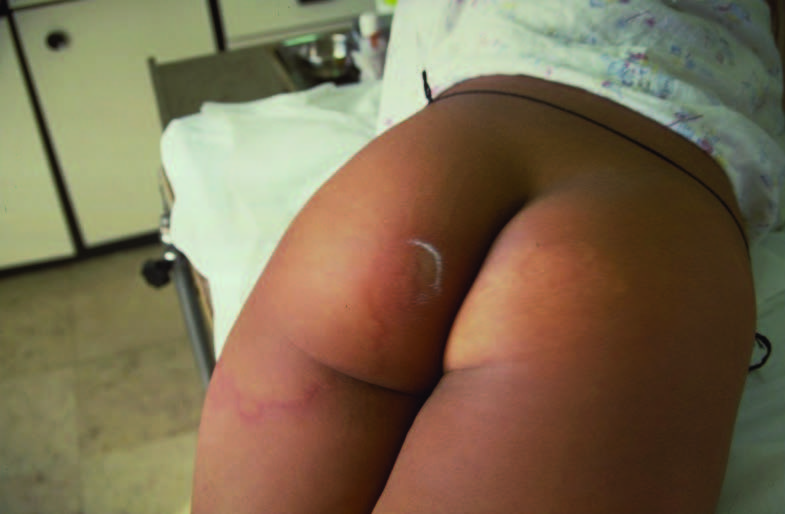
FIGURA 2. Larva migrans. (NIHDE)
Os céstodes no estado adulto são parasitas do tubo digestivo, vivendo no respectivo lume; no estado larvar fixam-se às vísceras (Quadro 7). Trata-se de parasitas prevalentes em todos os continentes, excepto na zona Antárctica, salientando-se que não existem sinais nem sintomas que se possam atribuir de modo distintivo a qualquer das formas no estádio de adulto, excepto no que toca ao Diphyllobothrium latum. Os estádios intermédios de alguns céstodos tais como Taenia solium e Echinococcus são invasivos e formam estruturas quísticas que produzem lesões em diversos tecidos por efeito de massa ou por reacção inflamatória.
Assim, as formas adultas podem ser facilmente diagnosticadas pelo achado de ovos ou de segmentos destacados nas fezes; para o diagnóstico das formas intermediárias/larvares, dada a sua localização em diversos tecidos, recorre-se a técnicas imagiológicas ou serológicas. (ver adiante)
De modo sucinto, e sem pormenorizar os respectivos ciclos evolutivos, para melhor compreensão das manifestações clínicas (com implicações no tratamento), recordam-se algumas noções fundamentais (cisticercose, hidátide e hidatidose ou doença hidática).
QUADRO 7 – Principais céstodes que parasitam o Homem.
| Doença/Parasita | Distribuição | Transmissão | Clínica | Tratamento |
| Teniose Taenia solium, T. saginata, Diphyllobothrium latum, Hymenolepis nana | Mundial | Oral (porco, vaca, peixe) | Assintomática. Astenia, dor abdominal, diarreia, perda de peso, deficiência em vitamina B12 (D. latum). | Praziquantel, niclosamida, nitazoxanida. |
| Cisticercose T. solium | Mundial | Fecal-oral | Neurocisticercose: cefaleias, mialgias, eosinofilia, “encefalite”, convulsões, hidrocefalia, sinais de hipertensão intracraniana. Medular: radiculopatia, mielite transversa. Ocular: dor, escotomas, visão turva, descolamento da retina. | Albendazol, praziquantel. |
| Hidatidose Echinococcus granulosus, Echinococcus multilocularis | Mundial Hemisfério Norte | Oral | Assintomáticos, desconforto abdominal, náuseas, vómitos, hepatomegália, massa abdominal. Tosse, hemoptises, pleurisia. Hipertensão intracraniana, convulsões, hidrocefalia. Pode ocorrer ruptura ou sobreinfecção bacteriana do cisto. Cada escólex pode originar um novo quisto. | Albendazol. Remoção cirúrgica. |
- Cisticercose → Infecção causada por cisticercos (larvas de vermes do género Taenia), que sobrevém após ingestão de ovos embrionados presentes nos alimentos crus (nomeadamente nos legumes contaminados por matérias fecais), cujos embriões, libertados no tubo digestivo, penetram em diversos tecidos e órgãos (olho, cérebro, coração, etc.), provocando lesões graves. Trata-se da forma parasitária mais comum e mais grave do SNC como resultado da infecção com a forma intermediária de solium, o céstode do porco. Este parasita, ao contrário de T. saginata, infecta a espécie humana e invade preferencialmente o SNC. T. solium pode existir também em água ou alimentos contaminados, não necessariamente carne de porco.
- Hidátide → Fase larvar dos céstodos Echinococcus granulosus ou Echinococcus multilocularis que tem a forma de uma vesícula mais ou menos volumosa, com forma esférica, cheia de líquido incolor, e que contém cabeças/proto-escólexes dos mesmos. (Figura 3)
- Hidatidose, equinococose ou doença hidática → Zoonose transmitida através de ovos de granulosus ou E. multilocularis existentes no intestino/fezes de animais domésticos/cães, gado, ou selvagens diversos. O Homem é contaminado ingerindo água ou alimentos contaminados com ovos, ou por contacto directo com cães infectados.
Existem duas formas clínicas de doença hidática:
- Doença quística hidática por E. granulosus;
- Doença alveolar, mais maligna, por E. multilocularis.
Após ingestão, as formas intermediárias penetram no tubo digestivo e, por via sanguínea ou linfática, atingem o fígado, pulmões e, menos frequentemente, outros tecidos. (Figs. 4, 5 e 6)
Nestes tecidos formam-se hidátides durante anos, sendo que o hospedeiro delimita a formação inicial que, entretanto, vai crescendo, formando-se, no caso de E. granulosus, um invólucro fibroso. Interiormente, o parasita produz uma camada celular germinal que produz milhares de parasitas ligados à parede interior da estrutura quística ou flutuando em líquido incolor, aquoso, no seu interior.
Tratando-se de E. multilocularis, a estrutura inicial não é tão delimitada, o que permite que os parasitas cresçam para o exterior, se disseminem nas estruturas vizinhas, tecidos e vasos, e metastizem, conferindo a esta forma clínica, características de malignidade.
Diagnóstico de algumas parasitoses intestinais
Exceptuando nos casos em que o parasita é visualizado, poderá ser necessário recorrer a exames complementares, designadamente laboratoriais, incluindo técnicas de biologia molecular. São referidos aspectos práticos relativamente a alguns parasitas (protozoários e helmintas).
- A observação microscópica das fezes permitirá a detecção de ovos, quistos ou trofozoítos. A colheita deve ser feita em três dias consecutivos, idealmente com intervalo de 48 horas, conservando-se as amostras no frigorífico a 4ºC até serem entregues no laboratório. Havendo diarreia, haverá maior probabilidade de detecção de trofozoítos. No caso de suspeita de Ascaris lumbricoides bastará uma amostra.
- Enterobius vermicularis pode ser detectado ocasionalmente nas fezes, mas os respectivos ovos em apenas ~ 5% dos casos. A forma mais simples de fazer o diagnóstico é identificar os ovos colocando uma fita-cola sobre a região anal durante a noite (período em que as fêmeas fazem a postura dos ovos); sendo retirada a fita-cola pela manhã, a mesma é colada a uma lâmina de microscópio para se proceder à visualização em microscópio.
- Tendo em conta distinguir entre Entamoeba histolytica e E. dispar (esta última mais frequente, mas não invasiva), podem ser utilizadas técnicas PCR ou enzimáticas.
- Cryptosporidium: os oócistos podem ser visualizados nas fezes ou na superfície de tecido de biópsia; contudo torna-se necessário proceder a técnicas específicas de coloração (por ex. Ziehl-Neelsen). Há também a possibilidade de utilizar técnicas de imunofluorescência (IFA), imunoenzimáticas (EIA) e de biologia molecular.
- Ténias: a visualização das proglótides é sinal patognomónico.
- Strongyloides stercoralis: as larvas poderão ser procuradas nas fezes (cultura de larvas durante 1 a 7 dias), no conteúdo duodenal e na expectoração.
- A colheita de sangue tem escassa utilidade, sendo clássica a eosinofilia (> 500 eosinófilos/mmc) ou hipereosinofilia (> 1.500 eosinófilos/mmc) associada a helmintíases com envolvimento tecidual. Pode verificar-se anemia por espoliação (por ex. nos casos de ancilostomose, ou por carência de vitamina B12 e folato (por ex. em parasitação por Strongyloides stercoralis).
Tratamento de situações específicas
Nesta alínea, em relação com o tratamento antiparasitário, é dada ênfase às parasitoses adiante discriminadas; de salientar que a giardiose, a doença de Chagas, a leishmaniose visceral e a malária integram capítulos próprios.
Amebiose
Quer se trate de doença invasiva (colite ou abcesso hepático), quer de colonização intestinal assintomática, utiliza-se o seguinte esquema: de início, metronidazol ou tinidazol, seguido de paromomicina ou iodoquinol.
– metronidazol → 35-50 mg/kg/dia, em 3 doses, durante 7-10 dias; – tinidazol → 50 mg/kg/dia, 1 dose, durante 3 dias (na colite), ou 5 dias (no abcesso hepático); – paromomicina → 25-35 mg/kg/dia, em 3 doses, durante 7 dias; – iodoquinol → 30-40 mg/kg/dia, em 3 doses, durante 20 dias.
Criptosporidiose (Cryptosporidium spp)
– nitazoxanida → 100 mg PO, duas doses diárias, (se 1-3 anos de idade), ou 200 mg (se 4-11 anos), ou 500 mg (se > 11 anos), durante período de diarreia; ou
– paromomicina → 25-35 mg/kg/dia, em 3 doses + azitromicina → 10 mg/kg/dia, 1 dose diária, durante 4 semanas, seguindo-se monoterapia com paromomicina durante mais 8 semanas (no contexto de infecção por VIH).
Toxoplasmose adquirida (Toxoplasma gondii)
– pirimetamina → 2 mg/kg/dia (dose de impregnação: 2 dias), seguindo-se 1 mg/kg/dia, (dose máxima de 50 mg/dia) + sulfadiazina (se > 1 ano de idade) → 100 mg/kg/dia (dose máxima de 4 g/dia) + leucovirina → 5-20 mg, 3 vezes/semana, durante 4-6 semanas.
|
Notas importantes:
|
Ascaridiose (Ascaris lumbricoides)
– albendazol → 400 mg PO, dose única; ou
– mebendazol → 100 mg PO, duas doses diárias, durante 3 dias.
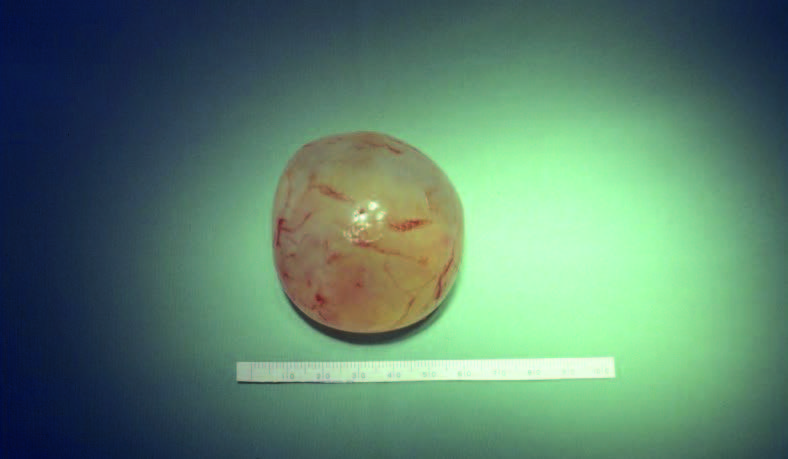
FIGURA 3. Aspecto de hidátide. (NIHDE)
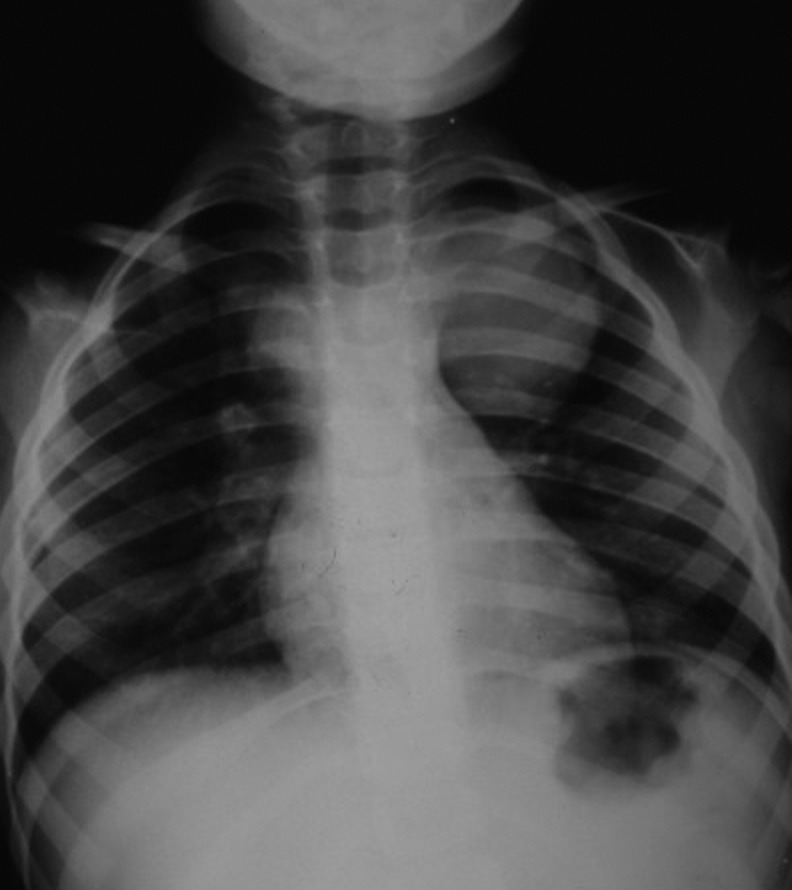
FIGURA 4. Hidatidose pulmonar. Opacidade redonda ocupando o ⅓ superior do campo pulmonar esquerdo (Radiografia póstero-anterior). (NIHDE)
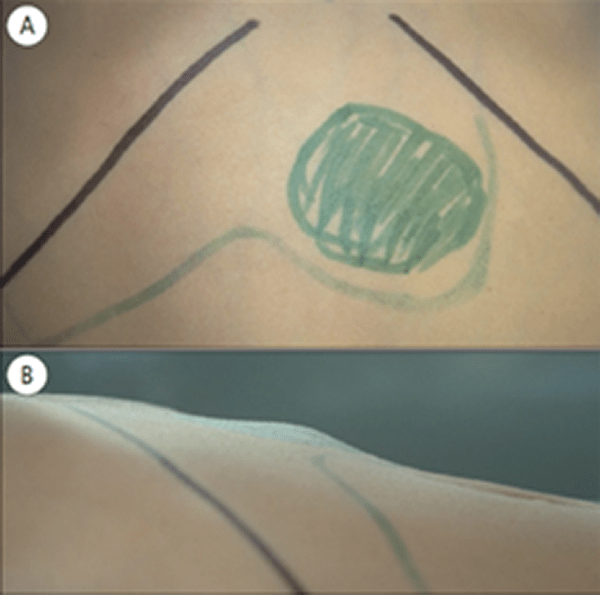
FIGURA 5. Hidatidose hepática. Observação de frente (A) e perfil direito (B) do hipocôndrico direito e epigastro permitindo visualizar procidência da parede abdominal por estrutura quística subjacente com superfície lisa palpável. (NIHDE)
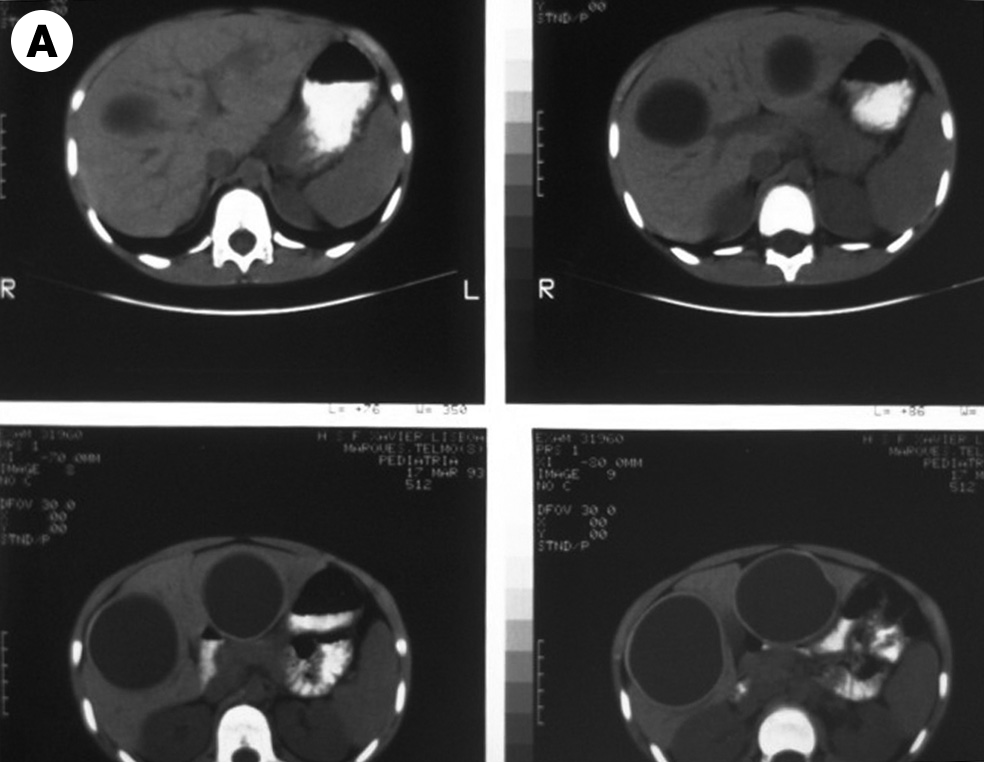
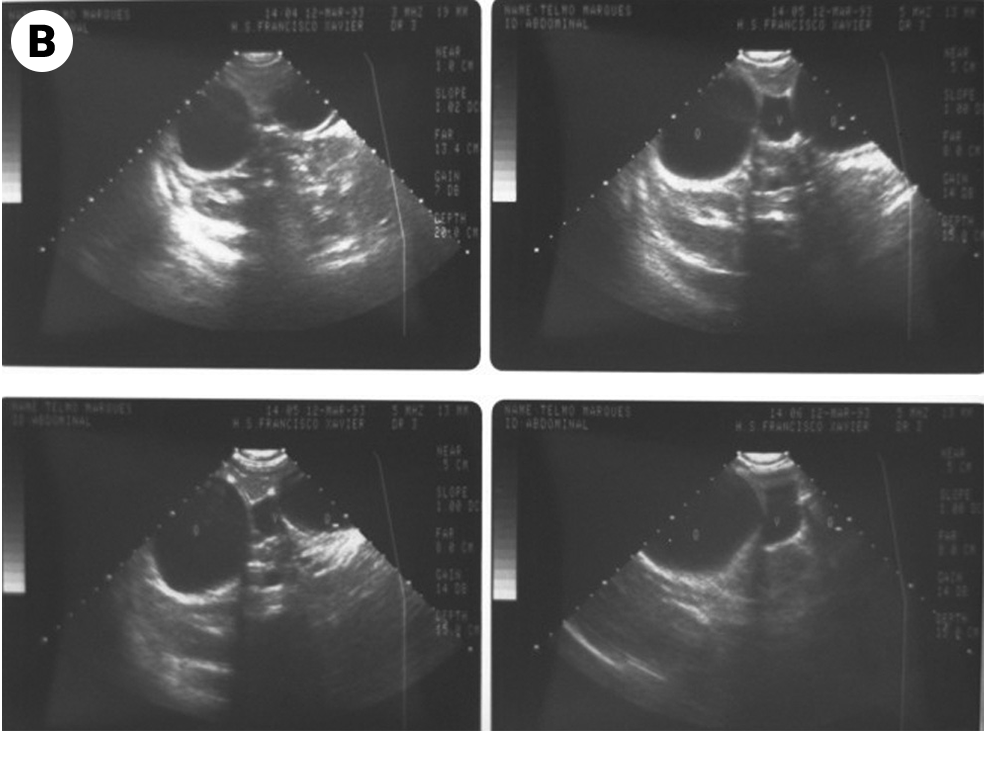
FIGURA 6. Imagens redondas de limites bem definidos (estruturas quísticas) no parênquima hepático relacionadas com hidatidose. A) TAC; B) Ecografia. (NIHDE)
Enterobiose (Enterobius vermicularis)
– albendazol → 400 mg PO, dose única (repetir 2 semanas depois); ou
– mebendazol → 100 mg PO, dose única (repetir 2 semanas depois).
Ancilostomose (Ancylostoma duodenale, Necator americanus)
– albendazol → 400 mg PO, dose única; ou
– mebendazol → 100 mg PO, duas doses diárias, durante 3 dias.
Estrongiloidose (Strongyloides stercoralis)
– ivermectina → 200 mcg/kg/dia PO, 1 dose diária, durante 1-2 dias; ou
– tiabendazol → 25 mg/kg/dia PO, 2 doses diárias, até dose máxima de 3 g/dia na síndroma de hiperinfecção durante 7-10 dias.
Tricuriose (Trichuris thrichiura)
– albendazol → 400 mg PO, durante 1-3 dias ; ou
– mebendazol → 100 mg PO, duas doses diárias, durante 3 dias, ou 500 mg PO em dose única; ou
– nitazoxanida → 100 mg PO, duas doses diárias, (se 1-3 anos de idade), ou 200 mg (se 4-11 anos), ou 500 mg (se > 11 anos), durante 3 dias.
Toxocarose (Toxocara canis e Toxocara catis)
– albendazol → 400 mg duas vezes por dia PO, durante 5 dias; ou
– mebendazol → 100-200 mg duas vezes por dia PO, durante 5 dias;
– corticosteróide associado (prednisolona → 1 mg/kg/dia durante 2-4 semanas).
Triquinose (Trichinella spiralis)
– albendazol → 400 mg duas vezes por dia PO, durante 8-14 dias; ou
– mebendazol → 200-400 mg três vezes por dia PO, durante 3 dias, seguindo-se → 400-500 mg três vezes por dia, durante 10 dias.
Larva migrans cutânea (Ancylostoma braziliense e Ancylostoma caninum)
– albendazol → 400 mg PO, durante 1-3 dias; ou
– ivermectina → 200 mcg/kg/dia PO, 1 dose diária, durante 1-2 dias.
Esquistossomose (Schistosoma)
– praziquantel → 40 mg/kg/dia PO, em duas doses diárias, durante 1 dia para S. heamatobium, S. mansoni e S. intercalatum; 60 mg/kg/dia para S. japonicum e S. mekongi.
Fasciolose (Fasciola hepatica)
– triclabendazol → 10-20 mg/kg/dia PO, 1 ou 2 doses diárias até total de 10-15 doses; ou
– bitionol → 30-50 mg/kg/dia PO, dose diária única, em dias alternados, até 10-15 doses.
Paragonimiose (Paragonimus spp)
– praziquantel → 75 mg/kg/dia PO, em três doses diárias, durante 2 dias.
Teniose (Taenia solium, T. saginata, Diphyllobothrium latum, Hymenolepis nana)
– praziquantel → 5-10 mg/kg PO, dose única; ou
– niclosamida → 50 mg/kg PO, dose única.
Cisticercose (Taenia solium)
– albendazol → 15 mg/kg/dia PO em duas doses diárias durante 28 dias, até dose máxima de 800 mg/dia; ou
– praziquantel → 50-100 mg/kg/dia PO em três doses diárias durante 28 dias; poderá equacionar-se a associação a corticóides, iniciados 2-3 dias antes da 1ª dose de praziquantel, e a cimetidina – inibidor do sistema citocrómio P450 – o que poderá contribuir para a eficácia do tratamento.
Hidatidose ou Equinococose (E. granulosus, E. multilocularis)
– albendazol → 15 mg/kg/dia PO, em duas doses diárias, durante 1-6 meses;
– como alternativa ao tratamento cirúrgico de remoção do quisto hidático, e em associação ao tratamento com albendazol, alguns centros aplicam a estratégia, conhecida pela sigla PAIR, nos casos de quistos mais acessíveis (aspiração percutânea, instilação de soro salino hipertónico ou outro agente que provoque destruição do escólex, e re-aspiração).
|
Notas importantes: De salientar, que nem todos os parasitas intestinais são patogénicos: 1) Amibas: Entamoeba dispar, Entamoeba coli, Entamoeba hartmani, Entamoeba moshkoushii, E chattoni, Endolimax nana, Iodamoeba buetschilii, Entamoeba gingivalis, Entamoeba polecki; 2) Protozoários flagelados: Trichomonas hominis, Chilomastix mesnili, Embadomonas intestinalis, Enteromonas hominis, Dientamoeba fragilis, Trichomonas tena; 3) Nemátodes: Capillaria hepatica, Dioctophima enale, Dipatelonema streptocerca, Mansonella ozzardi, Syngamus larnygeus, Ternides deminutus. |
Prevenção
- Os aspectos da prevenção de infecções e infestações descritos noutros capítulos e, designadamente, no Capítulo sobre Viagens, fundamentam-se na interrupção do ciclo epidemiológico; tal é conseguido, essencialmente, através de: medidas de higiene individual, saneamento público básico, controlo de vectores, quimioprofilaxia e uso de vacinas.
- No caso especial de crianças imigrantes, provenientes de áreas endémicas para certos parasitas, está indicado o exame parasitológico das fezes, mesmo na ausência de sintomas.
- De acordo com recomendações da OMS, apenas nos países com taxas de prevalência de parasitismo intestinal superiores a 20% está indicada a administração profiláctica de rotina com anti-helmínticos (albendazol ou mebendazol). Salienta-se que em Portugal não se justificam as “desparasitações de rotina” se não estiver provado o estado de parasitação do paciente.
- A quimioterapia em massa é também uma importante medida de prevenção para parasitoses como a filariose linfática (dietilcarbamazina) e a oncocercose (ivermectina).
- Vacinas. Nos últimos anos têm sido feitos progressos no sentido de desenvolver vacinas contra algumas das parasitoses mais importantes (nomeadamente para malária, esquistossomose, leishmaniose, giardiose e helmintíases intestinais). No entanto, com excepção da malária, vacinas eficazes não deverão estar disponíveis nos próximos anos.
BIBLIOGRAFIA
Bennett JF, Dolin R, Blaser MJ (eds). Mandell, Douglas and Bennett’s Principles and Practice of Infectious Diseases. Philadelphia: Elsevier, 2015
Cherry JD, Demmler-Harrison GJ, Kaplan SL, Hotez P, Steinbach WJ (eds). Feigin and Cherry’s Textbook of Pediatric Infectious Diseases. Philadelphia: Elsevier Saunders, 2014
Cholewiński M, Derda M, Hadaś E. Parasitic diseases in humans transmitted by vectors. Ann Parasitol 2015;61:137-157
Colley DG, Bustinduy AL, Secor WE, King CH. Human schistosomiasis. Lancet 2014;383:2253-2264
Cox FE. History of human parasitology. Clin Microbiol Rev 2002:15;595-612
Farrar J, Hotez P, Junghanss T, Kang G, Lalloo D, White N (eds). Manson’s Tropical Diseases. London: Saunders, 2014
Fernandes S, Beorlegui M, Brito MJ, Rocha G/SPP. Protocolo de parasitoses intestinais. Acta Pediatr Port 2012;43:35-41
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Hansen C, Paintsil E. Infectious diseases of poverty in children: A tale of two worlds. Pediatr Clin North Am 2016;63:37-66
Hotez PJ, Pecoul B, Rijal S, Boehme C, et al. Eliminating the neglected tropical diseases: translational science and new technologies. PLoS Negl Trop Dis 2016;10:e0003895
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: McGraw Hill Education, 2018
Llewellyn S, Inpankaew T, Nery SV, et al. Application of a multiplex quantitative PCR to assess prevalence and intensity of intestinal parasite infections in a controlled clinical trial. PLoS Negl Trop Dis 2016;10:e0004380
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
Magill AJ, Ryan ET, Hill RD, Solomon T (eds). Hunter’s Tropical Medicine and Emerging Infectious Diseases. Philadelphia: Saunders, 2013
Meurs L, Brienen E, Mbow M, Ochola EA, et al. Is PCR the next reference Standard for the diagnosis of Schistosoma in stool? A comparison with microscopy in Senegal and Kenya. PLoS Negl Trop Dis 2015;9:e0003959
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
F Read JS. Tickborne diseases in children in the United States. Pediatr Rev 2019;40:381-397. DOI: 1.1542/pir.2018-03404
Strickland GT(ed). Hunter’s Tropical Medicine and Emerging Infectious Diseases. Philadelphia: Saunders, 2000
Tarafdera MR, Carabina H, Josephb L, et al. Estimating the sensitivity and specificity of Kato-Katz stool examination technique for detection of hookworms, Ascaris lumbricoides and Trichuris trichiura infections in humans in the absence of a gold standard. Int J Parasitol 2010;40:399-404
Tékpa G, Fikouma V, Gbangba-Ngaï E, et al. Epidemiological and clinical profile of intestinal parasitosis of children in rural areas in Central African Republic. Arch Pédiatr 2019;26:34-37
Torgerson PR, Devleesschauwer B, Praet N, et al. World Health Organization estimates of the global and regional disease burden of 11 foodborne parasitic diseases, 2010: A data synthesis. PLoS Med 2015;12: e1001920
Varandas L. Viajar com Crianças para Regiões Tropicais. Lisboa: GSK, 2007
Ziegelbauer K, Speich B, Mausezahl D, Bos R, Keiser J, et al. Effect of sanitation on soil-transmitted helminth infection: systematic review and meta-nalysis. PLoS Med 2012;9:e1001162