Especificidade do período perinatal
Modernamente, é comum usar-se o título “Infecção associada à prestação de cuidados de saúde” como substituto de “Infecção hospitalar”. No entanto, aquele é um conceito mais amplo, englobando não só a infecção de origem hospitalar mas também a infecção adquirida em ambulatório, onde muitos doentes recebem cuidados de saúde.
Cabe salientar, a propósito, que a infecção associada à prestação de cuidados de saúde na comunidade é raríssima no período neonatal. Entendemos, por isso, que neste grupo etário, somente terá pertinência dar ênfase ao conceito clássico de infecção de origem hospitalar (IH).
Importância do problema
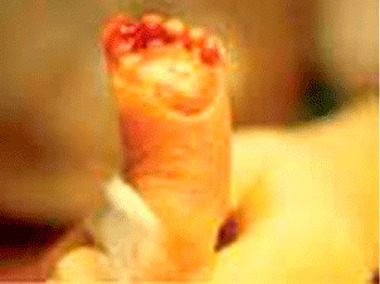
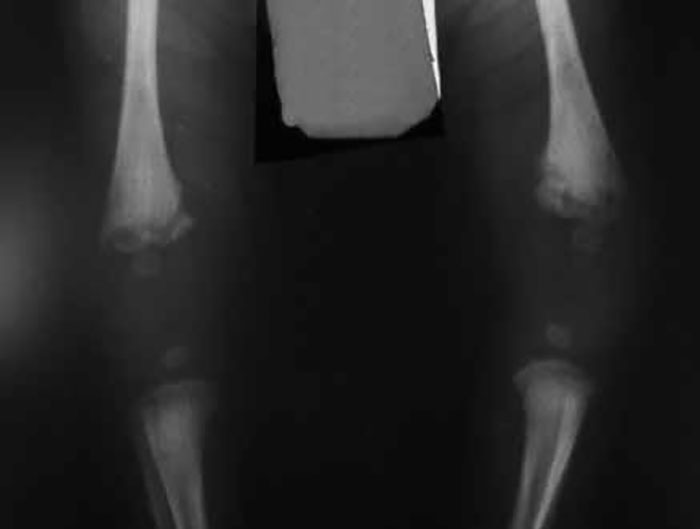
Os RN gravemente doentes admitidos em UCIN têm risco de IH, tanto mais elevado quanto mais grave for a doença de base, menor a idade de gestação, mais manobras invasivas forem realizadas, e maior tempo de internamento. Trata-se, pois, de problema comportando genericamente morbilidade e mortalidade evitáveis.
Por outro lado, tal problema é susceptível de agravar a doença de base, provado que está o seu efeito muito deletério sobre a própria doença de base, mais frequentemente sobre a patologia do SNC e do sistema respiratório.
Em termos quantitativos, o impacte pode ser tipificado pela seguinte realidade: a frequência das IH em unidades de cuidados intensivos neonatais (UCIN) só é ultrapassada pela frequência de infecção nas unidades de queimados, o que determina custos acrescidos.
Manifestações clínicas
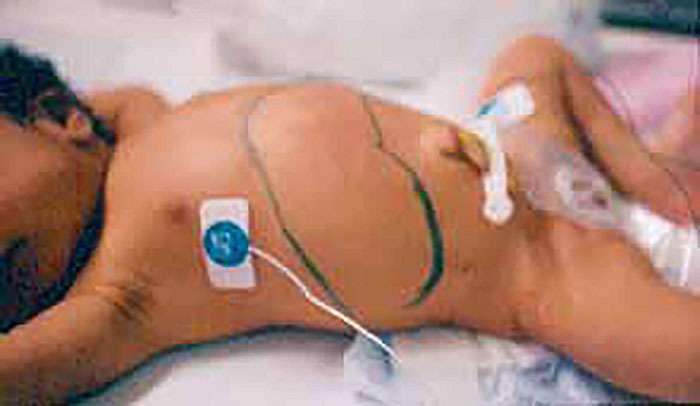
A septicémia relacionada com cateter venoso central (CVC) é muito frequente; mais rara é a pneumonia relacionada com o tubo traqueal nos RN submetidos a ventilação invasiva.
Ao contrário do que acontece em unidades de adultos em que a infecção mais frequente é a urinária, a infecção mais frequentemente encontrada nas UCIN é a sépsis (com hemocultura positiva ou negativa).
A lista dos agentes mais frequentemente isolados inclui Staphylococcus coagulase negativa, dos quais se destacam Staphylococcus epidermidis, frequentemente meticilinorresistentes – seguidos, de longe, pelas bactérias de Gram negativo de origem entérica ou não entérica, muitas vezes multirresistentes.
De notar, contudo, que a infecção que surge num RN admitido em UCIN, pode também ser de origem materna, pelo que tal hipótese deve estar sempre presente.
Prevenção
A atitude mais importante no que respeita às IH é a prevenção, e a medida isolada mais eficaz na prevenção é a lavagem das mãos. Depois, outros factores podem influenciar e ser melhorados no sentido de diminuir as taxas da referida morbilidade.
Uma correcta relação enfermeiro/doente, espaço físico e arquitectura adequados, equipas médica e de enfermagem estáveis, são alguns desse factores.
Outro factor de importância primordial é a política de antibióticos de uma unidade hospitalar. Dela depende a ecologia dos serviços e unidades. A multirresistência é, quer se queira aceitar ou não, uma consequência do uso desregrado de antibióticos, muitas vezes prescritos sem razão, para “alívio da consciência, por insegurança ou por ignorância”.
Se a lavagem das mãos é um procedimento fulcral no controlo de infecção, outras medidas não devem ser desprezadas, as quais fazem parte dos procedimentos escritos das unidades neonatais e da avaliação diária do doente. Referimo-nos aos seguintes procedimentos:
Notas importantes:
|
Para além das precauções a ter com os dispositivos invasivos, devem ser tomadas em atenção as medidas de isolamento adequadas a determinadas situações. Assim,
- um RN colonizado com bactéria multirresistente deve ser colocado em isolamento de contacto;
- um RN admitido do domicílio com infecção respiratória aparentemente vírica, em contexto de epidemia, deve ser colocado também em isolamento de contacto.
Numa perspectiva preventiva, é sempre importante reiterar certas noções consubstanciando regras básicas de não adiamento de certas atitudes:
- Retirar um CVC. Amanhã poderá já ser tarde, ter ocorrido um incidente – infecção, exteriorização, fractura, trombo;
- Extubar um doente. Neste intervalo o doente poderá contrair uma pneumonia, ou o tubo traqueal ficar obstruído e o doente falecer;
- Interromper antibioticoterapia;
- Dar alta ao doente. Em mais um dia de internamento muitos eventos adversos poderão ocorrer.
BIBLIOGRAFIA
Abbas S, Lee K, Pakyz A, et al. Knowledge, attitudes, and practices of bedside nursing staff regarding antibiotic stewardship: A cross-sectional study. Am J Infect Control 2019;47:230-233
Celik IH, Arifoglu I, Arslan Z, et al. The value of delta neutrophil index in neonatal sepsis diagnosis, follow-up and mortality prediction. Early Human Development 2019; 131: 6-9
Estañ-Capell J, Alarcón-Torres B, Bermúdez JD, et al. Effect of a surveillance system for decreasing neonatal nosocomial infections. Early Human Development 2019; 131: 36-40
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Krah NM, Hersh AL. OPAT for avoidance of hospitalisation in children. Lancet Infect Dis 2019;19:450-451
Long SS, Prober CG, Fischer M (eds). Principles and Practice of Pediatric Infectious Diseases. Philadelphia: Elsevier, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Moro M, Málaga S, Madero L (eds): Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Patel SJ, Saiman L. Principles and strategies of antimicrobial stewardship in the neonatal intensive care unit. Semin Perinatol 2012;36:431-6
Peters A, Tartari E, Mai SHC, et al. 2019 WHO hand hygiene campaign and global survey: clean care for all – it’s in your hands. Lancet Infect Dis 2019;19:463-464
Polin R, Denson S, Brady MT. Strategies for prevention of health care-associated infections in the NICU. Pediatrics 2012;129: e1085-e1109
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Vasudevan RS, Mojaver S, K-W Chang K-V, et al Observation of stethoscope sanitation practices in an emergency department setting. Am J Infect Control 2019;47:234-237
Willis Z, de St Maurice A. Strategies to improve antibiotic use in the neonatal ICU. Curr Opin Pediatr 2019;31:127-134