Definição e importância do problema
A leucomalácia periventricular (LPV) é uma forma de lesão estrutural da substância branca, em geral associada a HIPV da matriz germinal; tal designação foi usada pela primeira vez em 1962 por Banker e Larroche.
Malácia significa “amolecimento ou dissolução”. Tratando-se de tal fenómeno localizado na substância branca na zona periventricular (surgindo cerca de duas semanas após actuação da noxa), fala-se em leucomalácia periventricular. De salientar que o dito fenómeno de malácia, noutro contexto etiopatogénico poderá verificar-se noutras zonas da sustância branca: tratar-se-á de leucomalácia com outra localização.
Trata-se dum problema neurológico grave verificado predominantemente no RN pré-termo, integrando diversas entidades clinicopatológicas.
A incidência é tanto maior quanto menor a idade gestacional, o que se relaciona com o grau de vulnerabilidade da estrutura da substância branca e a data da agressão dos factores lesivos (intrauterinos e/ou pós-natais). O risco é maior nos casos de HIPV grave ou ventriculomegália.
Segundo a descrição clássica, como resultado de isquémia cerebral, são verificadas zonas bilaterais de necrose na área da substância branca periventricular, disrupção de axónios, inflamação, activação glial e lesão dos pré-oligodendrócitos conduzindo a sequelas em grau variável.
A lesão da substância branca tem sido também observada em situações com componentes de infecção e inflamação, tais como hipóxia ou hipotensão pós-natal, enterocolite necrosante, prematuridade tardia ou nascimento de termo e status pós-reparação cirúrgica de cardiopatia congénita.
De acordo com estudos realizados em diversos centros especializados em populações de crianças ex-RN com peso de nascimento inferior a 1.000 gramas, tem sido apurada incidência de LPV entre 3% e 5%.
Etiopatogénese
A compreensão da etiopatogénese da LPV tem evoluído ao longo do tempo, admitindo-se a comparticipação de eventos intrauterinos e pós-natais.
Realça-se uma complexa interacção entre determinados factores: o desenvolvimento da vasculatura cerebral, a regulação do débito sanguíneo cerebral (ambos dependendo da idade gestacional), o estado de maior ou menor vulnerabilidade (dependente do grau de maturação) dos precursores dos oligodendrócitos ou pré-oligodendrócitos, fundamentais para a mielinização, e os processos de infecção e inflamação materno-fetal.
Relativamente aos pré-oligodendrócitos (considerado factor major), importa referir que, quanto maior a sua maturação, maior a resistência à toxicidade do glutamato e dos radicais livres, gerados em abundância em caso de isquémia-reperfusão.
Acontece o contrário (maior vulnerabilidade) com os pré-oligodendrócitos imaturos. Trata-se, pois, de células extremamente vulneráveis à agressão por radicais livres.
A prematuridade constitui um importante factor predisponente de LPV.
No RN pré-termo, com imaturidade estrutural, são as áreas da substância branca as mais vulneráveis e susceptíveis a isquémia-reperfusão: pequenas zonas entre a confluência ou anastomose de dois sistemas de drenagem sanguínea em continuidade (zonas “fronteira”).
Tais áreas de perfusão inadequada, subsidiárias das artérias medulares profundas, localizam-se na substância branca a alguns milímetros da parede ventricular (localização periventricular). Sendo afectados os axónios que atravessam as referidas “zonas fronteira”, de tal interrupção anatomofuncional resultará diplegia espástica, a sequela ou perturbação motora típica do RN pré-termo.
Se as lesões da substância branca forem mais extensas, poderão ser afectados os axónios que se estendem até aos membros superiores e face. As ramificações ópticas e acústicas também podem ser atingidas.
Por outro lado, no RN pré-termo o córtex cerebral é mais poupado aos efeitos da isquémia-reperfusão porque possui abundante vascularização dependente das artérias leptomeníngeas.
No RN de termo a área de maior vulnerabilidade é o córtex cerebral, podendo então surgir outro tipo de leucomalácia – chamada leucomalácia subcortical, situação pouco abordada na literatura.
Para além da prematuridade per se, menciona-se o papel de outros factores que, por sua vez, podem estar associados a prematuridade:
|
Como consequência da isquémia-reperfusão e dos eventos referidos ao nível da substância branca periventricular, surge o quadro morfológico de leucomalácia, a forma mais característica de necrose axonal e glial na substância branca no RN pré-termo.
Segundo Volpe, a maior probabilidade de surgimento de LPV no contexto de hemorragia intraperiventricular (HIPV) pode relacionar-se com o aumento da concentração local de Ferro derivado da hemorragia.
A LPV constitui uma patologia sempre bilateral, com localização mais habitual na região do corpo do ventrículo lateral e do corno frontal, ao nível do buraco de Monro e do corno occipital. Pode ser difusa ou focal.
A LPV focal é classicamente descrita como áreas macroscópicas de necrose, as quais inicialmente são identificadas como lesões ecodensas na área periventricular, com ou sem sangue nos ventrículos. Algumas semanas depois, estas áreas ecodensas evoluem para áreas quísticas, quadro morfológico que traduz a chamada LPV quística, uma minoria entre as LPV (< 5% em RNMBP). A gliose cicatricial contribui, por sua vez, para a redução do volume das cavidades, podendo seguir-se microcalcificações secundárias.
A LPV difusa, na era moderna mais frequentemente explicada por maturação anormal dos neurónios e da glia do que por necrose, está associada a perda de pré-oligodendrócitos; tal facto conduz a hipomielinização e diminuição do volume da substância branca por retracção cicatricial, e à dilatação ventricular por mecanismo ex-vacuo.
No âmbito da avaliação imagiológica desta patologia está indicada a ressonância magnética (RM), tendo em conta as limitações da ecografia. (ver adiante)
Manifestações clínicas
Inicialmente, as manifestações clínicas podem ser inespecíficas. De facto, as mesmas correspondem a sequelas dos eventos descritos anteriormente: fundamentalmente, diplegia espástica (típica da LPV), alterações da motricidade fina, alterações da esfera cognitiva, problemas de memorização e atenção e, nalgumas crianças, insuficiência mental.
Para avaliação do prognóstico, torna-se necessário proceder a exame neurológico rigoroso e seriado durante o período de internamento hospitalar e após a alta.
A probabilidade de doença motora futura depende, entre outros factores, da localização e do tipo das lesões encontradas nos estudos imagiológicos.
Exames complementares
Na prática clínica corrente assume particular importância, como complemento do exame neurológico seriado, a ecografia transfontanelar (também realizada de modo seriado).
Os sinais ecográficos mais característicos de LPV são: hiperecogenicidade periventricular seguida de sinais de quistos porencefálicos (sinal do “queijo suíço”); numa fase mais tardia e nas formas mais graves passam a ser notórios sinais de atrofia cortical com alargamento dos ventrículos (Figuras 1, 2 e 3).
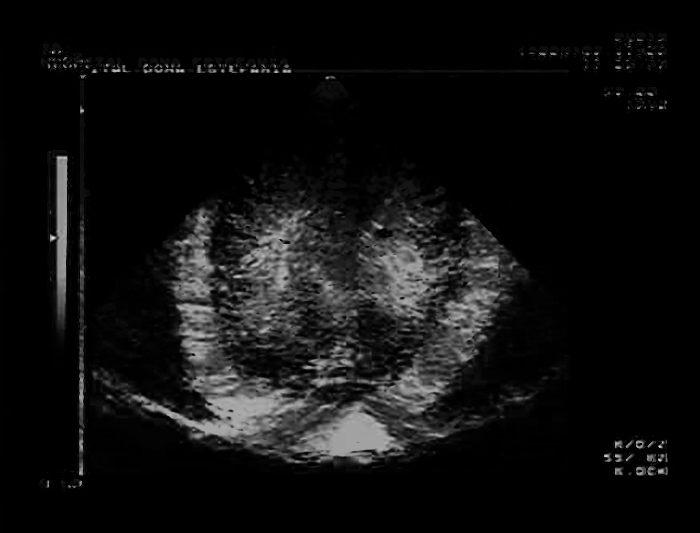
FIGURA 1. Aspecto ecográfico de leucomalácia não quística ao nível dos cornos frontais. Corte coronal e parassagital. (UCIN-HDE)
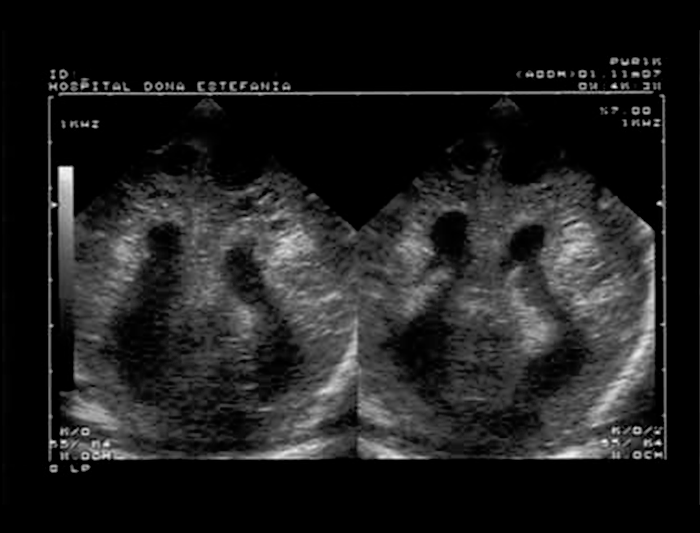
FIGURA 2. Leucomalácia periventricular (LPV) quística e alargamento do sistema ventricular por mecanismo ex vacuo. Corte coronal posterior. (UCIN-HDE)
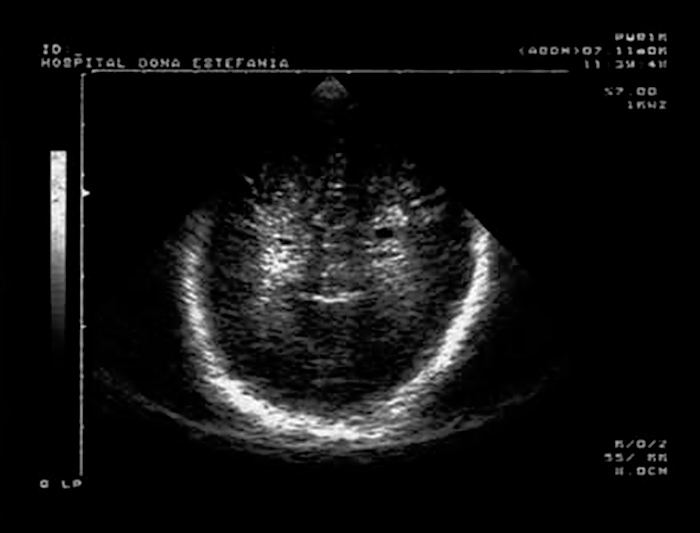
FIGURA 3. Leucomalácia quística posterior.Corte coronal. (UCIN-HDE)
Em estudos de correlação clínico-patológica, a sensibilidade da ecografia transfontanelar é cerca de 70%, o que equivale a dizer que existe fraca capacidade discriminativa para a detecção de pequenas áreas de necrose.
Assim, outros exames de imagem evidenciando maior sensibilidade, poderão estar indicados em função do contexto clínico (RM, TAC, Eco-doppler, Espectroscopia próxima dos infravermelhos, etc.).
A RM é um método mais rigoroso identificar todas as formas de LPV, quer no lactente, quer na criança mais velha, designadamente nos casos em que há antecedentes de prematuridade e quadro de alterações cognitivas, sensoriais e ou motoras. Em função do contexto clínico poderá estar indicado o EEG.
Tratamento e prevenção
Na fase actual dos conhecimentos não existem medicações nem medidas para o tratamento específico da LPV durante o período neonatal. Nesta perspectiva, todos os esforços deverão ser dirigidos essencialmente para a prevenção da isquémia-reperfusão e da HIPV, atendendo aos factores de risco e etiopatogénese.
Assim, torna-se fundamental garantir uma perfusão cerebral normal e estável através de procedimentos e atitudes no âmbito do internamento em UCIN: monitorização da pressão arterial (evitando variações bruscas deste parâmetro),* volémia, oxigenação e ventilação com especial atenção para a hipocápnia e hipóxia, manuseamento mínimo do RN, evicção da infecção materno-fetal, antibioticoterapia atempada para tratamento da infecção materno-fetal e neonatal, etc.. Resultados da investigação experimental apontam para a utilização de antagonistas dos radicais livres, de agentes anticitocinas e antiglutamato.
*Existe controvérsia acerca dos procedimentos para manter pressão arterial normal no pré-termo, pois, de acordo com o que foi referido na alínea Etiopatogénese, face às características de disfunção do mecanismo de autorregulação cerebral no RN pré-termo, pressão arterial normal não significa necessariamente perfusão cerebral normal, o que constitui uma dificuldade para o clínico. |
Prognóstico e seguimento
A LPV constitui a principal causa de disfunção cognitiva, comportamental, motora e sensorial em crianças nascidas com idade gestacional < 32 semanas. Nas formas mais graves poderá desenvolver-se epilepsia.
Como resultado da LPV, verifica-se incidência aproximada de paralisia cerebral ~10%, e de dificuldades escolares ~35%-50%, sendo que estes resultados traduzem, segundo alguns estudos, associação de HIPV e LPV. As sequelas são tanto mais frequentes quanto menor a idade gestacional.
A diplegia espástica constitui a sequela mais frequentemente associada a patologia do SNC em RN pré-termo, dado que a lesão na substância branca se localiza em geral na zona vizinha ou justaposta aos ventrículos. Se as lesões se localizarem mais perifericamente, poderão ser afectados os axónios de que dependem a face, os membros superiores e a visão (neste último caso, se a localização for dorsolateral ou contígua aos cornos occipitais).
Como se pode depreender, os casos de LPV, muitas vezes associados a outros problemas no contexto de ex-RN pré-termo, deverão ser seguidos pelo médico assistente, por sua vez, em ligação a uma equipa multidisciplinar no âmbito de um centro de desenvolvimento.
BIBLIOGRAFIA
Carrapato MRG, Andrade T, Caldeira T. Hypotension in small preterms: what does it mean? J Maternal-Fetal & Neonatal Medicine. https://doi.org/10.1080/14767058.2018.1481034
Carrapato MRG, Pereira T, Silva C, et al. Late preterms: are they all the same? J Maternal-Fetal & Neonatal Medicine. https://doi.org/10.1080/14767058.2018.1527897
Cloherty JP, Eichenwald EC, Strak AR. Manual of Neonatal Care. Philadelphia: Lippincott Williams & Wilkins, 2008
De Reuck J. The human periventricular arterial blood supply and the anatomy of cerebral infarctions. European Neurology 1971;5:321-334
Dyet LE, Kennea N, Counsell SJ, et al. Natural history of brain lesions in extremely preterm infants studied with serial MRI from birth and neurodevelopmental assessment. Pediatrics 2006;118:536-548
Fellman V, Raivio KO. Reperfusion injury as the mechanism of brain damage after perinatal asphyxia. Pediatr Res 1997;41:599-606
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Gilles FH, Leviton A. Neonatal white matter damage and the fetal inflammatory response. Semin Fetal Neonat Med 2020; 25: Article 101111
Guimarães JC, Carneiro MJ, Loio P, Macedo A, Tuna ML, et al. Manual Prático de Neonatologia. Lisboa: Hospital de S. Francisco Xavier/Uriage, 2016
Inder TE, Perlman JM, Volpe JJ. Volpe’s Neurology of the Newborn. Philadelphia: Elsevier, 2018
Jacobson L, Ygge J, Flodmark O, et al. Visual and perceptual characteristics, ocular, motility and strabismus in children with periventricular leukomalacia. Strabismus 2002;10:179-183
Kidokoro H, Neill JJ, Inder TE. New MR imaging assessment tool to define brain abnormalities in very preterm infnts at term. American J Neuroradiol/AJNR 2013;34:2208-2214
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lasry O, Shevell MI, Dagenais L, et al. Cross-sectional comparison of periventricular leukomalacia in preterm and term children. Neurology 2010; 74:1386-1391. doi: 10.1212/WNL.0b013e3181dad62d.
Levene M. Neonatal Neurology. Edinburgh: Churchil Livinstone, 2002
Lou H, Lassen N, Friis-Hansen B. Impaired autoregulation of cerebral blood flow in the distressed newborn infant. J Pediatr 1979;94:118-121
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saunders, 2015
Silveira RC, Procianoy RS, Dill JC, et al. Periventriculat leukomalacia in very low birth weight preterm neonates with high risk for neonatal sepsis. J Pediatr (Rio J) 2008;84:211-216
Soul JS, Hammer PE, Tsuji M, et al. Fluctuating pressure-passivity is common in the cerebral circulation of sick premature infants. Pediatr Res 2007;61:467-473
Verboon-Maciolek MA, Truttmann AC, Groenendaal F, et al. Development of cystic periventricular leukomalacia in newborn infants after rotavirus infection. J Pediatr 2012;160:165-168
Verboon-Maciolek MA, Utrecht FG, Cowan F, et al. White mat- ter damage in neonatal enterovirus meningoencephalitis. Neurology 2008; 71:536.doi: 10.1212/01.wnl.0000324706. 94229.88
Virella D, Folha T, Andrada MG, Gouveia R, Cadete A, Alvarelhão J, Calado E. Vigilância Neonatal da Paralisia Cerebral aos 5 anos de idade. Lisboa: UVP/SPP, 2016
Volpe JJ. Encephalopathy of prematurity includes neuronal abnormalities. Pediatrics 2005;116:221-225
Volpe JJ. Cerebral white matter injury of the premature infant- more common than you think. Pediatrics 2003;112:176-180
Volpe. JJ. Neurobiology of periventricular leukomalacia in the premature infant. Pediatr Res 2001;50:553-562. doi: 10.1203/00006450-200111000-00003.