Definições e importância do problema
A encefalopatia neonatal é uma síndroma definida clinicamente por disfunção neurológica no RN de termo no período neonatal precoce. Manifesta-se por uma combinação de sinais incluindo alteração do estado de consciência, tono muscular ou reflexos anormais, alterações da função autonómica, ou convulsões.
A importância deste problema clínico, relacionado com lesão neonatal do SNC, pode ser tipificada por números: em todo o mundo, anualmente, letalidade de 1 milhão de crianças e 1 milhão de casos com sequelas permanentes e invalidantes.
Como factores etiológicos descrevem-se os seguintes:
- combinação de hipóxia e isquémia intra ou pré-parto (encefalopatia hipóxico-isquémica/EHI) que pode ser acompanhada por sinais de sofrimento fetal, e diversas patologias do foro vascular, incluindo hemorragia intracraniana e acidente vascular cerebral;
- lesão secundária a traumatismo de nascimento;
- infecções;
- alterações genéticas;
- alterações metabólicas; e
- anomalias congénitas cerebrais.
Neste capítulo é dada ênfase à EHI em RN de termo. Nos capítulos seguintes são abordadas as seguintes nosologias: Hemorragias Intracranianas, Enfarte Cerebral e Leucomalácia Periventricular, esta última associada a determinado grupo de hemorragias intracranianas, como paradigma de lesão da substância branca.
Na literatura médica, relativamente à patologia parenquimatosa (adquirida) do SNC no RN, é adoptada uma sistematização nosológica diversa. Como alternativa ao termo Encefalopatia Neonatal, emprega-se o termo Lesão Cerebral Neonatal. Assim, neste conceito, são englobadas as seguintes entidades: Encefalopatia Hipóxico-Isquémica, Enfarte Cerebral, Hemorragia Intracraniana, Lesão da Substância Branca, Abcessos Cerebrais e Tumores Cerebrais. |
ENCEFALOPATIA HIPÓXICO-ISQUÉMICA
Introdução
A EHI pressupõe a existência de lesão cerebral atribuída a hipóxa-isquémia.
O défice de oxigenação tecidual pode ser causado, quer por hipoxémia (diminuição do conteúdo em oxigénio no sangue), quer por isquémia (redução da perfusão sanguínea em determinado território); em geral, estes dois eventos ocorrem em simultâneo ou de modo sequencial.
Asfixia define-se como o compromisso das trocas gasosas, correspondendo, não só ao défice de oxigenação sanguínea, mas igualmente ao excesso de CO2 (hipercápnia), com consequente acidose.
O diagnóstico de asfixia perinatal implica a presença de 4 critérios:
- pH arterial umbilical <7,0;
- índice de Apgar 0-3 aos 5 minutos;
- sinais neurológicos no pós-parto;
- disfunção multiorgânica no período neonatal imediato (pulmonar, renal, cardiovascular, metabólico, gastrintestinal, hematológico), ou morte.
Uma situação de asfixia perinatal mantida, determinando a hipotensão e isquémia e conduzindo a alteração do débito sanguíneo cerebral, é a causa mais frequente de encefalopatia hipóxico-isquémica (EHI).
A designação de depressão neonatal corresponde à situação clínica de RN de termo com adaptação prolongada à vida extrauterina, geralmente associada a índice de Apgar baixo ao 1 e 5 minutos.
Aspectos epidemiológicos
A incidência de EHI (causa importante de morbilidade e de mortalidade) é cerca de 2 a 9/1.000 nados-vivos, em proporção muito maior nos países em desenvolvimento.
A mortalidade global por asfixia perinatal oscila entre 10% e 30%; a frequência de sequelas no âmbito do neurodesenvolvimento em sobreviventes com tal patologia é da ordem de 15% a 45%.
O risco de paralisia cerebral (PC), havendo antecedentes de asfixia perinatal, é 5%-10% em comparação com 0,2% na população geral. De acordo com estudo nacional sobre PC aos 5 anos, foi possível atribuir a etiologia “asfixia perinatal e neonatal” em 11% dos casos.
Importa referir-se, a propósito, que qualquer anomalia neurológica detectada após o período neonatal (designadamente na 1ª e 2ª infância) somente poderá ser atribuída a asfixia perinatal se se tiver verificado quadro compatível com EHI no período neonatal imediato.
Nota importante: |
Etiopatogénese
A agressão hipóxico-isquémica pode verificar-se de maneira aguda ou crónica, e em qualquer momento da gestação. Actualmente, admite-se que a lesão neuronal conduzindo à necrose, e relacionada com asfixia, surge após fase inicial de hipóxia-isquémia, isto é, na fase de reperfusão cerebral.
Durante os eventos de asfixia (que, em 90% dos casos, ocorrem ante- ou intra-parto), o metabolismo cerebral altera-se substancialmente; na falta de O2, entra em acção a glicólise anaeróbia como fonte energética de alternativa para a célula nervosa o que, por sua vez, conduz a depleção rápida da ATP neuronal, acumulação de lactato, e falência dos mecanismos de “bomba” da membrana, o que leva ao aparecimento de acidose. Desta última falência resultam influxo e acumulação intracelular de Na+ e Ca++ e de aminoácidos excitatórios tais como o aspartato e glutamato, levando a edema citotóxico e a vasospasmo.
Sendo restaurado o débito sanguíneo cerebral (reperfusão), são produzidos radicais livres de oxigénio e de óxido nítrico, o que leva ao agravamento do vasospasmo e a lesão mitocondrial. Estes, juntamente com o edema citotóxico, conduzem à morte neuronal, que pode ser imediata ou processar-se de modo progressivo em diversas áreas.
O óxido nítrico (nas células e nos endotélios), considerado inicialmente factor protector pelo efeito vasodilatador e antiagregante das plaquetas, reage com o superóxido produzindo peroxinitrito, de cuja degradação resulta o radical hidroxilo, potente agente oxidante.
Outro efeito da elevação do cálcio intracelular é a estimulação das fosfolipases que promovem a destruição das membranas fosfolipídicas das membranas neuronais com libertação de ácido araquidónico cuja metabolização – quer pela via da cicloxigenase, quer pela da lipoxigenase – leva à formação de compostos vasoconstritores (por ex. leucotrienos e tromboxanos) agravando a isquémia inicial.
No recém-nascido de termo, a necrose neuronal é selectiva, sendo atingidas as seguintes zonas: os hemisférios, o córtex visual, o hipocampo, os núcleos cinzentos centrais, o tálamo e o hipotálamo. No tronco cerebral são afectados os tubérculos quadrigémeos, os núcleos oculomotores, a formação reticulada, os núcleos da protuberância e os núcleos bulbares.
A gravidade das lesões exprime-se em geral de forma descendente; nas formas moderadas, as lesões são restritas ao córtex; e, nas formas graves, são afectados os núcleos cinzentos centrais.
A propósito dos mecanismos de lesão cerebral no RN de termo cabe salietar os resultados da investigação de Ferriero. Este autor chamou a atenção para uma particularidade do efeito do estresse oxidativo e da excitotoxicidade: simultaneamente inflamação e fenómeno de reparação. A morte celular inicia-se imediatamente após a agressão, continuando durante dias ou semanas. Verifica-se, contudo, uma mudança no fenótipo da morte celular variando entre padrão de morfologia necrótica precoce e patologia assemelhando-se a apoptose. A este tipo de evolução chama-se continuum de necrose-apoptose.
A nova modalidade de tratamento com hipotermia (ver adiante) permite reduzir o metabolismo cerebral, o edema citotóxico, a pressão intracraniana e a apoptose. De referir também como efeitos benéficos limitar a extensão da lesão neuronal através de mecanismos diversos tais como inibição de radicais livres.
Para além do SNC, outros órgãos podem evidenciar repercussões da asfixia, tais como:
- rim, o órgão mais frequentemente afectado no contexto de asfixia perinatal (necrose tubular aguda ou cortical);
- miocárdio e músculo estriado (isquémia, diminuição da contractilidade ventricular, insuficiência tricúspide, frequência cardíaca fixa, com ausência de variabilidade);*
- sistema digestivo (isquémia intestinal e ECN);
- sangue periférico, medula óssea e fígado (disfunção hepática, deficiente produção de factores de coagulação, deficiente produção de plaquetas);
- sistema respiratório (aumento da resistência vascular pulmonar, disfunção e destruição do surfactante, hemorragia);
- suprarrenal (hemorragia suprarrenal).
Etiopatogénese
A agressão hipóxico-isquémica pode verificar-se de maneira aguda ou crónica, e em qualquer momento da gestação. Actualmente, admite-se que a lesão neuronal conduzindo à necrose, e relacionada com asfixia, surge após fase inicial de hipóxia-isquémia, isto é, na fase de reperfusão cerebral.
Durante os eventos de asfixia (que, em 90% dos casos, ocorrem ante- ou intra-parto), o metabolismo cerebral altera-se substancialmente; na falta de O2, entra em acção a glicólise anaeróbia como fonte energética de alternativa para a célula nervosa o que, por sua vez, conduz a depleção rápida da ATP neuronal, acumulação de lactato, e falência dos mecanismos de “bomba” da membrana, o que leva ao aparecimento de acidose. Desta última falência resultam influxo e acumulação intracelular de Na+ e Ca++ e de aminoácidos excitatórios tais como o aspartato e glutamato, levando a edema citotóxico e a vasospasmo.
Sendo restaurado o débito sanguíneo cerebral (reperfusão), são produzidos radicais livres de oxigénio e de óxido nítrico, o que leva ao agravamento do vasospasmo e a lesão mitocondrial. Estes, juntamente com o edema citotóxico, conduzem à morte neuronal, que pode ser imediata ou processar-se de modo progressivo em diversas áreas.
O óxido nítrico (nas células e nos endotélios), considerado inicialmente factor protector pelo efeito vasodilatador e antiagregante das plaquetas, reage com o superóxido produzindo peroxinitrito, de cuja degradação resulta o radical hidroxilo, potente agente oxidante.
Outro efeito da elevação do cálcio intracelular é a estimulação das fosfolipases que promovem a destruição das membranas fosfolipídicas das membranas neuronais com libertação de ácido araquidónico cuja metabolização – quer pela via da cicloxigenase, quer pela da lipoxigenase – leva à formação de compostos vasoconstritores (por ex. leucotrienos e tromboxanos) agravando a isquémia inicial.
No recém-nascido de termo, a necrose neuronal é selectiva, sendo atingidas as seguintes zonas: os hemisférios, o córtex visual, o hipocampo, os núcleos cinzentos centrais, o tálamo e o hipotálamo. No tronco cerebral são afectados os tubérculos quadrigémeos, os núcleos oculomotores, a formação reticulada, os núcleos da protuberância e os núcleos bulbares.
A gravidade das lesões exprime-se em geral de forma descendente; nas formas moderadas, as lesões são restritas ao córtex; e, nas formas graves, são afectados os núcleos cinzentos centrais.
A propósito dos mecanismos de lesão cerebral no RN de termo cabe salietar os resultados da investigação de Ferriero. Este autor chamou a atenção para uma particularidade do efeito do estresse oxidativo e da excitotoxicidade: simultaneamente inflamação e fenómeno de reparação. A morte celular inicia-se imediatamente após a agressão, continuando durante dias ou semanas. Verifica-se, contudo, uma mudança no fenótipo da morte celular variando entre padrão de morfologia necrótica precoce e patologia assemelhando-se a apoptose. A este tipo de evolução chama-se continuum de necrose-apoptose.
A nova modalidade de tratamento com hipotermia (ver adiante) permite reduzir o metabolismo cerebral, o edema citotóxico, a pressão intracraniana e a apoptose. De referir também como efeitos benéficos limitar a extensão da lesão neuronal através de mecanismos diversos tais como inibição de radicais livres.
Para além do SNC, outros órgãos podem evidenciar repercussões da asfixia, tais como:
- rim, o órgão mais frequentemente afectado no contexto de asfixia perinatal (necrose tubular aguda ou cortical);
- miocárdio e músculo estriado (isquémia, diminuição da contractilidade ventricular, insuficiência tricúspide, frequência cardíaca fixa, com ausência de variabilidade);*
- sistema digestivo (isquémia intestinal e ECN);
- sangue periférico, medula óssea e fígado (disfunção hepática, deficiente produção de factores de coagulação, deficiente produção de plaquetas);
- sistema respiratório (aumento da resistência vascular pulmonar, disfunção e destruição do surfactante, hemorragia);
- suprarrenal (hemorragia suprarrenal).
*De facto a hipóxia-isquémia leva a lesão da membrana e libertação de substâncias intracelulares para a corrente sanguínea como troponina cardíaca I (cTNI) e péptido natriurético (N-Terminal PRO-BNP) que podem servir de marcadores de disfunção miocárdica. A creatina-quinase (CK-MB) elevada traduz estresse ao nível do músculo liso (ver adiante). |
Manifestações clÍnicas
Quanto aos antecedentes há a referir: problemas obstétricos associados a dificuldade mecânica no parto e a difícil adaptação do feto à vida extrauterina com depressão grave traduzida por índice de Apgar baixo; e dificuldade na iniciação e manutenção da respiração espontânea obrigando a manobras de reanimação na sala de partos.
O quadro de EHI integra um conjunto de sinais neurológicos acompanhados ou não, em grau variável, doutras manifestações ao nível doutros sistemas (disfunção multiorgânica): disfunção renal, dificuldade respiratória, hipertensão pulmonar, hipoglicémia, hipocalcémia, acidose, disfunção hepática, enterocolite necrosante, trombocitopénia, CIVD, etc.. Os referidos sinais podem surgir no pós-parto imediato ou mais tarde.
O espectro de manifestações varia entre o grau I ou forma ligeira, grau II ou forma moderada e grau III ou forma grave (Quadro 1, adaptado de M Levene).
QUADRO 1 – Gravidade da EHI.
| (adaptado de M Levene, 1985) | ||
| Grau I (ligeira) | Grau II (moderada) | Grau III (grave) |
| Irritabilidade Hiperalerta Hipotonia ligeira Sucção débil Não convulsões | Letargia Hipotonia moderada | Coma Hipotonia grave |
Adoptando os critérios clássicos de Sarnat & Sarnat na EHI (englobando mais parâmetros do que os da classificação de M Levene) podem ser considerados três estádios evolutivos designados respectivamente por estádio 1 (manifestações ligeiras), estádio 2 (manifestações moderadas) e estádio 3 (manifestações graves) (Quadro 2).
QUADRO 2 – EHI – Critérios de Sarnat & Sarnat (Estádios 1, 2 e 3).
| Abreviaturas: > = aumentado; < = diminuído; Mov espont = movimentos espontâneos; N = normal; ROT = reflexos ósteo-tendinosos; FC = frequência cardíaca; EEG = electroencefalograma; d = dias; h = horas; episód. = episódios de; GI = gastrintestinal. | |||
| Parâmetros | 1 | 2 | 3 |
| Consciência Mov espont Tono muscular Postura | Irritabilidade Aumentados N ou > ligeiro Flexão discreta das extremidades | Letargia Diminuídos < ligeiro Flexão acentuada das extremidades | Estupor ou coma Diminuídos ou ausentes Flacidez Extensão dos membros superiores e inferiores |
| ROT Pupilas | N Midríase | < Miose ou anisocória | Arreflexia Hipo/arreflexia à luz |
| Respiração | Espontânea | Espontânea ou apneia episód. | Periódica ou apneia |
| FC Secreção salivar, brônquica Motilidade GI Convulsões EEG | > Escassa N ou < Não N | < Abundante > Frequentes Amplitude < Espículas focais | Variável Variável Variável Variável Padrão periódico com fases isoeléctricas ou isoeléctrico |
| Duração Prognóstico | < 24 h Bom | 2-14 d Bom (80%) se < 5 d Reservado se > 5 d | Horas a semanas Mortalidade ~50% Sequelas ~50% |
Diagnóstico diferencial
O diagnóstico diferencial da EHI faz-se designadamente com outras situações acompanhadas de convulsões.
Nesta alínea cabe uma referência especial a um quadro relacionado com enfarte cerebral de território irrigado pela artéria cerebral média. É caracterizado clinicamente por convulsões de manifestação precoce, tal como acontece em certas formas de EHI.
Com efeito, estes acidentes vasculares podem ocorrer já no período de vida fetal ou intraparto; situações como a gemelaridade e anomalias congénitas cardíacas podem constituir factores predisponentes. Em cerca de 50% dos casos surgem como consequência de asfixia perinatal. Outros mecanismos patogénicos incluem arteriopatia, tromboembolismo/hipercoagulabilidade, vasospasmo e acção traumática.
Exames complementares
Salientando-se a noção de que o diagnóstico de EHI é fundamentalmente clínico, cabe referir alguns exames complementares com interesse para o estudo evolutivo e para avaliação prognóstica e diagnóstico diferencial; a sua escolha deverá ser criteriosa em função dos antecedentes e da evolução clínica.
Genericamente, pode ser evidenciada por critérios bioquímicos (CK-MB, CK-BB), electrofisiológicos (ECG, EEG), imagiológicos (ecografia transfontanelar), TAC, RM, ou anomalias detectadas post-mortem.
Sintetizando:
- Exame do LCR – poderá estar indicado se existir suspeita de quadro infeccioso.
- ECG – no âmbito deste exame, segundo estudos recentes, valoriza-se o parâmetro variabilidade da frequência cardíaca (VFC ou HRV) como possível marcador de lesão cerebral, com valor prognóstico. De salientar que a HRV permite avaliar a actividade do sistema nervoso autónomo (simpático e parassimpático), recordando-se que a elevada FC no RN traduz predomínio da actividade simpática associada a diminuição da actividade vagal.
- EEG – reportando-nos ao Quadro 2, cabe salientar que o traçado se relaciona com a gravidade da situação.
- aEEG – actualmente, está disponível uma nova modalidade de EEG (designada EEG de amplitude integrada) com vantagens no que respeita à monitorização dos efeitos do tratamento efectuado em situações com convulsões e/ou submetidas a hipotermia como terapêutica (ver adiante).
- Ecografia transfontanelar – técnica com limitações, a realizar sistematicamente em todos os casos de asfixia perinatal na perspectiva de selecção de casos para outros exames; na fase inicial, a contribuição é escassa, podendo ser detectados sinais de edema; o eco-Doppler permite medir os fluxos arteriais e o chamado índice de resistência (Figuras 1 e 2).
- TAC – poderá fornecer dados representativos de lesões do córtex cerebral, tálamo, gânglios da base e região periventricular; indicada na 2ª-4ª semana de vida, poderá dar contributo quanto ao prognóstico; igualmente com interesse nos casos em que se admite a hipótese de enfarte cerebral;
- Espectroscopia de protões – trata-se duma técnica que permite avaliar a concentração de vários substratos do cérebro cujo perfil se altera após episódio de hipóxia-isquémia-reperfusão.
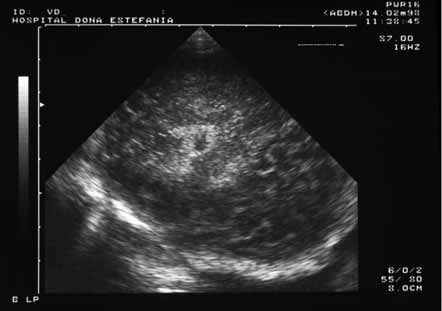
FIGURA 1. Imagem de ecografia transfontanelar de RN com EHI. Aspecto de enfarte na região têmporo-occipital (corte sagital). (UCIN-HDE)
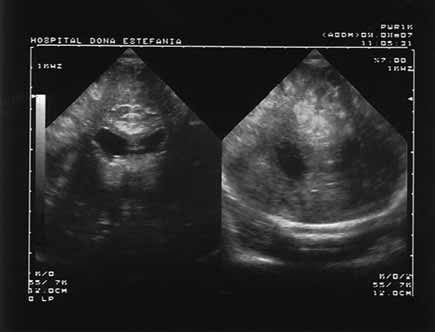
FIGURA 2. Imagem de ecografia transfontanelar de RN com EHI. Aspecto de enfartes na região da fenda e zona cortical (corte coronal). (UCIN-HDE)
No que respeita à avaliação dos efeitos da asfixia em diversos órgãos e sistemas, cabe referir os seguintes exames:
Coração
- Troponina cardíaca I (cTNI) e troponina cardíaca T (cTnT), proteínas que são marcadores de lesão do miocárdio, com efeito sobre a interacção entre actina e miosina, mediada pelo cálcio. Valores normais: I= 0-0,28 ±0,42 mcg/L; T= 0-0,097 mcg/L. Valores elevados associam-se situações de asfixia comprovada.
- Creatinacinase, fracção MB (CK-MB). Valores elevados >5-10% poderão indicar lesão miocárdica.
- NT-pro BNP (valores de referência entre as 24 e 48 horas de vida: mediana de 3300 pg/mL, diminuindo para 1180 pg/mL após 48 horas). Valores superiores devem ser avaliados em função do contexto clínico (ver Glossário Geral).
SNC
- CK, fracção BB (CK-BB). Valores elevados em situação de asfixia ao cabo de ~12 horas; contudo não tem valor prognóstico.
- Proteína S-100 + CK-BB. Valores elevados de proteína S-100 (>8,5 mcg/L) + de CK-BB, associados a pH arterial baixo são preditivos de encefalopatia moderada a grave (sensibilidade ~70% e especificidade ~90-95%).
Rim
- Beta-2 microglobulina urinária (proteína de baixo peso molecular filtrada pelo glomérulo e quase reabsorvida na totalidade no túbulo proximal). Valores elevados são indicadores de disfunção tubular proximal.
- FENa pode igualmente demonstrar a repercussão sobre a função renal.
- CysC/cistatina C urinária e NGAL (Neutrophil gelatinase-associated lipocalin) sérica e urinária elevados são também marcadores preditivos precoces de lesão renal aguda secundária a encefalopatia neonatal (consultar bibliografia).
- Ecografia renal. Anomalias detectadas correlacionam-se com oligúria.
Tratamento
Os princípios gerais do tratamento da EHI – não consensuais em centros internacionais idóneos – obedecem à noção de que a lesão neuronal pode ser minorada se a actuação no periparto for adequada e atempada.
Seguidamente resumem-se os tópicos principais de tal actuação:
- Ventilação mecânica desde o pós-parto, e por período variando entre 48 a 72 horas em função do contexto clínico, com o objectivo de normalização dos parâmetros de pH e gases no sangue na tentativa de manutenção dos seguintes valores: pH (7,25-7,40), PaO2 (50-70 mmHg), PaCO2 (45-60 mmHg), SpO2 (90-93%);
- Estabilização hemodinâmica, metabólica e hidroelectrolítica; ou seja, manutenção dos valores normais da pressão arterial, da glicémia, da natrémia, da potassémia com monitorização da diurese e dos parâmetros da função renal (osmolalidades sérica e urinária, creatinina sérica, ionogramas urinário e sérico, etc.);
- Tratamento das convulsões;
- Tratamento do edema cerebral através da administração de corticóides e manitol.
Outras medidas têm por finalidade prevenir a morte neuronal tardia por mecanismos diversos tais como administração de barbitúricos (tiopental), bloqueantes dos canais do cálcio, bloqueantes dos receptores dos neurotransmissores, inibidores da sintetase do óxido nítrico e células histaminais obtidas do cordão umbilical.
A hipotermia corporal iniciada antes das 6 horas de vida (providenciando temperaturas ~33-34ºC durante 72 horas, com reaquecimento ulterior progressivo), constitui um método já aplicado no nosso país com as seguintes indicações: < 6 horas de vida, > 36 semanas de idade gestacional, evidência de asfixia perinatal, EHI moderada ou grave e exclusão de defeitos congénitos.
O grau de EHI deve ser avaliado até 1 hora de vida no sentido de identificar forma ligeira (obrigando a hipotermia passiva), ou forma moderada a grave (obrigando a hipotermia induzida). Na forma moderada a grave está indicada transferência para hospital onde possa ser aplicada hipotermia induzida/terapêutica.
Os pormenores desta técnica ultrapassam os objectivos deste livro.
Como terapêuticas emergentes, em fase de investigação, citam-se a administração de eritropoietina e de células estaminais.
Prognóstico
Em complemento do que foi descrito no Quadro 2, e de acordo com diversos estudos multicêntricos, salienta-se que a mortalidade por EHI oscila entre 10 e 15%. As principais sequelas (15-20%) detectadas são: paralisia cerebral (formas discinéticas e tetraplegia), epilepsia, insuficiência mental, microcefalia, cegueira cortical, surdez e perturbações da linguagem.
Em suma, quanto mais precocemente se manifestarem os sinais neurológicos, maior duração tiverem, e mais exuberantes os achados do EEG, pior o prognóstico.
BIBLIOGRAFIA
ACOG Task Force on Neonatal Encephalopathy and Cerebral Palsy. Neonatal Encephalopathy and Cerebral Palsy: Defining the pathogenesis and pathophysiology. Washington DC: American College of Obstetricians and Gynecologists, 2003
Almeida CV, Carrapato MRG, Pinto F, et al. Cardiac Troponin I (cTNT) and N-Terminal PRO-B-Type natriuretic peptide (NT-proBNP) for the assessment of neonatal myocardial function. J Neonatal-Perinatal Med 2009;2:220 (abstract)
Azzopardi D, Strohm B, Marlow N, et al. TOBY Study Group. Effects of hypothermia for perinatal asphyxia on childhood outcomes. NEJM 2014;10:140-149
Bersani I, Piersigilli F, Gazzolo D, et al. Heart rate variability as possible marker of brain damage in neonates with hypoxic ischemic encephalopathy: a systematic review. Eur J Pediatr 2021;180:1335-1347. https://doi.org/10.1007/s00431-020-03882-3
Blackmon LR, Stark AR. Hypothermia: a neuroprotective therapy for neonatal hypoxic-ischemic encephalopathy. Pediatrics 2006;117:942-948
Carter BS, Haverkamp AD, Merenstein GB. The definition of acute perinatal asphyxia. Clin Perinatol 1993;20:287- 304
Chawl S, Bates SV, Shankaran S, et al. Is it time for a randomized controlled trial of hypothermia for mild hypoxic-ischemic encephalopathy? J Pediatr 2020;220:241-244
Cloherty JP, Eichenwald EC, Strak AR. Manual of Neonatal Care. Philadelphia: Lippincott Williams & Wilkins, 2008
Edwards AD, Azzopardi DV. Therapeutic hypothermia following perinatal asphyxia. Arch Dis Child Fetal Neonatal Ed 2006;91:F127-F131
Gouveia R, Sampaio I, Valente S, Graça A, Moniz C. EEG de amplitude integrada (aEEG) – Experiência de uma UCIN. Acta Pediatr Port 2011;42 (Supl1):s29
Graça AM, Sampaio I, Moniz C, Machado MC. EEG de amplitude integrada (aEEG) no RN com patologia neurológica – uma técnica a generalizar. Acta Pediatr Port 2012;43:202-209
Inder TE, Perlman JM, Volpe JJ (eds). Volpe’s Neurology of the Newborn. Phikadelphia: Elsevier, 2018
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saunders, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Rivkin MJ. Hypoxic-ischemic brain injury in the term newborn-neuropathology, clinical aspects and neuroimaging. Clin Perinatol 1997;24:607-625
Sampaio I, Graça A, Moniz C, Machado MC. Hipotermia indu zida na encefalopatia hipóxico-isquémica-experiência do Serviço de Neonatologia do Hospital de Santa Maria. Acta Pediatr Port 2012;43:183-189
Sarnat HB, Sarnat MS. Neonatal encephalopathy following fetal distress: a clinical and electroencephalographic study. Arch Neurol 1976;33:696-705
Sato Y, Tsuji M. Diverse actions of cord blood therapy for hypoxic-ischemic encephalopathy. Pediatr Int 2021; 63: 495-496
Shany E, Taha N, Benkovich E, Novoa R. Association of cerebral activity with MRI scans in infants with neonatal encephalopathy undergoing therapeutic hypothermia. Eur J Pediatr 2019;178:851-861
Scher MS. Seizures in the newborn infant. Diagnosis, treatment and outcome. Clin Perinatol 1997;24:735-772
Shankaran S, Pappas A, McDonald SA, et al. Predictive value of an early amplitude integrated EEG and neurological examination. Pediatrics 2011;128:e112–e120
Shankaran S, Pappas A, McDonald S, et al. Childhood outcomes after hypothermia for neonatal encephalopaty. NEJM 2012;366:2085-2092
Sweetman DU, Molloy EJ. Biomarkers of acute kidney injury in neonatal encephalopathy. Eur J Pediatr 2013;172:305-316
Thorensen M. Hypothermia after perinatal asphyxia: selection for treatment and cooling protocol. J Pediatr 2010;158:e45-e49
Virella D, Folha T, Andrada MG, Gouveia R, Cadete A, Calado E. Vigilância Neonatal da Paralisia Cerebral aos 5 anos de idade. Lisboa: UVP/SPP, Lisboa: Federação das Associações Portuguesas de Paralisia Cerebral, 2016