Introdução
As hemorragias intracranianas no RN compreendem classicamente as seguintes entidades clínicas:
- Hemorragia cerebelosa;
- Hemorragia intraparenquimatosa;
- Hemorragia intraperiventricular (HIPV);
- Hemorragia subaracnoideia;
- Hemorragia subdural.
No capítulo sobre Traumatismos de Parto foi feita referência sucinta às hemorragias subdural e subaracnoideia, entidades associadas a lesões traumáticas.
Relativamente à hemorragia subdural, rara e própria do RN de termo, é importante referir que:
- – quanto à evolução, estão descritas: – formas rapidamente letais; e formas mais benignas;
- – quanto à localização: – formas infratentoriais ou da fossa posterior; e – formas localizadas à convexidade cerebral.
Quanto à hemorragia subaracnoideia, a mesma pode surgir associada a alterações circulatórias em RN pré-termo sem antecedentes de traumatismo de parto.
Tal como na hemorragia subdural, quando abundante, pode também ser rapidamente fatal, descrevendo-se como manifestações típicas as convulsões.
Neste capítulo, dando ênfase à hemorragia intraperiventricular (HIPV), abordam-se também as hemorragias cerebelosa e parenquimatosa.
1. HEMORRAGIA CEREBELOSA
Definição e importância do problema
Trata-se de hemorragia de localização intracerebelosa, incluindo ambos os hemisférios e o vermis. As lesões mais pequenas podem localizar-se sob a pia-máter ou sob o epêndimo. Nos RN de termo, a hemorragia inicia-se no vermis. É mais frequente em RN pré-termo com < 32 semanas de idade gestacional (em cerca de 15%-25% da totalidade das referidas hemorragias).
Etiopatogénese
No que se refere à etiopatogénese, multifactorial, cumpre referir o papel importante do trauma relacionado com o parto no contexto de aplicação de fórceps, apresentação de nádegas e asfixia perinatal.
Manifestações clínicas
As manifestações são geralmente subtis, sendo que, nos casos mais graves, poderão iniciar-se entre o 1º dia e as 2-3 semanas de vida. Surgindo no pós-parto imediato em casos de prematuridade, a lesão é fatal.
Como sinais clínicos mais representativos apontam-se os derivados da compressão do tronco cerebral (apneia, dificuldade respiratória, bradicárdia) e da obstrução do LCR (com hipertensão da fontanela, disjunção das suturas e dilatação ventricular). Outros sinais possíveis são: estrabismo, parésia facial, extensão tónica intermitente das extremidades, opistótono e tetraparésia.
Exames complementares
Perante a suspeita clínica face aos antecedentes perinatais, importa proceder a ecografia transfontanelar, ou transasterion, havendo disjunção das suturas.
A TAC-CE tem indicação com o fundamento de avaliar a extensão e distribuição da lesão. A RM deve estar reservada para os casos em que a TAC não permite esclarecer o diagnóstico.
2. HEMORRAGIA PARENQUIMATOSA
Este tipo de hemorragias intracranianas, surgindo geralmente em RN de termo, tem um prognóstico mau pelo risco elevado: – de sequelas várias; – de mortalidade rondando os 25%; e – de associação a alta incidência de paralisia cerebral (~10%).
Como particularidade, importa referir que em cerca de 30% dos casos há antecedentes de cesariana electiva ou de partos sem complicações, sobretudo em nulíparas.
Generalidades sobre o tratamento das hemorragias intracranianas (exceptuando HIPV)
Não existem critérios uniformes quanto ao tratamento.
→ No que respeita aos hematomas da fossa posterior, os resultados são semelhantes apenas com vigilância ou com tratamento médico. A intervenção neurocirúrgica está indicada perante deterioração neurológica ou sinais de compromisso do tronco cerebral.
→ Quanto às hemorragias supratentoriais, está indicada a cirurgia se as dimensões do hematoma forem importantes e se surgirem sinais de hipertensão intracraniana.
→ Nas situações de hematoma subdural evoluindo para a cronicidade, a fim de evitar desproporção craniofacial ou hipertensão intracraniana, está indicada a realização de punções subdurais; se estas não conduzirem à regressão, procede-se a intervenção neurocirúrgica.
3. HEMORRAGIA INTRAPERIVENTRICULAR (HIPV)
Definição e importância do problema
A chamada hemorragia intraventricular (HIV) é uma situação clínica típica nos RN pré-termo, caracterizada por processo hemorrágico localizado na área cerebral da matriz germinal, contígua com o ventrículo lateral em localização lateral-ventral.
Quando se verifica ruptura do epêndimo, a hemorragia, inicialmente periventricular, estende-se ao ventrículo – que pode sofrer dilatação – passando a chamar-se intraperiventricular (HIPV).
Há duas décadas verificava-se uma incidência de 30% em RN pré-termo de peso inferior a 1.500 gramas; com os progressos na assistência perinatal tem-se assistido a diminuição da mesma (na actualidade, em países industrializados e com recursos de terapia intensiva, cerca 12% a 15% em RN com < 32 semanas gestacionais).
Salienta-se, a propósito, que a incidência global abrangendo as diversas formas de hemorragia intracraniana neonatal (subdural, epidural, subaracnoideia, parenquimatosa e da matriz germinativa/intraventricular) varia entre 2% e > 30% em função da idade gestacional.
Como resultado de tal patologia poderão surgir sequelas neurológicas graves.
Aspectos do desenvolvimento do sistema nervoso central (SNC)
Para a compreensão da problemática relacionada com a HIPV, é importante abordar de modo sucinto alguns aspectos do desenvolvimento do SNC, sugerindo-se a leitura complementar de textos relativos à anatomofisiologia respectiva, e do capítulo seguinte.
O desenvolvimento do sistema nervoso central (SNC) no decurso dos primeiros meses de gestação é caracterizado fundamentalmente por um processo de multiplicação e migração celulares: na sequência dum primeiro período de histogénese, na segunda metade da gravidez verifica-se marcado crescimento e diferenciação celulares, com continuidade após o nascimento.
A proliferação glial e neuronal é rápida nos primeiros meses, ocorrendo preferencialmente na zona ventricular do neuroepitélio primitivo. As células gliais radiárias estendem-se ao longo da parede ventricular até à pia-máter, servindo de guia a todos os neurónios jovens que vão surgir na zona germinativa ventricular. Todos estes eventos têm influência no número, diferenciação, e disposição da glia: qualquer noxa que actue nesta fase poderá originar alterações da migração, organização do tecido neuronal, e mielinização.
A partir da zona ventricular, uma primeira geração de neurónios em franca proliferação celular migra para a parte externa do tubo neural para formar a placa subcortical ou “sub placa”. Esta camada de células é em seguida atravessada por neurónios jovens que, em vagas sucessivas, vão formar, de dentro para fora, a placa cortical ou o futuro córtex. A migração celular termina por volta das 20-24 semanas, ficando então o capital neuronal fixado definitivamente.
A matriz germinativa é uma região transitória muito vascularizada, involuindo a partir das 34 semanas; praticamente desaparecida no termo da gestação, cabe salientar que os respectivos vasos, com características peculiares (grandes e irregulares, não exibindo características de arteríolas ou vénulas e constituídos basicamente por endotélio e membrana basal frágil), são muito vulneráveis a diversas noxas. A matriz germinativa, confinando com o ventrículo lateral, é um local de mitoses e proliferação celular, com produção de células gliais e de oligodendrócitos, os quais produzem mais tarde a mielina; a matriz germinativa produz igualmente astrócitos, que migram para a superfície externa do córtex.
A placa subcortical é uma estrutura transitória cujos neurónios, migrando, vão constituir o córtex; tais células, diferenciando-se, contribuem igualmente para a formação de receptores, de neurotransmissores e de factores de crescimento. A actividade destes neurónios processa-se a partir das 15 semanas de gestação, mantendo-se até cerca das 22-34 semanas; mediante processo de apoptose que, entretanto, se inicia e se processa até aos 6 meses de vida pós-natal, torna-se progressivamente nítido o desenvolvimento de conexões e de estruturas definitivas.
A formação dos sulcos acompanha a formação do córtex. O aspecto deste é liso cerca das 20 semanas, acelerando-se o seu crescimento no último trimestre; as etapas de formação dos sulcos são bem precisas, permitindo uma relação sequencial com a idade gestacional.
Os primeiros vasos sanguíneos provenientes da rede meníngea são alimentados por três grandes artérias cerebrais; têm um trajecto perpendicular à superfície na sua “penetração” e progressão para as camadas profundas. De salientar que a proliferação da árvore vascular é particularmente activa durante a fase de proliferação neuronal, sendo a maturação morfológica dos capilares muito precoce e muito rápida.
A mielinização constitui um fenómeno essencial para a velocidade de condução do influxo nervoso; o conjunto dos axónios mielinizados, formando um tecido branco nacarado, constitui a chamada substância branca.
Etiopatogénese e factores de risco
A HIPV, cuja etiopatogénese é multifactorial e envolve aspectos controversos, sem unanimidade entre os especialistas e investigadores, origina-se na zona da matriz germinal subependimária, zona muito vascularizada a partir da qual se geram neuroblastos e glioblastos. A mesma sofre processo de involução a partir das 34 semanas; ou seja, tal zona germinal tem tanto maior dimensão quanto menor a idade gestacional.
Os vasos capilares da referida matriz são constituídos por estrutura indiferenciada: endotélio e membrana basal frágil com escassez de tecidos de suporte envolvente e muito dependentes do metabolismo oxidante; tal fragilidade estrutural predispõe à ruptura e hemorragia por acção de determinados factores determinantes, mecânicos e hipóxico-isquémicos (factores vasculares).
Para além dos factores vasculares, são descritos outros factores determinantes (intravasculares e extravasculares).
Os factores extravasculares são constituídos pelo deficiente suporte tecidual envolvente e pela actividade fibrinolítica aumentada.
Os factores intravasculares podem ser sistematizados do seguinte modo:
- hipotensão arterial com consequente hipoxémia e isquémia, seguidas de reperfusão;
- alterações da coagulação e das plaquetas nem sempre explicadas (trombocitopénia, disfunção plaquetar), podendo originar obstrução paulatina de ramos das artérias cerebrais, já no terceiro trimestre da gravidez;
- pressão venosa aumentada por dificuldade do retorno venoso, determinando congestão excessiva ao nível da zona germinal (associada a situações clínicas na transição fetal para a vida extrauterina, tais como trabalho de parto laborioso por via vaginal e a dificuldade respiratória, etc.);
- débito cerebral aumentado e situações clínicas como hipertensão arterial de etiopatogénese diversa, hipercápnia e aumento da pressão arterial de CO2, hipervolémia, diminuição do hematócrito (a diminuição de 1 mmol/L de Hb contribui para incremento de 12% do débito cerebral), hipoglicémia, etc.;
- instabilidade hemodinâmica com flutuações da pressão arterial e do débito cerebral (por exemplo em casos de ventilação mecânica assíncrona com os movimentos respiratórios do RN, susceptível de ser revertida por acção de agentes paralisantes musculares), manuseamento intempestivo do RN, convulsões, pneumotórax, aspiração traqueal em RN ventilados, canal arterial permeável, FiO2 elevada, etc..
Os mecanismos de lesão cerebral associados a HIPV podem ser assim sintetizados:
- congestão venosa e isquémia periventricular;
- destruição da matriz (com consequente destruição dos precursores da glia, formação quística e repercussão no desenvolvimento futuro por lesão cerebral);
- necrose hemorrágica na substância branca periventricular (unilateralmente) por obstrução do retorno venoso por sangue coagulado.
De salientar que tal necrose/lesão da substância branca:- não resulta da extensão da hemorragia ventricular para o parênquima;
- é distinta da leucomalácia periventricular – LPV (lesão simétrica bilateral, não hemorrágica, relacionável com perturbação circulatória arterial), abordada adiante, em capítulo próprio.*
*A LPV é uma forma de lesão da substância branca, frequentemente associada a HIPV na zona da matriz germinal, e cujo mecanismo exacto não está totalmente esclarecido: admite-se que seja secundária a isquémia e inflamação, associada a activação glial e a lesão dos preoligodendrócitos. |
- hidrocefalia, desenvolvendo-se de forma aguda (dias), ou de modo progressivo e lento (designada lentamente progressiva, em semanas), explicável pelo fluxo de sangue coagulado ventricular através dos buracos de Magendie e Luschka, originando obstrução ao nível do quarto ventrículo e compromisso da circulação e/ou de reabsorção do LCR; se se verificar obstrução do aqueduto de Sylvius a hidrocefalia é não comunicante. Surge em cerca de 40% das grandes hemorragias.
Notas importantes:
|
As HIPV, em função da sua extensão e gravidade, podem ser classificadas em 4 graus de acordo com os critérios de Papile e colaboradores; tal classificação tem implicações práticas importantes na clínica pela sua correspondência com parâmetros imagiológicos (designadamente ecográficos) que, em certa medida, são preditivos das complicações e do prognóstico a curto e longo prazo (Quadro 1).
QUADRO 1 – Classificação das HIPV em função da gravidade (critérios de Papile).
Notas: Os graus III e IV comportam maior risco de sequelas neurológicas. |
Grau I |
Grau II |
Grau III |
Grau IV |
Volpe apresentou uma classificação baseada em critérios ecográficos, considerando três graus (Quadro 2).
QUADRO 2 – HIPV – Classificação de Volpe.
| Notas: Segundo este critério, deve ser anotado se existe ou não ecodensidade periventricular (localização e extensão) |
| I Hemorragia da matriz germinal não atingindo o ventrículo, ou sangue no ventrículo ocupando < 10% do seu volume |
| II HIV ocupando 10%-15% do volume ventricular (visão em plano ecográfico sagital) |
| III HIV ocupando > 50% do volume ventricular (visão em plano ecográfico para-sagital, com distensão lateral do ventrículo) |
Manifestações clínicas e exames complementares
Cerca de 90% dos casos de HIPV surgem até às 72 horas de vida (3 dias de vida) e 50% até às 24 horas de vida. Por outro lado, a extensão das lesões ocorre em 20% a 40% dos casos em cerca de 3 a 5 dias.
Formas clínicas
As manifestações clínicas da HIPV podem assumir três formas:
Forma subclínica ou silenciosa
Nesta forma, mais frequente, os sinais neurológicos são praticamente inexistentes, sobressaindo a diminuição do hematócrito como sinal mais típico, e a dificuldade de correcção do respectivo défice após transfusão; daí a necessidade da detecção, como rotina, da HIPV em todos os RN pré-termo assistidos em UCIN.
Forma intermitente ou saltitante
Nesta forma, que corresponde a hemorragia de pequenas dimensões, os sinais surgem por fases (períodos sintomáticos de horas ou dias entrecortados por períodos de duração idêntica com aparente estabilização): hipotonia, diminuição da actividade motora espontânea, dificuldade respiratória, movimentos oculares anómalos, alteração do sensório (estado vígil, irritabilidade, estupor), ângulo poplíteo em extensão, etc.. Estes sinais podem passar despercebidos em RN pré-termo já afectados por outros problemas, neurológicos ou não.
Forma catastrófica
Esta forma, correspondente a HIPV importante, traduz-se por:
- um ou mais sinais de deterioração neurológica de modo rápido, em minutos a escassas horas: estupor ou coma, dificuldade respiratória (diminuição da amplitude e frequência dos movimentos respiratórios, apneia), convulsões tónicas generalizadas, pupilas não reactivas, tetraparésia flácida, postura de descerebração, etc.;
- um ou mais dos seguintes sinais: hipertensão da fontanela anterior, diminuição do hematócrito, hipotensão, bradicárdia, instabilidade térmica, acidose metabólica, alterações da homeostase glicémica e hidroelectrolítica, etc..
Poderá surgir quadro de hidrocefalia aguda, sendo que a mortalidade nesta forma é elevada.
No âmbito da avaliação clínica diária (implicando, entre outros gestos, medição rigorosa do perímetro cefálico), a verificação de aumento do perímetro cefálico igual ou superior a 2 cm por semana aponta para a possibilidade de hidrocefalia pós-hemorrágica.
Exames complementares
Ecografia transfontanelar e ecografia com-doppler
O exame de eleição à cabeceira do doente é a ecografia transfontanelar, susceptível de identificar os 4 graus de HIPV conforme foi referido antes (classificação de Papile).
Tendo em conta a data habitual de aparecimento de HIPV atrás referida, e sem prejuízo das decisões pontuais em função do contexto clínico, é aconselhável proceder em todos os RN com idade gestacional inferior a 32 semanas, a exames ecográficos seriados no 1º, 3º e 7º dias de vida pós-natal e, depois, semanalmente.
No caso de se verificarem alterações relevantes, deve proceder-se a seguimento ecográfico mais pormenorizado e mais frequente para detecção atempada de complicações, tais como dilatação ventricular e hidrocefalia pós-hemorrágica (medição das dimensões dos ventrículos através da funcionalidade do ecógrafo, determinação do chamado índice de dilatação ventricular).
Utilizando o eco-doppler, pode determinar-se o índice de resistência (IR) através da fórmula: IR = (VFS-VFD)/VFS em que VF= velocidade de fluxo, S= sistólico, e D= diastólico; com o referido índice, pretende-se medir a resistência ao fluxo sanguíneo, sendo que um índice elevado pode indicar baixa compliance (distensibilidade) intracraniana, o que comporta risco de perfusão cerebral deficitária e, consequentemente, possibilidade de lesão isquémica.
Reportando-nos à classificação de Papile, será mais fácil interpretar os aspectos da ecografia transfontanelar. (Figuras 1, 2, 3 e 4)
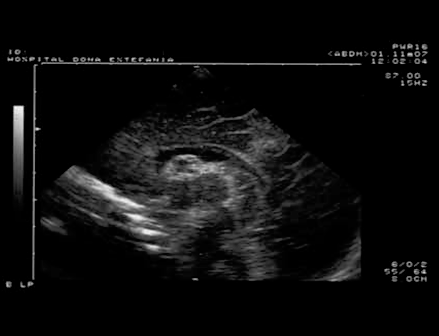
FIGURA 1. Hemorragia de grau I, já em fase de quisto. Corte sagital mediano. (UCIN-HDE)
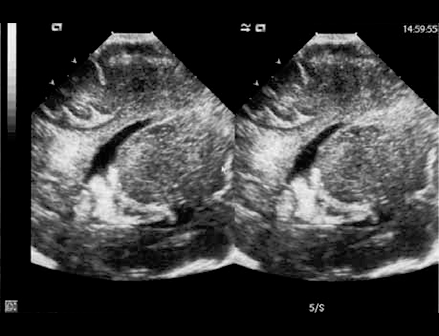
FIGURA 2. Hemorragia de grau II com coágulos visíveis ao nível do corno posterior. Corte sagital. (UCIN-HDE)
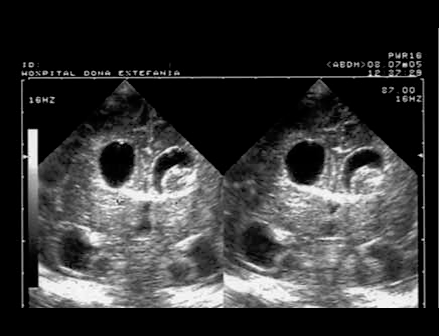
FIGURA 3. Hemorragia de grau III com coágulo de moldagem. Corte coronal. (UCIN-HDE)
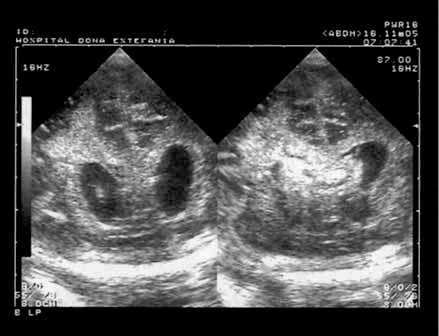
FIGURA 4. Hemorragia de grau III, com extensão ao parênquima (grau IV). Corte coronal. (UCIN-HDE)
Quando a hemorragia é maciça (grau III), pode observar-se todo o ventrículo preenchido e dilatado; a dilatação é proporcional às dimensões do conteúdo intraventricular. Em situações extremas poderão verificar-se sinais hemorrágicos no 3º e 4º ventrículo e, por vezes, no espaço subaracnoideu infratentorial, ocupando a cisterna magna.
A hemorragia intraparenquimatosa (grau IV), unilateral, é detectada como lesão hiperecogénica, ocupando o parênquima (evoluindo para cavitação), em contacto íntimo com o ventrículo lateral, de forma globosa ou de forma triangular; está associada a hemorragia intraventricular abundante. Por vezes produz efeito de massa e anomalias da circulação cerebral da zona atingida. (Figura 4)
A ecografia transfontanelar poderá igualmente identificar sinais de hemorragia cerebelosa cuja destrinça com hemorragia subdural infratentorial é difícil.
Tomografia axial computadorizada (TAC)
Em situações especiais poderá estar indicado este tipo de exame imagiológico para esclarecimento etiopatogénico de lesões intraparenquimatosas mais periféricas; está também indicado em casos compatíveis com síndromas neurológicas acompanhadas de hemorragia intracraniana, havendo antecedentes de parto traumático (por ex. hematoma subdural e epidural da fossa posterior, hemorragia cerebelosa no pré-termo).
Ressonância magnética (RM)
Tendo em conta as limitações técnicas relacionadas com a sua execução, está indicada apenas em formas graves e no estudo evolutivo pós-neonatal.
Espectroscopia próxima dos infravermelhos
Nalguns centros especializados e em situações seleccionadas, utiliza-se este método para avaliar o processo de autorregulação da circulação cerebral.
Exame do líquido cefalorraquidiano (LCR)
Somente se justifica a punção lombar em RN sem condições para intervenção cirúrgica e com a finalidade de tentar reverter a dilatação ventricular (ver adiante); no caso de ser realizada, é possível verificar-se eritrorráquia, hiperproteinorráquia e hipoglicorráquia.
Diagnóstico diferencial
No RN pré-termo poderá surgir um quadro neurológico (tipificado por uma das formas clínicas atrás descritas), caracterizado fundamentalmente por convulsões e depressão respiratória, e explicado por hemorragia cerebelosa espontânea ou de causa traumática (partos de apresentação pélvica ou manobras de reanimação com máscara implicando compressão da face e região occipital); como consequência poderá surgir enfarte venoso.
Como factores predisponentes citam-se alterações hemodinâmicas e da coagulação.
Prevenção
A prevenção da HIPV implica um conjunto de medidas pré-natais, intra-parto e pós-natais.
Medidas pré-natais
As medidas pré-natais dizem respeito essencialmente à correcta assistência da grávida transferindo-a atempadamente para centros especializados se existir risco de parto pré-termo. Duas medidas pré-natais importantes dizem respeito:
- à administração de antibioticoterapia à grávida em caso de ruptura prematura das membranas como medida eficaz de prevenção da hemorragia da matriz germinal e de parto pré-termo (com efeito, a infecção das membranas, associada à sua ruptura prematura, poderá desencadear o parto pelo facto de certos microrganismos, produtores de prostaglandinas, estimularem a contractilidade uterina);
- à corticoterapia com betametasona como medida potencialmente útil no que respeita à maturação dos vasos da matriz germinal.
Medidas intra-parto
Estas medidas dizem respeito ao parto minimamente traumático e realizado por equipa experiente em centro especializado.
Medidas pós-natais
Reanimação neonatal
- minimamente traumática, em ambiente de termoneutralidade;
- evitando a utilização de solutos hipertónicos e de expansão rápida da volémia;
- evitando hipóxia, hiperóxia, hipercápnia, hipocápnia e oscilações da pressão arterial.
Cuidados gerais
- mantendo a cabeça do RN em posição neutra/decúbito dorsal (a rotação da cabeça poderá aumentar a pressão venosa central);
- promovendo a mínima manipulação, o mínimo ruído e a mínima luminosidade.
Nota importante: |
Tratamento
Caso se verifiquem sinais de dilatação ventricular progressiva para além das quatro semanas de vida, há que intervir com um conjunto de procedimentos e atitudes cujo objectivo é facilitar a eliminação ou a remoção do LCR; está indicada tal remoção assistida por eco-doppler caso se verifique incremento de IR > 30% em relação à linha de base, ou linha de base de IR > 0,9.
- punção lombar periódica: em geral procede-se à extracção de parcelas de 10-15 mL/kg de LCR em cada punção lombar, dependendo o número e duração das mesmas da evolução e resultado conseguido; este método tem riscos, tais como meningite e ventriculite;
- drenagem ventricular: a drenagem ventricular recomendada é a drenagem definitiva ventriculoperitoneal por equipa de neurocirurgia pediátrica; como técnica invasiva, indicada em cerca de 10% das HIPV, comporta também riscos relacionados com morbilidade infecciosa; como alternativa provisória, em certos casos, pode utilizar-se a derivação externa para correcção emergente de hipertensão intracraniana ou nos casos de obstrução da derivação definitiva.
Como se pode depreender, em todas as circunstâncias torna-se obrigatória a vigilância seriada ecográfica (enquanto a fontanela anterior persistir) e/ou através de TAC.
- inibidores da anidrase carbónica: em geral utiliza-se a acetazolamida, que também comporta riscos como aparecimento de acidose metabólica e efeito desmielinizante; caso se associe ao furosemido, existe ainda o risco de nefrocalcinose por hipercalciúria.
Prognóstico
O prognóstico da HIPV é, em princípio, reservado, designadamente nas situações correspondentes aos graus III e IV; tal circunstância implica um esquema organizado de seguimento multidisciplinar a longo prazo. Contudo, em RN pré-termo com formas de grau I-II, em comparação com idêntica população sem HIPV, existe maior probabilidade de paralisia cerebral e de alterações do foro cognitivo.
As sequelas mais frequentemente surgidas, dependentes das lesões associadas, são as seguintes: epilepsia, sequelas motoras, hemiplegia espástica, e alterações cognitivas por lesões de diversas estruturas como axónios, dendritos, sinapses e mielina.
BIBLIOGRAFIA
Alderliesten T, Lemmers PM, Smarius JJ, et al. Cerebral oxygenation, extraction, and autoregulation in very preterm infants who develop peri-intraventricular hemorrhage. J Pediatr 2013;162:698-704
Ancel PY, Livinec F, Larroque B, et al. Cerebral palsy among very preterm children in relation to gestational age and neonatal ultrasound abnormalities. The EPIPAGE cohort study. Pediatrics 2006;117:828-835
Argyropoulou MI. Brain lesions in preterm infants: initial diagnosis and follow-up. Pediatr Radiol 2010;40:811-818
Bada HS. Prevention of intracranial hemorrhage . NeoReviews 2000;1:e48-e58
Ballabh P. Intraventricular hemorrhagein preterm infants: mechanism of disease. Pediatr Res 2010;67:1-8
Bolisetty S, Dhawan A, Abdel-Latif M,et al. Intraventricular hemorrhage and neurodevelopmental outcomes in extreme preterm infants. Pediatrics 2014;133:55-62
Bossenmeyer C, Chihab R, Muller S, Schroeder H, Daval JL. Hipoxia /reoxygenation induces apoptosis through biphasic induction of protein synthesis in cerebral neurons. Brain Res 1998;787:107-116
Caicedo A, Naulaers G, Lemmers P, et al. Detection of cerebral autoregulation by near-infrared spectroscopy in neonates: performance analysis of measurement methods. J Biomed Opt 2012 Nov;17(11):117003.doi: 10.1117/1.JBO.17.11.117003
Chawl S, Bates SV, Shankaran S, et al. Is it time for a randomized controlled trial of hypothermia for mild hypoxic-ischemic encephalopathy? J Pediatr 2020;220:241-244
Cloherty JP, Eichenwald EC, Strak AR. Manual of Neonatal Care. Philadelphia: Lippincott Williams & Wilkins, 2008
Dyet LE, Kennea N, Counsell SJ, et al. Natural history of brain lesions in extremely preterm infants studied with serial MRI from birth and neurodevelopmental assessment. Pediatrics 2006;118:536-548
Fellman V, Raivio KO. Reperfusion injury as the mechanism of brain damage after perinatal asphyxia. Pediatr Res 1997;41:599-606
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Graça AM. Definição do prognóstico neurológico da prematuridade – estado da arte. Acta Pediatr Port 2014; 45: 211-225.
Guimarães JC, Carneiro MJ, Loio P, Macedo A, Tuna ML, et al. Manual Prático de Neonatologia. Lisboa: Hospital de S. Francisco Xavier/Uriage, 2016
Inder TE, Perlman JM, Volpe JJ. Volpe’s Neurology of the Newborn. Philadelphia: Elsevier, 2018
Kidokoro H, Neill JJ, Inder TE. New MR imaging assessment tool to define brain abnormalities in very preterm infnts at term. American J Neuroradiol/AJNR 2013;34:2208-2214
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Levene M. Neonatal Neurology. Edinburgh: Churchil Livinstone, 2002
MacDonald MG, Seshia MMK (eds). Avery’s Neonatology: Pathophysiology and Management of the Newborn. Philadelphia, PA: Lippincott Williams & Wilkins, 2015
Mian Q, Cheung P-Y, O’Reilly M, et al. Impact of delivered tidal volume on the occurrence of intraventricular haemorrhage in preterm infants during positive pressure ventilation in the delivery room. Arch Dis Child Fetal & Neonatal Ed 2019;104:F57-F62
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nathan DG, Orkin SH, Ginsburg D (eds). Hematology of Infancy and Childhood. Philadelphia: Saunders, 2003
Papile LA, Burnstein J, Burnstein R, et al. Incidence and evolution of subependymal and intraventricular hemorrhage : a study of infants with birth weights less than 1,500 grams. J Pediatr 1978;92:529-534
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saunders, 2015
Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW (eds). Fetal and Neonatal Physiology. Philadelphia: Elsevier, 2017
Roland EH, Hill A. Intraventricular hemorrhage and posthemorrhagic hydrocephalus: current and future potential interventions. Clin Perinatol 1997;24:589-606
Soul JS, Eichenwald E, Walter G, et al. CSF removal in infantile posthemorrhagic hydrocephalus results in significant improvement in cerebral hemodynamics. Pediatr Res 2004;55:872-876