Definição e importância do problema
As síndromas auto-inflamatórias são um conjunto de patologias caracterizadas por episódios recorrentes de febre e inflamação localizada ou sistémica, sem envolvimento de agentes infecciosos, mecanismos autoimunes ou linfócitos T autorreactivos. Após a classificação inicial que incluía apenas as síndromas auto-inflamatórias com transmissão familiar, várias outras patologias foram, entretanto, incluídas sob a mesma denominação auto-inflamatória incluindo, não só certas doenças de transmissão mendeliana como a síndroma de Blau, mas também de transmissão mais complexa como a doença de Behçet.
Uma classificação possível das síndromas auto-inflamatórias é apresentada no Quadro 1.
O projecto Eurofever constitui um registo internacional para as afecções com características auto-inflamatórias com a finalidade de promover e disseminar o conhecimento sobre tal rara patologia, que é rara. Apesar da raridade, é importante para o pediatra geral saber reconhecê-las, uma vez que o atraso no diagnóstico e instituição de terapêutica podem levar a danos permanentes, assim como a morbilidade e mortalidade significativas.
QUADRO 1 – Síndromas auto-inflamatórias
| Síndromas (OMIM) | Transmissão | Gene | Clínica |
| Síndromas de febre periódica hereditárias | |||
| Febre Mediterrânica Familiar – FMF (249100) | AR | MEFV | Febre, serosite (peritonite, pleurite, pericardite), artralgias ou artrite, lesão Símile-erisipelas nos membros inferiores, vasculite, amiloidose nos doentes não tratados |
| TNF receptor-associated periodic syndrome – TRAPS (142680) | AD | TNFRSF1A | Febre, mialgias migratórias, exantema, artralgia/artrite, dor abdominal e/ou torácica, vómitos, serosite (pleurite, pericardite), hiperémia conjuntival e edema peri-orbitário, amiloidose |
| Síndroma Hiper IgD com febre periódica – HIDS (260920) | AR | MVK | Febre, exantema polimorfo, artralgias, dor abdominal de gravidade variável, diarreia, adenomegálias, aftose oral, esplenomegália |
| Familial Associated Cold Autoinflammatory Syndrome – FCAS (120100) | AD | CIAS1/NALP3/PAF1 | Febre, exantema urticariforme desencadeado pelo frio, conjuntivite, artralgias |
| Síndroma Muckle-Wells (MWS) (191900) | AD | CIAS1/NALP3/PAF1 | Febre, exantema urticariforme, conjuntivite, artralgias, surdez neurossensorial, amloidose |
| Chronic Infantile Neurologic Cutaneous and Articular syndrome (CINCA) (607115) | Esporádico e AD | CIAS1/NALP3/PAF1 | Exantema urticariforme, meningite asséptica crónica, papiledema, atrofia nervo óptico, surdez neurossensorial, osteoartropatia deformante de grandes articulações (com crescimento anómalo das rótulas), amiloidose |
| Familial Associated Cold Autoinflammatory Syndrome 2 – FCAS2 (609648) | AD | NLRP12 | Febre, exantema urticariforme desencadeado pelo frio, adenomegálias, aftose oral, dor abdominal |
| Síndromas Febris Idiopáticas | |||
| Síndroma de febre periódica, aftas, faringite e adenopatias (PFAPA) | Não familiar | __ | Início idade pré-escolar, febre periódica, amigdalite, aftas e adenomegálias. Boa resposta toma única corticoesteróide. Remissão até adolescência. |
| Artrite Idiopática Juvenil – Sistémica (AIJ-S) Doença de Still do adulto | Complexa AR Complexa | Polimorfismos IL-6, MIF LACC Polimorfismos IL-6, MIF | Febre prolongada, artrite, exantema evanescente, adenomegálias, hepato-esplenomegália, serosite; risco síndroma de activação macrofágica |
| Doenças Granulomatosas | |||
| Doença de Chron | Complexa | NOD2/CARD15, ABCB1 (Ala893) | Diarreia com sangue e/ou muco, perda de peso, aftas, fístulas peri-anais |
| Síndroma de Blau (186580) e Sarcoidose de início precoce | AD e Esporádica e AD (respectivamente) | NOD2/CARD15 | Exantema acastanhado, poliartrite simétrica e uveíte granulomatosas |
| Doenças Piogénicas | |||
| Síndroma de artrite piogénica, pioderma gangrenoso e acne – PAPA (604416) | AD | PSTPIP1 | Artrite piogénica estéril recorrente de início na infância, pioderma gangrenosum e acne quística de início na adolescência; abcessos estéreis nos locais de punção |
| Osteomielite Crónica Não Bacteriana (259680) | Esporádica | LPIN (associado a síndroma de Majeed); PSTPIP2(?) | Osteomielite crónica ou recorrente sem isolamento de agente, habitualmente multifocal, podendo ser unifocal; associação história pessoal ou familiar de outras patologias imunes como psoríase, doença inflamatória do intestino, ou pustulose palmo-plantar |
| Síndroma de Majeed (609628) | LPIN2 | Início precoce de anemia diseritropoiética e osteomielite crónica não bacteriana multifocal; pode ter manifestações cutâneas como pustulose e dermatose neutrofílica | |
| Interleukin 1 receptor antagonist deficiency – DIRA (612852) | AR | Antagonista do receptor da Interleucina-1 | Osteomielite não bacteriana multifocal com início neonatal, periosteíte costelas e ossos longos, rash pustular com transformação ictiosiforme |
| Síndromas Associadas ao Imunoproteossoma | |||
Autoinflammation, lipodystrophy, and dermatosis syndrome (256040)
|
AR | PSMB8 | Febre recorrente, artralgia, lesões cutâneas purpura–like, lipodistrofia, condrite nariz e pavilhão auricular, calcificações gânglios da base, clubbing dedos mãos e pés, contracturas musculares, atrofia muscular, anemia microcítica |
| Síndromas com Exantema Cutâneo Pustular sem Envolvimento de Órgão | |||
| CARD14-mediated pustular psoriasis CAMPS (177900) | AR | CARD14 | Psoríase pustular, pitiríase rubra pilaris |
| IL-36 receptor antagonist deficiency-DITRA (614204) | AR | IL36RN | Pustulose palmo-plantar, cansaço, febre; pode haver envolvimento inflamatório articular e mucosas |
| Doenças com Hemofagocitose | |||
| Autoinflammation with infantile enterocolitis-AIFEC (616050) | AD | NLRC4 | Febre, artralgias, hepatoesplenomegália, enterocolite início precoce, coagulopatia, pancitopenia, aumento ferritina e triglicéridos |
| Síndromas com Imunodeficiência e/ou Imunodesregulação | |||
| Autoinflammation and PLCG2-Associated Antibody Deficiency, and Immune Dysregulation – PLAID (614468) | PLCG2 | Urticária com o frio, infecções recorrentes (imunodeficiência variável incluindo humoral e das células B), fenómenos autoimunes | |
| PLCG2-Associated Antibody Deficiency, and Immune Dysregulation – APLAID (614878), | AD | PLCG2 | Placas eritematosas e lesões vesicopustulares desencadeadas pelo calor e exposição solar, celulite, erosões córneas, hipertensão ocular, cataratas, envolvimento articular e gastrointestinal variável. Imunodeficiência humoral ligeira associada a infecções sino-pulmonares recorrentes |
| HOIL 1 Deficiency | AR | HOIL1 | Infecções bacterianas invasivas, febre recorrente e amilopectinose muscular |
| Sideroblastic anemia with B-cell Immunodeficiency, periodic fevers, and developmental delay – SIFD (616084) | AR | TRNT1 | Anemia sideroblástica grave neonatal ou infância; atraso DP Neurodesenvolvimento secundário a alterações neurodegenerativas variáveis; febre recorrente sem causa infecciosa; linfopénia B e hipogamaglobulinémia; surdez neurossensorial |
| Interferonopatias | |||
| STING-associated vasculopathy with onset in infancy – SAVI (615934) | AD | STING (TMEM173) | Úlceras cutâneas graves com formação de escaras e necrose da face, pavilhão auricular, nariz e dedos; doença intersticial pulmonar |
| Síndromas Vasculíticas | |||
| Deficiência de ADA2-DADA2 (615688) | AR | CECR1 | Poliarterite nodosa de início precoce (primeira década), AVCs recorrentes, livedo reticularis, febre recorrente, necrose por isquémia (vasculite) dedos |
| Doença de Behçet | Complexa | Úlceras orais e genitais, tromboses arteriais e venosas, uveíte, pseudofoliculite, eritema nodoso, doença neurológica | |
1. SÍNDROMAS AUTO-INFLAMATÓRIAS MONOGÉNICAS
As síndromas auto-inflamatórias hereditárias compreendem um grupo de doenças caracterizadas por episódios recorrentes de febre e inflamação sistémica, na ausência de causas infecciosas, neoplásicas ou autoimunes; as mesmas estão relacionadas com mutações de genes implicados na imunidade inata, na produção de citocinas pró-inflamatórias, e na apoptose.
Apesar de apresentarem um curso semelhante com episódios recorrentes de inflamação sistémica, distinguem-se entre si por variantes quanto a manifestações clínicas, por mutações genéticas específicas, e pelo modo de transmissão hereditária indicados no Quadro 1. As opções terapêuticas para cada uma destas síndromas também são diferentes.
O diagnóstico diferencial é feito através de exame clínico exaustivo seguido da análise genética específica para a síndroma (ou síndromas) mais provável. No que diz respeito a outros grupos nosológicos, é importante excluir a patologia inflamatória crónica, neoplasia e infecção. As características clínicas, genéticas e a súmula breve da terapêutica das síndromas de febre periódica hereditárias constam do Quadro 2.
QUADRO 2 – Síndromas auto-inflamatórias com febre periódica
| MKD/HIDS | FMF | TRAPS | CIAS | PFAPA | |
| Idade de Início | 1º ano | Variável | 3 – 20 A | Neonatal a primeira infância | < 5 A |
| Duração da Febre | 3 – 7 dias | 1 – 4 dias | ≥ 1 semana | FCAS: 12 h (30 min- 3 dias) MWS: 24-65 h) CINCA: curto a contínua | 4 – 5 dias |
| Intervalo Intercrise | Irregular (4 – 6 semanas) | Irregular | Irregular (semanas a meses) | Variável | Regular (4 – 6 semanas) |
| Características Específicas | Linfadenopatia cervical Vómitos/diarreia Artralgias/artrite Crises podendo ser desencadeadas por vacinas, estresse, infecções | Serosite Artrite | Dor abdominal Conjuntivite Mialgias Artralgias Pleurisia | MWS: poliartrite/artralgias, mialgias, conjuntivite, surdez neurossensorial FCAS: poliartralgias, mialgias, conjuntivite, frio desencadeia crises CINCA: artropatia deformante, surdez neurossensorial, edema papilar, dismorfia facial, meningite asséptica | Estomatite aftosa Linfadenopatia cervical Faringite |
| Envolvimento Cutâneo | Exantema polimorfo (máculo-papular, purpúrico, petequial) | Exantema erisipelóide dos membros inferiores | Eritema migratório/placas de edema | Exantema urticariforme não pruriginoso | Raro |
Uma vez que o tópico em análise constitui uma área do conhecimento em franca expansão, com várias novas síndromas a serem descritas todos os anos, neste capítulo precede-se a uma descrição não exaustiva das principais.
Febre mediterrânica familiar (FMF)
A FMF é uma doença de transmissão autossómica recessiva, frequente em populações da bacia mediterrânica, nomeadamente judeus sefarditas, turcos e descendentes de povos islâmicos. O gene envolvido, MEFV, codifica uma proteína denominada pirina ou marenostrina.
Esta afecção é caracterizada por episódios recorrentes de febre e serosite (peritonite, pleurite ou artrite) de início súbito e curta duração, entre 6 horas a 4 dias.
As manifestações mais frequentes são a dor abdominal, geralmente muito intensa e acompanhada de prostração, com ou sem sinais de peritonite franca (sendo frequente a dor à descompressão na palpação abdominal), artralgias e artrites. A dor torácica surge como manifestação de pleurite.
As alterações cutâneas são características: exantema erisipelóide nos pés e zona pré-tibial. O envolvimento de outras serosas, com pericardite ou inflamação do escroto é pouco comum.
Os resultados de exames laboratoriais revelam leucocitose, aumento da Proteína C reactiva, do fibrinogénio e da proteína amilóide A sérica.
O tratamento com colchicina é eficaz na prevenção das crises, diminuindo a sua frequência e, também, a probabilidade de aparecimento de amiloidose secundária; esta última constitui a complicação mais grave e temível desta doença.
O diagnóstico precoce e a adesão à terapêutica com colchicina são os aspectos fundamentais para garantir o correcto tratamento da FMF e a prevenção da amiloidose secundária, a qual se associa a morbilidade (principalmente a síndroma nefrótica, insuficiência renal e eventual transplante renal) e mortalidade significativas.
Nos raros casos de insucesso terapêutico com colchicina, poderá obter-se melhoria através da terapêutica anti-IL1 com anakinra.
TRAPS – Síndroma periódica associada ao receptor do TNF
(TNF Receptor Associated Periodic Syndrome)
É causada por mutações no gene TNFRSF1A e apresenta uma transmissão autossómica dominante. Os dados clínicos mais úteis para distinguir esta síndroma das outras febres periódicas são: o carácter prolongado dos episódios febris, que podem chegar a ter várias semanas de duração, a conjuntivite e as mialgias localizadas. O edema periorbitário é considerado patognomónico, mas nalgumas séries está presente em apenas 20% dos casos. Outros sinais e sintomas frequentes são a dor abdominal, o exantema macular eritematoso com placas de edema e as artralgias.
A avaliação laboratorial na crise revela neutrofilia, aumento da PCR e estimulação policlonal de imunoglobulinas, em especial IgA e IgD.
O tratamento consiste na administração de corticóides em altas doses na crise, podendo ser útil terapêutica com etanercept em casos de maior gravidade. No entanto, a resposta clínica ao etanercept diminui ao longo do tempo. O uso de anticorpos monoclonais anti-TNF como o infliximab deve ser evitado, uma vez que pode levar a um aumento paradoxal da actividade inflamatória. A terapêutica anti-IL1 com anakinra parece ser mais promissora, com melhores taxas de eficácia, mesmo em doentes que não respondem ao etanercept.
Actualmente estão a decorrer ensaios clínicos para avaliar a eficácia do canakinumab.
Síndroma Hiper-IgD (ou de deficiência de mevalonato cinase) (HIDS – “Hyper IgD Syndrome” )
O gene implicado é o da mevalonatocinase (MVK), enzima que nestes doentes apresenta uma actividade de 5 a 15% do normal. O modo de transmissão é autossómico recessivo. Esta afecção caracteriza-se por episódios de febre recorrente, os quais geralmente se iniciam no primeiro ano de vida, com cerca de 4-6 dias de duração, seguindo-se diminuição gradual da febre. Os episódios febris tendem a recorrer a cada 4-6 semanas, podendo ser desencadeados por vacinações, traumatismos mínimos, cirurgias ou estresse.
A clínica engloba adenopatias cervicais, dor abdominal, vómitos e diarreia. As manifestações cutâneas e articulares (artralgias ou artrites de grandes articulações, exantema máculo-papular eritematoso ou púrpura petequial) quando presentes, desaparecem lentamente após a regressão da crise.
A associação do quadro clínico característico a duas determinações de IgD superiores a 100U/ml com um mês de intervalo sugere o diagnóstico. No entanto, como os valores de IgD não se encontram elevados numa percentagem considerável de casos, actualmente considera-se mais correcta a designação de “deficiência de mevalonato-cinase”. Os valores de IgA também se encontram frequentemente elevados.
Corticóides em alta dose na fase de crise podem encurtar a duração do episódio febril. Uma vez que esta enzima faz parte da via de síntese do colesterol, alguns estudos avaliaram a eficácia das estatinas nesta patologia, com resultados desapontantes.
Estão descritos bons resultados com o etanercept nalguns casos, enquanto outros respondem melhor ao anakinra (anti-IL1). É sugerido que os doentes que não apresentem resposta favorável ao etanercept possam beneficiar de anakinra e vice-versa.
Síndromas periódicas associadas à criopirina
Três síndromas – Urticária familiar ao frio (FCAS – Familial Cold Auto-inflammatory Syndrome), síndroma de Muckle-Wells (MWS) e síndroma CINCA – compõem o grupo das síndromas periódicas associadas à criopirina. Estas síndromas resultam de várias mutações diferentes no gene NLRP3 (NLR family, Pyrin domain containing 3) que dão origem a anomalias na criopirina, um dos componentes do inflamassoma NLRP3, com transmissão autossómica dominante. No entanto, em cerca de 50% dos casos não são detectadas mutações no gene NLRP3 por sequenciação convencional. Estudos recentes mostraram que o mosaicismo somático para mutações NLRP3 pode ser responsável, numa proporção até 70%, por estes casos aparentemente “sem mutação”.
Clinicamente, as três síndromas representam um espectro contínuo da mesma entidade nosológica, sendo a FCAS a forma mais ligeira, e a síndroma CINCA a mais grave.
O critério de avaliação clínica designado por CAPS disease activity score (CAPS-DAS) é usado para monitorizar a actividade clínica da doença e resposta à terapêutica.
As manifestações clínicas da FCAS iniciam-se no primeiro ano de vida, com episódios recorrentes de febre, exantema urticariforme não pruriginoso e artralgia, precipitados pela exposição ao frio. As mialgias, cefaleias, sudação, sede intensa e náuseas são outros sintomas frequentes.
Na MWS a clínica é semelhante à da FCAS; no entanto, há algumas diferenças: os sintomas tendem a ser contínuos, em vez de episódicos; a existência de factores precipitantes pode ser menos comum, nomeadamente a exposição ao frio; as manifestações articulares são mais marcadas, podendo haver sinovite recorrente das grandes articulações. É frequente haver compromisso oftalmológico (conjuntivite, episclerite, iridociclite), surdez neurossensorial e amiloidose secundária.
A síndroma CINCA caracteriza-se pelo aparecimento dos sintomas pouco após o nascimento, com envolvimento cutâneo, articular e neurológico permanentes.
Geralmente a primeira manifestação da doença é o exantema máculo-papular ou urticariforme, não pruriginoso, cuja intensidade varia com o tempo e o grau de actividade da doença. (Figura 1)

FIGURA 1. Doente de 6 anos de idade com história de exantema urticariforme e máculo-papular eritematoso, não pruriginoso, iniciado durante a 1ª semana de vida, ao nível da face (A), tronco e membros (B), que se manteve de forma praticamente contínua até aos 21 anos (idade actual). O doente sofre também de períodos frequentes de febre alta (39-40ºC) intermitente, oligoartrites recorrentes, predominantes ao nível dos joelhos, cefaleias crónicas, uveíte crónica recorrente com algum grau (intermitente) de edema da papila, e surdez neurossensorial moderada. Os resultados dos exames laboratoriais evidenciaram, ao longo do tempo, anemia (Hb: 8-10 g/dL), leucocitose (20-30000/mm3), trombocitose (500 a 800000/mm3) e VS elevada (80-100 mm/1ª hora). Um estudo do líquido cefalorraquidiano, a que foi submetido cerca dos 9 anos de idade, revelou pleiocitose (C) e ligeiro aumento das proteínas.
A doença foi resistente a todas as terapêuticas instituídas – AINEs, corticosteróides, MTX – estando o doente actualmente (isto é, nos últimos 6 meses) apenas com analgésicos em SOS (devido às cefaleias) e sem sinais inflamatórios articulares ou oculares
Segue-se o envolvimento ósseo e articular, que pode surgir em 2 tempos diferentes, com implicações prognósticas importantes:
- Durante o primeiro ano de vida – poliartrite simétrica afectando preferencialmente as grandes articulações, com deterioração rápida, perda de função e deformidade articular resultante de um hipercrescimento ósseo nas epífises e cartilagens de crescimento com ossificação irregular, sendo típica a deformação esferoidal das rótulas (Figura 2);
- Após os 2 anos de vida (50%) – artrite não destrutiva ligeira.
Practicamente todos os pacientes sofrem uma deterioração neurológica progressiva em resultado de meningite asséptica crónica (90%) (Figura 1-C). Podem ainda desenvolver diplegia espástica e epilepsia.
É típico verificar-se macrocrânia, bossa frontal, nariz em sela, mãos e pés curtos e grossos, palmas e plantas enrugadas.
A RM-CE pode ser normal ou mostrar sinais de atrofia cerebral e ventriculomegalia, achados associados à presença de hipertensão intracraniana e hidrocefalia, e que podem tambem estar relacionados com a presença de atraso cognitivo (75%).
É também frequente haver inflamação ocular (panuveíte, papiledema, papilite ou atrofia óptica) que pode levar à cegueira; a surdez neurossensorial é também uma complicação frequente.
Enquanto a utilização de corticóides e AINEs proporciona alguma melhoria clínica temporária, a terapêutica de primeira linha com agentes biologicos anti-IL1 (anakinra e canakinumab) constitui uma opção muito eficaz no tratamento deste grupo de síndromas.
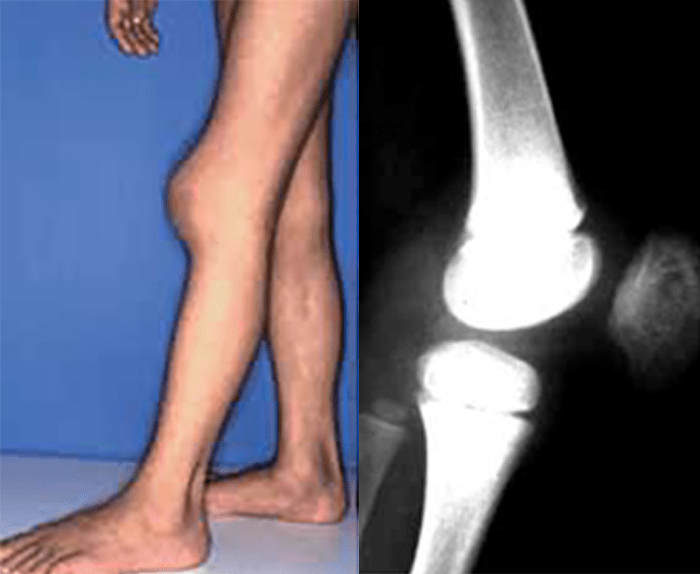
FIGURA 2. Alterações típicas das rótulas, com deformação esferoidal, em menina com síndroma de CINCA. Note-se a acentuada procidência na face anterior do joelho, que na radiografia se verifica ser devida a uma deformação da rótula, em que os seus diâmetros vertical e ântero-posterior são quase iguais
Síndroma periódica associada ao NLRP12
A síndroma periódica associada ao NLRP12 caracteriza-se por episódios recorrentes de artralgia-mialgia associados a febre e exantema urticariforme. A surdez neurossensorial está também descrita nalguns casos. Devido à semelhança clínica com as criopirinopatias, incluindo o facto de a exposição ao frio ser um factor precipitante, esta síndroma é também conhecida por FCAS2.
Esta afecção resulta de mutações esporádicas e/ou de transmissão autossómica dominante no gene NLRP12 (NLR family, Pyrin containing 12), o qual pertence à mesma família do gene NLRP3.
O tratamento consiste na administração de anti-inflamatórios não esteróides e corticóides na crise (casos mais ligeiros), ou por terapêutica anti-IL1 com anakinra.
Artrite granulomatosa pediátrica
O termo artrite granulomatosa pediátrica engloba a síndroma de Blau e sarcoidose de início precoce, situações correspondentes à forma familiar com transmissão autossómica dominante e esporádica da mesma doença auto-inflamatória granulomatosa.
Esta entidade clínica está associada a mutações heterozigóticas no gene NOD2, com um papel importante na imunidade inata e reconhecimento de patogénios.
A tríade clássica compreende a existência de artrite, uveíte e exantema. No entanto, a criação de bases de registo internacionais e a maior facilidade na realização de testes genéticos permitiu concluir que esta tríade pode não estar completa numa percentagem significativa de casos; de facto, poderá integrar um espectro clínico bastante mais alargado, incluindo manifestações sistémicas, vasculite e compromisso de vários órgãos e sistemas.
A artrite é geralmente crónica, poliartcular e simétrica, com envolvimento de grandes e pequenas articulações, podendo apresentar um aspecto tufado e estar asssociada a tenossinovite. A ocorrência de campto dactilia é frequente.
As manifestações cutâneas variam desde um exantema máculo-papular até ictiosiforme, podendo apresentar um aspecto eczematiforme com pele de aspecto bronzeado. O eritema nodoso é frequente e estão também descritos casos de vasculite leucocitoclástica.
O envolvimento ocular caracteriza-se por uveíte bilateral recorrente que pode atingir o segmento anterior e posterior. Outras manifestações oculares que podem surgir no decurso da doença incluem sinéquias, cataratas e hipertensão intraocular.
Embora menos típicas, as manifestações sistémicas incluem febre recorrente, hepatoesplenomegália e adenopatias, pelo que o quadro pode inicialmente ser confundido com AIJ sistémica. A hipertensão arterial sistémica pode estar presente em cerca de 20% dos casos.
Relativamente ao envolvimento de órgãos, o mais comum é o renal, que se manifesta por nefrite intersticial e/ou glomerular, nefrocalcinose e, eventualmente, insuficiência renal. O acometimento cardíaco pode manifestar-se por pericardite e as manifestações neurológicas incluem envolvimento dos pares cranianos e papiledema. O envolvimento pulmonar é muito menos frequente do que na sarcoidose de tipo adulto. Está também descrita a associação com vasculite de grandes vasos.
Os resultados dos exames laboratoriais revelam leucocitose com predomínio de polimorfonucleares, trombocitose ligeira, e elevação dos valores dos parâmetros inflamatórios e reagentes de fase aguda, incluindo proteína amilóide sérica; de referir, no entanto, que não estão descritos casos de amiloidose secundária. A nível histopatológico é característica a presença de granulomas não-caseosos.
Para o tratamento utiliza-se corticoterapia sistémica e agentes biológicos. Os mais usados são os anti-TNF, salientando-se que existem casos descritos de resposta favorável a anti-IL1 (anakinra e canakinumab).
Síndroma PAPA (artrite piogénica, pioderma gangrenoso, acne)
A síndroma PAPA é uma afecção transmitida de modo autossómico dominante, causada por mutações no gene PTSTPI1 (Proline-Serine-Threonine Phosphatase Interacting Protein1).
É caracterizada por episódios recorrentes de inflamação que afectam preferencialmente as articulações e a pele:
- Artrite piogénica estéril, de início na infância;
- Pioderma gangrenoso;
- Acne quística grave, de início na adolescência e persistindo na idade adulta.
Apesar de os episódios de inflamação serem auto-limitados, a sua recorrência leva à acumulação de material piogénico estéril (rico em neutrófilos) nas articulações afectadas, do que resulta numa destruição significativa dessas mesmas articulações. Os episódios recorrentes de artrite estéril ocorrem geralmente após traumatismos mínimos, mas também podem surgir espontaneamente.
Outras manifestações menos frequentes são a diabetes mellitus insulinodependente de início na idade adulta, proteinúria, e formação de abcessos no local de injecções.
Alguns casos respondem à administração de corticóides. Nos casos refractários, estão descritas duas alternativas terapêuticas:
- Anti-TNFα, que também parece ser eficaz no tratamento do pioderma gangrenoso;
- Antagonistas do receptor da IL-1, administrados continuamente ou de forma intermitente, apenas no tratamento das crises de artrite.
Interferonopatias (doenças do proteossoma e CANDLE)
O grupo das interferanopatias engloba as doenças do proteossoma ou do “factor de degradação proteica” (PRAAS – PRoteasome-Associated Autoinflamatory Syndromes e CANDLE – Chronic Atypical Neutrophilic Dermatosis with Lipodystrophy and Elevated temperature), para além das mais raras síndromas de Aicardi-Goutieres (AGS) e síndroma SAVI (STING-Associated Vasculopathy with onset in Infancy). No seu conjunto são caracterizados por desregulação da sinalização e/ou produção de interferão (IFN) tipo 1.
As doenças do proteossoma e a síndroma CANDLE são causadas por mutações de transmissão autossómica recessiva (AR) no gene PSMB8 e/ou outros componentes do proteossoma. Algumas mutações apresentam efeito fundador, contribuindo para um relativo aumento de prevalência em certas populações. E o caso da mutação T75M na população portuguesa, espanhola e latino-americana, ou a mutação G201V na população japonesa, sendo a doença associada descrita como síndroma de Nakajo-Nishimura.
Estas afecções apresentam-se com um quadro de dermatose neutrofílica atípica generalizada, lipodistrofia, contracturas articulares e atrofia muscular, inflamação sistémica e anemia microcítica. A morbilidade e mortalidade associadas são significativas, especialmente em doentes não tratados.
A terapêutica anti-IL6 (tocilizumab) não é totalmente eficaz. Actualmente encontram-se em curso estudos-piloto para testar a eficácia do bloqueio IFN com inibidores da JAK-cinase.
Síndroma vasculítica. Deficiência de adenosina desaminase 2 (DADA2)
Recentemente foi descrito uma síndroma vasculítica monogénica causada por mutações AR no gene CECR1, conduzindo a deficiência da enzima adenosina desaminase 2 (ADA2).
As manifestações clínicas de tal síndroma são muito semelhantes à poliarterite nodosa: acidente vascular cerebral nos primeiros anos de vida, e/ou vasculite sistémica com livedo reticularis, febre recorrente, hepatoesplenomegália, mialgia, e alterações oftalmológicas (tais como, atrofia do nervo óptico ou oclusão da artéria central da retina). A nível cutâneo, observam-se também frequentemente úlceras nos membros inferiores (que podem levar a amputação), fenómeno de Raynaud, nódulos subcutâneos, púrpura e necrose digital.
Os resultados de exames laboratoriais indicam dos parâmetros de fase aguda da inflamação, anemia, e hipo ou hipergamaglobulinemia. Anticorpos antinucleares podem ser detectados nalguns doentes, o que não acontece com os anticorpos anti-fosfolípidos. Alguns casos podem apresentar sinais de imunodeficiência associada, com citopenias e baixos níveis de IgM.
Estão descritos resultados satisfatórios do tratamento com agentes anti-TNF. Outras terapêuticas sugeridas passam pela utilização de plasma fresco congelado, ADA2 recombinante e transplante de medula óssea nos casos refractários.
2. SÍNDROMAS AUTO-INFLAMATÓRIAS NÃO HEREDITÁRIAS
Seguidamente são descritas algumas das síndromas auto-inflamatórias sem transmissão mendeliana conhecida.
Síndroma PFAPA (febre periódica, estomatite aftosa, faringite e adenopatias).
PFAPA (Periodic Fever, Aphtous Stomatitis, Pharyngitis and Adenopathy)
Os surtos de PFAPA têm o seu início entre os 2-4 anos e recorrem em intervalos de 3-6 semanas. Uma importante característica é a precisão do intervalo inter-crise em cada doente (a vida é programada de acordo com o dia em que se prevê que a criança vai ter febre). Após um pródromo de mal-estar geral e anorexia, a febre inicia-se com picos 38-41ºC, muitas vezes com calafrio, persistindo por 3-6 dias. A febre é acompanhada por mal-estar geral, amigdalite, e adenomegálias cervicais dolorosas e, muitas vezes, úlceras orais dolorosas. De notar que não é necessária a presença de todas as manifestações em todas as crises para se admitir o diagnóstico. Outras manifestações associadas podem ser cefaleias, náuseas e vómitos, dor abdominal moderada e, mais raramente, artralgias e/ou mialgias. Nos períodos inter-crise as crianças estão assintomáticas, não havendo repercussão sobre o crescimento nem sobre o neurodesenvolvimento. (Quadro 3)
A sua etiologia, forma de transmissão hereditária e eventual predilecção étnica são desconhecidas. Durante as crises IL-6, IL1B, TNF-alfa e INF-gama estão elevados.
QUADRO 3 – Critérios de diagnóstico de PFAPA
|
O diagnóstico é clínico. Os critérios de diagnóstico avançados por Thomas em 1999 permitem a inclusão de alguns doentes com HIDS e TRAPS. Assim, nos doentes com suspeita de PFAPA devem ser excluídas, preferencialmente por estudo genético, estas patologias, bem como, a FMF em populações com alta prevalência desta patologia.
Apesar de não incluída nos critérios de diagnóstico, o cessar imediato de uma crise com a toma de corticóide no início da febre é utilizado, em muitos centros, como ajuda ao diagnóstico.
O tratamento recomendado é prednisona ou prednisolona 1 mg/Kg no início da crise e, se necessário, repetida, no dia seguinte. Os efeitos secundários dos corticóides devem ser ponderados sobre o benefício, já que as crises são auto-limitadas e não deixam sequelas. Alguns doentes têm beneficiado de terapêutica profiláctica com cimetidina ou com colchicina.
A realização de amigdalectomia (com ou sem adenoidectomia) tem taxas de sucesso variáveis que podem rondar os 80%. No entanto, é importante salientar que se trata dum procedimento invasivo, com riscos (anestésicos, hemorragia) e que, sendo o PFAPA uma doença benigna e auto-limitada, a cirurgia deve ser reservada para doentes seleccionados refractários ou intolerantes à terapêutica médica.
Osteomielite crónica não bacteriana – CNO (Chronic Non bacterial Osteomyelitis)
A CNO foi descrita pela primeira vez em 1972 por Giedion e colaboradores. Desde então foram descritas centenas de casos na literatura com uma predominância do sexo feminino sobre o masculino (4/1).
A CNO tem manifestações clínicas sobreponíveis às da osteomielite infecciosa. Os sinais e sintomas são insidiosos. Os doentes apresentam dor óssea multifocal, por vezes unifocal, acompanhada ou não de febre baixa. A sintomatologia local é a de um processo inflamatório com dor, tumefacção, rubor e impotência funcional. A zona metafisária dos ossos longos, como a tíbia, é mais frequentemente envolvida; no entanto, costelas, clavícula e corpos vertebrais também o podem ser. Ao contrário da osteomielite bacteriana, não existe repercussão sobre o estado geral do doente.
A evolução da doença é habitualmente caracterizada por crises dolorosas periódicas com posterior remissão. A maioria dos doentes, embora apresente várias lesões simultâneas, apenas uma é sintomática em cada crise. Foi descrita a associação de CNO a outras patologias tais como doença inflamatória do intestino, psoríase, pustulose palmoplantar e síndroma de Sweet.
Embora a etiologia seja desconhecida, está provado que pode existir susceptibilidade genética. Embora na maioria dos casos se verifique manifestação esporádica, existe uma forma da doença de transmissão autossómica recessiva, denominada síndroma de Majeed que se deve a mutações homozigóticas do gene LPIN2. Diversos estudos apontam para a localização de mutações no gene PSTPIP2 que partilha uma homologia sequencial significativa com o PSTPIP1, que é responsável pelo PAPA.
A suspeita do diagnóstico é clínica. As alterações analíticas mostram uma velocidade de sedimentação ligeiramente menos elevada do que na osteomielite infecciosa e o hemograma é habitualmente normal. As alterações radiográficas, dependendo da fase da doença, são sobreponíveis às encontradas na osteomielite: lesões osteolíticas no início da doença que gradualmente são rodeadas por esclerose marginal com alargamento do osso afectado. A RM pode proporcionar informação relativamente às articulações e tecidos moles envolventes, sendo os achados ósseos sobreponíveis aos da osteomielite infecciosa. A RM de corpo inteiro, quando possível realizar, ou a cintigrafia óssea, nessa impossibilidade, são úteis para a detecção de outros focos ósseos assintomáticos. (Figura 3)
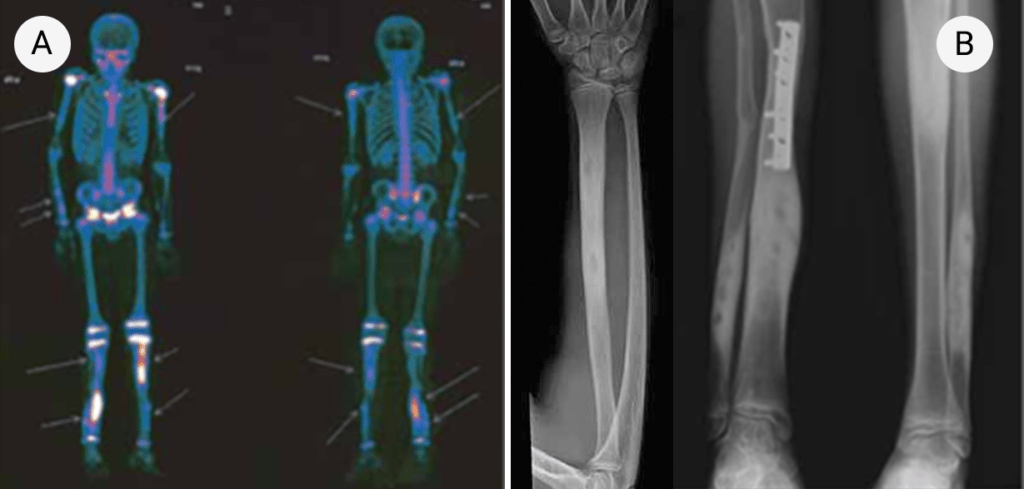
FIGURA 3. Alterações cintigráficas (A) e radiográficas esqueléticas (B) de doente com CNO
Os achados histopatológicos são inespecíficos, salientando-se, no entanto, que a biopsia óssea é necessária, sobretudo nos casos unifocais, de localização atípica ou com sintomas gerais associados para excluir um processo infeccioso. Haverá que efectuar igualmente culturas para bactérias aeróbias e anaeróbias, fungos e micobactérias típicas e atípicas, ou outras de acordo com epidemiologia. Os exames histopatológicos e microbiológicos são fundamentais na perspectiva do diagnóstico diferencial com doenças neoplásicas.
Os anti-inflamatórios, em doses anti-inflamatórias adequadas, constitui a terapêutica de eleição, com boa resposta na grande maioria dos doentes. Outros fármacos utilizados nos casos refractários são os corticosteróides em cursos curtos (1-2 semanas), o pamidronato endovenoso e, mais recentemente, os bloqueadores do TNFa, com boa resposta à semelhança de alguns doentes com síndroma SAPHO
Artrite idiopática juvenil – sistémica (AIJ-S)
Incluir a AIJ-S nas síndromas auto-inflamatórias não é tão estranho quanto possa parecer. Clinicamente a AIJ-S é passível de confusão com síndromas HIDS, TRAPS (especialmente na sua forma cíclica e quando os sintomas sistémicos precedem a artrite), e CINCA.
Por outro lado, a AIJ-S pode ser considerada uma entidade clínica única, diferente, mesmo na sua forma clínica típica, das restantes AIJ. Tal sugere diferentes mecanismos etiopatogénicos, tal como é referido no artigo original de George Frederic Still. Os ANA e FR são geralmente negativos, bem como não foi consistentemente demonstrada a presença de outros auto-anticorpos ou células T auto-reactivas. A associação genética a polimorfismos dos genes das citocinas inflamatórias IL-6, TNF-alfa e MIF (macrophage migration inibition factor) evidenciam de forma indirecta a possibilidade de inclusão da AIJ-S nas síndromas auto-inflamatórias. Alguns destes polimorfismos têm significado funcional já que estão associados a uma maior expressão das citocinas inflamatórias a eles associados. A boa resposta aos anti-IL1 (anakinra e canakinumab), à semelhança de outras síndromas auto-inflamatórias (por exemplo as síndromas periódicas associadas à criopirina) poderá bem constituir outra prova da sua natureza auto-inflamatória.
A clínica, terapêutica e prognóstico da AIJ-S estão descritos no capítulo dedicado à Artrite Idiopática Juvenil.
BIBLIOGRAFIA
Almeida de Jesus A, Canna SW, Liu Y, Goldbach-Mansky R. Molecular mechanisms in genetically defined autoinflammatory diseases: disorders of amplified danger signaling. Annu Rev Immunol 2015; 33: 26.1-26.52
Almeida de Jesus A, Goldbach-Mansky R. Monogenic autoinflammatory diseases: Concept and clinical manifestations. Clin Immunnol 2013; 147: 155-174
Dierselhuis MP, Frenkel J. Anakinra for flares of of pyogenic arthritis in PAPA syndrome. Rheumatology 2005; 44: 406-408
Feder HM, Salazar JC. A clinical review of 105 patients with PFAPA (a periodic fever syndrome). J Pediatr 2010; 99: 178-184
Frenkel J, Kuis W. Overt and occult rheumatic diseases: the child with chronic fever. Best Practice & Clinical Rheumatology 2002; 16: 443-469
Georgin-Lavialle S, Fayand A, Rodrigues F, et al. Autoinflammatory diseases: State of the art. Presse Med 2019;48 (1 Pt 2): e25-e48. doi: 10.1016/j.lpm.2018.12.003
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Guillén Martín S, et al. Osteomielitis crónica multifocal recurrente. An Pediatr 2005; 62: 573-578
Hentgen V, Reinert P. TNF-associated periodic syndrome (TRAPS): clinical aspects and physiopathology of a rare familial disease. Arch Pediatr 2003; 10: 45-53
Huber AM, Lam PY, Duffy CM, Yeung RS, Ditchfield M, Laxer D, et al. Chronic recurrent multifocal osteomyelitis: Clinical outcomes after more than five years of follow-up. J Pediatr 2002; 141: 198-203
Jeru I, Le Borgne G, Cochet E, Hayrapetyan H, Duquesnoy P, et al. Identification and functional consequences of a recurrent NLRP12 missence mutation in periodic fever syndromes. Arthritis Rheum 2011; 63: 1459-1464
Kastner DL. Hereditary periodic fever syndromes. Hematology. Am Soc Hematol Educ Program 2005: 74-81
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Kolly L, Busso N, et al. Periodic fever, aphthous stomatitis, pharyngitis, cervical adenitis syndrome is linked to dysregulated monocyte IL-1β production. J Pediatr 2013; 131: 1635-1643
Kümmerle-Deschner JB, Tyrrel PN, Reess F, et al. Risk factors for severe Muckle-Wells Syndrome. Arthritis Rheum 2010; 62: 3783-3791
Lachmann HJ, Papa R, Gerhold K, Obici L, Touitou I, Cantarini L, et al. The phenotype of TNF receptor-associated autoinflammatory syndrome (TRAPS) at presentation: a series of 158 cases from the Eurofever/EUROTRAPS international registry. Ann Rheum Dis 2014; 73: 2160-2167
Long SS. Syndrome of period fever, aphtous stomatitis, pharyngitis and adenitis (PFAPA)-what it isn’t. what it is? J Pediatr 1999; 135: 1-5
Marshall Gs, Edwards KM, Butler J, Lawton AR. Syndrome of period fever, pharyngitis and aphtous stomatitis. J Pediatr 1987; 110: 43-46
McDermott M, Frenkel J. Hereditary periodic fever syndromes. The Netherlands Journal of Medicine 2001; 59 :118-125
Mongil Ruiz I, Canduela Martinez V. Fiebre periodica. Annales de Pediatria 2002; 57: 334-344
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Ozen S, Frenkel J, Ruperto N. The eurofever project: towards better care for autoinflammatory diseases. Eur J Pediatr 2011; 170: 445-452
Poli MC. New autoinflammatory diseases. Curr Opin Pediatr 2018; 30: 837-847
Scolozzi R, Boccafogli A, Vicentino L. Hyper IgD syndrome and hereditary periodic fever syndromes. Reumatismo 2004; 56 :147-155.
Simon A, Van der Meer JW, et al. Approach to genetic analysis in the diagnosis of hereditary autoinflammatory syndromes. Rheumatology (Oxford), 2006; 45: 269-273
Tanaka N, Izawa M, Saito MK, et al. High incidence of NLRP3 somatic mosaicism in patients with chronic infantile neurologic, cutaneous, articular syndrome: results of an International Multicenter Collaborative Study. Arthritis Rheum 2011; 63: 3625-3632.
Tasher D, Stein M, Dalal I, Somekh E. Colchicine prophylaxis for frequent periodic fever, aphthous stomatitis, pharyngitis and adenitis episodes. Acta Paediatr 2008; 97: 1090-1092
Ter Haar N, Lachmann HJ, Ozen S, Woo P, Uziel Y, Modesto C, et al. Treatment of autoinflammatory diseases: results from the eurofever registry and a literature review. Ann Rheum Dis 2013; 72: 678-685
Thomas KT, Feder HM Jr, Lawton AR, Edwards KM. Periodic fever syndrome in children. J Pediatr 1999, 135: 15-21
Vigo G, Zulian F. Periodic fevers with aphthous stomatitis, pharyngitis, and adenitis (PFAPA). Autoimmun 2012; 12: 52-55
Wise CA, Gillum JD, Seidman CE, et al. Mutations in CD2BP1 disrupt binding to PTP PEST and are responsible for PAPA syndrome, an autoinflammatory disorder. Human Mol Gen 2002; 11: 961-969