Definições
A puberdade é o período de transição entre a infância e a idade adulta, caracterizado pela maturação da gametogénese, secreção de hormonas gonadais, desenvolvimento de características sexuais secundárias, aquisição de capacidade reprodutiva e aumento da massa óssea e da estatura.
Por outro lado, a adolescência, muitas vezes usada erradamente como sinónimo de puberdade, reflecte as alterações cognitivas, psicossociais e emocionais inerentes a este período de mudança e readaptação.
A gonadarca diz respeito ao início da função pubertária gonadal, com a produção da maioria das hormonas subjacentes às alterações sexuais secundárias que caracterizam cada um dos géneros.
No sexo feminino, a telarca traduz o início do desenvolvimento mamário, enquanto a menarca indica o início dos ciclos menstruais.
No sexo masculino, a espermarca refere-se ao aparecimento de espermatozóides no líquido seminal.
A adrenarca consiste no início da produção de androgénios pela suprarrenal.
A pubarca denota o início do crescimento do pelo púbico secundário ao aumento androgénico de origem suprarrenal e/ou gonadal.
1. Desenvolvimento pubertário normal
Gonadarca
A puberdade resulta da maturação da atividade do eixo hipotálamo-hipofisário-gonadal (HHG). A hormona libertadora de gonadotrofinas (GnRH) é produzida no hipotálamo de forma pulsátil, levando à secreção intermitente, pela hipófise anterior, de duas outras hormonas: a hormona luteinizante (LH) e a hormona folículo-estimulante (FSH).
O aumento gradual da pulsatilidade da GnRH, decorrente da maturação neurológica central que controla a estimulação e a inibição dos neurónios hipotalâmicos, desencadeia o início da puberdade. Na verdade, esta decorre da alteração da sensibilidade do sistema neuroendócrino ao efeito retroactivo negativo produzido pelas hormonas gonadais. Assim, enquanto na infância a inibição central da produção de GnRH acontece apenas com uma quantidade residual de esteróides sexuais, na puberdade são necessárias concentrações sobreponíveis às existentes na idade adulta para que ocorra efeito retroactivo negativo a nível hipotâmico. Os principais inibidores da GnRH são o ácido gama-amino-butírico (GABA) e os opióides, enquanto os estimulantes incluem o glutamato e o kisspeptin, sendo as células da glia facilitadoras desta secreção.
Sabe-se actualmente que grande parte da variabilidade relativa ao momento de início da puberdade é determinada geneticamente, sendo a etnia o principal factor subjacente. O processo pubertário é ainda influenciado pelo estado geral de saúde do indivíduo, pela nutrição, pela hormona de crescimento, pela função tiroideia e por disruptores endócrinos ambientais.
A maturação pubertária e a esquelética têm determinantes somáticos comuns. Na verdade, as crianças geralmente entram na puberdade quando atingem uma determinada idade óssea (IO), estando os estádios pubertários mais correlacionados com esta do que com a cronológica. Assim, por exemplo, a telarca ocorre geralmente aos 10 anos de IO, enquanto a menarca tem lugar, em média, aos 12,5 anos de IO. Por outro lado, é fundamental um estado nutricional adequado para o início e manutenção de uma função reprodutiva normal. Desta forma, a menarca também se correlaciona mais com o peso e a massa gorda do que com a idade cronológica ou a estatura. Esta ligação pode ser a explicação para o atraso pubertário em populações subnutridas e para o aparecimento mais precoce naquelas com excesso ponderal. A leptina, uma hormona produzida pelos adipócitos que sinaliza o armazenamento energético, parece ser o elo de ligação entre o estado nutricional e o início e manutenção da capacidade reprodutiva. Esta hormona actua no hipotálamo, reduzindo o apetite e estimulando a secreção de gonadotrofinas. A sua concentração aumenta ao longo da infância e da puberdade, atingindo níveis mais elevados no sexo feminino.
O eixo HHG encontra-se activo durante os períodos fetal e neonatal, sendo que o padrão de secreção hormonal sexual nesta fase parece ter um papel importante na programação sexual dimórfica adulta a nível neuroendócrino, metabólico e comportamental. O eixo HHG é formado no primeiro trimestre gestacional, passando a contribuir no trimestre seguinte para o crescimento peniano e para a fase de descida inguinoescrotal dos testículos, no rapaz. No final da segunda metade da gravidez, a sua actividade é suprimida pela grande quantidade de estrogénios sintetizados pela unidade fetoplacentar.
No período neonatal, e na ausência dos estrogénios maternos, o eixo funciona a um nível semelhante ao pubertário. Esta “mini-puberdade do recém-nascido”, apesar de subclínica, pode contribuir para o crescimento genital externo, para a presença de acne e para uma telarca transitória. Posteriormente e durante toda a infância, por acção inibitória do sistema nervoso central, o eixo HHG passa a uma fase de latência.
No final do período pré-pubertário, esta inibição diminui progressivamente, com aumento gradual da atividade do eixo, até finalmente ser atingida a fase pubertária.
A primeira alteração hormonal que ocorre na puberdade é o aumento nocturno da libertação pulsátil de LH hipofisária. A FSH é segregada em paralelo, mas com um aumento relativo bastante inferior. No início da puberdade ocorre uma variação hormonal circadiana única, com um aumento pulsátil significativo de LH durante o sono, ao qual se opõe uma secreção mínima durante o período diurno. A resposta gonadal a este padrão de secreção de LH difere entre os dois sexos: o pico de secreção ovárica de estradiol tem lugar por volta do meio-dia, enquanto a testosterona testicular é libertada também durante o sono e com pico cerca de 2 horas após o de LH. Além disso, na rapariga desde o início da puberdade, existe uma secreção hormonal cíclica subclínica.
À medida que a puberdade progride, a secreção de LH prolonga-se pelo período diurno e, depois da menarca, esta variação circadiana desaparece. Contudo, a concentração adulta de esteróides sexuais apresenta uma ligeira variação diurna, sendo mais elevada ao acordar. Cada uma das gonadotrofinas exerce a sua acção em células gonadais específicas: a LH estimula as células intersticiais ováricas (células da teca) a produzir androgénios precursores do estradiol e as células intersticiais testiculares (células de Leydig) a segregar testosterona; a FSH estimula o crescimento gonadal e a gametogénese, actuando nas células da granulosa ováricas promovendo o crescimento folicular, e nas de Sertoli testiculares. Estimulando a espermatogénese na granulosa, a FSH estimula ainda a aromatase, que transforma os androgénios produzidos pela teca, em estradiol.
À medida que as gónadas se tornam mais sensíveis ao efeito estimulante das gonadotrofinas, o seu volume e secreção hormonal aumentam progressivamente. Nos primeiros 3 anos após o início da puberdade, o estradiol aumenta anualmente cerca de 20 pg/mL, enquanto o da testosterona é de aproximadamente 10 ng/dL. (Quadro 1)
QUADRO 1 – Hormonas pubertárias: intervalos séricos basais normais, no início da manhã
Adaptado de Bordini B, Rosenfield RL. Pediatr Rev, 2011 | ||||||
| LH (UI/L) | FSH (UI/L) | Estradiol (pg/mL) | Testosterona total (ng/dL) | DHEA-S (µg/dL) | ||
| Pré-púbere (1-5 anos) | < 0,2 | < 4 | < 10 | < 20 | 5 – 40* | |
| Rapariga Púbere | Pré-menarca | ≤ 12 | 1 – 12 | < 50 | 13 – 44 | 35 – 130 |
| Pós-menarca# | 2 – 11 | 1 – 12 | 20 – 85 | 15 – 59 | 75 – 255 | |
| Homem adulto• | 1,4 – 9 | 1 – 9,2 | < 60 | 300 – 950 | 100 – 460 | |
Na rapariga, este aumento hormonal culmina num efeito retroactivo positivo, levando a que o sistema neuroendócrino passe a ser capaz de segregar o pico de LH a meio do ciclo menstrual, quando o ovário assinala que se encontra preparado para a ovulação, através da secreção de um nível crítico e mantido de estrogénios. Por seu turno, estes vão estimular o desenvolvimento mamário, o crescimento do endométrio e a secreção de muco cervical. Paralelamente, os androgénios vão estimular o pêlo púbico e axilar e as glândulas sebáceas. A função gonadal é responsável por mais de 90% da produção de estradiol na mulher adulta (50% no homem) e por mais de 90% da síntese de testosterona no homem adulto (50% na mulher).
As hormonas gonadais desencadeiam o impulso e a função sexual, bem como o surto de crescimento pubertário. Se por um lado ambos os esteróides sexuais estimulam directamente o crescimento e a maturação epifisária, por outro diferem em alguns efeitos sobre o crescimento esquelético: enquanto os androgénios promovem o alargamento ósseo, os estrogénios são necessários à fusão epifisária e os maiores inibidores da reabsorção óssea.
Estas hormonas afectam ainda o crescimento de uma variedade de outros tecidos somáticos: os estrogénios promovem a lipogénese e a distribuição de tecido adiposo caracteristicamente ginóide; pelo contrário, os androgénios são lipolíticos (apesar de favorecerem a adiposidade visceral) e promotores do desenvolvimento muscular. Assim, apesar de ocorrer um aumento do índice de massa corporal, tanto na rapariga como no rapaz, a proporção relativa de massa magra (maior no rapaz) e gorda (superior na rapariga) difere bastante.
O surto de crescimento pubertário também é induzido de forma indirecta pelas hormonas sexuais ao potenciarem a secreção hipofisária de hormona de crescimento (HC), e com isso um aumento acentuado de factor de crescimento semelhante à insulina tipo 1 (IGF-I). Por outro lado, a HC é também essencial para que possa ocorrer o potencial efeito gonadotrófico máximo sobre o crescimento e função gonadais. Desta forma, será fácil compreender que o défice ou a resistência à HC, além de conduzirem à ausência do estirão de crescimento pubertário, sejam acompanhados de hipogonadismo, micropénis e desenvolvimento mamário escasso.
O início do ciclo menstrual provém da maturação cíclica dos folículos ováricos, da qual resulta uma variação periódica nos níveis de estradiol e progesterona que, por sua vez, induzem variações na concentração das gonadotrofinas. O objectivo biológico desta variação mensal é a selecção e maturação de um folículo dominante capaz de ser libertado e potencialmente fecundado.
Um ciclo menstrual (interlúnio) tem em média 28 dias, sendo composto por duas metades: a fase folicular (desde o primeiro dia menstrual até ao pico de LH indutor da ovulação) e a fase lútea (desde a formação do corpo lúteo até à menstruação seguinte). Nesta segunda fase (que tem lugar apenas nos ciclos ovulatórios), o corpo lúteo produz uma grande quantidade de progesterona e uma mais discreta de estradiol, de forma a manter a camada endometrial do útero, em preparação para uma potencial nidação. Se a fecundação (e com ela o aumento da gonadotrofina coriónica humana – hCG) não ocorrer, o corpo lúteo involui, com subsequente decréscimo hormonal seguido de fluxo menstrual (cataménio).
O doseamento sérico das várias hormonas mencionadas anteriormente requer que seja tida em consideração a sensibilidade e especificidade da metodologia utilizada pelo laboratório. Por outro lado, como referido previamente, os níveis estão sujeitos, não só a variações circadianas, mas também, no caso feminino, a alterações cíclicas (Quadro 1). Por estes motivos, é frequentemente necessário realizar uma prova de estimulação com GnRH (ou um agonista da GnRH) para diagnóstico de distúrbios pubertários: um pico de LH superior a 4.0 UI/L é sugestivo de início da puberdade.
Adrenarca
Durante a gestação, a zona fetal do córtex da suprarrenal produz grandes quantidades de sulfato de de-hidroepiandrosterona (DHEA-S), o principal substrato da síntese placentar de estrogénio. No primeiro ano de vida, esta zona vai sofrendo regressão progressiva. A adrenarca tem início na segunda infância, à medida que a zona reticularis do córtex suprarrenal se desenvolve.
O hipotálamo produz hormona libertadora de corticotrofina (CRH) que, ao estimular a hipófise anterior, leva à libertação de hormona adrenocorticotrófica (ACTH). Na infância, em resposta à ACTH, a zona reticularis tem a capacidade de sintetizar DHEA-S, mas não cortisol. Por este motivo, enquanto a cortisolémia não sofre grande alteração até à idade adulta, a concentração sérica de DHEA-S aumenta gradualmente a partir da segunda infância (Quadro 1). Apesar de este período coincidir aproximadamente com a produção de androgénios gonadais, a adrenarca é independente da maturação pubertária do eixo HHG, ou seja, da gonadarca. A suprarrenal produz mais de 90% de DHEA-S na criança e na mulher, e mais de 70% no homem. Por outro lado, esta glândula sintetiza 50% da testosterona na mulher adulta, e menos de 10% no homem adulto. A partir da idade escolar, o aumento da concentração de androgénios é responsável pelo estímulo apócrino e respectivo odor corporal, levando, aproximadamente a partir dos 10 anos, ao crescimento do pêlo púbico.
Estadiamento
Actualmente, na população geral, a idade de início da puberdade considerada normal é entre 8 e 13 anos na rapariga e entre 9 e 14 anos no rapaz. Contudo, nas raparigas de origem africana ou hispânica é habitual que a telarca ocorra um ano antes. Por outro lado, nos dois sexos, quando há excesso de peso e por ação da leptina, a puberdade tende a ter início cerca de 6 meses mais cedo.
Em 1969, Marshall e Tanner, com base numa amostra branca da população britânica e de forma a documentarem a progressão da maturação sexual em cada um dos géneros, desenvolveram uma escala utilizada até aos dias de hoje e mais conhecida como Estádios de Tanner. Através da palpação mamária feminina (M) e genital masculina (G), bem como da avaliação dos pêlos púbicos em ambos os sexos (P), os indivíduos são classificados em 5 estádios: 1- pré-púbere; 2- início da puberdade; 3 e 4- progressão da maturação; 5- morfologia adulta. (Figuras 1 e 2)
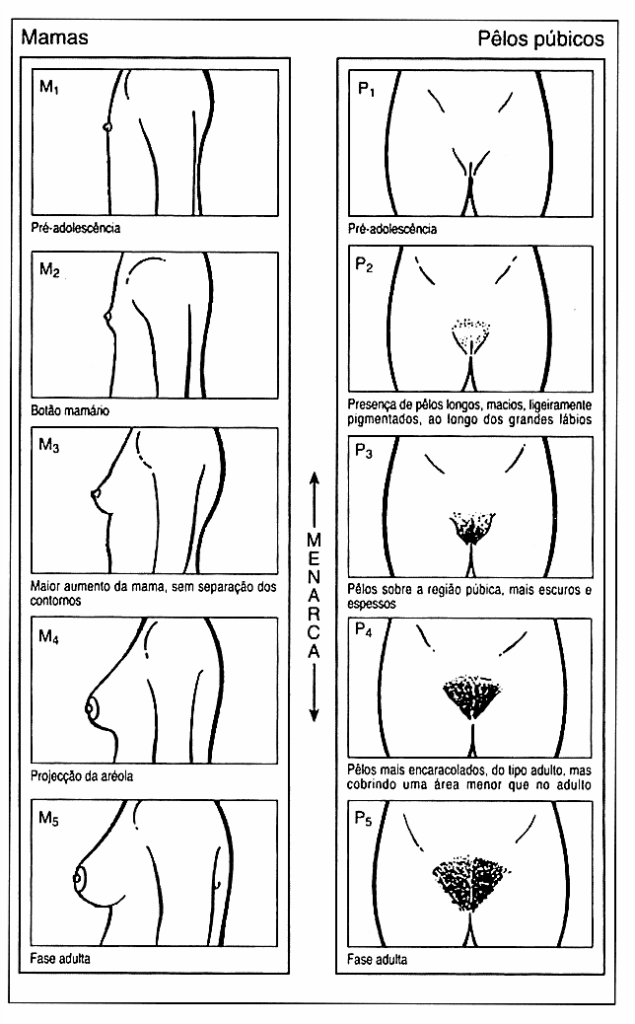
FIGURA 1. Desenvolvimento pubertário feminino: critérios de Tanner

FIGURA 2. Desenvolvimento pubertário masculino: critérios de Tanner
A puberdade feminina tem início com a telarca (M2), podendo o desenvolvimento mamário pode ser assimétrico, ou seja, existir 1 estádio de diferença entre as mamas. Tipicamente precede a pubarca em 1 a 1,5 anos, apesar de esta poder ocorrer em simultâneo ou um pouco antes. A menarca tem lugar cerca de 2,5 (0,5 a 3) anos após a telarca, em média aos 12,6 anos na população normoponderal branca e aos 12,1 anos na negra. O surto de crescimento pubertário começa em M2P2, com atingimento do pico de velocidade (8,25 cm/ano) em P3, cerca de um ano antes da menarca. Posteriormente, apesar de ocorrer uma desaceleração, há ainda um ganho de cerca de 7 cm, sendo que 99% do crescimento está concluído quando a idade óssea atinge 15 anos.
A puberdade masculina tem início quando o volume testicular atinge 4 mL (G2). Paralelamente ao que acontece na rapariga, pode ocorrer também assimetria testicular de 1 estádio. O estádio P3 ocorre cerca de 1 a 1,5 anos depois. Habitualmente, a espermarca tem início em G3, enquanto a barba e a alteração vocal ocorrem em G4. O pico de crescimento pubertário tem lugar durante os estádios G3 e G4 (9,5 cm/ano), em média 2 anos mais tarde que nas raparigas. Quando a idade óssea atinge 17 anos, 99% do crescimento está completo. Um período de crescimento mais longo e um pico de velocidade superior explicam a discrepância de estatura final entre os dois sexos.
2. Variantes do desenvolvimento pubertário normal
Adrenarca prematura
A adrenarca prematura diz respeito à presença de pêlo púbico antes dos 8 anos na rapariga e dos 9 anos no rapaz, sendo rara antes dos 6 anos. Pode ser acompanhada de pêlo axilar, odor corporal e acne ligeira. No seguimento do que foi dito, além de ser mais frequente na rapariga e nos indivíduos com excesso ponderal, tem ainda maior incidência quando a origem é africana ou hispânica.
Como explicado previamente, a adrenarca é independente do eixo HHG, ocorrendo como consequência do aumento de DHEA e DHEA-S androgénico produzidas pelo córtex da suprarrenal. O fenótipo da adrenarca prematura varia consideravelmente entre populações, podendo estar associado a baixo peso ao nascer, a resistência à insulina, a síndroma de ovário poliquístico e a risco cardiometabólico. Esta condição é considerada uma variante benigna, na ausência de outros sinais de puberdade, nomeadamente: surto de crescimento linear, clitoromegália, aumento fálico ou acne grave. A sua progressão pode ocorrer, mas associada a uma velocidade de crescimento normal.
A avaliação inclui a determinação da idade óssea que, podendo estar ligeiramente avançada, não deverá exceder 2 desvios-padrão relativamente à idade cronológica. Na presença de sinais sugestivos de excesso de androgénios, e para exclusão de hiperplasia congénita da suprarrenal e de tumor produtor de androgénios, deverá ser feito o doseamento de 17-hidroxiprogesterona (17-OHP), DHEA-S e testosterona. Na adrenarca prematura a DHEA-S geralmente está elevada, sendo, contudo, consistente com o estádio de Tanner púbico. (Quadro 1)
Telarca prematura
A telarca prematura é definida como o desenvolvimento mamário na rapariga com menos de 8 anos e na ausência de outros sinais pubertários. Podendo estar presente desde o nascimento, é frequente nos primeiros dois anos de vida, após os quais tende a regredir. A causa exacta do aparecimento prematuro isolado da telarca continua desconhecida; admite-se que possa ser provocada pelo aumento da sensibilidade do tecido glandular, apesar da existência de níveis muito baixos de estrogénios. Paralelamente, há estudos que sugerem a associação a disruptores endócrinos, nomeadamente, a soja.
Uma vez que o desenvolvimento mamário é a primeira manifestação pubertária na rapariga, é essencial distinguir a telarca prematura da puberdade precoce de causa central. Assim, se a velocidade de crescimento for normal e o desenvolvimento mamário for mínimo, não é necessário proceder a qualquer investigação, devendo ser realizada apenas vigilância rigorosa da evolução. Contrariamente, se ocorrer aceleração do crescimento linear ou progressão do desenvolvimento pubertário, a exclusão de puberdade precoce torna-se obrigatória, e mais ainda pelo facto de numa pequena percentagem de raparigas com telarca prematura se poder vir a desenvolver ulteriormente puberdade precoce central.
Atraso constitucional do crescimento e da puberdade
O atraso constitucional do crescimento e da puberdade traduz uma demora exagerada no início do surto pubertário e da maturação em crianças saudáveis: ambos ocorrem de forma normal, mas numa idade mais tardia. Em 50-70% dos casos existe uma história familiar sobreponível. Nestes indivíduos, a estatura e o estádio pubertário são concordantes com a idade óssea, também ela atrasada. A estatura adulta final está de acordo com a estatura-alvo familiar.
O atraso constitucional do crescimento e da puberdade é um diagnóstico de exclusão, sendo por vezes difícil de distinguir do hipogonadismo hipogonadotrófico.
Actualmente, não são recomendados exames de rotina para distinguir estas duas entidades, pelo que os indivíduos deverão ser seguidos de perto até ao aparecimento de características pubertárias ou, na sua ausência, até ao limite superior do intervalo de normalidade para o início da puberdade, data em que se deverá proceder a investigação. (ver adiante)
Ginecomastia
A ginecomastia pubertária pode ocorrer em 50-60% dos rapazes, de forma fisiológica e geralmente entre os estádios 3 e 4 de Tanner, devendo-se essencialmente ao desequilíbrio entre as concentrações séricas de estrogénios e androgénios. Com duração de cerca de um ano, tem autorresolução no final da puberdade, não requerendo tratamento.
A ginecomastia pode ser uni ou bilateral, sendo frequentemente assimétrica. O diagnóstico é clínico, através da palpação mamária, sendo perceptível tecido glandular sob a região areolar. Esta entidade deve ser distinguida da pseudoginecomastia, provocada pelo aumento do tecido adipocitário (adipomastia). Por outro lado, no adolescente, as causas patológicas de ginecomastia são raras e incluem o hipogonadismo, o uso de drogas recreativas, a doença hepática crónica, a doença renal crónica e tumores secretores de hCG.
3. Puberdade precoce
Como explicado previamente, a puberdade é definida como precoce quando as características sexuais secundárias ocorrem antes dos 8 anos na rapariga ou dos 9 anos no rapaz. A sua causa pode ser dependente das gonadotrofinas (central) ou independente (periférica). (Quadro 2)
QUADRO 2 – Causas de puberdade precoce
Adaptado de Williams Textbook of Endocrinology, 13th Ed. 2016 |
Central ou Dependente de Gonadotrofinas
|
Periférica ou Independente de Gonadotrofinas
|
A história clínica deverá ser detalhada, precisando o momento e a ordem de aparecimento das várias alterações pubertárias e do surto de crescimento. Deverá ainda ser questionada a presença de cefaleia ou outros sintomas neurológicos centrais, bem como de antecedentes de traumatismo craniano, infecção do SNC e corticoterapia.
No rapaz, deverá proceder-se à medição do volume testicular com o auxílio do orquidómetro de Prader e ao estadiamento do pêlo púbico. Quando a causa for central haverá aumento do tamanho testicular, contrariamente à origem periférica em que este permanece pré-púbico (< 4 mL).
Na rapariga, deverá ser determinado o estádio de Tanner da mama e do pêlo púbico. O aumento mamário é indicador de puberdade precoce de origem central. O exame vaginal externo permitirá verificar se existe estrogenização da mucosa (baça e rosa), ou não (luzidia).
A estrogenização é também sugestiva de causa central. Uma vez que os esteroides sexuais estimulam o crescimento linear e a maturação epifisária, as crianças com puberdade precoce apesar de poderem ser mais altas que os seus pares durante esta fase, sofrerão encerramento precoce das epífises e, por conseguinte, no caso de não serem tratadas, serão mais baixas na idade adulta. Uma idade óssea superior a 2 anos em relação à cronológica ou de +2 desvios-padrão para a idade é sugestiva deste processo.
Puberdade precoce central
A puberdade precoce central (PPC) deve-se a uma activação prematura do eixo HHG, com secreção de gonadotrofinas hipofisárias, motivo pelo qual também é designada por puberdade precoce dependente de gonadotrofinas. A mesma ocorre mais frequentemente nas raparigas, sendo na maioria das vezes idiopática. Pelo contrário, nos rapazes, além de mais rara, geralmente identifica-se factor etiológico, nomeadamente massas ou lesões do SNC, sendo o hamartoma hipotalâmico o mais frequente.
O diagnóstico de PPC deve ser considerado quando há desenvolvimento prematuro do botão mamário ou aumento simétrico dos testículos, acompanhados por surto de crescimento. Nestes casos, o exame objectivo deverá incluir também a fundoscopia.
A investigação laboratorial pode revelar valores pubertários de gonadotrofinas e de esteróides sexuais (Quadro 1). Uma razão LH/FSH < 1, com um predomínio de FSH, é indicativa de um estado pré-pubertário, com um eixo HHG inactivo. Quando são utilizados métodos ultrassensíveis, um valor basal de LH ≥ 0,2 UI/L é suficiente para estabelecer o diagnóstico de PPC. Contudo, uma vez que as gonadotrofinas são segregadas de forma pulsátil, inicialmente os níveis basais podem ser baixos. Por este motivo, nos casos em que o índice de suspeita é elevado, deverá ser realizado um teste de estimulação com GnRH, o que confirmará a presença de PPC quando a LH ≥ 8,0 UI/L. Nestas situações, é obrigatório proceder a estudo imagiológico através de ressonância magnética para avaliação hipotálamo-hipofisária.
O tratamento tem por objectivo suprimir a produção de gonadotrofinas e, consequentemente, de esteróides sexuais. Nos casos com identificação de patologia subjacente, deverá ser tratada a condição de base, tendo, porém em consideração que na maioria dos casos de hamartomas hipotalâmicos não está indicada intervenção cirúrgica.
Por outro lado, o tratamento da PPC idiopática inclui a utilização de análogos da GnRH de longa ação: leuprorrelina e triptorrelina (injecção intramuscular ou subcutânea; 3,75 mg/mês ou 11,25 mg trimestrais); goserrelina e buserrelina (implante subcutâneo; 3,6 mg/mês ou 10,8 mg trimestrais); histrelina (implante subcutâneo; 50 mg/ano).
Estes fármacos, quando administrados de forma contínua, suprimem de forma paradoxal a libertação de gonadotrofinas e de esteróides sexuais, levando à frenação do aparecimento das características sexuais secundárias, do surto de crescimento pubertário e da maturação óssea, bem como da menarca na rapariga. A duração do tratamento, não sendo inferior a 2 anos, é determinada, caso a caso, tendo em mente os objectivos enumerados.
No que concerne à estatura final, existe maior benefício terapêutico se o tratamento for iniciado mal a PPC seja detectada (geralmente antes dos 6 anos), sendo menos eficaz quando introduzido mais tardiamente. O tratamento com análogos da GnRH é seguro e sem efeitos nefastos na futura função reprodutora, permitindo uma progressão pubertária normal após a sua interrupção. A menarca ocorre tipicamente 12 a 18 meses após a suspensão. Esta é baseada na idade cronológica (aproximadamente 11 anos), na idade óssea (cerca de 12 anos) e na velocidade de crescimento, tendo ainda em consideração os aspetos psicológicos do jovem e a vontade dos pais.
Puberdade precoce periférica
A puberdade precoce periférica (PPP), relativamente rara e contrariamente à central, independente do eixo HHG, é causada pela exposição exógena ou pela secreção endógena de hormonas gonadais e suprarrenais. Caracteriza-se pelo aparecimento prematuro de características sexuais secundárias juntamente com aumento da velocidade de crescimento na presença de valores normais ou baixos de LH e FSH, os quais não aumentam após teste de estimulação com GnRH.
Crianças com virilização isolada e rapidamente progressiva, acompanhada de surto pubertário, devem ser avaliadas para patologias que resultam em excesso de androgénios, nomeadamente: hiperplasia congénita da suprarrenal (HCSR), tumores adrenais produtores de androgénios, tumores ováricos produtores de androgénios (rapariga), tumores das células de Leydig (rapaz).
A HCSR tardia frequentemente é provocada pela deficiência da enzima 21-hidroxilase, levando ao aumento de 17-hidroxiprogesterona (17-OHP) a montante. Raparigas com excesso de androgénios circulantes podem apresentar clitoromegália.
Paralelamente, os rapazes terão crescimento peniano que, contudo, não é acompanhado de aumento do volume testicular; este facto permite distinguir o excesso de androgénios circulante da PPC. Uma assimetria testicular marcada associada a sinais de androgenização e a surto de crescimento é sugestiva de tumor das células de Leydig produtor de testosterona.
Raramente, a síndroma de Cushing pode também apresentar-se como virilização isolada, embora na ausência de surto de crescimento pubertário acompanhante. A avaliação dos casos em que existe virilização inclui a determinação da idade óssea e da velocidade de crescimento, bem como de 17-OHP, DHEA-S e testosterona. A determinação dos esteróides adrenais antes e depois da prova de estimulação com ACTH permite identificar os casos de HCSR.
A testitoxicose é uma forma de PPP familiar masculina, autossómica dominante, que geralmente surge aos 2-3 anos de idade, com valores de testosterona semelhantes aos do adulto, e gonadotrofinas suprimidas. Os doentes apresentam virilização excessiva, com aumento fálico, acne e comportamento mais agressivo, mas com testículos desproporcionalmente pequenos para o grau de virilização. Esta alteração genética rara é causada pela activação do receptor de LH, com hiperplasia das células de Leydig.
Também no sexo masculino, a produção ectópica de hCG por tumores de células germinativas ou por hepatoblastoma pode também estimular a produção de testosterona pelas células de Leydig testiculares. Nestes casos, os testículos podem estar aumentados de forma simétrica, apesar de também desproporcionalmente pequenos face ao grau de virilização. O diagnóstico é confirmado pela determinação da hCG sérica.
Nas raparigas, o desenvolvimento mamário rapidamente progressivo, quando associado a aceleração da estatura e a níveis significativamente elevados de estradiol com gonadotrofinas suprimidas, deve alertar para a possibilidade da existência de um tumor ovárico produtor de estrogénios ou de síndroma de McCune-Albright. Deverá ser realizada ecografia pélvica para avaliar a presença de quistos ou massas ováricas. Os quistos foliculares ováricos benignos podem apresentar-se como episódio isolado de hemorragia vaginal, regredindo espontaneamente. Porém, quistos de dimensões maiores podem predispor a torção ovárica, requerendo intervenção.
A síndroma de McCune-Albright (SMA) é definida pela tríada de: 1- PPP; 2- manchas café-com-leite unilaterais e que não cruzam a linha média; 3- displasia óssea fibrosa. Apesar de também poder ser observada no sexo masculino, é mais frequente nas raparigas. Estas, frequentemente, apresentam episódios recorrentes de hemorragia vaginal associados à formação de quistos foliculares que podem ser identificados ecograficamente.
Por outro lado, os rapazes apresentam sinais de excesso de androgénios, com crescimento peniano. Além da observação minuciosa do tegumento cutâneo, deverão ser realizadas radiografias de todo o esqueleto no intuito de identificar lesões ósseas de displasia fibrosa poliostótica. Esta síndroma é causada pela activação do gene GNAS1, provocando a estimulação continuada desta proteína em vários tecidos endócrinos (tiróide, suprarrenal, gónadas, hipófise), levando ao aumento da sua função.
Também o hipotiroidismo primário grave pode causar PPP em ambos os sexos. Na rapariga, cursa com aumento mamário, hemorragia vaginal e quistos ováricos; no rapaz leva a aumento testicular.
O objectivo do tratamento da PPP sobrepõe-se ao da PPC: retardar o aparecimento de características sexuais secundárias e diminuir o surto pubertário e a maturação óssea de forma a preservar a estatura adulta final. É importante ter em consideração que a PPP, sendo independente do eixo HHG, não responde aos análogos da GnRH, pelo que o tratamento deverá ser dirigido à patologia subjacente.
No caso da HCSR tardia, as crianças são tratadas com glucocorticóides no intuito de suprimir a produção androgénica. Nestes casos, a deficiência de 21-hidroxilase resulta de uma mutação mais ligeira, sem perda de sal, pelo que geralmente não é necessária a substituição com mineralocorticóides.
Nos tumores adrenais ou gonadais o tratamento é cirúrgico, enquanto os tumores produtores de hCG podem requerer ainda radioterapia.
O tratamento das raparigas com SMA inclui anti-estrogénios: anastazol ou letrozol (inibidores da aromatase), e tamoxifeno (modulador do receptor selectivo de estrogénios). Os rapazes com testitoxicose são tratados com uma combinação de espironolactona (bloqueante de receptor de androgénios), testolactona (inibidor da aromatase) e cetoconazol (inibidor da produção de androgénios testiculares e adrenais).
Nas crianças com exposição externa a hormonas, a sua remoção geralmente é suficiente para a regressão do processo.
4. Puberdade tardia
A puberdade tardia é definida pela inexistência de características sexuais secundárias após os 13 anos na rapariga, ou após os 14 anos no rapaz. A ausência de menarca (amenorreia primária) após os 16 anos é também considerada atraso pubertário. A puberdade tardia pode ter causa gonadal ou primária (hipogonadismo hipergonadotrófico), ou causa central ou secundária (hipogonadismo hipogonadotrófico). (Quadro 3)
QUADRO 3 – Causas de puberdade tardia
Hipogonadismo Hipergonadotrófico ou Primário
|
Hipogonadismo Hipogonadotrófico ou Secundário
|
É muito importante ter em consideração que estas entidades são referentes ao atraso da gonadarca e relativas ao eixo HHG. Assim, o pêlo púbico e axilar, bem como o odor corporal, relacionados com a presença de androgénios suprarrenais (adrenarca), podem estar presentes.
A história clínica deverá ter em consideração, não só a história familiar da idade pubertária, mas também antecedentes pessoais de condições sistémicas (por ex. anorexia, má-absorção, parotidite, malária, autoimunidade, hipopituitarismo) ou gonadais (radio/quimioterapia, traumatismo, cirurgia) que possam estar na origem deste atraso.
Também nesta situação, a avaliação da estatura, da velocidade de crescimento e da idade óssea são muito importantes: em regra, quando a causa é central, ocorre diminuição da velocidade de crescimento e atraso da idade óssea. A investigação laboratorial é a chave etiológica, sendo mandatória a determinação da LH e da FSH, bem como da testosterona total no rapaz ou do estradiol na rapariga.
Nos jovens com baixa estatura, deverá ser excluído hipopituitarismo, com determinação do IGF-1, da TSH e da ACTH. Caso o mesmo se confirme, deverá ser realizada ressonância magnética para avaliação da sela turca.
O tratamento das causas permanentes de hipogonadismo, seja ele primário ou secundário, são as mesmas, ou seja, a substituição hormonal com estrogénio na rapariga ou com testosterona no rapaz.
Em ambos os sexos, a dose inicial deve ser pequena e gradualmente aumentada ao longo dos 2-3 anos seguintes, de forma a mimetizar a puberdade normal. Na rapariga, o 17ß-estradiol é preferível ao etinilestradiol sintético, podendo ser administrado por via oral (inicialmente 5 µg/kg/dia, com incrementos de 5 µg/kg/dia a cada 6-12 meses, até à dose de adulto de 1-2 mg/dia), ou por via transdérmica (3,1-6,2 µg/dia, ou seja, ⅛–¼ do adesivo de 25 µg; incrementos de 3,1-6,2 µg/dia a cada 6-12 meses, até à dose de adulto de 50-100 µg/dia). Ao evitar o efeito de primeira passagem pelo fígado e minorando o risco protrombótico, a segunda via é preferível.
A adição de progesterona 10 dias por mês, geralmente sob a forma de acetato de medroxiprogesterona (5-10 mg/dia), deverá ser iniciada 1-2 anos após o início da terapêutica com estrogénio ou após a menarca. No rapaz, apesar de existirem várias formas de suplementação com testosterona, a mais utilizada é a intramuscular (enantato, cipionato ou propionato de testosterona) administrada a cada 28 dias. A dose inicial é de 50 mg, a qual é aumentada em 50 mg a cada 6-12 meses; após ser alcançada a dose de 100-150 mg/mês, o intervalo entre as administrações deverá ser reduzido para 2 semanas; a dose do adulto é de 200 mg a cada 2 semanas. As formulações em gel ou em penso transdérmico não são tão fáceis de manipular na criança; por outro lado, as orais comportam risco de toxicidade hepática, pelo que não são aconselhadas.
Hipogonadismo hipergonadotrófico ou primário
O hipogonadismo hipergonadotrófico refere-se à falência gonadal primária (ovárica ou testicular) na produção de esteróides sexuais. Esta carência, pela ausência de efeito retroactivo negativo sobre o eixo hipotálamo-hipofisário, leva a um aumento marcado da produção de gonadotrofinas, característica desta entidade.
A síndroma de Turner (45 X0) é a causa mais frequente de falência ovárica primária. As jovens apresentam baixa estatura associada a alterações características, nomeadamente: implantação capilar e auricular baixas, pescoço alado, tórax em escudo com aumento da distância intermamilar, cardiopatia direita.
Em todos os indivíduos do sexo feminino com baixa estatura, atraso do desenvolvimento mamário ou amenorreia primária, deve proceder-se obrigatoriamente a cariótipo. A fertilidade encontra-se comprometida por atrésia gonadal, pelo que as raparigas necessitam de terapia hormonal de substituição com estrogénios, a iniciar por volta dos 12 anos de idade, de forma a permitirem um desenvolvimento adequado das características sexuais secundárias, do útero e da massa mineral óssea.
A síndroma de Klinefelter (47 XXY, 48 XXXY, etc.) é a causa mais frequente de hipogonadismo primário no rapaz. As características clínicas incluem estatura elevada, ginecomastia, testículos pequenos e baixo QI. Em todos os indivíduos com estas características deve ser realizado cariótipo. Apesar de estes rapazes poderem apresentar adrenarca e início espontâneo da virilização, não ocorre desenvolvimento genital adequado e a fertilidade encontra-se comprometida por falência das células de Sertoli.
A terapêutica de substituição com testosterona deve ser iniciada quando a FSH e a LH começam a aumentar, de forma a promover o aparecimento das características sexuais secundárias e o aumento da densidade mineral óssea.
A falência ovárica autoimune é uma causa importante de hipogonadismo primário na rapariga, a qual pode estar associada a outras patologias autoimunes, incluindo: hipotiroidismo, insuficiência adrenal, diabetes mellitus tipo 1 ou hipoparatiroidismo.
A anorquia bilateral congénita (síndroma dos testículos desaparecidos) refere-se à regressão testicular que ocorre ainda in utero. A propósito da causa, ainda não bem estabelecida, admite-se que esta entidade possa resultar de trombose vascular ou de torção testicular, provavelmente após as 20 semanas de gestação, tendo em conta o desenvolvimento sexual dos genitais externos adequado, o que traduz função testicular normal durante o início da gestação.
Os agentes quimioterapêuticos (especialmente os alquilantes), assim como a radioterapia local podem desencadear insuficiência gonadal em ambos os sexos. Por outro lado, infecções como malária, parotidite, varicela, por vírus Coxsackie ou por Shigella podem desencadear ooforite ou orquite, levando a hipogonadismo. Por fim, o traumatismo pode também ser uma causa importante de falência testicular.
Hipogonadismo hipogonadotrófico ou secundário
O hipogonadismo hipogonadotrófico diz respeito à falência do eixo hipotálamo-hipofisário em segregar GnRH e/ou gonadotrofinas, com consequente ausência de estimulação gonadal, o que culmina na ausência de produção de esteróides sexuais. Os adolescentes com esta condição têm níveis basais baixos de LH e de FSH, não apresentando aumento das gonadotrofinas ou dos esteróides sexuais após prova de estimulação com GnRH.
A síndroma de Kallman, condição genética que pode afectar tanto rapazes como raparigas, caracteriza-se por hipogonadismo central associado a infertilidade e a anosmia. A sua origem está na falência da migração para o hipotálamo dos neurónios responsáveis pela produção de GnRH durante o desenvolvimento embrionário.
O hipopituitarismo, como referido anteriormente, está associado a sinais e sintomas relativos a outras deficiências hipofisárias. O exame objectivo pode ainda evidenciar defeitos da linha média associados a displasia septo-óptica ou a agenésia do septo pelúcido.
Doenças crónicas que envolvam o coração, o aparelho gastrintestinal, o fígado, o rim ou outras glândulas endócrinas, assim como neoplasias ou infecções crónicas, podem também estar na origem de atraso pubertário hipogonadotrófico.
Apesar de o tratamento de substituição com esteróides sexuais ser a base da intervenção para aquisição das características sexuais secundárias, no rapaz com hipogonadismo hipogonadotrófico a testosterona não induz crescimento testicular ou espermatogénese, que são dependentes do estímulo da LH nas células de Leydig e da FSH nas de Sertoli. Assim, a indução da fertilidade requer a administração de GnRH de forma pulsátil ou de hCG + FSH exógenas.
BIBLIOGRAFIA
Abreu AP, Kaiser UB. Pubertal development and regulation. Lancet Diabetes Endocrinol 2016; 4: 254-264
Biro FM, Chan YM. Normal Puberty. UpToDate. Disponível em: http://www.uptodate.com. Consultado a 20.12.2016
Bordini B, Rosenfield RL. Normal puberty development: Part I: The Endocrine Basis of Puberty. Pediatr Rev 2011; 32: 223-229
Bordini B, Rosenfield RL. Normal puberty development: Part II: Clinical Aspects of Puberty. Pediatr Rev 2011; 32: 281-292
Bourguignon JP, Parent AS. (eds) (2016) Puberty from Bench to Clinic: Lessons for Clinical Management of Pubertal Disorders. Basel: Karger, 2016
Braun LR, Marino R. Disorders of growth and stature. Pediatr Rev 2017; 38: 293-304.doi:10.1542/pir.2016-0178
Butler G, Kirk J (eds). Puberty and its Disorders. Paediatric Endocrinology and Diabetes. Oxford: Oxford University Press, 2011
Caler JC, Eugster EA, Rogol A, et al, on behalf of the ESPE-LWPES GnRH Analogs Consensus Conference Group. Consensus statement on the use of gonadotropin-releasing hormone analogs in children. Pediatrics 2009; 123: e752 – e762
Carel JC, Léger J. Precocious Puberty. NEJM 2008; 258: 2366-2377
Crowley Jr WF, Pitteloud N. Diagnosis and treatment of delayed puberty. UpToDate. Disponível em: http://www.uptodate.com. Consultado a 20.12.2016
Dwyer AA, Phan-Hug F, Hauschild M, Elowe-Gruau E, Pitteloud N. Hipogonadism in Adolescence. Europ J Endocr 2015: R15 – R24
Haddad NG, Eugster EA (eds). Endocrinology: Adult and Pediatric. Philadelphia: Elsevier, 2016
Harrington J, Palmert MR. Definition, etiology, and evaluation of precocious puberty. uptodate. Disponível em: http://www.uptodate.com. Acesso em Setembro de 2019
Kaplowitz PB. Delayed puberty. Pediatr Rev 2010; 31: 189-195
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Latronico AC, Brito VN, Carel JC. Causes, diagnosis, and treatment of central precocious puberty. Lancet Diabetes Endocrinol 2016; 4: 265-274
Meyer SL, Obrynba K, Almazan S. Update on common childhood endocrine disorders. Curr Probl Pediatr Adolesc Health Care 2015; 45: 250-280
Neeman B, Bello R, Lazar L, Phillip M, et al. Central precocious puberty as presenting sign of non-classical congenital adrenal hyperplasia – clinical characteristics. J Clin Endocrinol Metab 2019 Feb 19. pii: jc.2018-02605. doi: 10.1210/jc.2018-02605.
Palmert MR, Dunkel L, Witchel SF (eds). Pediatric Endocrinology. Philadelphia: Elsevier, 2014
Radovick S, Misra M (eds). Pediatric Endocrinology. A Practical Clinical Guide. Berlin: Springer, 2018
Styne DM, Grumbach MM (eds). Physiology and Disorders of Puberty. Williams Textbook of Endocrinology. Philadelphia: Elsevier, 2016
Utriainen P, Laakso S, Liimatta J, Jääskeläinen J, Voutilainen R. Premature adrenarche – a common condition with a variable presentation. Horm Res Paediatr 2015; 83: 221-231
Viswanathan V, Eugster EA. Etiology and treatment of hypogonadism in adolescents. Pediatr Clin North Am 2011; 58: 1181-1200
Willemsen RH, Elleri D, Williams RM, Ong KK, Dunger DB. Pros and cons of GnRH treatment for early puberty in girls. Nat Rev Endocrinol 2014; 10: 352-363
Williams RM, Ward CE, Hughes IA. Premature adrenarche. Arch Dis Child 2012; 97: 250-254
Winter S, Durand A, Brauner R. Precocious and early central puberty in children with pre-existing medical conditions: a single center study. Front Pediatr 2019 Feb 14;7:35. doi: 10.3389/fped.2019.00035