Definição e importância do problema
A síndroma do intestino curto (SIC) é uma situação clínica caracterizada pela perda superior a 50% do comprimento do intestino delgado, com ou sem uma parcela do intestino grosso, do que resultam aceleração do trânsito intestinal, má absorção de macro e de micronutrientes, vitaminas, minerais e, consequentemente, má nutrição.
Esta entidade clínica constitui a causa mais frequente de insuficiência intestinal na idade pediátrica.
Os cirurgiões geralmente consideram uma pequena ressecção se o comprimento do intestino delgado residual (abaixo do ângulo de Treitz, até à válvula íleo-cecal) medir 100-150 cm, uma grande ressecção se medir entre 40-100 cm, e ressecção maciça (intestino ultracurto) se menos de 40 cm.
Até aos anos 70, a grande maioria dos recém-nascidos com SIC não sobrevivia à perda de mais de 15% da área do intestino delgado. Tem-se assistido, no entanto, a uma melhoria significativa do prognóstico desta situação que se deve essencialmente ao desenvolvimento das técnicas de nutrição parentérica, a melhores conhecimentos sobre estratégias de suporte nutricional e fisiologia intestinal e, mais recentemente, à possibilidade de realização de transplantação intestinal.
Efectivamente, hoje em dia existe possibilidade de sobrevivência com 15 cm de intestino delgado com válvula íleo-cecal, e com 20 cm sem a referida válvula havendo suporte nutricional parentérico e normalidade do funcionamento do restante intestino. De referir igualmente que a ressecção intestinal em idade pediátrica (sobretudo nos casos de prematuridade e, dum modo geral até ao 1 ano) tem melhor prognóstico do que no adulto dada a potencialidade do crescimento intestinal no primeiro caso. A este propósito importa realçar a elevada velocidade de crescimento do intestino no último trimestre da gravidez.
Factores etiológicos
Na maioria dos doentes pediátricos com SIC, a situação decorre de problemas que têm a sua génese no período perinatal. As causas mais comuns são: enterocolite necrosante (ECN), atrésia jejunal ou ileal, gastrosquise, doença de Hirschsprung total e anomalias vasculares congénitas. O Quadro 1 resume as causas principais.
Numa das Unidades de Pediatria Médica do Hospital de Dona Estefânia, no ano de 2015, foram assistidos 14 doentes com insuficiência intestinal, em regime de nutrição parentérica (NP) com duração superior a 60 dias; quanto às respectivas nosologias há a referir a seguinte distribuição: ECN → 5; atrésia intestinal → 3; gastrosquise com atrésia intestinal → 2; volvo do intestino médio com pan-necrose intestinal → 2; pseudo-obstrução intestinal crónica → 2.
QUADRO 1 – Causas de síndroma do intestino curto
| Enterocolite necrosante (ECN) Atrésia intestinal Gastrosquise Volvo do intestino delgado Pseudo-obstrução intestinal Aganglionose intestinal total Malformações vasculares congénitas Doença inflamatória intestinal * Tumores* Enterite da radiação* *Causas raras |
Fisiopatologia e manifestações clínicas
A perda de uma quantidade significativa de intestino dá origem a um conjunto de alterações fisiológicas, cujas manifestações clínicas, terapêutica e prognóstico dependem de vários factores: comprimento e segmento do intestino ressecado; presença ou ausência de válvula íleocecal; capacidade funcional e adaptativa do intestino residual, e estado funcional dos órgãos que participam no processo de digestão e absorção.
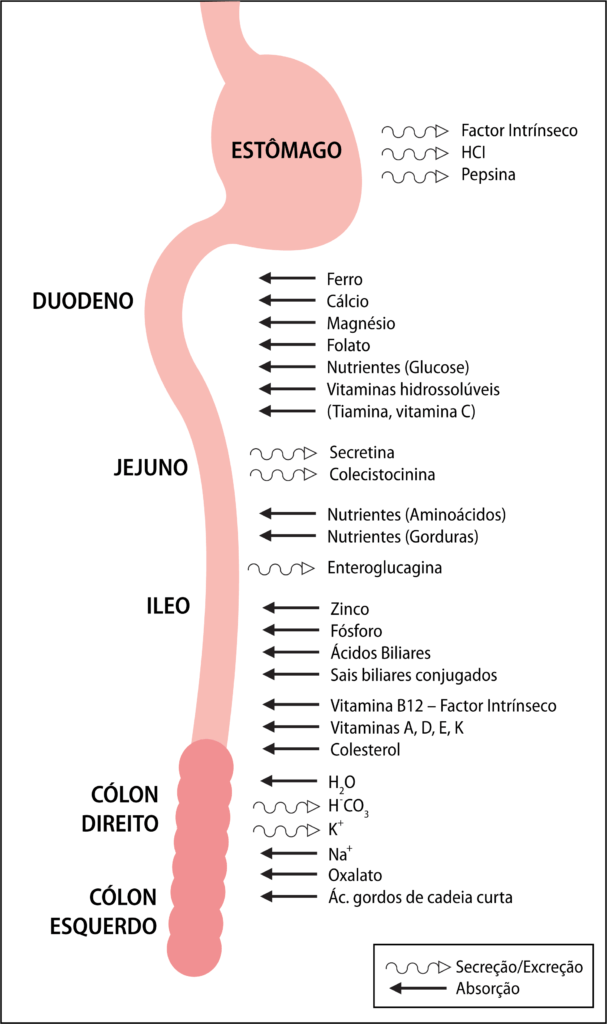
FIGURA 1. Locais de absorção e secreção/excreção no tracto gastrintestinal
O comprimento do intestino delgado no recém-nascido (RN) é 217 ± 24 cm às 27-35 semanas de idade gestacional, 304 ± 44 cm após as 35 semanas. No RN de termo é 250 a 300 cm, crescendo mais 2 a 3 metros até à idade adulta. O intestino grosso mede 40 a 60 cm no RN de termo, crescendo até 1.5 a 2 metros na idade adulta.
A perda de um segmento intestinal pode limitar a digestão ao diminuir a exposição dos nutrientes às enzimas hidrolíticas da mucosa intestinal, assim como às secreções pancreáticas e biliares.
Cada segmento intestinal tem diferentes funções de absorção:
- Duodeno: glucose, ferro, folato, cálcio, magnésio e vitaminas hidrossolúveis;
- Jejuno: lípidos e aminoácidos;
- Íleo: ácidos biliares, sais biliares conjugados, vitamina B12, factor intrínseco, vitaminas lipossolúveis, zinco, fósforo.
Deste modo, o quadro de má-absorção dependerá do segmento intestinal ressecado e da sua extensão. Será mais importante quando a ressecção envolver o jejuno, uma vez que no indivíduo saudável quase toda a digestão e absorção se completam nos primeiros 100 a 150 cm de intestino. Assim, quanto mais proximal a ressecção, maior a perda de líquidos e sódio.
O íleo, para além das suas funções de absorção únicas – vitamina B12 e sais biliares – tem outras funções, nomeadamente secreção de substâncias hormonais, e maior capacidade de adaptação designadamente para substituir o jejuno nas suas funções essenciais. Ao revés, o jejuno tem baixa capacidade de substituir as especificidades de absorção do íleo terminal.
A válvula íleo-cecal tem duas funções principais: regulação do trânsito intestinal e prevenção do refluxo bacteriano do cólon para o intestino delgado. A sua ausência diminui o tempo do trânsito intestinal (com exacerbação das perdas de líquidos e nutrientes) e aumenta o risco de crescimento bacteriano no intestino delgado. A colonização bacteriana do intestino delgado pode provocar desconjugação dos ácidos biliares alterando a formação de micelas, o que poderá agravar a esteatorreia.
A presença do cólon é importante para a absorção dos ácidos gordos de cadeia curta, água e electrólitos. Este segmento intestinal tem a capacidade de aumentar até 5 vezes a absorção de água e electrólitos; por outro lado, pode fornecer energia suplementar através da absorção de ácidos gordos de cadeia curta que são produzidos pela fermentação dos hidratos de carbono dependente das bactérias no cólon. (Figura 1)
Após ressecção intestinal extensa, o intestino restante tem a capacidade de se adaptar anatómica e funcionalmente, de modo a aumentar as suas funções de digestão e absorção. Estas alterações iniciam-se nas primeiras 24 a 48 horas após a ressecção e podem prolongar-se para além de um ano. Vários factores parecem mediar estes efeitos; o mais importante parece ser a presença de nutrição entérica que leva a um aumento de nutrientes não digeridos a nível distal, provocando um aumento na libertação de hormonas intestinais (péptido YY, substância P, CCK, glucagon-like peptide 2). As alterações de adaptação traduzem-se essencialmente em: aumento do diâmetro, espessura e comprimento intestinais, aumento da altura das vilosidades, da profundidade das criptas, e mais intensa proliferação e migração celulares para a extremidade das vilosidades.
Esta resposta adaptativa, que é mais acentuada nas crianças, verifica-se sobretudo no íleo em relação ao jejuno. Um dos marcadores de massa funcional intestinal na SIC é a citrulina, aminoácido não essencial produzido apenas nos enterócitos. A sua concentração sérica está diminuída em casos de atrofia da mucosa intestinal, podendo aumentar ao longo do processo de adaptação.
Nos doentes com SIC, a colestase e disfunção hepática são complicações frequentes que alteram a capacidade de absorção e utilização de nutrientes. A colestase nestas situações é geralmente multifactorial, sendo a atrofia da mucosa, a alimentação entérica diminuta, a perturbação do ciclo entero-hepático de sais biliares, a sépsis e o hipercrescimento bacteriano os factores predisponentes mais importantes. O tipo de NP pode ter um papel contributivo.
Tratamento
Actualmente, mais de 90% dos doentes com SIC sobrevivem, recorrendo à NP total (NPT). O tratamento é complexo e requer uma abordagem multidisciplinar em centro especializado.
Tal procedimento diz respeito essencialmente ao suporte nutricional, cujo objectivo é manter o crescimento da criança dentro dos parâmetros normais, promover a adaptação intestinal e evitar as complicações resultantes da ressecção intestinal e da referida NPT (soluções preparadas pelo serviço farmacêutico em condições de assépsia em câmara de fluxo laminar).
A primeira etapa inicia-se com a intervenção cirúrgica cujo objectivo é salvar a vida e preservar a maior extensão possível de intestino viável. Geralmente dura 1 a 3 semanas após ressecção cirúrgica, sendo caracterizada pelo início da NPT, com especial atenção ao equilíbrio hidro-electrolítico e à hipergastrinémia.
A hipergastrinémia leva a aumento da secreção ácida gástrica com inibição das enzimas pancreáticas, a agravamento da esteatorreia, assim como a possíveis ulcerações gástricas e duodenais. Tende a ser transitória (durando cerca de 6 -12 meses).
Na segunda fase procede-se ao início da nutrição entérica contínua, a qual permite melhor saturação dos transportadores e enzimas da mucosa intestinal, assim como maior eficácia da absorção, com redução progressiva da NP.
A terceira fase corresponde à adaptação à nutrição entérica e ao início da nutrição oral.
A transição de uma fase para outra é variável de doente para doente, dependendo da evolução clínica e da eficiência e qualidade do crescimento. Pode durar meses ou anos.
Sintetizam-se, a seguir, os procedimentos nas fases de nutrição parentérica /entérica e introdução de alimentos sólidos.
Fase 1: Nutrição parentérica (NP)
A nutrição parentérica é administrada por cateter venoso central e deve ser constituída por uma mistura equilibrada de glúcidos, proteínas, lípidos, electrólitos, vitaminas, minerais e oligoelementos de modo a promover o crescimento adequado. Calculadas as necessidades de fluidos em função do peso e idade, as necessidades calóricas são aumentadas progressivamente, até se atingir 100 kcal/Kg/dia.
A glicose deve ser iniciada ao ritmo de 5-7 mg/kg/min, com incrementos de 1-3 mg/kg/min até se atingir 12-14 mg/kg/min, evitando hiperglicémia e glicosúria.
Os aminoácidos são iniciados na dose de 1 g/kg/dia, e aumentados até 3 mg/kg/dia, em 2-3 dias.
Os lípidos iniciam-se na dose de 1 g/kg/dia com incrementos de 1 g/kg/dia até 3 g/kg/dia, em crianças até ao 1 ano de idade, e até 2 g/kg/dia em crianças acima de 1 ano. Não devem exceder 30-40% do valor calórico total, de modo a prevenir a hiperlipidémia.
Os sais minerais e as vitaminas devem ser fornecidos de acordo com as necessidade diárias e grupo etário.
Na fase inicial (primeiras 3 semanas) deve ter-se em especial atenção os electrólitos, em particular o sódio, sendo por vezes necessário fornecer soluções com sódio (80-100 mEq / litro da solução) dependendo das perdas pelo estoma ou do grau de diarreia. Também nesta fase, por haver hipergastrinémia, inicia-se terapêutica com ranitidina (0,75-1,5 mg/kg/dia, por via endovenosa de 6/6h ou 8/8h). Esta fase prolonga-se por cerca de 1 ano, pelo que se deve manter a terapêutica. Pode também ser administrado o omeprazol.
Durante a fase de nutrição parentérica, após estabilização clínica, é importante a vigilância laboratorial (Quadro 2).
QUADRO 2 – Esquema de monitorização de doentes submetidos a nutrição parentérica total (NPT)
* Eventualmente com maior frequência de acordo com a evolução | |||
| Parâmetros | Diário | Semanal* | Periódico* |
| Peso | X | ||
| Balanço hídrico | X | ||
| Sinais vitais | X | ||
| Glicose/acetona urinários | X | ||
| Cateter (local e função | X | ||
| Exames laboratoriais (sangue) | X | ||
| Sódio, potássio, cloro | X | ||
| Bicarbonato | X | ||
| Glicose | X | ||
| Ureia e creatinina | X | ||
| Triglicéridos | X | ||
| Cálcio, fósforo e magnésio | X | ||
| Proteínas totais | X | ||
| Albumina e pré-albumina | X | ||
| ALT | X | ||
| Fosfatase alcalina | X | ||
| Bilirrubina (total e directa) | X | ||
| Selénio | X | ||
| Cobre | X | ||
| Zinco | X | ||
| Ferro | X | ||
| Sódio urinário | X | ||
Fase 2: Nutrição entérica (NE)
A segunda fase caracteriza-se pelo início da nutrição entérica, fundamental para estimular a adaptação intestinal uma vez garantida a estabilidade hidroelectrolítica.
É fornecida por sonda nasogástrica em débito contínuo devendo ser iniciada logo que ultrapassado o íleo pós-operatório.
O tipo de alimentação entérica é controverso. O leite materno deverá ser a primeira opção. Este poderá favorecer a adaptação intestinal e deve ser encorajado, sempre que possível. Dietas semi-elementares, se toleradas, são preferíveis a dietas elementares, na medida em que está demonstrado que a absorção pelo enterócito de pequenos péptidos é superior à de aminoácidos, o que é benéfico por estimular a adaptação intestinal. Inicia-se com volume de 10-20 ml/kg/dia e concentração de 0,20 kcal/ml, que se aumentam (conforme a tolerância) até 0,67 kcal/ml, em crianças até um ano, e até 1 kcal/ml acima dessa idade. Quando atingida essa concentração, procede-se ao incremento do volume (10-20 ml/kg/dia, com intervalos de 1-3 dias) até atingir 130-200 ml/Kg/dia com 100-140 kcal/kg/dia, com diminuição isocalórica simultânea do suprimento através da NPT. Quando 20% do valor calórico for fornecido por via entérica, a NP contínua pode passar a cíclica, sendo reduzida progressivamente até 12 horas/dia.
Cerca do 5º dia após o início da nutrição entérica contínua, devem ser fornecidos 3-4 biberões/dia, com volume correspondente ao suprimento em 1 hora da nutrição entérica contínua, a qual é suspensa nesses períodos; tal permite manter as capacidades de sucção e deglutição, assim como o prazer associado à alimentação.
A progressão deste esquema de alimentação deve ser regulada pelo número de dejecções/dia, pelas perdas pelos estomas, pelo pH, identificação de substâncias redutoras fecais, pelo resíduo gástrico e pelos sinais de desidratação (Quadro 3).
QUADRO 3 – Esquema de progressão da nutrição entérica (NE)
*suspender NE durante 8 horas e retomá-la com 3/4 do ritmo anteriorAdaptado de Walker WA, et al, 2004. |
| A. Dejecções |
| 1. Se < 10 g/Kg/dia ou < 10 dejecções/dia, aumentar ritmo 10-20 ml/Kg/d 2. Se 10-20 g/Kg/dia ou 10-12 dejecções/dia, não alterar 3. Se > 20 g/Kg/dia ou > 12 dejecções/dia, reduzir ou suspender alimentação* |
| B. Perdas pelos estomas |
| 1. Se < 2 g/Kg/h, aumentar ritmo 10-20 ml/Kg/d 2. Se 2-3 g/Kg/h, não alterar 3. Se > 3 g/Kg/h, reduzir ou suspender NE* |
| C. Substâncias redutoras nas fezes |
| 1. Se < 1%, aumentar ritmo de acordo com débito das dejecções ou dos estomas 2. Se = 1%, não alterar 3. Se > 1%, reduzir ou suspender NE* |
| D. Sinais de desidratação |
| 1. Se ausentes, aumentar NE de acordo com débito das dejecções ou estomas 2. Se presentes, reduzir ou suspender NE*, e providenciar reidratação |
| E. Aspirado gástrico (2x dia) |
| 1. Se < 4x o volume da perfusão/hora, aumentar NE 2. Se > 4x o volume da perfusão/hora, reduzir ou suspender NE* |
Fase 3: Introdução de alimentos sólidos
Por volta dos 4-6 meses de idade, se o crescimento se tiver processado com regularidade, podem ser introduzidos os alimentos sólidos. Começa-se com a carne, porque é bem tolerada; os alimentos ricos em hidratos de carbono, como os cereais, vegetais e frutas devem ser evitados uma vez que causam sobrecarga osmótica no intestino delgado, aumentando as perdas, sobretudo nos doentes com ressecção ileal. Geralmente, após 2 anos, fase em que os doentes já toleram fórmulas complexas, estes alimentos podem ser fornecidos em maior quantidade. Nos doentes sem íleo, mas com cólon intacto, devem ser evitados alimentos ricos em oxalatos, tais como chá, colas, chocolate, vegetais de folha verde, aipo, morangos, para prevenir o aparecimento de cálculos renais de oxalato de cálcio. Quando o cálcio é quelado pelo excesso de lípidos que chega ao cólon, não está disponível para se conjugar com os oxalatos livres, permitindo uma absorção excessiva destes.
À medida que a NE vai substituindo a NP, deve ter-se particular atenção aos défices de vitaminas lipossolúveis – A, D, E e K – fornecendo-as sob forma hidrossolúvel: ADEK® 1 ml/dia dos 0-1 ano, 2 ml/dia dos 1-3 anos, 3-4 ml/dia após os 4 anos. Deve também proceder-se aos doseamentos séricos dos oligoelementos e da vitamina B12, tendo em atenção as manifestações clínicas dos respectivos défices para tratamento correcto e atempado. (Quadros 4 e 5)
QUADRO 4 – Monitorização laboratorial (vitaminas e oligoelementos) nos doentes com SIC, após suspensão da NPT
| Parâmetros | Frequência |
| Vitamina B12 e folato | 3/3 meses, nos primeiros 6 meses; depois, de 6/6 meses |
| Zinco, crómio, cobre, magnésio, selénio, manganês | 6/6 meses |
| Vitaminas A, E, D | 3 meses após suspensão da NPT; depois de 6/6 meses |
QUADRO 5 – Clínica e terapêutica das deficiências em micronutrientes
| Nutriente | Sinais/sintomas | Doses |
| Vitamina B12 | Astenia, anemia megaloblástica | 0,3-2 mcg/dia oral; ou 1 mg i.m. cada 3-6 meses |
| Zinco | Alopécia, lesões eczematosas, diarreia, anorexia | 0.5-2 mg/Kg/dia, oral (zinco – elemento) 300 mcg/Kg/dia, via endovenosa (ev) (zinco-elemento) |
| Ferro | Anemia | 1-2 mg/Kg/dia, oral (ferro – elemento) |
| Cálcio | Depressão, espasmos musculares, arritmia | Dose inicial: Gluconato de cálcio a 10% (9,4 mg de Ca elemento/ml ou 102 mg de gluconato de Ca/ml): 200 mg/kg de gluconato (2 ml/kg) em 10 minutos via endovenosa Dose de manutenção: 700-800 mg de gluconato de Ca/Kg/dia |
| Magnésio | Letargia, tetania | Dose inicial: MgSO4 a 50% (49,3 mg de Mg elemento/ml ou 500 mg de MgSO4/ml): 5-10 mg/Kg de Mg elemento ou 50-100 mg/Kg de MgSO4 via intra-muscular ou endovenosa em 60 minutos Dose de manutenção: 0,4-0,8 ml/Kg/dia (4 doses, via oral) |
Tratamento das complicações mais comuns
1. Proliferação bacteriana no intestino delgado
Trata-se duma complicação frequente que provoca lesão da mucosa, má-absorção e translocação bacteriana. Define-se pela presença no intestino delgado de bactérias do cólon em número igual ou superior a 105/ml. Clinicamente manifesta-se por anorexia, vómitos, distensão abdominal, hematoquesia, dificuldade em tolerar a NE e perda de peso. Por vezes pode ocorrer um quadro neurológico caracterizado por alteração do estado de consciência (incluindo coma), hiperventilação, acidose metabólica com hiato aniónico elevado, resultante da acumulação de ácido D-láctico, (substância não metabolizável na espécie humana), resultante da fermentação bacteriana dos hidratos de carbono da alimentação. O diagnóstico é sugerido pela determinação sérica do D-lactato, estando o lactato sérico normal.
Deve suspeitar-se de proliferação bacteriana no intestino delgado em doentes sem válvula íleocecal, e ou com dismotilidade, ou com segmentos intestinais dilatados. O diagnóstico é difícil, podendo ser confirmado por cultura de líquido duodenal, coprocultura e pelo teste do hidrogénio expirado.
Dos vários esquemas terapêuticos pode utilizar-se por via oral: metronidazol (15 mg/kg/dia, 8/8h) isolado ou associado ao cotrimoxazol (40-50 mg/kg/dia, 12/12h); ou gentamicina (5 mg/kg/ dia), durante 5 dias; deve, entretanto, reduzir-se a NE, nomeadamente o suprimento em hidratos de carbono, e suspender-se os antiácidos.
Esta situação pode ser prevenida, nos doentes de risco, administrando nos primeiros 5 dias de cada mês um dos antibióticos acima referidos, alternando-os para evitar resistências bacterianas. Em casos de dilatação intestinal acentuada pode ser necessário proceder a intervenção cirúrgica – ressecção, modelagem ou alongamento intestinal – para resolução desta complicação.
2. Doença hepática associada à insuficiência intestinal
A doença hepática associada à insuficiência intestinal pode compreender colestase, esteatose, cirrose, hipertensão portal e insuficiência hepática. Trata-se duma situação frequente nos doentes com SIC que, juntamente com a sépsis, constitui uma das principais causas de morte.
Admite-se que a causa da doença hepática é multifactorial, sendo determinantes a ausência de NE, a presença de endotoxinas bacterianas e a hepatotoxicidade directa associada aos componentes da NPT. Manifesta-se por icterícia e hepatomegália, associadas a elevação das transaminases, fosfatase alcalina e bilirrubina conjugada. A melhor actuação consiste na introdução progressiva de NE, se possível; em geral a colestase resolve-se com a suspensão da NPT. Deve prevenir-se a proliferação bacteriana intestinal e a sépsis, garantir uma mistura adequada de glicose, proteínas, lípidos e oligoelementos na NPT e realizar esta última de modo cíclico. Como terapêutica dirigida utiliza-se o ácido ursodesoxicólico (10-40 mg/kg/dia, 12/12h, por via oral).
O interesse no uso de emulsões lipídicas de NP ricas em óleo de peixe é crescente, logo, em ácidos gordos w-3 com potencial de prevenir ou reverter a colestase secundária à NP em recém-nascidos. Recentemente foi comercializada uma nova formulação, usada entre nós, o SMOFlipid®, composto por 30% de óleo de soja (predomínio de TCL ω-6), 30% TCM, 25% de azeite, contendo quantidade importante de ácidos gordos monoinsaturados e α-tocoferol, e ainda 15% de óleo de peixe (TCL ω-3).
A lama/ litíase biliar é frequente nos casos com ressecção do íleo terminal; em tal circunstância, a diminuição da concentração de sais biliares torna a bilis litogénica.
3. Sépsis
É uma complicação comum que põe em risco a vida dos doentes com SIC. São considerados factores etiológicos importantes a contaminação externa dos cateteres e a migração bacteriana intestinal. Os agentes etiológicos são geralmente Staphylococcus aureus e as enterobactérias. Por vezes são isolados fungos como Candida albicans, que devem ser sempre considerados como hipótese etiológica em doentes que terminaram recentemente antibioticoterapia. Qualquer doente com SIC, com cateter central, em que se inicie febre, letargia ou outros sinais de infecção, deve ser considerado como tendo sépsis, até prova em contrário. Deve proceder-se a culturas de sangue colhido de dois locais simultaneamente (cateter central e veia periférica) e iniciar antibioticoterapia de largo espectro, mantendo-a até conhecimento do resultado das hemoculturas. Se a infecção for fúngica está indicada anfotericina B lipossómica, removendo-se o cateter. Nas infecções bacterianas não há, em princípio, necessidade de remover o cateter, a não ser em situações de recorrência de sépsis, choque séptico ou persistência de hemocultura positiva.
Os probióticos (espécies Gram positivas anaeróbias) com a potencialidade de suprimirem a adesão e translocação de bactérias Gram negativas susceptíveis de originarem septicémia, terão um papel também na SIC; contudo, relativamente à segurança na sua utilização, existe carência de provas científicas inequívocas e conclusivas.
Em determinados centros têm sido utilizados nos cateteres centrais dispositivos/locks de antissépticos à base de taurolidina ou etanol; de acordo com os resultados obtidos foi demonstrada eficácia avaliada pela redução em número de episódios de sépsis.
4. Défice em Vitamina B12 e outras vitaminas lipossolúveis
A consequência desta do défice em vitamina B12 é o surgimento de anemia macrocítica e neuropatia. Este quadro clínico secundário está em geral associado a ressecção de íleo terminal.
5. Hiperoxalúria/cálculos renais
Esta complicação resulta da má absorção de lípidos, ligando-se o cálcio preferencialmente aos ácidos gordos no lume do cólon, deixando os oxalatos livres para absorção e excreção renal.
6. Linfo-histiocitose hemofagocítica
Esta complicação, mais rara, está associada a NP prolongada. Admite-se que seja secundária à activação de macrócitos por “excesso de lípidos”, estando na sua base um processo imune/infeccioso subjacente.
Perspectivas terapêuticas
Factores tróficos: os factores tróficos, promovendo o crescimento da mucosa, maior altura das vilosidades, diminuição da motilidade intestinal e aumento da superfície de absorção (nomeadamente glutamina combinada com hormona de crescimento, ou o factor enteroendócrino trófico teduglutide/ GLP2- glucagon-like peptide 2), associados à NE, evidenciam efeitos positivos na adaptação intestinal, reduzindo a necessidade de nutrição parentérica.
Em fase de investigação, e tendo em conta efeitos acessórios como polipose e hiperplasia gástrica, a utilização dos referidos fármacos e, nomeadamente, do teduglutide (de que há já experiência no Hospital de Dona Estefânia), deverá contudo ser cuidadosa.
Cirurgia: existem várias “técnicas cirúrgicas de aumento” intestinal. Em casos de dilatação de um segmento intestinal (por adaptação ou obstrução crónica) pode ser útil um procedimento cirúrgico que: – resolve a dilatação (a qual comporta risco de estase e sobrecrescimento bacteriano); e – permite um aumento da superfície de absorção.
No chamado LILT (longitudinal intestinal lengthening and tailoring) o intestino delgado dilatado é dividido em dois tubos e suturado justaposto de maneira isoperistáltica.
No chamado STEP (serial transverse enteroplasty) procede-se a secção transversal em direcções opostas, criando um trajecto tipo “zigzag” que aumenta a superfície de absorção.
Transplantação intestinal: a transplantação intestinal tornou-se uma opção terapêutica para os doentes com insuficiência intestinal permanente em que o crescimento fica na dependência da NPT. A decisão de indicar o transplante deve ser extremamente bem ponderada, após esgotar todas as opções terapêuticas, nomeadamente a NPT, o uso de factores tróficos, e as terapêuticas cirúrgicas alternativas, devido aos riscos e à qualidade de vida associada ao transplante intestinal. A Associação Americana de Transplantação considera como indicações para transplantação intestinal na criança: doença hepática irreversível associada à NPT (hiperbilirrubinémia com bilirrubina conjugada superior a 3 mg/dl persistindo para além de 3-4 meses acompanhada de sinais de hipertensão portal tais como esplenomegália, trombocitopénia ou circulação venosa superficial colateral marcada), sépsis recorrente e falta de acessos venosos centrais.
Outra indicação será ainda doença com perda hidro-electrolítica incontrolável, causando desidratação grave, que é frequente.
Na situação de doença hepática irreversível, poderá estar indicada a transplantação hepática e intestinal combinada.
No caso de envolvimento multiorgânico (por ex. pseudo-obstrução intestinal crónica) está indicada a transplantação multivisceral.
Prognóstico
O prognóstico após ressecção intestinal depende da respectiva extensão, da função e capacidade adaptativa do intestino residual, das complicações, nomeadamente da doença hepática associada a NPT, da proliferação bacteriana intestinal, e do número de episódios de sépsis.
Considera-se de bom prognóstico a situação em que se verifica crescimento adequado, não dependente da NPT. Em geral, o melhor prognóstico verifica-se em casos de SIC com 40-80 cm de intestino delgado residual e com válvula íleocecal intacta; nestes, a independência da NPT durante 1 ano é atingida em 80% dos casos; os doentes com menos de 40 cm de intestino residual e sem válvula íleo-cecal permanecem dependentes da NPT para além dos 8 anos. No entanto, há casos descritos de SIC com menos de 15 cm de intestino residual que se tornaram independentes da NPT. Geralmente as doenças graves da motilidade (como por ex. doença de Hirschprung extensa, e enteropatias congénitas) têm maior risco dependência de NP.
O crescimento e o desenvolvimento dos doentes com SIC são adequados na generalidade, embora na sua grande maioria se verifique menor estatura comparativamente à população geral.
De referir ainda: maior número de dejecções diárias (com válvula íleo-cecal, cerca de 2 dejecções/dia; sem vávula, 2-10 dejecções/dia). São comuns a dificuldade de digestão e absorção de hidratos de carbono, bem como a intolerância ao leite e a alimentos condimentados.
Existe risco aumentado de colelitíase, sobretudo nos casos submetidos a ressecção ileal importante. A hiperoxalúria e os cálculos renais são mais frequentes nos adultos.
Em relação ao transplante intestinal, nos últimos 10 anos, em 1351 crianças transplantadas, a sobrevivência do enxerto/doente, aos 5 e 10 anos, foi respectivamente de cerca de 50% e 30%. Estes números obrigam à adopção de todas as estratégias médicas e cirúrgicas mais conservadoras para evitar o transplante até que novos protocolos permitam melhor prognóstico. O prognóstico do transplante é largamente condicionado pelo elevadíssimo risco de rejeição aguda, rejeição crónica e infecções víricas letais.
Em suma, os importantes avanços conseguidos com a terapêutica nutricional, a terapêutica médico-cirúrgica e o transplante intestinal contribuíram decisivamente para melhorar as perspectivas dos doentes com síndroma do intestino curto.
O dia dos tolos de abril está chegando. Aperte seus amigos abrindo um tela de atualização falsa sem fim no seu computador. Sente-se e assista a sua reação.
BIBLIOGRAFIA
Abad-Siden A, Sutphen I. Nutritional management of pediatric short bowel syndrome. Pratical Gastroenterol 2003; 27: 28-48
Brown SK, Davies N, Smyth E. Intestinal failure: the evolving demographic and patient outcomes on home parenteral nutrition. Acta Paediatrica 2018; 107: 2207-2211
Cohran V. Intestinal failure: the long and the short of the matter. J Pediatr 2015; 167: 6 – 8
D’Antiga L, Goulet O. Intestinal failure in children: the European view. J Pediatr Gastroenterol Nutr 2013;56:118- 126
Dibaise JK, Young RJ, Vanderhoof JA, Intestinal rehabilitation and the short bowel syndrome: (Part 2). Am J Gastroenterol 2004; 99: 1823-1832
Fisbein TM, Matsumoto CS. Intestinal replacement therapy: Timing and indications for referral of patients to an intestinal rehabilitation and transplant program. Gastroenterology 2006; 130: 5147-5151
Goulet O, Ruemmele F, Lacaille F, Colomb V. Irreversible intestinal failure. J Pediatr Gastroenterol Nutr 2004; 38: 250-269
Goulet O, Ruemmele F. Causes and management of intestinal failure in children. Gastroenterology 2006;130(2 Suppl 1):S16-28
Hwang ST, Shulman RJ, Update on management and treatment of short gut. Clin Perinatol 2002; 29: 181-194
Kauffman SS, Atkinson JB, Bianchi A, et al. Indications for pediatric intestinal transplantation: A position paper of the American Society of Transplantation. Pediatr Transplant 2001; 5: 80-87
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Norsa L, Nicastro E, Di Giorgio A, et al. Prevention and treatment of intestinal failure-associated liver disease in children. Nutrients 2018 Jun; 10(6): 664. doi: 10.3390/nu10060664
Peterson J, Kerner JA, Jr. New advances in the management of children with intestinal failure. J Parenter Enteral Nutr 2012;36(1 Suppl):36S-42S
Protheroe S. Long term parenteral nutrition. Paediatr Child Health 2015:399-405
Sigalet DL. Short bowel syndrome in infants and children: An overview. Semin Pediatr Surg 2001; 10: 49-55
Soondrum K, Hinds R. Management of intestinal failure. Indian J Pediatr 2006; 73: 913 – 918
Vanderhoof JA, Young RJ. Enteral nutrition in short bowel syndrome, Semin Pediatr Surg 2001; 10: 65-71
Vanderhoof JA, Young RJ, Thompson JS. New and emerging therapies for short bowel syndrome in children. Paediatr Drugs 2003; 5: 525-531
Walker WA, Goulet O, Kleinman RE, et al (eds). Pediatric Gastrointestinal Disease. Hamilton, Ontario: Decker, 2004
Wyllie R, Hayms JS, Marsha K (eds). Pediatric Gastrointestinal and Liver disease. Philadelphia: Elsevier, 2016