Introdução
Como foi referido no primeiro capítulo da Parte sobre Nutrição, os micronutrientes compreendem 13 vitaminas e 17 minerais essenciais. Nas sociedades industrializadas, pressupondo regime alimentar equilibrado, os quadros clínicos das respectivas carências por insuficiência de suprimento são raros actualmente, surgindo contudo em certas circunstâncias de risco. Entre os factores de risco com maior relevância, destacam-se as síndromas de malabsorção e o aumento das necessidades nutricionais no contexto de certas doenças crónicas.
Quanto aos minerais, no referido capítulo (Quadro 10) são descritos sucintamente os sinais e sintomas de diversas carências, em paralelo com os quadros clínicos de excesso.
Neste capítulo é dada ênfase às carências de vitamina D, A e C.
1. CARÊNCIA DE VITAMINA D e RAQUITISMO
Definição e importância do problema
As síndromas raquíticas (ou raquitismos em geral) são situações clínicas caracterizadas por falência do ritmo normal de mineralização da matriz óssea devida a inadequadas concentrações de iões cálcio e de fosfato mono-hidrogeniónico nos líquidos do organismo em crescimento, com consequente acumulação de osteóide não mineralizado. Portanto, o cálcio e ou o fosfato podem estar deficitários nos raquitismos. O desequilíbrio fosfo-cálcico tem repercussões multissistémicas: sistema ósseo (de modo especial ao nível da zona metafisária de crescimento activo), muscular, pulmonar, etc..
Se tal perturbação surgir num organismo após se completar o crescimento linear (idade adulta), a síndroma denominar-se-á osteomalácia (com sintomatologia mais discreta).
A carência de vitamina D continua a ser a causa mais prevalente de raquitismo em todo o mundo, mesmo nos países industrializados (raquitismo carencial comum/RCC). Uma vez que a vitamina D pode ser obtida, quer de fontes exógenas nutricionais, quer através da síntese cutânea por acção directa (sem interposição de roupa ou vidraça) da luz solar através da radiação ultravioleta B e A, conclui-se que a carência em vitamina D na infância pode ser devida a combinação de défice de suprimento e de insuficiente síntese cutânea. De salientar o baixo teor em vitamina D no leite materno, implicando a necessidade de os bebés amamentados receberem suplemento de vitamina D ou, se possível, de exposição solar.
Etiopatogénese
Embora a vitamina D activa se encontre pouco difundida na natureza, os seus precursores ou pró-vitaminas (esteróis) derivados do colesterol, encontram-se largamente distribuídos, quer nas plantas, quer nos animais.
A provitamina D das plantas (ergosterol) é susceptível de ser transformada em vitamina D2 ou ergocalciferol.
A provitamina D animal (7-de-hidro-colesterol), produzida na mucosa intestinal, dirige-se, depois, para a camada malpighiana da pele onde adquire actividade vitamínica (vitamina D3 ou colecalciferol) quando exposta aos raios ultravioletas (290-320 mm) – síntese cutânea.
A fotossíntese epidérmica pode estar comprometida de vários modos:
- inefectividade da acção dos raios solares na época fria em que a criança usa mais roupa, e em latitudes do globo > 50º designadamente no inverno e primavera;
- menor exposição solar face ao receio com o cancro cutâneo;
- pigmentação cutânea em crianças de pele negra; 4) poluição e efeito de filtração dos raios UVB < 334 nm pelo vidro das janelas.
A carência de suprimento oral em vitamina D poderá decorrer de certas práticas de raiz cultural como dietas vegetarianas, ingestão de leite de soja ou leite de “arroz”, por exemplo.
Se o ergocalciferol ou o colecalciferol forem veiculados pelos alimentos, a sua absorção é rápida, verificando-se sobretudo ao nível do duodeno-jejuno e por via linfática (Figura 1).
FIGURA 1. Metabolismo da vitamina D (Cerca de 80% da vitamina D no organismo deriva da exposição solar e 20% da alimentação)
A seguir à conversão fotoquímica na pele ou à absorção intestinal, a vitamina D2 ou a vitamina D3 são transportadas em direcção ao fígado com o auxílio duma globulina alfa-2; no fígado sofrem uma 25-hidroxilação ou transformação nos respectivos derivados 25-hidroxilados por intermédio da 25-hidroxilase, enzima do sistema microssómico (família das oxidases do citocrómio P450).
A actividade da 25-hidroxilase específica é regulada por um mecanismo de retroacção representado pela taxa sérica dos compostos 25-hidroxilados e do cálcio.
Os compostos 25-hidroxilados circulam também ligados a uma globulina alfa-2, sendo a sua semivida de 19,6 dias (a semivida do ergo ou cole-calciferol é apenas de 12 a 25 horas).
A acção dos compostos 25-hidroxilados (25-HC) consiste essencialmente no transporte de cálcio ao nível do intestino, na mobilização do cálcio ósseo e na reabsorção tubular proximal de sódio e fosfato.
Ao nível do rim gera-se, depois, a forma metabolicamente activa, o 1-25 hidroxicolecalciferol (ou 1-25 hidroxi-ergocalciferol) (1-25-HC ou calcitriol) a partir do 25-HC (ou calcidiol) que sofre nova hidroxilação em posição 1, com o concurso duma enzima que faz parte dum sistema mitocondrial das células tubulares: a 1-alfa-hidroxilase.
A actividade de 1-alfa hidroxilase é regulada, quer pela carência do organismo em vitamina D, quer pela taxa de cálcio circulante, directamente ou por intermédio da paratormona e calcitonina; depende, ainda, da fosforémia e do teor em fosfatos do tecido renal.
Em caso de normocalcémia ou hipercalcémia, poderá originar-se um composto hidroxilado em 24-25 que não tem qualquer função específica, pois tende a degradar-se.
A acção dos compostos di-hidroxilados (1-25 HC) traduz-se no transporte de cálcio e fósforo ao nível do intestino (quantitativamente a sua acção quanto a este aspecto é cerca de 1 vez e meia superior aos compostos 25-HC) e na mobilização do cálcio ósseo (acção cerca de 100 vezes superior à dos 25 HC). Quanto à reabsorção tubular de sódio, fosfato e cálcio, o seu efeito pode considerar-se, ao contrário, mínimo em relação aos 25-HC.
Quer a vitamina D3, quer os seus derivados 25-hidroxilados, são susceptíveis de se armazenarem ou constituirem em depósitos ao nível dos tecidos adiposo e muscular. Existe, no entanto, uma diferença de comportamento entre os dois: enquanto a vitamina D3 é mais lipossolúvel e se concentra rapidamente no tecido adiposo e por muito tempo – cerca de 80% do seu depósito inicial pode ser encontrado ao cabo de 3 meses – os 25 HC são armazenados em menor quantidade pela sua menor lipossolubilidade, constituindo as formas circulantes por excelência (Figura 1).
A vitamina D não actua directamente sobre as células intestinais ou ósseas; com efeito os seus metabolitos hidroxilados induzem a síntese duma proteína necessária ao transporte activo do cálcio (a CaBP-Calcium-Binding-Protein) e à ligação a receptores.
Demonstrou-se que existem hormonas reguladoras dos fosfatos – as fosfatoninas – de que a principal é o chamado factor de crescimento 23 do fibroblasto (FGF23). Esta fosfatonina diminui a reabsorção tubular de fosfato e a síntese de 1-25-HC, interferindo nos co-transportadores de sódio-fosfato no rim. Em situações de normalidade o FGF23 é degradado em compostos inactivos, não produzindo efeitos adversos. Tal factor é produzido no esqueleto(particularmente osteoblastos e osteócitos), o que tipifica fisiologicamente o chamado eixo osso-rim, regulando a homeostase do fosfato.
De salientar que todos os tecidos do organismo humano (incluindo o tecido ósseo, alvo mais reconhecido desde há muito) contêm um receptor para a vitamina D. Nesta perspectiva, diversos estudos sugerem efeitos da vitamina D nos sistemas imune, cardiovascular e pâncreas endócrino, tendo-se demonstrado papel de protecção contra o cancro, doenças cardiovasculares, infecções, e doenças autoimunes como esclerose múltipla e diabetes mellitus tipo 1. Muito recentemente, em 2019, foram publicados resultados de estudos de meta-análise questionando o papel protector contra cancro e doenças cardiovasculares.
Classificação dos raquitismos
Se nos reportarmos ao ciclo da vitamina D será relativamente fácil deduzir uma classificação etiopatogénica das síndromas raquíticas. Assim, podemos estabelecer dois grandes grupos. (Quadro 1).
- Grupo calciopénico que decorre da interferência num ou vários «passos» do ciclo metabólico da vitamina D por parte de determinados factores ou circunstâncias, o que condicionará uma diminuição da concentração dos metabólitos (25-HC e 1-25HC); o perfil bioquímico característico deste grupo é constituído pela deficiência em cálcio ou interrupção no suprimento ou utilização da vitamina D.
- Grupo fosfopénico devido a suprimento inadequado de fosfato na dieta ou a perda tubular renal excessiva. As maioria das situações que integram o subgrupo A corresponde ao chamado raquitismo carencial comum, vitamino-sensível ou vitaminoprivo; como se referiu, é o que surge com maior frequência, é evitável com profilaxia correcta e é curável com doses usuais de vitamina D.
As situações que integram os subgrupos B, C e D surgem com profilaxia correcta e não são curáveis com doses terapêuticas usuais de vitamina D (na designação antiga classificados como vitaminorresistentes).
Na Parte XX (Endocrinologia) são abordadas noções sucintas sobre alguns raquitismos carenciais não comuns.
Neste capítulo é dada ênfase ao raquitismo carencial comum (RCC).
QUADRO 1 – Carência e alterações do metabolismo da vitamina D – Raquitismos
Abreviaturas: CLCN5: Chloride channel, voltage-sensitive 5; DMP1: Dentin matrix protein; ENPP1: Ectonucleotide pyrophosphatase/phosphodiesterase; FGF23: Fibroblast growth factor 23; FGFR1: Fibroblast growth factor receptor; GNAS1: Guanine nucleotide-binding protein, a-stimulating activity polypeptide 1; PHEX: Phosphate-regulating gene with homologies to endopeptidases on the X chromosome; PTH1R: Parathyroid hormone 1 receptor; OCRL1: Oculocerebrorenal syndrome of Lowe; NPT2: Type II sodium/phosphate cotransporter |
| A – Raquitismo Calciopénico |
i. Défice de vitamina D / Carencial comum ii. Alterações do metabolismo da vitamina D iii. Resistência periférica à vitamina D iv. Ingestão insuficiente de cálcio |
| B – Raquitismo fosfopénico |
i. Ingestão insuficiente de fosfato ii. Perda renal de fosfato associada a aumento de FGF23 iii. Perda renal de fosfato associada a hipercalciúria |
Manifestações clínicas, radiológicas e laboratoriais do RCC
O RCC constitui o exemplo paradigmático de carência extrema de vitamina D a qual se estabelece de modo progressivo antes de os sinais clínicos se tornarem evidentes.
As manifestações do RCC podem assim ser sistematizadas, salientando-se que a deficiência de vitamina D pode ser assintomática:
a) Sinais clínicos ósseos
Os sinais clínicos característicos, dependendo da idade de apresentação, decorrem de alterações ósseas indolores, simétricas, localizando- se na zona de crescimento activo com evolução (em geral com início desde os primeiros meses, progredindo no primeiro ano de vida no sentido crânio-caudal): cranio-tabes (consistência mole do crânio, evidente sobretudo ao nível da região parieto- occipital, dando a sensação de palpação de bola de ping-pongue – após compressão, o osso volta à posição inicial), atraso de encerramento das suturas cranianas cujos bordos são moles, deformações diversas do crânio relacionadas com a diminuição de consistência da calote craniana susceptível de deformação postural, atraso da erupção dentária,tumefacção esferóide ao nível das articulações condrocostais por hipertrofia das respectivas cartilagens (por acumulação de osteóide) cujo conjunto ao longo do tórax aparenta um rosário (é o chamado rosário costal); deformação do tórax, em sino, com alargamento da base e evidência do chamado sulco de Harrison; alargamento das epífises dos ossos longos especialmente notória ao nível dos punhos (chamados “de boneca”) e regiões tíbio- társicas; deformações dos membros inferiores (tíbias em “parêntesis”, genu varum, etc.); ao nível da coluna pode verificar-se cifose com formação de saliência lombar típica nas formas exuberantes – saliência ou gibosidade do raquis, donde o nome de raquitismo).
De referir a relação que existe entre a velocidade de crescimento e o aparecimento do quadro clínico; ou seja, a probabilidade de aparecimento do quadro clínico é tanto maior quanto maior a velocidade de crescimento (Figuras 2, 3 e 4). Nos lactentes poderão surgir sinais atípicos como cardiomiopatia e, nos adolescentes, dores e fraqueza musculares.
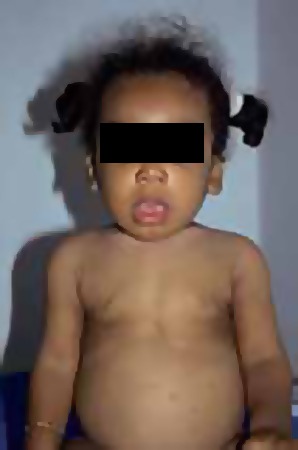
FIGURA 2 – Criança com raquitismo: deformação torácica (NIHDE)
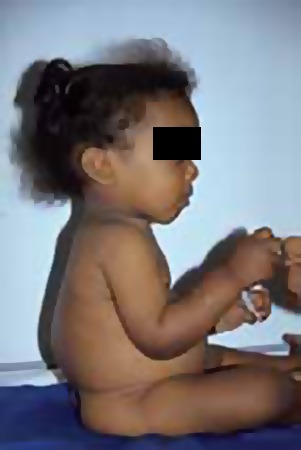
FIGURA 3 – Raquitismo: cifose dorso-lombar e deformação da coluna com gibosidade (NIHDE)
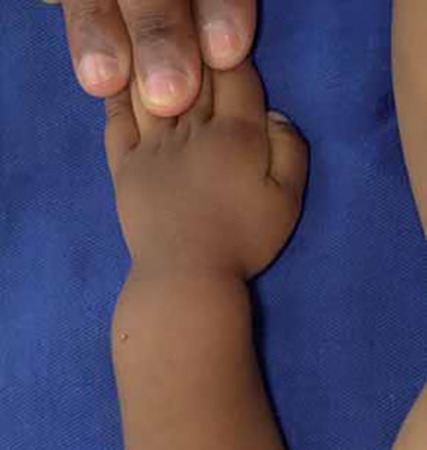
FIGURA 4 – Raquitismo: “ Punho de boneca”/alargamento dos punhos (NIHDE)
b) Sinais clínicos músculo-ligamentosos
Salienta-se a hiperlaxidão dos ligamentos e a hipotonia muscular as quais condicionam o atraso do desenvolvimento motor (início do sentar-se e da marcha), designadamente.
c) Sinais radiológicos
As lesões ósseas com tradução radiológica têm, sobretudo, uma localização metafisária: a metáfise dos osssos longos está alargada, côncava, “em taça”, com aspecto franjado e limite irregular; as diáfises evidenciam diminuição da densidade óssea com trabeculação nítida e aspecto de duplo contorno, por vezes sinais de fracturas e de calos de fracturas; espaço epífise- metáfise alargado podendo haver atraso de aparecimento dos núcleos de osssificação; ao nível do tórax, em complemento dos sinais clínicos já referidos, torna- se evidente o alargamento das articulações condro- costais em “raquete” (Figuras 5 e 6).
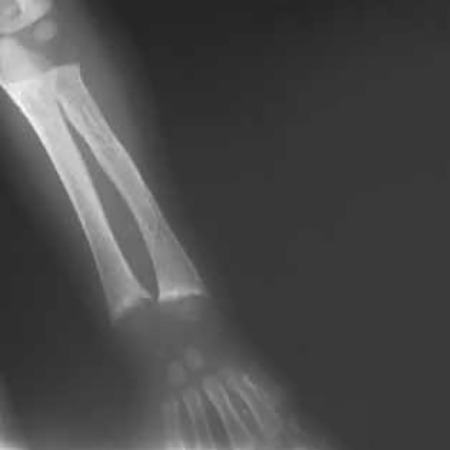
FIGURA 5 – Sinal radiológico de raquitismo: metáfise do rádio e cúbito ao nível de punho, alargamento em taça, de contorno irregular (NIHDE)
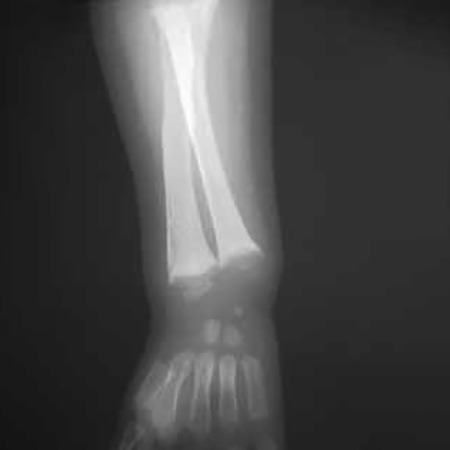
FIGURA 6 – Sinal radiológico de raquitismo: esboço de aparecimento da linha de calcificação preparatória ao nível das metáfises alargadas (rádio e cúbito) como resposta do tratamento (maior densidade óssea relativamente à figura 5) (NIHDE)
Pode haver sinais de infecção parenquimatosa (pneumonia, bronquite) face à susceptibilidade para as infecções, enquadrando a situação classicamente conhecida por “pulmão raquítico”. (ver capítulo sobre Pneumonia).
Os primeiros sinais aparecem em geral entre os 4 e 6 meses; no caso de não tratamento, a forma exuberante é notória por volta do final do 1º ano de vida e durante o 2º ano.
d) Sinais laboratoriais
Os valores séricos do cálcio, fósforo e fosfatase alcalina podem variar em função da fisiopatologio, já exposta: fase precoce com hipocalcémia e fósforo normal; fase intermédia resultante da estimulação da PTH, com normocalcémia e fósforo diminuído; fase avançada com cálcio e fósforo baixos por insuficiente mobilização a partir do osso. A fosfatase alcalina está aumentada em todos os tipos de raquitismo, e mais intensamente nas formas calciopénicas. A PTH está sempre aumentada nas formas calciopénicas e muitas vezes normal nas formas fosfopénicas.
Determinando o valor decálcio x fósforo séricos em mg/dL para o diagnóstico, classicamente considera- se: 30 (raquitismo certo); 30-40 (raquitismo possível); > 40 (raquitismo impossível ou em via de cura).
Sendo possível o doseamento dos metabólitos da vitamina D, considera-se que o valor do metabólito mono – hidroxilado (25-HC) ou 25-hidroxivitamina D <15 ng/mL corresponde a carência ou deficiência de vitamina D. Valores entre 15-30 ng/mL correspondem a insuficiência, e >30 ng/mL a suficiência.
Relacionando os sinais clínicos com os laboratoriais e radiológicos, chama- se a atenção para uma forma clínica (fase precoce) de carência de vitamina D ocorrendo habitualmente no lactente, sobretudo antes dos 6 meses com o seguinte quadro: sintomas de hipocalcémia- cálcio ionizado inferior a 3-4 mg/dl ou total inferior a 7-7.5 mg/dl (irritabilidade neuromuscular incluindo convulsões, tetania, espasmo carpo pedal, laringospasmo) com ou sem evidência radiológica de raquitismo. É a chamada “tetania” do lactente por carência de vitamina D, hoje rara no nosso país.
A hipocalcémia susceptível de originar tetania (não manifesta ou latente) pode ser identificada através da pesquisa dos clássicos sinais de Chvostek, Trousseau e de Erb.
A hipocalcémia sintomática é mais frequente nas idades extremas (1ª infância e adolescência), a que correspondem períodos de crescimento rápido.
Esta situação é hoje rara.
Tratando-se duma síndroma com repercussão sistémica, nas formas de deficiência extrema, também já raras, é habitual o quadro de anemia hipocrómica, traduzindo carência concomitante em ferro. No entanto, poderá igualmente surgir anemia megaloblástica por carência de vitamina B12 ou ácido fólico e anemia pluricarencial.
Uma forma clássica, rara, é a anemia de Von-Jaksch-Luzet ou anemia pseudo leucémica cursando com hiperleucocitose e hepatosplenomegália, relacionável com eritropoiese compensadora ectópica.
São citadas situações raras na actualidade por razões didácticas e históricas.
Diagnóstico diferencial
A anamnese é fundamental para a destrinça com outras situações acompanhadas de alterações esqueléticas.
O craniotabes não é patognomónico do raquitismo, podendo surgir nalgumas displasias ósseas.
As deformações do tórax poderão enquadrar-se em situações acompanhadas de anomalias congénitas.
O rosário costal pode surgir igualmente no escorbuto (défice de vitamina C), hoje praticamente uma raridade, sendo acompanhado doutras carências; no entanto, nesta última situação o rosário costal resulta de luxação condrocostal e os sinais radiológicos esqueléticos são diferentes: é típica a hemorragia subperióstica, e as alterações esqueléticas são acompanhadas de dor. Podem também surgir hematúria e hemorragias petequiais.
Uma história familiar de raquitismo poderá sugerir forma hereditária, sendo o raquitismo hipofosfatémico ligado ao X o mais frequente. Antecedentes familiares de consanguinidade poderão apontar para raquitismo vitamina D dependente do tipo II, raro.
Prevenção
Este tópico integra duas possíveis estratégias: exposição solar ou administração de vitamina D
Exposição solar
O RCC (deficiência primária de vitamina D) é susceptível de prevenção através da exposição directa à luz solar (fracção leve da radiação ultravioleta B / UVB) ou da administração de vitamina D. Sobre esta questão, a comunidade científica tem debatido sobre o balanço entre risco de cancro da pele pela exposição solar, e o benefício da exposição.
De acordo com os resultados de diversos estudos, considera-se eficaz e segura a prevenção através da exposição directa diária (~30 minutos) da face e membros superiores nas latitudes da Europa do Sul. Com regra geral, é estabelecido que, quanto maior o afastamento do equador, maior o tempo necessário de exposição, e menor o risco.
No que respeita ao risco da exposição solar para a retina, os especialistas aconselham, já em lactentes, designadamente em tempo de praia, para além doutras medidas, o uso de óculos de sol com protecção contra UVB:
Administração de vitamina D
Sobre esta questão, não totalmente consensual, salientando que têm sido produzidas recomendações variando ao longo do tempo em função de estudos científicos), e tendo em conta a diversidade do panorama da saúde, dos hábitos culturais e do ambiente em diversas latitudes do globo, importa descrever certas noções essenciais a aplicar em grávidas e mulheres lactantes, e em lactentes, crianças e adolescentes considerados, de resto, saudáveis:
- a grávida e a lactante (mulher que amamenta) devem ingerir 1.000 UI de vitamina D diariamente. (Segundo as normas NICE: 400 UI/dia -ver bibliografia- Wood Cl, et al, 2016).
- em lactentes alimentados com leite materno na maioria dos casos de raquitismo carencial comum, este pode ser prevenido através da administração diária de 400 UI de vitamina D. (Segundo as normas NICE, 2016: 0-6 meses à 340 UI/dia; 6 meses -5 anos à 280 UI/dia).
- os lactentes e crianças que não recebam teor adequado de vitamina D através das fórmulas preparadas ou da dieta (ou alimentados com fórmula suplementada se ingerirem < 500 mL/dia), e que não tenham exposição à luz solar directa considerada suficiente, também devem receber 400 U de vitamina D diariamente.
- embora não haja consenso no âmbito dos vários organismos internacionais, e excluindo situações clínicas especiais, é recomendada a dose diária de 400 U de vitamina D durante toda a vida, devendo entrar em consideração com o teor em vitamina D no leite e no regime alimentar em geral, e igualmente com a exposição regular e directa ao sol.
Notas importantes:
- De acordo com diversos estudos, o suplemento de vitamina D entre 200 e 400 UI por dia garante a manutenção do nível sérico de 25-hidroxi-vitamina D > 25 nmol/ L (10 ng/ml) compatível com ausência de deficiência de vitamina D. Idealmente o referido nível sérico deverá ser igual ou superior a 30ng/ml.
- Dum modo geral as fórmulas para lactentes contêm cerca de 400 UI/Litro, sendo de salientar que a concentração da vitamina D no leite humano é muito mais baixa, embora mais biodisponível (cerca de 25 UI /Litro) .
Tratamento
Na criança ou adolescente, para o tratamento do RCC (deficiência de vitamina D) estão indicadas doses orais diárias de 50-150 mcg (2.000- 10.000 UI) de vitamina D3 ou de 0.5-2 mcg de 1,25- di-hidroxi-colecalciferol durante 8-12 semanas; com cerca de 2-4 semanas de tratamento produz-se uma melhoria dos sinais radiológicos traduzida pelo aparecimento da chamada “linha de calcificação preparatória” ao nível das metáfises (Figura 6).
Uma vez verificada a resposta inicial, a dose diária deve ser reduzida para [400 UI (até idade de 1 ano) ou 600UI (> 1 ano) ] como esquema profiláctico.
O doseamento sérico do metabólito mono-hidroxilado (25-hidroxi-colecalciferol) serve de orientação para avaliação do resultado terapêutico, salientando-se que o valor sérico de 25-HC vit. D não deverá ultrapassar 100 ng/mL.
Para além da avaliação clínica, o efeito da terapêutica poderá também ser comprovado mais objectivamente com doseamentos séricos e urinários de cálcio, assim como da fosfatase alcalina (cujos valores decrescem com a melhoria).
Como alternativa, poderá optar- se por outro esquema de administração de vitamina D: 50.000 UI semanais durante 8 semanas, ou uma simples dose (anteriormente designada “choque vitamínico”) de 150.000 a 600.000 UI em função da idade do doente e do estado clínico.
Se não ocorrer resposta ao tratamento a curto prazo, tratar-se-á provavelmente, não de um RCC, mas de uma deficiência secundária de vitamina D ou de forma fosfopénica.
Recorda-se que em situações de carência de cálcio, a calcémia pode ser normal ou baixa e que a hipocalcémia sintomática é pouco comum.
Uma vez iniciado o tratamento com vitamina D, está indicado o suplemento de cálcio-elemento (30-75 mg/kg/dia).
O regime alimentar deverá logicamente conter cálcio e fósforo através da ingestão de leite e produtos lácteos.
A correcção da hipocalcémia sintomática obriga a terapêutica de substituição emergente com gluconato de cálcio, a qual é abordada noutro capítulo.
Em situações específicas e graves acompanhadas de deformações esqueléticas sequelares, poderá haver necessidade de intervenção ortopédica.
2. CARÊNCIA DE VITAMINA A
Importância do problema
Faz-se uma breve referência a este estado carencial, raro em crianças saudáveis com regime alimentar equilibrado, mas com elevada prevalência nos países em desenvolvimento, sobretudo da África, constituindo um grave problema de saúde pública.
Poderá surgir igualmente como resultado de síndromas de má-absorção e em situações com deficiência de ingestão em lípidos.
As consequências de tal carência, que surgem insidiosamente, verificam-se sobretudo ao nível do sistema ocular: essencialmente, xerose da conjuntiva e da córnea com ulterior opacificação desta; dificuldade de adaptação à escuridão e cegueira nocturna. A pele é seca e descamativa.
O tratamento consiste na administração diária de doses entre 1500 e 3000 mcg de vitamina A por via oral com vigilância da evolução clínica tentando evitar a toxicidade. Na xeroftalmia são utilizadas doses maiores. Vários organismos internacionais e várias equipas de profissionais de saúde colaboram em campanhas nos países mais afectados.
3. CARÊNCIA DE VITAMINA C
O quadro clínico típico de carência de ácido ascórbico (vitamina C) designa-se por escorbuto. O défice de tal vitamina (que acelera as reações de hidroxilação da prolina na formação do colagénio), contribui para a fragilidade de determinados tecidos, designadamente da parede vascular.
Poderá surgir no primeiro ano de vida em lactentes alimentados com leite de vaca não suplementado e com regime alimentar isento de frutos, designadamente citrinos e vegetais frescos. Com a fervura, a fonte de ácido ascórbico nestes produtos naturais é destruída.
Na idade pediátrica, as manifestações clínicas incluem essencialmente irritabilidade, gengivite ulcerosa e sangrante, hemorragia subperióstica originando dores ósseas, hipomobilidade dos membros simile paralisia, rosário condrocostal e hematúria. Na ausência de tratamento correctivo, poderão surgir petéquias, hiperqueratos dos folículos do cabelo e alterações mentais.
Nas formas crónicas poderá verificar-se anemia secundária à perda sanguínea, diminuição da absorção do ferro, assim como alteração do metabolismo do folato.
O tratamento consiste na administração diária de vitamina C (250-500 mg/ dia). Nos casos de malabsorção, devem ser utilizadas doses superiores.
BIBLIOGRAFIA
Benn CS, Martins C, Rodrigues A, et al. Randomized study of effect of different doses of vitamin A on childhood morbidity and mortality. BMJ 2005; 331: 1428-1430
Bishop N. Don’t forget vitamin A. Arch Dis Child 2006; 91: 549-550
Casswall TH. Vitamin D deficiency in adolescents living at high latitudes: are we missing something in the recommendations? Acta Paediatrica 2013; 102: 569-571
Chesney RW. Vitamin D and the magic mountain: the anti-infectious role of the vitamin. J Pediatr 2010; 156:698-703
Chesney RW. The five paradoxes of vitamin D and the importance of sunscreen protection. Clinical Pediatrics (Phila) 2012; 51:819-827
Davies JH, Shaw NJ. Preventable but no strategy: vitamin D deficiency in the UK. Arch Dis Child 2011; 96:614-615
Diab L, Krebs NF. Vitamin E excess and deficiency. Pediatr Rev 2018; 39: 161-179; DOI: 10.1542/pir.2016-0068
Estrade S, Majorel C, Tahhan N, et al. Severe nutritional rickets in young children: resurgence of an old disease. Arch Pédiatr 2017; 24:737-742
Gartner LM, et al. Americam Academy of Pediatrics/Section on Breast Feeding and Committee on Nutrition. Pediatrics 2003; 111: 908- 910
Kliegman RM, Stanton BF, StGeme JW, Schor NF (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2015
Koletzko B, Koletzko S, Ruemmele F (eds). Drivers of innovation in pediatric nutrition. Basel: Karger/Nestlé Nutrition Institute, 2010
Kreiter SR, Schwartz RP, Kirknan HN Jr, Charlton PA, et al. Nutritional rickets in African american breast-fed infants. J Pediatr 2000; 137: 153- 157
Ladhani S, Srinivasan L, Buchanan C, Allgrove J. Presentation of vitamin D deficiency. Arch Dis Child 2004; 89: 781-784
Lee WS, Jalaludin MY, Wong SY, et al. Vitamin D non-sufficiency is prevalent in children with chronic liver disease in a tropical country. Pediatr & Neonatol 2019; 60: 12-18
Manson JE, Cook NR, Lee I-M, et al. Vitamin D supplements and prevention of cancer and cardiovascular disease. NEJM 2019; 380: 33- 44
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Pai B. Understanding rickets. Paediatr Child Health 2011; 21: 315-321
Rajakumar K, Thomas SB. Reemerging nutritional rickets. Arch Pediatr Adolesc Med 2005; 159: 335-341
Reid IR. What diseases are causally linked to vitamin D deficiency? Arch Dis Child 2016; 101: 185 – 189
Saggese G, Vierucci F, Boot Am, et al. Vitamin D in childhood and adolescence: an expert position statement. Eur J Pediatr 2015; 174: 565 – 576
Saraff V, Shaw NJ. Sunshine and vitamin D. Arch Dis Child 2016; 101: 190 – 192
Shaw N, Mughal MZ. Vitamin D and child health: part 1(skeletal aspects) and part 2 (extraskeletal and other aspects). Arch Dis Child 2013; 98: 363-372
Turer CB, Lin H, Flores G. Prevalence of vitamin D deficiency among overweight and obese US children. Pediatrics 2013;131: e152- e161
Uzoigwe CE, Ali O. Breastfeeding and vitamin D. Arch Dis Child 2018;103:405–406
Vidailhet M, Mallet M, Bocquet A, et al. Vitamin D: still a topical matter in children and adolescents. Archives de Pédiatrie 2012; 19: 316-328
Wall CR, Grant CC, Jones I. Vitamin D status of exclusively breastfed infants aged 2-3 months. Arch Dis Child 2013; 98:176-179
Wood CL, Cheetham TD. Vitamin D: increasing supplement use at-risk groups (NICE guideline PH56). Arch Dis Child Educ Pract Ed 2016; 101: 43 – 45
Yeung C-Y. Fat-soluble vitamin deficiency in pediatric patients with chronic liver disease. Pediatr & Neonatol 2019; 60: 1-2