Definição e importância do problema
O conceito de adaptação fetal à vida extrauterina engloba o conjunto de modificações de ordem anatomofisiológica (metabólicas/bioquímicas, imunológicas, hormonais, etc.) na transição da vida fetal (que decorre em meio líquido/líquido amniótico), para a vida extrauterina, (em meio envolvente aéreo), de cuja perturbação poderão resultar determinados problemas clínicos no RN com possível repercussão futura.
O processo de tal adaptação, sobretudo intraparto (estresse do nascimento) é comparticipado de modo muito importante pelos sistemas simpático-suprarrenal (tendo papel importante a adrenalina e a noradrenalina, quimiorreceptores, barorreceptores), e parassimpático, o que é testemunhado pelos níveis elevados de catecolaminas, angiotensina e vasopressina no pós-parto. No entanto, no conceito de adaptação estão também englobados certos eventos fisiológicos – não imediatos – que se processam nas semanas e meses seguintes, não sendo possível determinar, com precisão, quando termina tal adaptação.
Durante o período médio de duração da gravidez de termo (40 semanas), a placenta tem como funções primordiais as da respiração, da termorregulação, da nutrição, da excreção de catabólitos, endócrinas, etc.. No embrião, primeiramente, (4ª-12ª semanas – precedidas pela fase pré-embrionária no período compreendido entre a 1ª e 3ª semanas), e no feto, depois (13ª-40ª semanas), ocorrem processos complexos de crescimento e de maturação até ser viável a autonomia do produto de concepção após o nascimento.
Na realidade, o processo de mudança mais espectacular e relativamente mais rápido na transição da “vida aquática” para a “vida gasosa” é o que diz respeito ao aparecimento da respiração e ao concomitante incremento da perfusão pulmonar (adaptação respiratória e cardiocirculatória envolvendo processos interligados); de uma PaO2 fetal ~ 25 mmHg passa-se, em situação de normalidade, para uma PaO2 neonatal ~ 60 mmHg ao cabo de 30 minutos de vida com movimentos respiratórios, inspirando ar cuja FiO2 é ~ 21%.
Ora, o RN (ex-feto) para sobreviver em ambiente rico em oxigénio necessita que os sistemas de defesa antioxidante – defesa contra radicais livres de oxigénio (intracelulares: dismutases do superóxido, peroxidase da glutationa, catalase; extracelulares: ascorbato, etc.) – estejam desenvolvidos ao nascer. Acontece que tal desenvolvimento se completa somente no termo da gestação, (sobretudo os sistemas de defesa intracelular), o que equivale a dizer que a probabilidade de lesão oxidante de órgãos por radicais livres é maior nos RN pré-termo. Curiosamente, o desenvolvimento de tais sistemas de defesa processa-se paralelamente à maturação do sistema enzimático responsável pelo desenvolvimento do surfactante pulmonar.
Adaptação respiratória
Líquido pulmonar fetal (LPF)
Durante o período fetal as trocas gasosas são asseguradas através da “membrana” placentar. Desde a concepção, o sistema respiratório evolui em 5 períodos – cuja nomenclatura não coincide precisamente com os períodos atrás considerados – e chamados:
- Embrionário → com vias aéreas proximais (0-7 semanas);
- Pseudoglandular → com vias condutoras (8-16 semanas);
- Canalicular → com formação dos ácinos (17-27 semanas);
- Sacular → com áreas para trocas gasosas (28-35 semanas);
- Alveolar → com expansão da área para as trocas gasosas (das 36 semanas ao termo da gravidez).
Concomitantemente desenvolvem-se as estruturas da microcirculação; e, a partir da 26ª-28ª semana, existe superfície de troca suficiente para assegurar as trocas gasosas após o nascimento.
Durante a vida fetal os pulmões estão preenchidos pelo chamado líquido pulmonar fetal (LPF, de características diferentes do líquido amniótico com o qual contacta ao nível da hipofaringe) segregado pelo epitélio respiratório (pneumatócitos do tipo I); o referido PPF aumenta progressivamente, sobretudo após a 18ª semana, ao ritmo de 2-4 mL/kg/hora, atingindo o volume de cerca de 20 mL/kg pelas 36 semanas, semelhante ao valor da capacidade residual funcional (CRF); isto é, o pulmão durante a vida intra-uterina é maciço.
A secreção de tal LPF para o interior das vias aéreas (exercendo pressão de distensão contínua e garantindo como “molde” o crescimento/ expansão do pulmão, e o desenvolvimento epitelial da via respiratória) – predomina sobre a absorção, dependendo de um gradiente osmótico entre a circulação e o espaço aéreo virtual; neste fluxo circulação → alvéolo, entram em acção um sistema de bomba sódio-potássio/ATP-ase localizado no pólo basal do pneumatócito I junto ao capilar.
O LPF contém quantidade significativa de cloro (> 150 mEq/L) e baixa de bicarbonato (~ 2,8 mEq/L), e de proteínas (< 0,3 mg/mL) sendo o pH ~ 6,27. A pressão do LPF, superior à do líquido amniótico (em cerca de 2 mmHg), permite que circule segundo trajecto vias distais → traqueia: a maioria é deglutida pelo feto e uma pequena porção é eliminada para a cavidade amniótica.
Tal movimento é igualmente facilitado pelas forças de elastância do pulmão (ou de tendência para a retracção).
A partir da 11ª semana surgem, com carácter intermitente, movimentos de expansão e retracção do tórax (movimentos pseudo “respiratórios”) irregulares, baixa amplitude e ao ritmo de 60-90/minuto, cuja regulação poderá estar relacionada com o estímulo de receptores periféricos. Associados ao sono REM, a frequência de aparecimento, a frequência por minuto e a amplitude são influenciados por estímulos como acidose e hipercárbia (aumento), ou hipóxia, hipoglicémia, sedativos, etc. (diminuição).
Durante os períodos de movimentos de expansão-retracção fica facilitado o movimento do LPF no sentido vias distais → traqueia atrás referido. Concomitantemente com os períodos de movimentos torácicos verifica-se dilatação da glote; pelo contrário, nos períodos sem movimentos/”apneia” verifica-se constrição da glote com aumento da resistência à saída do LPF.
É importante acentuar que a diminuição do ritmo e frequência dos movimentos de expansão/retracção do tórax fetal compromete o crescimento do pulmão.
Na parte final da gravidez, cerca de dois dias antes do início do trabalho de parto espontâneo, começa a verificar-se: diminuição da secreção do LPF; fluxo deste no sentido alvéolo → capilar → microcirculação → linfáticos; e a aumentar a absorção ou fluxo no sentido inverso, preparando o pulmão para receber ar no pós-parto. Ou seja, a partir desta data e no período pós-natal passa a predominar a absorção sobre a secreção: a adrenalina e noradrenalina libertadas pelo sistema simpático-suprarrenal, assim como a vasopressina, actuando sobre receptores no pólo basal do pneumatócito I, vão estimular o AMP-cíclico e promover a abertura de canais de sódio no pólo apical do mesmo pneumatócito, facilitando tal fluxo e progressivo esvaziamento do alvéolo em LPF.
Calcula-se que durante o trabalho de parto e durante as primeiras horas de vida seja absorvido, cerca de 90% do LPF. Durante a passagem do feto pelo tracto genital inferior a compressão do tórax também contribui para a expulsão do LPF pela boca e nariz, sendo que este mecanismo apenas contribui para a expulsão de cerca de 10% do total de LPF. Este fenómeno fica comprometido se se verificar extracção do feto por cesariana electiva (antes do início do trabalho de parto), determinando que o volume do LPF no ser extrauterino (RN) seja, em tais circunstâncias, praticamente igual ao que existe na vida fetal, o que poderá dificultar a entrada de ar na via respiratória.
Os primeiros movimentos respiratórios
A primeira inspiração sobrevém aproximadamente dentro dos primeiros 15 segundos de vida extrauterina; é desencadeada pelo frio, estímulos nociceptivos e variações das PA (alveolares) de O2 e de CO2 secundárias à laqueação do cordão umbilical.
Entre o feto e o RN existe diferença significativa quanto à sensibilidade dos quimiorreceptores. A resposta do RN de termo ao CO2 é semelhante à do adulto; no RN pré-termo tal resposta é mais fraca, aumenta com a idade gestacional, podendo ficar comprometida se existir hipóxia associada.
A primeira inspiração é caracterizada pela abertura da glote e aumento do tono da musculatura respiratória; durante cerca de 0,5 a 1 segundo exerce-se uma pressão negativa de abertura atingindo (– 40) a (– 80) cm H2O, que permite opor-se à resistência viscosa do LPF existente na via respiratória e às forças de tensão superficial e resistências teciduais, e facilitar a entrada de 50-60 mL de ar na via aérea. De salientar que a abertura alveolar pulmonar não é uniforme dada a raridade dos poros de Kohn no RN, o que constitui um factor predisponente de pneumotórax.
A primeira expiração efectua-se com a glote semi-encerrada: corresponde ao primeiro choro. A pressão pleural mantém-se positiva (~ 20-30 cm H2O); por outro lado, nem todo o ar inspirado é expirado, sendo de referir que cerca de 20-30 mL (ar residual) fica localizado nos alvéolos que mantêm distensão residual estável desde que exista surfactante funcionante.
O estabelecimento de movimentos respiratórios rítmicos está essencialmente na dependência de quimiorreceptores carotídeos. Durante os primeiros dias que se seguem ao nascimento, dois reflexos com ponto de partida pulmonar desempenham igualmente papel importante:
- O reflexo de Hering-Breuer, não existindo no adulto, mas sim no RN de termo e pré-termo: a insuflação pulmonar determina cessação do esforço respiratório;
- O reflexo paradoxal de Head: inspiração activa como resposta a insuflação pulmonar.
O reflexo de Head, muito mais importante no RN do que em qualquer outra fase da vida, é responsável por frequentes “suspiros” observados no período neonatal, com utilidade no sentido de manter arejamento pleno dos pulmões.
Os primeiros movimentos respiratórios, irregulares e bastante amplos, são entrecortados por esforços expiratórios. À medida que se verifica a manutenção dos movimentos respiratórios, sucessivamente mais alvéolos vão sendo “recrutados” ou preenchidos, com aumento progressivo da capacidade residual funcional (CRF), a qual atinge o valor ~ 30 mL/kg ao 30º minuto de vida extrauterina.
Em sucessivas inspirações cada vez menos ar é mobilizado, sendo que o volume corrente diminui e estabiliza no valor ~ 6 mL/kg.
Quanto à distensibilidade (compliance) pulmonar, dependente da secreção de surfactante pulmonar a partir da 20ª semana de gestação pelos pneumatócitos do tipo II, os valores são, progressivamente: 2 mL/cmH2O aos 3 minutos, e 5 mL/cm H2O aos 7 dias de vida (no adulto: ~ 170 mL/cm H2O).
O défice de surfactante, levando ao colapso alveolar, compromete a manutenção do ar residual e, por isso, a adaptação respiratória.
Relação entre ventilação e perfusão
A distensão alveolar acompanha-se de abertura do leito vascular pulmonar; a superfície alveolocapilar torna-se, assim, a zona de trocas gasosas, sendo que a relação ventilação/perfusão não é considerada óptima no RN. A abertura alveolar não é homogénea, havendo certas zonas perfundidas não ventiladas criando-se um curto-circuito direito-esquerdo intrapulmonar (15-30% no RN contra 5% no adulto).
Hemoglobina F e hemoglobina A
Muito progressivamente, no decurso do 3º trimestre da vida extrauterina a Hb F (fetal) dá lugar à Hb A (do tipo adulto), tendo esta última menor afinidade para o oxigénio.
Condições básicas para a adaptação respiratória
Após descrição sucinta dos passos mais importantes da adaptação respiratória (indissociável da adaptação cardiocirculatória) será mais fácil deduzir as condições básicas para a manutenção do automatismo e função respiratórios, assim como os problemas clínicos – abordados noutros capítulos – que decorrem de perturbações das referidas condições. (Quadro 1)
QUADRO 1 – Função respiratória – Condições básicas.
|
Adaptação cardiocirculatória
In utero, a circulação fetal é fundamentalmente caracterizada pela importância do débito placentar e pelo escasso débito pulmonar (inferior a 10% do débito ventricular).
Com o nascimento verificam-se transformações radicais: supressão da circulação placentar com a laqueação do cordão, e aumento maciço da perfusão pulmonar coincidindo com o arejamento das vias respiratórias.
A adaptação cardiocirculatória corresponde, afinal, ao somatório de modificações anatómicas e fisiológicas sob a dependência de factores mecânicos e bioquímicos.
Circulação fetoplacentar
O esboço embrionário do coração funciona como “bomba” efectiva pela 8ª semana de gestação, sendo que a estrutura do coração está completamente formada cerca da 10ª semana.
A circulação fetoplacentar relativamente à verificada após o nascimento difere fundamentalmente:
- Pela existência da placenta como órgão interposto entre o feto e a grávida (hemodinamicamente é uma região de baixa resistência);
- Pela existência do foramen ovale (ou buraco de Botal) que permite a passagem de sangue da aurícula direita para a aurícula esquerda;
- Pela existência do ductus arteriosus ou canal arterial que também determina um curto circuito direito-esquerdo pela comunicação que estabelece entre a artéria pulmonar e aorta.
O sangue que circula no feto é bombeado pela circulação fetal através das duas artérias umbilicais em direcção à placenta. Na placenta fazem-se as trocas gasosas (transferência de CO2 para a circulação materna e aquisição de O2 e nutrientes para a circulação fetal). O sangue oxigenado volta ao feto através da veia umbilical que dá origem a dois importantes ramos antes de alcançar o fígado: um ramo para o lobo esquerdo do fígado; e outro ramo (ductus venosus) que se liga à veia cava inferior, o que determina mistura de sangue mais oxigenado (proveniente da placenta) com sangue não oxigenado (proveniente dos membros inferiores e órgãos infradiafragmáticos).
Determinadas particularidades anatómicas no local em que a veia cava inferior se liga à aurícula direita fazem com que:
- O sangue não oxigenado proveniente dos membros inferiores e órgãos infradiafragmáticos se dirija para o ventrículo direito através da válvula tricúspide; este sangue mistura-se, por sua vez, com o sangue, também não oxigenado, que provém da cabeça e membros superiores. A grande parcela do débito do ventrículo direito dirige-se para a circulação sistémica através do curto circuito – ductus arteriosus – ligando a artéria pulmonar à aorta descendente;
- O sangue mais oxigenado atingindo a aurícula direita (parcela superior à do sangue não oxigenado) dirige-se preferencialmente da aurícula direita para a aurícula esquerda através do foramen ovale e, a seguir, para o ventrículo esquerdo.
Consequentemente, no feto, considerando o volume de sangue que atinge a aurícula direita, somente cerca de 10% do mesmo irriga o território pulmonar, sendo o restante “desviado” para a circulação sistémica por meio do foramen ovale e ductos arteriosus.
O facto de o ductus arteriosus (conduzindo sangue menos oxigenado) desembocar na aorta a jusante da emergência das artérias que contribuem para a irrigação do miocárdio e encéfalo (recebendo sangue mais oxigenado através do circuito foramen ovale → aurícula esquerda → ventrículo esquerdo), faz com que estes territórios (encéfalo e miocárdio) recebam sangue mais oxigenado.
Os dois ventrículos trabalham “em paralelo”, sendo a frequência cardíaca elevada (130-150/minuto) e o débito importante: entre a 10ª e 30ª semanas o somatório dos débitos direito e esquerdo totaliza cerca de 200 mL/kg/minuto.
A circulação pulmonar é caracterizada por resistência vascular elevada (cerca de cinco vezes superior à resistência sistémica. As arteríolas são submetidas, sobretudo a partir da 28ª semana de gestação, a uma modificação anatómica e estrutural: aumento global do peso do pulmão (cerca de 4 vezes), aumento progressivo da espessura da musculatura da média em relação à espessura da íntima, aumento do número de pequenos vasos (cerca de 40 vezes), aumento do número de vasos por unidade de volume da ordem de 10 vezes até ao termo da gestação; tais alterações podem ser interpretadas como preparação do pulmão para receber na vida extrauterina um volume de sangue 10 vezes superior ao que se verifica in utero.
O tono vascular pulmonar é sensível a mediadores endoteliais vasoactivos (vasodilatadores ou vasoconstritores), por ex. pH, PO2, PCO2, NO, endotelina, etc.; in utero predomina a acção de factores que promovem vasoconstrição.
Caberá referir, a propósito, que no feto, tal como a resistência vascular placentar, a resistência vascular periférica e a pressão arterial sistémica têm valores baixos.
Circulação neonatal de transição
A supressão brusca da circulação placentar coincide com o início da ventilação pulmonar que conduz a:
- Elevação do nível de oxigenação alveolar e arterial;
- Dilatação rápida dos vasos pulmonares que promovem incremento do débito sanguíneo pulmonar na ordem de 10 vezes (em cerca de 24 horas).
O aumento significativo do débito sanguíneo pulmonar conduz a maior volume sanguíneo de retorno à aurícula esquerda aumentando a respectiva pressão e determinando o encerramento funcional do foramen ovale, o que contribui para diminuir o curto-circuito direito-esquerdo a este nível. O aumento do débito sanguíneo pulmonar coincide com diminuição da pressão na artéria pulmonar e no ventrículo direito.
Por sua vez, a redução do gradiente de pressão entre artéria pulmonar e aorta, associada à constrição progressiva (primeiramente funcional, e depois anatómica) do ductus arteriosus (DA) determinada pela elevação do nível de oxigenação tecidual, leva à diminuição e eliminação progressiva do curto circuito direito-esquerdo, através daquele (DA).
A laqueação do cordão umbilical, eliminando a circulação placentar – região de baixa resistência – vai contribuir para elevar a pressão arterial sistémica, sendo que a pressão aórtica se torna superior à pressão na artéria pulmonar.
A Figura 1 representa de modo esquemático a circulação fetal e neonatal.
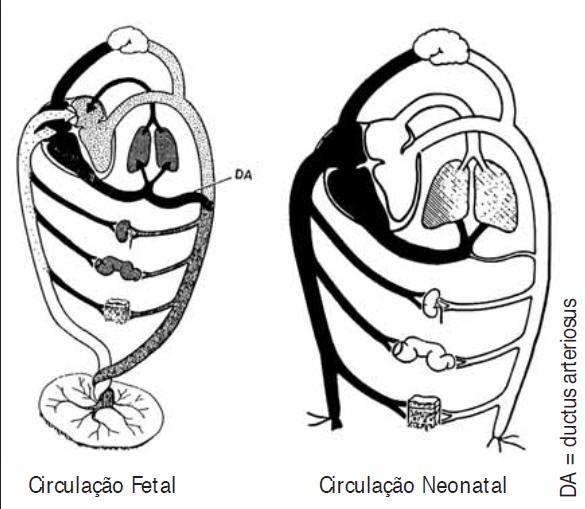
FIGURA 1. Representação esquemática dos circuitos da circulação fetal e neonatal (consultar texto). Vasos de cor branca <> sangue oxigenado; vasos de cor preta <> sangue não oxigenado; vasos com ponteado em diversas tonalidades <> sangue de mistura (mais oxigenado com menos oxigenado, em graus variáveis).
Fases de diminuição da resistência vascular pulmonar ex-útero
A diminuição da pressão na artéria pulmonar processa-se em três fases:
Primeira fase (0-1 minuto)
Logo após os primeiros movimentos respiratórios, com a substituição do LPF por ar e a formação de interface líquido/ar ao nível da superfície alveolar, são criadas imediatamente forças de tensão superficial que, diminuindo a pressão no interstício do parênquima pulmonar, permite dilatação dos vasos e aumento do débito pulmonar.
Segunda fase (até 12-24 horas)
Nesta fase, ao longo de 12 a 24 horas a RVP diminui por acção de mediadores com acção vasoactiva produzidos no endotélio (exemplificam-se como mais importantes o NO e a prostaciclina).
Terceira fase (entre as 12-24 horas e cerca de 10 dias)
Nesta fase continua, de modo mais lento, a diminuição da RVP, sobretudo à custa da diminuição da espessura da camada muscular e achatamento das respectivas células endoteliais, o que contribui para aumentar, mais ainda, o calibre das artérias pulmonares de menor calibre.
FIGURA 2. Adaptação cardiocirculatória à vida extrauterina.
Encerramento do foramen ovale
O encerramento do foramen ovale inicia-se ao cabo de algumas horas. Nos primeiros dias poderá ocorrer curto circuito bidireccional por hiperpressão ocasional na aurícula direita (por ex. com choro), originando cianose transitória. O encerramento torna-se mais efectivo ao cabo de 8-10 dias, sendo que o encerramento anatómico é mais tardio.
Encerramento do ductus arteriosus
O canal arterial é uma estrutura muito particular: camada muscular lisa interposta entre duas camadas elásticas, com orientação longitudinal e circular das respectivas fibras.
Como estímulos que podem gerar constrição citam-se designadamente o incremento da PaO2 e de prostaglandinas no sangue circulante do canal, e da respectiva artéria nutritiva (ramo da aorta descendente ou duma coronária). Situações como SDR/hipóxia e prematuridade poderão levar a atraso de encerramento.
O encerramento funcional verifica-se em 80%-90% dos casos entre as 10 e 18 horas de vida; e o encerramento anatómico, na maioria dos casos, cerca das 8 semanas; por conseguinte, neste período poderá haver curto-circuito bidireccional e hipóxia transitórios. A permeabilidade permanente é estimada em cerca de 0,04% dos RN de termo, e em 20%-40% de RN pré-termo com peso de nascimento < 1.000 gramas.
A Figura 2 sintetiza os principais fenómenos da adaptação cardiocirculatória à vida extrauterina.
Circulação de tipo adulto
A circulação neonatal definitiva é caracterizada pelo funcionamento “em série” dos dois ventrículos. O ventrículo esquerdo torna-se progressivamente preponderante e as pressões sistémicas aumentam também progressivamente.
Condições básicas para a adaptação cardiocirculatória
Após descrição sucinta dos passos mais importantes da adaptação cardiocirculatória (indissociável da adaptação respiratória) será mais fácil deduzir as condições básicas para a manutenção da função cardiocirculatória, assim como os problemas clínicos – abordados noutros capítulos – que decorrem de anomalias das referidas condições. (Quadro 2)
QUADRO 2 – Função cardiocirculatória – Condições básicas.
|
Adaptação térmica
Termorregulação durante a vida fetal
Os mecanismos fundamentais de produção e de perda de calor (regulação térmica) são regulados pelo centro termorregulador, no hipotálamo. O referido centro recebe informações de receptores térmicos, quer superficiais (pele), quer profundos (músculos esqueléticos, abdómen, espinhal medula, mucosa respiratória, etc.).
In utero, o metabolismo fetal determina uma temperatura fetal que é superior, em cerca de 0,5ºC, à temperatura da mãe, criando-se um gradiente que permite perda de calor no sentido feto → mãe, sobretudo através da circulação umbilical e placenta; isto é, na ausência de placenta, a temperatura fetal elevar-se-ia na ordem de 3ºC por hora.
Termorregulação após o nascimento
No momento do nascimento a temperatura rectal do RN é cerca de 37,6ºC-37,8ºC, e a do ambiente do bloco de partos, em geral, 23ºC. Após o nascimento, a situação inverte-se completamente, pois o RN é confrontado numa luta contra o frio, estabelecendo-se um importante gradiente térmico.
Por um lado, a pele do RN está molhada com resto do líquido amniótico; por outro, o mesmo RN tem panículo adiposo escasso e pele não queratinizada (características mais acentuadas no RN pré-termo), e a relação superfície corporal/volume corporal é muito superior à do adulto (sobretudo nos RN pré-termo de peso < 1.500 gramas).
Criam-se, assim, condições para uma perda térmica importante no sentido interior corporal → superfície corporal → ar ambiente, de quatro modos:
Evaporação
(RN molhado – líquido amniótico aderente à pele ou água do banho à superfície da pele);
Condução
(perda de calor por “contacto directo” com uma superfície de temperatura inferior à da pele, por ex. colchão frio, prato da balança frio, etc.);
Radiação
(perda de calor “à distância” para superfícies não em contacto com a pele – por ex. parede da sala ou da incubadora);
Convecção
(perda de calor tendo como “veículo” ar em movimento/corrente de ar).
Na ausência de cuidados, no RN deixado à temperatura ambiente, molhado, não vestido, não colocado sob fonte de calor, a temperatura cutânea pode baixar rapidamente (0,3ºC/minuto), assim como a temperatura rectal, de modo mais lento.
As possibilidades de adaptação ou de resposta do RN ao ambiente exterior frio são de dois tipos:
Diminuição da perda de calor
O RN submetido ao frio responde com vasoconstrição periférica por libertação de adrenalina e noradrenalina, levando a: 1) vasoconstrição pulmonar; 2) aumento do débito cardíaco; 3) incremento do metabolismo anaeróbio (elevação do glucagon, diminuição de insulina; glicogenólise e elevação da glicémia numa primeira fase, seguidas de esgotamento das reservas de glicogénio e hipoglicémia ulterior); e 4) acidose metabólica.
Produção de calor (termogénese)
A termogénese no RN é limitada e, por isso, diferente da do adulto: 1) o fenómeno de calafrio (contracção muscular) praticamente não existe, embora o choro e a agitação contribuam para aumentar a actividade muscular; 2) a maior fonte de produção de calor no RN é constituída pela chamada gordura castanha, mais abundante no RN do que no adulto, mas insuficiente nos primeiros dias de vida, sobretudo nos RN pré-termo ou de baixo peso, o que constitui uma limitação.
Os depósitos de gordura castanha, muito vascularizados e com inervação simpática, localizam-se na região subescapular, trajecto dos grandes vasos, goteiras paravertebrais, mediastino, e regiões perirrenais e perissuprarrenais.
Como resultado da exposição ao frio, a libertação de adrenalina e noradrenalina desencadeia lipólise ao nível da gordura castanha: hidrólise de triglicéridos com libertação de glicerol e ácidos gordos livres, e consequente produção de energia sob a forma de calor que, por condução, se vai transmitir aos vasos e sangue circulante nos tecidos contíguos.
Relativamente às possibilidades de resposta do RN ao ambiente exterior quente (situações relacionadas, por ex. com falta de precaução: tempo quente e excesso de roupa, hiperaquecimento inadvertido, etc.), há que salientar que existem limitações no que respeita ao mecanismo de compensação de perda de calor – normalmente funcionante em crianças de mais idade e adultos – através da sudorese. Com efeito, face à imaturidade do RN e lactente, as glândulas sudoríparas têm capacidade limitada de secreção, o que aumenta a probabilidade de hipertermia face a temperatura exterior elevada.
Em suma, os mecanismos de termorregulação nos RN têm limitações, havendo maior risco comparativamente a crianças de maior idade, quer de elevação anormal da temperatura se colocados em ambiente quente, quer de diminuição anormal da temperatura se colocados em ambiente frio.
Adaptação digestiva
Nutrição e crescimento fetais
Durante a vida fetal a nutrição é de tipo hematogénico, assegurada pela via transplacentar. De salientar que o crescimento pré-natal está dependente sobretudo de factores de crescimento maternos e placentares (e fetais em menor escala) tais como insulina e factores de crescimento semelhantes a insulina (IGF 1 e 2), leptina, etc., enquanto o crescimento pós-natal depende fundamentalmente de hormonas hipofisárias e doutras.
No 1º trimestre verifica-se aumento do número de células; no 2º trimestre verifica-se, quer aumento do número, quer do volume das mesmas células, sendo o incremento de gordura cerca de 50 gramas e o peso atingido do feto cerca de 1/3 do peso de nascimento.
No 3º trimestre – o período de verdadeira preparação para a vida extrauterina – continua o aumento do volume das células já formadas, o que se traduz num incremento de 500 gramas de gordura branca e castanha (10 vezes mais do que nos trimestres anteriores), e da maior parte das reservas
de minerais, glicogénio e oligoelementos; neste trimestre verifica-se incremento de peso correspondente a 2/3 do peso de nascimento.
As principais fontes energéticas para o feto são os hidratos de carbono representados pela glucose: por difusão, verifica-se um suprimento do referido nutriente no sentido mãe → feto, da ordem de 4-6 mg/kg/minuto durante o 2º trimestre da gravidez, período em que já é possível a glucogénese. A neoglucogénese processa-se no terceiro trimestre. (ver adiante)
O suprimento em azoto para a síntese proteica é levado a cabo através da transferência directa activa de aminoácidos mãe → feto, sendo que também se verifica síntese dos mesmos no citosol da placenta.
No que respeita aos lípidos, cabe referir que a lipogénese se processa no feto a partir das 12 semanas, sendo estimulada pela insulina e inibida pelo glucagon e AMPc. As fontes de lípidos para o feto são constituídas por: ácidos gordos livres provenientes da mãe e da síntese na placenta; ou da lipólise de triglicéridos, lipoproteínas ou fosfolípidos, quer da mãe, quer do próprio feto (salientando-se o papel da lipoproteína-lipase do endotélio capilar na hidrólise dos triglicéridos).
Tubo digestivo fetal
Todas as estruturas do tubo digestivo estão individualizadas desde a 12ª semana de gestação, sendo que a maturação anatómica e funcional se efectua progressivamente das regiões proximais para as regiões distais.
Como particularidades essenciais da fisiologia do tubo digestivo fetal cabe referir:
- O feto tem capacidade para a sucção e deglutição; no termo da gestação tem possibilidade de deglutir até 10 mL/hora de líquido amniótico;
- O processo de absorção intestinal activa da glucose existe desde a 12ª semana, aumentando significativamente até à 16ª semana; de referir que os elementos contidos no líquido amniótico são em grande parte absorvidos;
- À medida que se vai constituindo o mecónio, este vai-se acumulando no tubo digestivo; somente em caso de sofrimento fetal se verifica emissão do mesmo para o espaço amniótico.
Nutrição e alimentação neonatais
Com a laqueação do cordão umbilical, a nutrição hematogénica transplacentar é bruscamente interrompida. Estando o tubo digestivo desenvolvido no termo da gestação, a via natural para o suprimento alimentar é a via digestiva; no caso de imaturidade, compreende-se que esta via (natural, extrauterina) comporta algumas limitações. Como particularidades essenciais da fisiologia do tubo digestivo do recém-nascido cabe referir:
- A sucção e a deglutição, já presentes no feto, estão bem coordenadas no recém-nascido de termo a partir das 12 horas de vida; no RN pré-termo, e tanto mais quanto menor a idade gestacional, existe incoordenação da sucção-deglutição;
- Atraso do esvaziamento gástrico nas primeiras 12 horas de vida pós-natal, melhorando gradualmente nos primeiros 4 dias;
- O trânsito intestinal estabelece-se, na ausência de anomalias morfológicas e funcionais desde o nascimento. O ar penetra no tubo digestivo atingindo o intestino delgado entre as 2 e 12 horas de vida, e a porção mais distal do cólon entre as 18 e 24 horas;
- O refluxo gastresofágico de grau variável por relaxamento do esfíncter esofágico inferior é habitual, sobretudo nos primeiros três dias;
- A actividade proteolítica (pancreática e da pepsina) é baixa até cerca de 1 ano, desenvolvendo-se até aos 3 anos;
- A lipase pancreática, com actividade fraca, é compensada pala lipase salivar;
- As amilases salivar e pancreática também evidenciam actividade deficitária nos primeiros meses de vida;
- As dissacaridases (sacarase, lactase, maltase) atingem a actividade máxima no termo da gravidez após incremento progressivo durante a gestação; a actividade da lactase diminui progressivamente com a idade e, designadamente após o período de alimentação láctea exclusiva;
- A primeira refeição estimula a libertação duma variedade de hormonas entéricas incluindo insulina, hormona de crescimento, gastrina, enteroglucagon e motilina;
- A primeira emissão de mecónio – que pode ser desencadeada pela primeira refeição de leite que estimula a motilidade através de hormonas intestinais – sobrevém nas primeiras 24 horas; situações em que tal não se verifique até às 48 horas implicam vigilância; de salientar que, nos casos de eliminação de mecónio in utero, se comprovou elevação dos níveis de motilina no sangue do cordão;
- O atraso da eliminação de mecónio com sinais de obstrução intestinal pode observar-se em diversas situações como “síndroma de rolhão de mecónio” e síndroma de microcólon esquerdo; uma vez que cerca de 50% dos casos de atraso de eliminação de mecónio surgem em RN de mãe diabética, admite-se que a elevação do glucagon (secundária à hipoglicémia) pode diminuir a motilidade do cólon; a diminuição de tal motilidade por défice de libertação de acetilcolina secundária a hipermagnesémia neonatal pode também verificar-se nos casos de tratamento de eclâmpsia materna com magnésio.
Adaptação metabólica
A composição do meio interno do feto depende da concentração dos diversos elementos do sangue circulante materno, dos mecanismos de troca verificados ao nível da placenta e, em menor grau, da aquisição progressiva de funções de regulação (maturação) do próprio feto.
A laqueação do cordão umbilical interrompendo de modo abrupto, quer o suprimento de nutrientes e doutros compostos provenientes do organismo materno, quer o processo de depuração de catabólitos anteriormente a cargo da placenta, cria no RN uma situação de instabilidade metabólica ou de perturbação da homeostasia de grau e duração variáveis em função da idade gestacional do mesmo.
Dois tipos principais de situações podem ser considerados representativos de tal perturbação da homeostasia no período neonatal:
- Carência em reservas energéticas para satisfazer as necessidades nutricionais, com maior acuidade nos RN com antecedentes de gravidez encurtada (pré-termo), de insuficiência placentar e/ou com restrição de crescimento intra-uterino;
- Doenças hereditárias do metabolismo cujos efeitos in utero são compensados pelos mecanismos homeostáticos do organismo materno: sendo muitas das situações referidas assintomáticas ou acompanhando-se de período assintomático, o clínico deverá proceder ao respectivo rastreio na base da anamnese perinatal, do exame objectivo e de eventuais exames complementares.
Nesta alínea é dada ênfase a aspectos da adaptação do metabolismo do cálcio e dos hidratos de carbono.
Metabolismo do cálcio
In utero, o cálcio é transportado pela placenta de modo activo para o feto de modo que, no termo da gestação, os níveis séricos de cálcio sérico fetal sejam superiores aos níveis de cálcio materno.
No feto os níveis séricos de PTH (hormona paratiroideia) e de 1,25 (OH)2 – vitamina D são baixos, mas os níveis de calcitonina e de 24, 25 (OH)2 – vitamina D são elevados, o que favorece a deposição de cálcio no tecido ósseo.
Após o nascimento, a interrupção brusca de suprimento de cálcio transplacentar determina que no RN se verifique, não só diminuição da taxa de deposição de cálcio no osso, mas ainda remoção do mesmo para o sangue como “garantia” da manutenção da homeostase do cálcio extracelular até à data em que se inicia a ingestão de leite (que corresponde ao suprimento de cálcio e outros minerais).
Nas primeiras 24 horas verifica-se diminuição progressiva dos níveis de cálcio sérico que estimula a libertação de PTH que, por sua vez, estimula a síntese de 1,25 (OH)2 – vitamina D. Consequentemente verifica-se elevação do cálcio sérico explicada pelos seguintes mecanismos: 1) reabsorção/ remoção de cálcio ósseo por acção de PTH e 1,25 (OH)2 – vitamina D; 2) absorção de cálcio intestinal por efeito de 1,25 (OH)2 – vitamina D; 3) redução da eliminação renal de cálcio por acção de PTH e 1,25 (OH)2 – vitamina D; 4) redução gradual do fósforo sérico por excreção renal aumentada, como efeito da PTH.
Em condições de normalidade, o cálcio sérico estabiliza com valor > 8 mg/dL cerca de 48 horas após o nascimento, aumentando depois durante a primeira semana.
Metabolismo dos hidratos de carbono
O feto está dependente do suprimento materno de glucose, sendo que a glicémia fetal corresponde a cerca de 60%-70% da glicémia materna. Após a laqueação do cordão umbilical verifica-se descida abrupta da glicémia no RN, sendo atingido o nadir entre 1 e 2 horas de vida pós-natal, aumentando subsequentemente.
Os níveis de glucose no sangue são inicialmente mantidos através da mobilização e eventual depleção das reservas de glicogénio hepático, o que é facilitado pela elevação das catecolaminas e glucagon, e diminuição da insulina pós-natal.
Tendo em conta que o suprimento de hidratos de carbono através da alimentação nos primeiros dias de vida é escasso, e que somente cerca de 20%-50% da glucose para as necessidades provém do leite, o RN fica dependente da neoglucogénese a partir de aminoácidos, glicerol e lactato.
Alterações metabólicas diversas, maternas (diabetes, excessivo suprimento de glucose por via parentérica intra-parto, tocolíticos beta-simpaticomiméticos, etc.) ou neonatais (asfixia perinatal, hipotermia, restrição de crescimento intra-uterino, hiperinsulinémia, excesso de peso para a idade gestacional, etc.) poderão resultar em perturbação do metabolismo da glucose no RN conduzindo a hipoglicémia.
No RN de termo saudável alimentado nas primeiras 4 horas de vida verifica-se em geral glicémia superior a 40 mg/dL.
A hiperglicémia é rara no RN de termo.
Adaptação renal
Funções do rim
O rim tem numerosas funções: regula o volume e a composição do líquido extracelular, participa na manutenção do equilíbrio ácido-base, elimina os catabólitos azotados, activa a vitamina D, segrega a eritropoietina e sintetiza localmente prostaglandinas, endotelina, bradiquinina, NO e dopamina; é igualmente o alvo de numerosas hormonas extra-renais: vasopressina, hormona paratiroideia, aldosterona, catecolaminas, corticóides, etc.. Por intermédio do balanço do sódio e do sistema renina-angiotensina-aldosterona contribui para a regulação da pressão arterial. Sob o ponto de vista farmacológico, o rim constitui a via de eliminação de numerosos compostos activos ou dos seus catabólitos.
Rim fetal
No decurso da vida intra-uterina o feto não necessita dos seus rins, pois todas as funções homeostáticas são asseguradas pela placenta, a qual constitui um verdadeiro “rim artificial”.
A formação dos nefrónios processa-se numa sequência centrífuga e completa-se pela 35ª semana de gestação. O desenvolvimento da filtração glomerular e da perfusão renal têm uma evolução característica ao longo do último trimestre da gravidez. A maturação funcional é muito mais rápida do que o crescimento morfológico até à 35ª semana de gestação; a partir desta data verifica-se menor ritmo de incremento da filtração glomerular que passa a desenvolver-se paralelamente à massa renal.
A formação de urina pelo rim fetal começa entre a 9ª e 12ª semana de gestação.
A diurese, estimada por técnica ecográfica, é cerca de 10 mL/hora pela 32ª semana, atingindo cerca de 28 mL/hora no termo da gestação; a urina é hipotónica, com uma osmolalidade de cerca de 200 mOsm/kg H2O. No decurso do 2º trimestre verifica-se já um processo de reabsorção activa de glucose, cloro e sódio.
Nas situações de obstáculo da uretra o débito urinário pode ser < 2 mL/hora, verificando-se concomitantemente elevação da concentração urinária de sódio (> 100 mmol/L) e de cloro (> 90 mmol/L), assim como elevação da osmolalidade urinária (> 200 mOsm/kg/ H2O).
A indometacina (inibidor da síntese das prostaglandinas), que é utilizada na grávida como tocolítico, atravessa a placenta podendo diminuir a diurese fetal e originar oligoâmnio. Os inibidores da enzima de conversão da angiotensina utilizados como agentes anti-hipertensão podem igualmente originar oligo-anúria fetal e oligoâmnio.
Maturação renal pós-natal
Filtração glomerular e perfusão renal
Após o nascimento, o rim encarrega-se das funções homeostáticas até então desempenhadas pela placenta; em situações de normalidade a primeira micção do RN de termo verifica-se em cerca de 97% dos casos até às 24 horas de vida e em 100% até às 48 horas. A inexistência de diurese até às 24 horas no RN de termo levanta a suspeita clínica de patologia subjacente que importa investigar (por ex. hipóxia – isquémia, anomalias congénitas, fármacos administrados à mãe, etc.).
A filtração glomerular e a perfusão renal aceleram o ritmo desde as primeiras horas de vida extrauterina. A filtração glomerular, cerca de 20 mL/min x 1,73 m2 no RN de termo, duplica nas primeiras duas semanas (num adulto cuja superfície corporal média é cerca de 1,73 m2, a filtração glomerular atinge 100-120 mL/min). O desenvolvimento do débito plasmático renal segue uma evolução paralela, sendo que no período neonatal a maturação funcional é mais rápida que o crescimento morfológico.
No RN pré-termo, a filtração glomerular, partindo dum nível mais baixo, desenvolve-se de modo rápido. Esta maturação depende de modificações anatómicas e hemodinâmicas:
- Crescimento glomerular;
- Elevação da pressão arterial;
- Diminuição da resistência vascular renal; e
- Aumento da superfície de filtração e da permeabilidade capilar.
Está igualmente associada a importantes alterações da concentração de hormonas vasoactivas:
- Diminuição da angiotensina II, das prostaglandinas, do péptido natriurético auricular (PNA ou ANP produzido nos miócitos da aurícula como resposta a hipoxémia ou a distensão da cavidade auricular); e da
- Endotelina.
A maturação da filtração glomerular traduz-se clinicamente por modificações da creatininémia. No pós-parto, o RN apresenta valores elevados da creatininémia que reflectem a concentração materna desta substância. A creatinina plasmática do RN de termo diminui rapidamente e estabiliza por volta do 5º dia de vida num valor de cerca de 35 μmol/L. No RN pré-termo de muito baixo peso com cerca de 28 semanas de gestação e taxa de filtração glomerular muito mais baixa (cerca de 10 mL/min x 1,73 m2), o tempo necessário para excretar a creatinina materna é muito mais longo, podendo atingir 1 mês.
Regulação homeostática
A capacidade de diluição do RN de termo ou pré-termo é eficaz: a osmolalidade pode atingir valores até cerca de 40 mOsm/kg H2O. A capacidade de concentração no RN pré-termo é, pelo contrário, limitada em comparação com o adulto: osmolalidade urinária máxima de cerca de 680
mOsm/kg/H2O contra cerca de 1400 mOsm/kg/H2O no adulto; no RN pré-termo tal valor é < 680 mOsm/kg/H2O.
Tendo em conta a fraca capacidade de concentração, o RN de termo e, ainda mais, o RN pré-termo, necessitam de um volume mais importante de água para a excreção da carga osmótica diária.
Balanço do sódio
O rim desempenha papel primordial na regulação do balanço de sódio e, por conseguinte, na manutenção da osmolalidade e volume do líquido extracelular.
Como particularidades do mecanismo do balanço do sódio cabe referir:
- Existe equilíbrio, quer no RN, quer no adulto, entre a filtração e reabsorção de sódio;
- A fracção excretada de sódio (FeNa ou percentagem de sódio filtrado não reabsorvido e excretado) na data de nascimento está inversamente correlacionada o com a idade gestacional; e, mais tarde, com a idade pós-natal. Este facto dificulta a interpretação dos valores de FeNa no RN pré-termo com suspeita de insuficiência renal aguda;
- Os RN pré-termo (e em menor grau os RN de termo) evidenciam incapacidade para excretar excesso de sódio resultante de suprimento excessivo do mesmo (por menor filtração glomerular, actividade aumentada do sistema renina-angiotensina-aldosterona, perfusão preferencial dos glomérulos juxtaglomerulares em detrimento dos corticais, etc.); tal conduz a balanço positivo em sódio;
- Os RN pré-termo evidenciam incapacidade para reter sódio em situações de carência do mesmo (por resistência parcial do túbulo renal distal à aldosterona, entre outros factores);
- As perdas de água transepiderme, muito elevadas no RNMBP, poderão originar hipernatrémia mesmo que o suprimento em sódio não seja excessivo;
- No RN pré-termo de muito baixo peso é relevante considerar o período inicial em que ocorre, paralelamente à perda de peso, contracção do espaço extracelular que contém sódio; uma vez que a referida contracção corresponde a passagem de sódio do espaço extravascular para o vascular, haverá que adoptar prudência na prescrição de sódio em tal período de adaptação.
Equilíbrio ácido-base
A regulação do equilíbrio ácido-base é relativamente eficaz no RN. Este excreta, desde os primeiros dias, os ácidos produzidos pela oxidação dos substratos metabólicos e reabsorve os bicarbonatos filtrados.
Existe igualmente capacidade para diminuir o pH urinário em situação de acidose metabólica (valores mais baixos no RN de termo); os valores mais baixos são atingidos proporcionalmente a partir da 2ª semana de vida.
Tendo em conta o baixo limiar de excreção urinária, é importante referir as diferenças de comportamento no RN de termo e no pré-termo; no primeiro caso a concentração de bicarbonato plasmático é cerca de 20-22 mmol/L e, no segundo caso, 18-20 mmol/L.
Actividade da renina plasmática (ARP)
Na data do nascimento a concentração da RP no RN de termo é cerca de 10-12 ng/mL/hora; tal concentração vai diminuindo até cerca de 1 ng/mL/hora pelos seis anos de idade, valor que se mantém até à idade adulta.
Os principais estímulos para a libertação de renina são mediados pela PG-E2 e PG-I1. Ora, a excreção urinária destas prostaglandinas é relativamente maior nos RN pré-termo, variando de modo inversamente proporcional à idade de gestação.
Carga de soluto renal
A quantidade de água necessária para a formação da urina depende, não só da função renal, mas também da chamada carga de soluto renal. Esta última deriva, quer de produtos do catabolismo tecidual quando o suprimento energético e proteico é insuficiente, quer do suprimento exógeno de proteínas e electrólitos. Por sua vez, para o rim excretar a carga de soluto renal através da urina, necessita de água cujo volume deve oscilar entre 40 mL/kg/dia inicialmente, e 60-80 mL/kg dia nas semanas subsequentes.
Adaptação hematológica
Tendo em consideração que determinados tópicos relacionados com esta alínea foram analisados noutros capítulos, é dada ênfase à transfusão placentar e à dinâmica dos neutrófilos.
Transfusão placentar
A prática corrente tem sido proceder à laqueação entre os 30 e 60 segundos de vida extrauterina, considerando que o RN e placenta são colocados no mesmo plano da vulva (salientando-se que as normas actuais recomendam tempo não inferior a 1 minuto).
Estudos muito recentes (Junho de 2021) advogam diferir a laqueação do cordão até cerca de 3 minutos em RN de termo, com vantagens no neurodesenvolvimento.
Recordando que o volume total de sangue (da placenta + do RN de termo) varia entre 115-120 mL/kg, e que o valor da volémia do RN em idênticas circunstâncias varia entre 70-100 mL/kg, compreende-se que a placenta constitui um reservatório importante de sangue, podendo influenciar a volémia do RN.
A posição da placenta cerca de 50 cm acima do plano do RN favorece a transfusão placenta-feto, enquanto a posição inversa favorece a transfusão feto-placenta.
Se a laqueação for precoce (< 30 segundos) com RN-placenta-vulva no mesmo plano, obtém-se, na ausência de anomalias hematológicas prévias ou de patologia associada, hematócrito ~ 48-50%; se a laqueação tiver lugar aos 30 segundos, obtém-se incremento do valor de Hb em + 2g/dL; se ao cabo de 3 minutos, o valor da transfusão placento-fetal é cerca de 25-50 mL/kg (o que conduz a incremento da volémia de ~ +50%).
Dinâmica dos neutrófilos
Entre as 12 e 24 horas após o nascimento verifica-se elevação do número de neutrófilos, diminuindo depois até às 72 horas, mantendo-se com número relativamente estável a partir desta data; a relação entre número absoluto de neutrófilos imaturos e o número absoluto de neutrófilos totais é < 0,2. Nas situações de estresse perinatal tais, como infecção perinatal, asfixia, eclâmpsia, etc., aumenta a proporção de neutrófilos imaturos.
Adaptação neurológica e comportamental do RN
No que respeita aos ritmos circadianos, os chamados ritmos diurnos encontram-se no feto desde as 20 semanas, possivelmente relacionados com os ritmos de melatonina materna.
O comportamento do RN no pós-parto, designadamente no que respeita à actividade motora e alternância de sono-vigília, pode ser influenciado por factores diversos tais como analgesia materna, anestesia intraparto, toxicodependência materna, etc..
Nos primeiros 120 minutos pós-parto o RN está alerta, executa movimentos de rotação da cabeça, de flexão e extensão dos membros, movimentos de sucção e simile mastigação, evidenciando mímica semelhante a “caretas”, e movimentos mioclónicos dos globos oculares.
Após os primeiros 120 minutos começa a verificar-se alternância de períodos de actividade com períodos de sono; o sono activo pode oscilar em períodos de minutos a cerca de 4 horas; no entanto, este processo de ritmo circadiano pós-natal (alternância sono-vigília em relação com os níveis de cortisol e melatonina) poderá levar entre 8 e 12 semanas e estabilizar.
De salientar que tais fases evolutivas podem sofrer alteração como resultado de determinadas situações como toxicodependência, diabetes materna, e restrição do crescimento intra-uterino.
A hemorragia intracraniana secundária a traumatismo do nascimento pode ser considerada uma anomalia da adaptação fetal à vida extrauterina; tal como a asfixia, poderá traduzir-se por apneia ou convulsões nas 48 horas a seguir ao parto. Apneia e convulsões poderão também ocorrer secundariamente a hipoglicémia, hipocalcémia, abstinência de drogas ou policitémia.
Outras formas de adaptação
Resistência do cérebro à hipóxia perinatal
Durante a vida intra-uterina as necessidades do encéfalo em energia e em oxigénio são mais baixas em relação ao RN, à criança maior e ao adulto (menor idade <> neurónios mais pequenos, menos ramificados e com menor número de sinapses); contudo, tais necessidades aumentam com a idade gestacional. De salientar que o encéfalo imaturo, com capacidade glicolítica anaeróbia, utiliza como alternativa, entre outras fontes energéticas, os corpos cetónicos.
O período de transição feto-RN é também acompanhado de alterações neuroquímicas importantes. A concentração de aminoácidos excitatórios, tais como o glutamato atingindo a concentração máxima no termo da gestação, poderá contribuir para maior sensibilidade à hipóxia no RN de termo em comparação com o pré-termo.
Activação de genes
O trabalho de parto interfere no mRNA no que respeita à codificação dum certo número de enzimas (tais como hidroxilase da tirosina e a betahidroxilase da dopamina), e de compostos (como a chamada substância P). Esta última, produzida no tractus solitarius, evidencia uma concentração que aumenta significativamente nos primeiros dias de vida; admite-se que possa ter papel de regulação no automatismo respiratório como mediador na estimulação de quimiorreceptores em situações de hipóxia.
Índice de Apgar
O chamado índice de Apgar, criado em 1953 nos EUA por Virgínia Apgar, é um método de avaliação vital do RN, traduzindo a adaptação imediata do feto à vida extrauterina (ao 1 minuto e 5 minutos; e, eventualmente, também aos 10 minutos e 15 minutos). De modo estruturado, são avaliados 5 parâmetros, a cada um dos quais é atribuída respectivamente a pontuação de 0 ou 1 ou 2. (Quadro 3)
QUADRO 3 – Índice de APGAR.
| 0 | 1 | 2 | |
| Frequência cardíaca | ausência de batimentos | < 100/min | > 100/min |
| Respiração | apneia | irregular | choro forte |
| Irritabilidade reflexa | ausente | fraca | boa |
| Cor da pele | palidez | cianose | rosada |
| Tono muscular | hipotonia marcada | flexão ligeira das extremidades | flexão franca das extremidades actividade motora |
De acordo com a pontuação verificada, é possível dividir as situações encontradas em 4 grupos:
- 0 <> feto morto;
- 1-3 <> depressão grave;
- 4-6 <> depressão ligeira a moderada;
- 7-10 <> boa vitalidade ou boa adaptação à vida extrauterina.
Sugere-se a consulta do Capítulo sobre Reanimação Neonatal.
Como notas importantes relativamente a este critério de avaliação, cabe acentuar:
- Trata-se dum instrumento que orienta quem assiste ao parto sobre a eventual necessidade de executar manobras de reanimação (o principal interesse deste critério);
- Índice de Apgar baixo (depressão ou adaptação difícil) não traduz necessariamente situação de asfixia perinatal, nem de probabilidade de sequelas futuras;
- Em situações específicas acompanhadas de valor baixo persistente (< 3) até aos 15 minutos existe, de facto, probabilidade de sequelas neurológicas.
Nota – Sobre as limitações do índice da Apgar, designadamente em situações de prematuridade, e quanto ao significado do parâmetro “cor da pele”, consultar o Capítulo sobre Reanimação Neonatal.
BIBLIOGRAFIA
Andersson O, Mercer JS. Cord management of the term newborn. Clin Perinatol 2021; June: 447-470
Apgar V. A proposal for a new method of evaluation of the newborn infant. Anesth Analg 1953; 32: 260-263
Bancalari E, Eisler E. Neonatal respiratory support. In Kirby RR et al (eds). Mechanical Ventilation. New York: Churchill Livingstone, 1995
Britton JR. The transition to extrauterine life and disorders of transition. Clin Perinatol 1998; 25: 271-294
Cloherty JP, Eichenwald EC, Strak AR. Manual of Neonatal Care. Philadelphia; Lippincott Williams & Wilkins, 2008 Davis PG, Dawson JA. New concepts in neonatal resuscitation. Curr Opin Pediatr 2012; 24: 147-153
Dukarm RC, Steinhorm RH, Morin FC. The normal pulmonary vascular transition at birth. Clin Perinatol 1996; 23: 711-726
Garcia JJ, Cruz O, Mintegi S, Moreno JM (eds). M Cruz Manual de Pediatria. Madrid: Ergon, 2020
Greenough A, Milner AD (eds). Neonatal Respiratory Disorders. London: Arnold, 2006
Hillman NH, Kallapur SG, Jobe AH. Physiology of transition from intrauterine to extrauterine life. Clin Perinatol 2012; 39: 769-783
Hooper SB, Pas AB, Kitchen M. Respiratory transition in the newborn. Arch Dis Child Fetal Neonatal Ed 2016; 101: F266-271
Hooper SB, Polglase GR, Roeher Ch. Cardiopulmonary changes with aeration of the newborn lung. Pediatr Resp Rev 2015; 16: 147-150
Kirby RR, Smith RA, Desautels DA (eds). Mechanical Ventilation. New York: Churchill Livingstone, 1985
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Manroe BL, Rosenfeld CR, Weinberg AG, Browne R. The neonatal blood count in health and disease. I- Reference values for neutrophilic cells. J Pediatr 1979; 95: 89-98
McInerny T(ed). Tratado de Pediatria /American Academy of Pediatrics. Madrid: Panamericana, 2010
Kurjak A(ed). Textbook of Perinatal Medicine. London: Parthenon, 1998
McIntosh N, Helms P, Smyth R, Logan S (eds). Forfar and Arneil´s Textbook of Pediatrics. London: Churchill Livingstone, 2008
Moro M, Málaga S, Madero L (eds). Cruz. Tratado de Pediatria. Madrid: Panamericana, 2015
Platt MPW. The antenatal diagnosis of fetal anomaly: where to deliver the baby? Arch Dis Fetal Neonatal Ed 2013: 98:F190-F191
Polin RA, Yoder MC. Workbook in Practical Neonatology. Philadelphia: Elsevier Saundders, 2015
Raju TNK. Timing of umbilical cord clamping after birth for optimizing placental transfusion. Curr Opin Pediatr 2013; 25: 180-187
Rao R, Bora R. Timing of umbilical cord clamping and infant brain development. J Pediatr 2108; 203: 8-9
Trines J, Hornberger LK. Evolution of heart in utero. Pediatr Cardiol 2004; 25: 287-298
Uslu S, Bulbul A, Can E, et al. Relationship between oxygen saturation and umbilical cord immediately after birth. Pediatrics and Neonatology 2012; 53: 340-345
Yu VYH (ed). Pulmonary Problems in the Perinatal Period and their Sequelae. London: Baillère Tindall, 1995