Definição e etiopatogénese
A designação de síndroma de Cushing aplica-se às situações clínicas causadas por concentração excessiva de glucocorticóides em circulação, resultante de administração exógena, ou de secreção endógena.
Apesar de se tratar dum quadro clínico raro na criança, coloca algumas vezes problemas de diagnóstico diferencial em casos de obesidade.
As causas da síndroma de Cushing estão descritas no Quadro 1, sendo mais frequente a relacionada com administração de corticóides para tratamento de várias doenças.
QUADRO 1 – Causas de síndroma de Cushing
| 1. Dependente de ACTH |
|
| 2. Independente de ACTH |
|
Nas crianças com menos de 7 anos as causas adrenais são as mais frequentemente implicadas na etiologia da síndroma de Cushing.
Manifestações clínicas
Os sintomas mais frequentes na criança são aumento de peso e obesidade, associados a baixa estatura e atraso da idade óssea, ao contrário do que habitualmente acontece na obesidade exógena. (Figura 1)
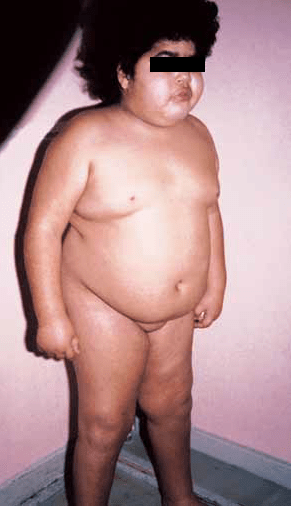
FIGURA 1. Obesidade no contexto de síndroma de Cushing
Podem também existir: fácies peculiar designada habitualmente cushingóide, acne, hirsutismo/hipertricose, alterações menstruais ou atraso de progressão da puberdade, cefaleias, hipertensão arterial, hiperpigmentação, fadiga ou astenia, pele fina, estrias purpúreas e equimoses. A diminuição das massas musculares dos membros não é habitualmente muito marcada nas crianças. Mais raramente, verificam-se ainda: alterações psíquicas tais como depressão, irritabilidade e alterações do sono, osteopénia, cálculos renais, edema, necrose avascular da cabeça do fémur ou deslizamento da epífise da cabeça do fémur. Este quadro instala-se, em geral, de forma insidiosa, decorrendo em média 3 anos desde o início dos primeiros sintomas até ao diagnóstico; esta progressão lenta é evidente quando existem fotografias do doente ao longo dos anos.
A hiperplasia nodular associada ou não à síndroma de Carney (mixomas cardíacos e cutâneos, hiperactividade endócrina, lesões cutâneas lentiginosas, nevus azuis da pele e mucosas) caracteriza-se por obesidade, grande diminuição das massas musculares, osteoporose e hiperprodução cíclica de corticóides.
Exames complementares
O diagnóstico da síndroma, bem como da sua etiologia, pode ser muito difícil; com efeito, apesar de protocolos de diagnóstico muito elaborados, não há exame 100% sensível ou específico. O diagnóstico etiológico obriga a estudos endocrinológicos e de imagiologia para esclarecimento. A maioria destes exames só está disponível nalguns centros especializados. Assim, e face à suspeita clínica apoiada em determinados exames auxiliares, a criança deverá ser enviada para esclarecimento a uma consulta de Endocrinologia Pediátrica.
Os exames laboratoriais podem revelar:
- Hemoglobina, hematócrito e eritrócitos no limite superior do normal;
- Leucopénia e eosinopénia;
- [Na+] dentro dos limites dos limites normais e ↓ [K+];
- Hiperglicémia ou alteração da prova de tolerância à glucose;
- Elevação do valor das lipoproteínas (VLDL, HDL, LDL);
- Hipercalcémia e hipercalciúria.
As determinações endocrinológicas que permitem a confirmação ou a exclusão da síndroma de Cushing são:
- Determinação da excreção de cortisol livre em urina de 24 horas, em 3 dias;
- Estudo do ritmo circadiano do cortisol [9h, 18h, meia-noite (a dormir)]; o valor normal do cortisol à meia-noite a dormir é < 1,8 ug/dl;
- Teste de supressão com dexametasona em dose baixa [0,5 mg (doentes com peso > 40 Kg) ou 30 ug/kg/d (doentes com peso < 40 kg)] de 6/6h (9, 15, 21, 3h) durante 48h com determinação do cortisol sérico no tempo 0 e 6h depois da última administração; o cortisol sérico deverá ser indetectável às 48h (< 1,8 ug/dl) nos casos normais.
Em caso de resultados negativos, face a forte suspeita clínica, dever-se-ão repetir os doseamentos, pois poderá existir apenas hipercortisolismo cíclico.
Tratamento
A terapêutica é variável consoante a etiologia, devendo ser individualizada consoante o doente. Na doença de Cushing está indicada a remoção do adenoma hipofisário por cirurgia transesfenoidal. Esta técnica neurocirúrgica é especialmente difícil nas crianças, e mesmo com neurocirurgiões experientes pode haver 50% de recidivas que obrigam a radioterapia. Pelo contrário, há também o risco de a remoção originar defeitos múltiplos da secreção hipofisária, obrigando a terapêutica de substituição.
BIBLIOGRAFIA
Auron M, Raissouni N. Adrenal insufficiency. Pediatr Rev 2015; 36: 92-104
Bertrand J, Rappaport R, Sizonenko. Pediatric Endocrinology Physiology, Pathophysiology, and Clinical Aspects. Philadelphia: Lippincott Williams & Wilkins, 2003
Cooper MS, Stewart PM. Corticosteroid supplementation in acutely ill patients. NEJM 2003; 348: 727-734
Goldman L, Schafer AI (eds). Goldman – Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lodish MB, Keil MF, Stratakis CA. Cushing’s syndrome in Pediatrics: An Update.
Endocrinol Metab Clin North Am 2018; 47: 451-462. doi: 10.1016/j.ecl.2018.02.008.
Miller BS, Spencer SP, Geffner ME, et al. Emergency management of adrenal insufficiency in children: advocating for treatment options in outpatient and field settings. J Investig Med 2019; 0: 1–10. doi:10.1136/jim-2019-000999
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Newell-Price J, Bertagna X, Grossman AB, et al. Cushing´s syndrome. Lancet 2006; 367: 1605-1617
Niemen LK. Recent updates on the diagnosis and management of Cushing’s syndrome. Endocrinol Metab (Seoul) 2018; 33: 139-146.
doi: 10.3803/EnM.2018.33.2.139
Nieman LK, Biller BM, Findling JW, et al. The diagnosis of Cushing’s syndrome: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008; 93: 1526-1540
Pescovitz OH, Eugster EA. Pediatric Endocrinology: Mechanisms, Manifestations, and Management. Philadelphia: Lippincott Williams & Wilkins, 2004
Pombo MA. Tratado de Endocrinologia Pediatrica. Madrid: Ediciones Diaz de Santos, 1997.
Radovick S, Misra M (eds). Pediatric Endocrinology. A Practical Clinical Guide. Berlin: Springer, 2018
Stratakis CA. Cushing syndrome in Pediatrics. Endocrinol Metab Clin N Am 2012; 41: 793-803
Ten S, New M, Maclaren N. Addison‘s disease 2001. J Clin Endocrinol Metab 2001; 86: 2909-2922