Definição e etiopatogénese
A insuficiência suprarrenal deve-se, como o nome indica, às consequências da incapacidade de produção de glucocorticóides (cortisol) e mineralocorticóides (aldosterona).
Pode ser provocada por grande número de situações (congénitas ou adquiridas) as quais podem ser divididas em dois grandes grupos: primárias quando a causa reside na suprarrenal; e secundárias quando se deve a insuficiente estimulação do córtex suprarrenal pela hipófise anterior (ACTH) ou hipotálamo (CRH). (Quadro 1)
QUADRO 1 – Causas de insuficiência suprarrenal
Adaptado de Pombo M, et al, 1997 | |
| A – Insuficiência suprarrenal primária (↓ Cortisol, ↑ ACTH / CRH) | |
Congénita
| Adquirida
|
| B – Insuficiência suprarrenal secundária (↓ Cortisol, ↓ ACTH / CRH) | |
Congénita
| Adquirida
|
Sob o ponto de vista etiopatogénico, a insuficiência suprarrenal primária pode dividir-se em 3 grandes grupos: disgenésia/hipoplasia da suprarrenal que inclui as alterações dos genes SF-1, DAX-1/NR0B1 e receptor de ACTH; destruição da suprarrenal por mecanismos auto-imune, infeccioso, hemorrágico ou adrenoleucodistrofia; alterações da esteroidogénese por anomalias da síntese de colesterol (abetalipoproteinémia e síndroma de Smith-Lemli-Opitz); ou por anomalias da síntese de esteróides (hiperplasia congénita da suprarrenal).
Na criança, se excluirmos a insuficiência iatrogénica pós-corticoterapia local ou sistémica, a causa mais frequente é a hiperplasia suprarrenal congénita, já descrita. Por isso serão abordadas as outras causas de insuficiência. A idade e o sexo da criança são importantes para o diagnóstico etiológico. (Quadro 2)
QUADRO 2 – Causas de insuficiência suprarrenal de acordo com idade e sexo
| Adaptado Ten S, et al, 2001 | |||
| Sexo | 0-2 anos | > 2-14 anos | > 14 anos |
| Masculino |
|
|
|
| Feminino |
|
|
|
Manifestações clínicas
A carência em glucocorticóides traduz-se clinicamente por: astenia (díficil de valorizar nas crianças), anorexia, cansaço fácil, perda de peso ou má progressão ponderal, infecções recorrentes, sintomas gastrintestinais (náuseas, vómitos, dor abdominal, diarreia) e hipoglicémia.
A carência em mineralocorticóides traduz-se por hipovolémia, hipotensão postural, taquicárdia e, por vezes, choque.
Inicialmente pode apenas existir sintomatologia de uma das duas linhas, aparecendo depois os sintomas de insuficiência da outra.
Os sinais e sintomas de insuficiência suprarrenal podem instalar-se de forma lenta e progressiva, ou de forma aguda (1/3 dos casos). Os sintomas da crise aguda são: dor abdominal intensa, febre, obnubilação, alteração do estado de consciência, desidratação desproporcionada para a perda de líquidos calculada, e colapso cardiocirculatório. A crise aguda pode ser precipitada por vómitos, infecção intercorrente banal, traumatismo, intervenção cirúrgica, estadia em país quente, paragem de corticoterapia prolongada ou não aumento da dose de substituição em situação de estresse. Habitualmente a evolução é lenta (4 anos, em média); os seus sintomas são vagos e inespecíficos, o que dificulta o diagnóstico; muitas vezes, o défice crónico só diagnosticado aquando da descompensação aguda, pode mesmo confundir-se com doença psiquiátrica.
A clínica é também diferente se se tratar de lesão da própria glândula com eixo hipotálamo-hipofisário funcionante, ou se a insuficiência for secundária.
Assim, se a insuficiência for de causa suprarrenal a produção de glucocorticóides e a de mineralocorticóides encontra-se afectada; se a causa se localizar ao nível do eixo hipotálamo-hipofisário apenas a via glucocorticóide está alterada, pois a secreção de mineralocorticóides depende, sobretudo, do sistema renina-angiotensina-aldosterona.
No primeiro caso, a elevação da ACTH por falta de retrocontrolo produz hiperpigmentação da pele e mucosas, que é mais marcada na palma das mãos, pregas de flexão, cicatrizes, mucosa oral, mamilos, escroto e grandes lábios.
No segundo caso descreve-se uma pele “de alabastro” por ausência de estimulação melanocítica.
Exames complementares
A suspeita clínica obrigará à realização de um conjunto de exames complementares em centro especializado cujos resultados são orientadores.
1. Exames auxiliares gerais
Exames de sangue e outros:
- ↓[Na+], ↑[K+], ↓[Cl–] plasmáticos, podendo ser normais fora da crise aguda
- ↑Ureia e creatinina
- Anemia normocítica moderada
- ↑Hematócrito
- ↑Proteínas plasmáticas
- Neutropénia com linfocitose relativa
- Eosinofilia
- Hipoglicémia
- Acidose metabólica moderada
- Cetonémia
- Radiografia de tórax PA: coração “pequeno”
- ECG: diminuição da voltagem, QRS vertical e amplo, segmento QT alterado, ondas T aplanadas
Exame de urina:
- [Na+] urina ↑ ou normal apesar de [Na+] no plasma↓
2. Exames endocrinológicos
Na insuficiência suprarrenal aguda só é geralmente possível colher uma única amostra de sangue para os doseamentos endocrinológicos, dada a urgência do início da terapêutica.
Determinações basais
- Cortisol plasmático (entre as 8.00 – 9.00 horas): < 10 µg/dL
- 17OH-progesterona, Δ4-androstenediona, testosterona, 17OH-pregnenolona, DHEA, DHEA-S, desoxicortisol: normais
- ACTH ↑ na insuficiência primária; ACTH normal, ou pouco elevada para os níveis de cortisol plasmático na insuficiência secundária
- PRA ou renina activa normal ou ↑
Testes dinâmicos
- Prova de estimulação pela ACTH (Synacthen®) por via endovenosa:
- Cortisol aos 60 minutos depois da administração de ACTH: < 18 µg/dL ou inferior a 2 vezes o valor basal
- Aldosterona aos 60 minutos depois da administração de ACTH: < 80 ng/dL ou inferior a 3 vezes o valor basal
- Prova de estimulação pelo glucagom ou pela hipoglicémia insulínica para avaliação da reserva funcional da suprarrenal:
- < 18 µg/dL ou subida < 8 µg/dL em relação ao valor basal
Nota: Estas provas permitem determinar também a resposta da hormona de crescimento (GH), importante no hipopituitarismo.
FORMAS CLÍNICAS
1. Insuficiência suprarrenal primária
Doença de Addison
É o paradigma da insuficiência suprarrenal primária descrita acima. Muitas vezes idiopática, deve-se à destruição progressiva do córtex suprarrenal por mecanismo autoimune, infeccioso, infiltrativo, hemorrágico ou traumático. Associa-se à presença de autoanticorpos e, por vezes, a doença de outros órgãos no quadro das várias síndromas poliglandulares autoimunes.
A história natural desta afecção é muito lenta, sendo diagnosticada após anos de evolução, uma vez que os sintomas são muito inespecíficos.
Nos doentes com doenças autoimunes a pesquisa de autoanticorpos em presença de sinais mínimos de insuficiência suprarrenal (por exemplo, hipoglicémias graves ou frequentes em doentes com diabetes mellitus tipo 1) ou nas famílias com casos de síndromas poliglandulares autoimunes, o rastreio sistemático da presença poderá permitir o diagnóstico em fase inicial, ou mesmo subclinical, da doença. (Quadro 1)
Síndroma poliglandular autoimune de tipo I (APECED)
O seu acrónimo tem como significado a associação de candidíase mucocutânea crónica, poliendocrinopatia (hipoparatiroidismo e insuficiência suprarrenal) e distrofia ectodérmica (Autoimmune PolyEndocrinopathy, Candidiasis, Ectodermal Dystrophy). É uma doença esporádica, por vezes familiar, com uma incidência variável. Associa-se a mutação do gene AIRE, localizado no cromossoma 21q22.3.
As manifestações clínicas são múltiplas, surgindo ao longo da vida do doente; quanto mais precoce é a primeira manifestação, tanto mais componentes irão, provavelmente, aparecer.
São manifestações major as seguintes: candidíase mucocutânea crónica, hipoparatiroidismo, insuficiência suprarrenal; como manifestações minor citam-se: hipogonadismo hipergonadotrófico, doença auto-imune da tiroideia, diabetes mellitus tipo 1, hipofisite.
Outras manifestações incluem: alopécia, vitíligo, ceratopatia, anemia perniciosa, gastrite atrófica, má-absorção e/ou esteatorreia, hepatite crónica activa, colelitíase, vasculite, asplenia, distrofia ectodérmica e síndroma de Sjögren*
*A síndroma de Sjögren constitui um problema inflamatório crónico autoimune em que se verifica infiltração progressiva de linfócitos e plasmócitos nas glândulas salivares, lacrimais e parótida. Daí os sintomas oculares (boca e olhos “secos” /xeroftalmia, xerostomia), e parotídeos. |
A primeira manifestação clínica da doença é, em geral, a candidíase que aparece, habitualmente, durante o primeiro ano de vida. Trata-se de lesões da mucosa oral por Candida albicans, os vulgares “sapinhos” dos lactentes, que se tornam crónicas ou recorrentes; pode também existir candidíase cutânea, ungueal ou vulvovaginal. Em 3/4 dos casos, a primeira doença endócrina é o hipoparatiroidismo, a que se segue a insuficiência suprarrenal; inicialmente a tetania por hipocalcémia poderá só ocorrer em jejum, ou ser tão vaga que o doente parece ser só “desajeitado”. O hipogonadismo é mais frequente no sexo feminino (60%). A distrofia ectodérmica traduz-se por hipoplasia do esmalte dentário, perfurações punctiformes das unhas e atrofia da membrana do tímpano. (Figura 1)
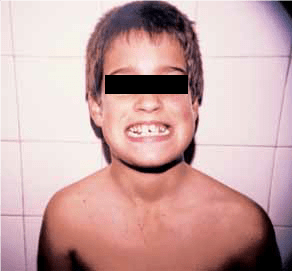
FIGURA 1. Síndroma poliglandular auto-imune do tipo I. Hipoplasia do esmalte dentário e pigmentação da mucosa bucal.
Síndroma poliglandular auto-imune de tipo II
É mais frequente que a síndroma de tipo I descrita. Em 50% dos casos trata-se de uma situação familiar (autossómica dominante com penetrância incompleta), sendo mais frequente no sexo feminino. Está associada a determinados fenótipos do complexo major de histocompatibilidade (HLA).
Caracteriza-se pela associação de doença de Addison ou evidência serológica de anticorpos anti-suprarrenal, doença autoimune da tiroideia (em geral hipotiroidismo nas crianças), diabetes mellitus do tipo 1 e outras doenças auto-imunes como vitíligo, gastrite atrófica e doença celíaca.
Adrenoleucodistrofia
Definição e importância do problema
É uma doença metabólica, recessiva ligada ao cromossoma X (Xq28) causada pela mutação do gene ABCD1 que codifica a proteína ALDP ou ABCD1, uma proteína da membrana do peroxissoma pertencente à superfamília de transportadores ATP-binding cassette e que promove o transporte dos ácidos gordos de cadeia muito longa (AGCML) do citosol para o interior do peroxissoma.
Etiopatogénese e aspectos epidemiológicos
Caracteriza-se bioquimicamente pela acumulação de ácidos gordos de cadeia média e longa (AGCML) nos tecidos levando a lesão desmielinizante da substância branca do sistema nervoso central e periférico e lesão do córtex suprarrenal. Desconhecem-se actualmente os mecanismos fisiopatológicos que ligam o excesso de AGCML à degenerescência axonal e à inflamação e desmielinização.
A sua incidência é de 1/17.000 recém-nascidos e a sua prevalência 1/20.000 a 1/50.000 indivíduos; trata-se da doença peroxissomal mais frequente.
Formas clínicas
Existem duas formas fenotípicas principais da doença: a adrenoleucodistrofia cerebral e a adrenomieloneuropatia, não existindo qualquer correlação genótipo/fenótipo.
A adrenomieloneuropatia é a forma mais frequente. Manifesta-se, em geral, na idade adulta, envolve predominantemente a medula e nervos periféricos e a sua progressão é lenta. No entanto, cerca de 20% dos doentes do sexo masculino acabam por desenvolver a forma cerebral da doença.
A adrenoleucodistrofia cerebral tem início na criança (sempre depois dos 2,5 anos), adolescente ou mesmo, no adulto. Inicialmente existe uma fase de desmielinizante lenta que é clinicamente assintomática ou apenas se traduz por ligeiras alterações cognitivas. Depois, e de forma imprevisível, inicia-se uma fase inflamatória intensa com desmielinização rápida e progressiva afectando primariamente os hemisférios cerebrais; quanto mais precoce o início desta fase, tanto mais rápida a progressão da doença, a qual se torna rapidamente progressiva e devastadora. Clinicamente traduz-se por perturbações do comportamento, insucesso escolar, disartria, cegueira, surdez e demência progressiva, até à morte, 2 a 5 anos depois. A realização de RM cranioencefálicas semestrais nas crianças entre os 3-12 anos permite detectar as alterações características da substância branca cerca de 6 meses antes da disfunção cognitiva. Cerca de 10% dos doentes com adrenoleucodistrofia cerebral não chegam a desenvolver a fase aguda da doença.
A insuficiência suprarrenal ocorre em cerca de 2/3 dos doentes do sexo masculino afectados. Os sintomas da insuficiência suprarrenal podem, em especial quando se iniciam antes dos 15 anos, preceder os sintomas neurológicos, podendo, também, coexistir ou desenvolver-se após a disfunção neurológica. Por outro lado, a insuficiência suprarrenal pode ser assintomática, diagnosticada por doseamentos hormonais. O défice da linha mineralocorticóide acaba por ocorrrer ao longo da vida em 50% dos doentes.
A partir da adolescência pode existir cabelo fino e esparso e, nos homens adultos, insuficiência testicular.
Cerca de 65% das mulheres portadores podem vir a apresentar sintomas neurológicos que são menos graves tais como paraparésia espástica.
Na mesma família podem coexistir formas diferentes da doença; podendo existir formas assintomáticas, é importante proceder ao rastreio de toda a família quando se diagnostica um caso index.
Diagnóstico
O diagnóstico faz-se através do doseamento dos ácidos gordos de cadeia muito longa no sangue periférico; nos heterozigóticos poderão ser obtidos resultados falsamente negativos.
A confirmação do diagnóstico pode ser feita por estudo molecular para identificação da mutação do gene; há mais de 1500 mutações diferentes identificadas, 8 delas em famílias portuguesas.
O estudo por imagem (RM cranioencefálica semestral) permite avaliar e seguir ao longo do tempo as alterações da substância branca determinando a indicação do transplante. (ver adiante)
O diagnóstico pré-natal pode ser feito pela pesquisa de mutação.
Tratamento
A única medida com resultados positivos na progressão da desmielinização se realizada precocemente é o transplante de células estaminais hematopoiéticas. Estão também descritos 2 casos de terapêutica génica utilizando como vector um vírus lento com resultados sobreponíveis ao transplante.
Hipoplasia congénita da suprarrenal
A hipoplasia congénita da suprarrenal é clinicamente muito semelhante à hiperplasia congénita da suprarrenal: má progressão ponderal, perda de sal e convulsões causadas por hipoglicémia. Distinguem-se quatro formas: esporádica, miniatura, citomegálica e citomegálica associada a deleção de genes contíguos.
A chamada hipoplasia citomegálica é uma doença recessiva ligada ao cromossoma X. O gene (DAX-1), cuja mutação provoca a doença, tem uma localização próxima dos genes que codificam o défice de glicerolcinase e a distrofia muscular de Duchenne, pelo que estas patologias podem associar-se à hipoplasia citomegálica.
A insuficiência suprarrenal inicia-se, em geral, nas primeiras semanas de vida, com má progressão ponderal e perda de sal; pode ocorrer deterioração súbita e rápida da função suprarrenal, pondo em risco a vida do lactente se a perda de sal não for reconhecida. Acompanha-se de hipogonadismo hipogonadotrófico, traduzido clinicamente por criptorquidia e atraso pubertário.
A forma com deleção de genes contíguos tem pior prognóstico que a forma associada a deleção do gene DAX-1.
A hipoplasia miniatura é uma doença recessiva que se acompanha, por vezes, de puberdade precoce.
Doença de Wolman
É uma doença metabólica recessiva do metabolismo do colesterol que se deve ao défice da lipase ácida lisossómica, enzima que permite a formação de colesterol livre utilizável pelas células do organismo. É progressiva e fatal. A sintomatologia inicia-se na infância e traduz-se por sintomas de perda de sal, de défice glucocorticóide, esteatorreia e hepatosplenomegália.
Síndroma de Smith-Lemli-Opitz
Trata-se duma afecção transmitida de modo autossómico recessivo causada pela mutação do gene da enzima 7-dehidrocolesterol redutase, localizado no cromossoma 11q13.4; esta proteína cataboliza o passo final da síntese de colesterol levando à acumulação de 7-dehidrocolesterol e diminuição dos níveis séricos de colesterol. As manifestações fenotípicas podem ter gravidade variável. Os sinais físicos da doença relacionam-se com o grau das alterações bioquímicas; de salientar que as alterações do comportamento podem ocorrer em doentes com dismorfias discretas.
Como manifestações clínicas há a salientar: atraso do desenvolvimento psicomotor, alterações do comportamento e cognitivas, microcefalia, fácies característica com aspecto “em pera” (andar superior < andar inferior da face), fenda palatina, sindactilia em Y do 2º e 3º dedos dos pés, polegares de implantação externa, cardiopatia congénita, defeitos congénitos gastrintestinais e renais, masculinização variável do doente do sexo masculino (desde genitais externos normais, micropénis, hipospadia e criptorquidia até fenótipo feminino, neste último caso em 25% dos pacientes) e fotossensibilidade.
Nos casos mais graves pode existir insuficiência suprarrenal.
Hipoaldosteronismo
Existem dois tipos de défice exclusivo da linha mineralocorticóide: a) por défice enzimático de corticosteronametiloxidase II que leva a incapacidade de síntese de aldosterona e, consequentemente, com aldosterona baixa e aumento da PRA; b) por alteração do receptor da aldosterona (pseudo-hipoaldosteronismo) que cursa com valores elevados de aldosterona. Ambos se traduzem clinicamente por perda de sal.
Resistência familiar à ACTH ou défice familiar de glucocorticóides
Os sinais e sintomas aparecem precocemente e caracterizam-se por episódios recorrentes de convulsões e hipoglicémia acompanhados por hiperpigmentação exuberante. Existem duas formas: a) défice isolado; b) défice associado a outras manifestações da síndroma de Allgrove (o qual é abordado a seguir).
Síndroma de Allgrove ou Síndroma dos 3/4A
É uma doença recessiva causada pela mutação de um gene localizado no cromossoma 12. É caracterizada pela associação: insuficiência suprarrenal, acalasia, alacrimia e alterações neurológicas, em especial do sistema nervoso autónomo [Adrenalcortical insufficiency associated with Achalasia, Alacrima (3A), Autonomic and other neurologic abnormalities (4A)].
Há grande variabilidade na idade e na forma de apresentação. A insuficiência suprarrenal é progressiva e deve-se à insensibilidade à ACTH; traduz-se por perda de sal, hipoglicémia e convulsões. As manifestações neurológicas são habitualmente precoces e traduzem-se por hiperreflexia, diminuição da força muscular, disartria, ataxia, défice de inteligência, diminuição da variabilidade cardíaca, hipotensão postural, diminuição do diâmetro e da velocidade de constrição pupilar, e diminuição da velocidade de condução nervosa. Os doentes apresentam fácies característica, hiperqueratose e também cicatrização difícil.
2. Insuficiência suprarrenal secundária
A insuficiência suprarrenal secundária, mais frequente que a primária, é geralmente iatrogénica e causada por tratamento com corticóides. Está descrita supressão do eixo-hipotálamo-hipófise-suprarrenal, quer com a administração por via sistémica, quer por via cutânea ou inalatória, (por exemplo com fluticasona ou budesonido, utilizados no tratamento preventivo da asma, mesmo com pequenas doses) não implicando também administrações muito prolongadas (2 semanas ou menos, de tratamento sistémico, por exemplo).
Se a causa não for iatrogénica, a insuficiência suprarrenal associa-se geralmente a outros défices hipofisários nomeadamente hormona de crescimento (GH) e TSH. Em tal circunstância a insuficiência é, em geral moderada, afectando apenas a linha glucocorticóide; por vezes, só é demonstrável pela prova de estimulação da suprarrenal.
Os achados laboratoriais são semelhantes aos descritos para a insuficiência primária, não existindo alteração da PRA/renina activa, pois a linha mineralocorticóide não se encontra afectada. No entanto, poderá existir hiponatrémia causada por secreção inapropriada de hormona antidiurética associada ao défice de cortisol.
A terapêutica de substituição e da crise aguda é igual à anteriormente pormenorizada para os casos de formas clássicas de hiperplasia congénita da suprarrenal, exceptuando no que respeita à distribuição das doses de hidrocortisona (a dose maior deve ser administrada de manhã, a fim de imitar o ciclo de cortisol).
Nos casos de insuficiência suprarrenal secundária, a dose a administrar poderá ser menor que nas formas primárias. No entanto, em caso de estresse agudo, a dose preconizada é 40-60 mg/m2, não sendo suficiente duplicar ou triplicar a dose habitual. A adequação da terapêutica baseia-se em dados clínicos – melhoria da astenia, cansaço fácil, falta de forças, sensação de bem-estar – e não em doseamentos laboratoriais.
A educação do doente/família é fundamental a fim de evitar as descompensações agudas que podem ser muito graves ou mesmo fatais. Assim, quem presta os cuidados, deve ter instruções formais, por escrito das situações de estresse (febre alta > 38°C, vómitos, diarreia, letargia, intervenção cirúrgica, traumatismos, tratamentos dentários, etc.) em que a dose de hidrocortisona deve ser aumentada; esta dose deve ser actualizada pelo menos uma vez por ano. A criança deve ser sempre portadora de cartão de alerta médico descrevendo a sua situação clínica, a terapêutica realizada habitualmente e a dose prescrita para situações de estresse.
BIBLIOGRAFIA
Auron M, Raissouni N. Adrenal insufficiency. Pediatr Rev 2015; 36: 92-104
Bertrand J, Rappaport R, Sizonenko. Pediatric Endocrinology Physiology, Pathophysiology, and Clinical Aspects. Philadelphia: Lippincott Williams & Wilkins, 2003
Cooper MS, Stewart PM. Corticosteroid supplementation in acutely ill patients. NEJM 2003; 348: 727-734
Engelen M, Kemp S, Visser M, Geel BM, Wanders RJA, Aubourg P, Poll-The BT. X-Linked adrenoleukodystrophy (X-ALD): clinical presentation and guidelines for diagnosis, follow-up and management. Orphan J Rare Dis 2012; 7: 51-54
Eyal O, Levin Y, Oren A, et al. Adrenal crises in children with adrenal insufficiency: epidemiology and risk factors. Eur J Pediatr 2019; 178: 731-738
Frias J, Levine LS, Oberfield SE, Pang S, Silverstein J. Technical report: Congenital adrenal hyperplasia. Pediatrics 2000; 106: 1511-1518
Girard S, Bruckert E, Turpin G. Généralités et atteintes endocriniennes de l’adrénoleucodystrophie. Ann Med Interne 2001; 152: 15-26
Goldman L, Schafer AI (eds). Goldman – Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Hughes IA. Management of congenital adrenal hyperplasia. Arch Dis Child 1998; 63: 1399-1404
Kemp S, Berger J, Aubourg P. X-linked adrenoleukodystrophy: clinical, metabolic, genetic and pathophysiological aspects. Biochem Biophysi Act 2012; 1822: 1465-1474
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Leblond P, Delebarre M, Aubert S. Le corticosurrenalome chez l’enfant: prise en charge actuelle et perspectives. Bull Cancer 2011; 8: 595-605
Levine LS. Congenital adrenal hyperplasia. Pediatr Rev 2000; 21: 159-170
Miller BS, Spencer SP, Geffner ME, et al. Emergency management of adrenal insufficiency in children: advocating for treatment options in outpatient and field settings. J Investig Med 2019;0: 1–10. doi:10.1136/jim-2019-000999
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Moser H, Dubey P, Fatemi A. Progress I X-linked Adrenoleukodystrophy. Curr Opin Neurol 2004; 17: 263-269
Newell-Price J, Bertagna X, Grossman AB, et al. Cushing´s syndrome. Lancet 2006; 367: 1605-1617
Perheentupa J. APS-I/APECED: the clinical disease and therapy. Endocrinol Metab Clin North Am 2002; 31: 295-320
Pescovitz OH, Eugster EA. Pediatric Endocrinology: Mechanisms, Manifestations, and Management. Philadelphia: Lippincott Williams & Wilkins, 2004
Pombo MA. Tratado de Endocrinologia Pediátrica. Madrid: Ediciones Diaz de Santos, 1997.
Radovick S, Misra M (eds). Pediatric Endocrinology. A Practical Clinical Guide. Berlin: Springer, 2018
Ribeiro RC, Figueiredo B. Childhood adrenocortical tumours. Eur J Cancer 2004; 40: 1117-1126
Speiser PW, White PC. Congenital adrenal hyperplasia. NEJM 2003; 349: 776-788
Ten S, New M, Maclaren N. Addison‘s disease 2001. J Clin Endocrinol Metab 2001; 86: 2909-2922