Definição e importância do problema
A designação actual de hemossiderose pulmonar corresponde a situações em que se verifica hemorragia alveolar difusa (HAD) com acumulação de ferro nos macrófagos (na forma de hemossiderina), hemoptise, anemia ferropénica, subsequente fibrose pulmonar traduzida radiologicamente por infiltrados alveolares.
A HAD ocorre como resultado de lesão da microvasculatura do pulmão, em geral lenta e insidiosa devido à baixa pressão circulatória pulmonar.
Tal condição pode manifestar-se isolada, mas é mais frequentemente associada a outra patologia. Surge assim a designação de hemossiderose pulmonar idiopática (HPI) quando a DAH surge isoladamente na ausência de patologia subjacente exaustivamente pesquisada.
Aspectos epidemiológicos
As situações patológicas que decorrem com HAD são muito variáveis quanto a sintomatologia, gravidade e alterações laboratoriais.
A verdadeira incidência de HPI não é conhecida. Estudos Suecos e Japoneses estimam uma prevalência de 0,24 a 1,23 casos por milhão de crianças, sendo que em geral ocorre entre 1-7 anos, e mais raramente na idade adulta. Quando surge em idade inferior a 10 anos (em 80% dos casos versus 20% restantes até aos 30 anos), apresenta igual distribuição por sexos; no entanto, em crianças com mais de 10 anos ocorre mais frequentemente no sexo masculino (2/1).
Etiopatogénese e classificação
Na maioria dos casos a hemorragia alveolar difusa (HAD), com ou sem capilarite pulmonar, associa-se a uma grande variedade de entidades patológicas sintetizadas no Quadro 1. Tais entidades integram essencialmente nosologias do foro da Reumatologia, Imunoalergologia, Pneumologia Nefrologia e Cardiologia, e englobam doenças e síndromas abordadas noutros capítulos desta obra.
Dada a importância da capilarite pulmonar na patogénese da HAD, importa referir algumas das respectivas características histológicas para melhor enquadramento das manifestações clínicas:
– trombos de fibrina ocluindo capilares; -coágulos de fibrina aderentes aos septos interalveolares; – necrose fibrinóide das paredes capilares;
– eritrócitos nos espaços intersticiais com deposição de hemossiderina (ver atrás).
Nas formas clínicas não acompanhadas de capilarite são notórios os seguintes achados patológicos: – hipertrofia da musculatura lisa vascular podendo determinar hipertensão pulmonar; – edema; -trombose vascular e enfarte; – eritrócitos na via aérea.
Em ambas as formas verifica-se coloração acastanhada do tecido pulmonar pela presença de hemossiderina no interior dos macrófagos (aspecto identificado, quer por lavado broncoalveolar, quer por amostra de biopsia). Macroscopicamente o pulmão tem peso elevado, com áreas de consolidação vermelho-acastanhadas.
Quanto às lesões, distinguem-se as chamadas formas difusas e as formas focais.
QUADRO 1- Síndromas de hemorragia alveolar difusa
| Com capilarite pulmonar |
| Capilarite pulmonar idiopática, granulomatose com poliangeíte ou de Wegener, lúpus eritematoso disseminado, síndroma de Goodpasture, síndroma de anticorpos antifosfolípidos, púrpura de Schonlein-Henoch, nefropatia IgA, poliarterite nodosa, síndroma de Behçet, crioglobulinémia, capilarite induzida por fármacos, síndroma pulmonar renal idiopática. |
| Sem capilarite pulmonar |
| · Causas não cardiovasculares: Hemossiderose pulmonar idiopática, síndroma de Heiner, hemorragia pulmonar idiopática da infância, transplantação da medula óssea, imunodeficiência, coagulopatias, doença celíaca (síndroma de Lane-Hamilton). · Causas cardiovasculares: Estenose mitral, doença venoclusiva pulmonar, anomalias arteriovenosas, hipertensão pulmonar, insuficiência cardíaca crónica, trombose vascular com enfarte,etc.. |
Manifestações clínicas
As formas de apresentação clínica, muito variáveis, traduzem hemorragia alveolar difusa conduzindo à tríade de hemoptise, por vezes grave, anemia e infiltrados pulmonares.
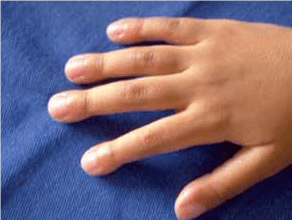
FIGURA 1. Sinais de hipocratismo digital no contexto de hemossiderose pulmonar. (NIHDE)
A forma aguda caracteriza-se por episódios recorrentes ou crises respiratórias com polipneia, sibilância, tosse, cianose, febre, taquicardia, dor abdominal. Em cerca de 20% das crianças há hepatoesplenomegália e linfadenopatia.
Descreve-se também uma forma de apresentação insidiosa caracterizada por palidez, cansaço fácil, défice de progressão ponderal e anemia crónica ferropénica refractária ao tratamento.
O sangue deglutido pode simular hemorragia digestiva. O surgimento de alterações cutâneas e ou articulares podem sugerir colagenose ou vasculite sistémica. Sinusite recorrente, otite ou hemorragias ou úlceras nasais podem sugerir vasculite de Wegener.
A recorrência da hemorragia ocasiona uma evolução progressiva com insuficiência respiratória crónica associada a fibrose pulmonar. Poderá igualmente surgir hemorragia pulmonar maciça.
A figura 1 mostra sinais de hipocratismo digital por insuficiência respiratória crónica no contexto de hemossiderose pulmonar.
Deve valorizar-se a tríade clássica: anemia ferropénica, hemoptises e infiltrados alveolares detectados pela radiografia do tórax.
Deve valorizar-se a tríade clássica: anemia ferropénica, hemoptises e infiltrados alveolares detectados pela radiografia do tórax.
Exames complementares
Uma vez que os macrófagos alveolares não conseguem metabolizar o ferro da hemoglobina, este acumula-se no seu interior provocando anemia ferropénica com níveis de ferro sérico e medular muito baixos. Assim, esta patologia é caracterizada pelo paradoxo de uma anemia ferropénica com ferro depositado no tecido pulmonar, o que condiciona fibrose. A anemia é tipicamente microcítica e hipocrómica com reticulocitose.
Os níveis de bilirrubina sérica estão aumentados bem como a excreção urinária de urobilinogénio.
Em geral, após um episódio agudo há leucocitose com desvio à esquerda (neutrófilos imaturos no sangue periférico). Em cerca de 15 a 20% dos casos verifica-se eosinofilia.
Pela deglutição de saliva com sangue, a pesquisa de sangue nas fezes pode ser positiva.
Na radiografia do tórax pode observar-se infiltrado alveolar uni ou bilateral, migratório, e que pode sofrer remissão completa após a fase sintomática. (Figura 2)
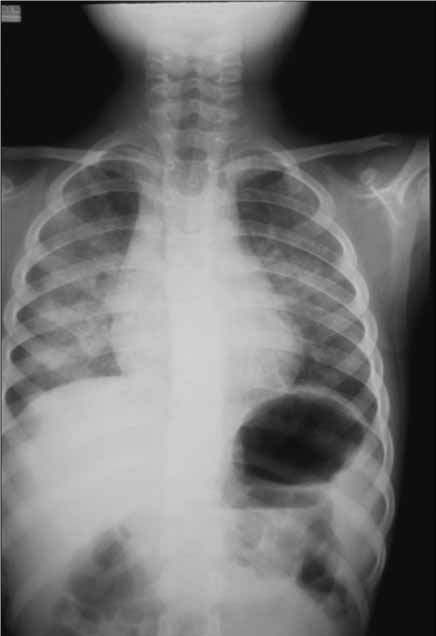
FIGURA 2. Hemossiderose pulmonar: radiografia do tórax (AP) evidenciando opacidades dispersas em ambos os campos pulmonares. (NIHDE)
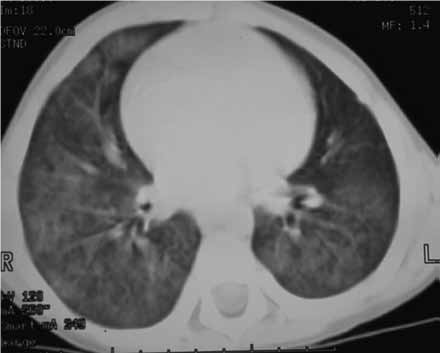
FIGURA 3. Hemossiderose pulmonar: TAC torácica evidenciando opacidades dispersas e sinais de bronquiectasias. (NIHDE)
Durante a fase aguda a cintigrafia pode demonstrar sinais de hemorragia. A capacidade de difusão do monóxido de carbono está aumentada (uma vez que este se liga aos eritrócitos presentes nos alvéolos).
A broncoscopia com lavado broncoalveolar pode revelar a presença de macrófagos com depósito abundante de hemossiderina (apenas se a hemorragia tiver ocorrido há mais de 2 ou 3 dias); no entanto, este achado apenas comprova a ocorrência de hemorragia pulmonar e não a etiologia. O exame cultural é negativo.
A negatividade doutros exames específicos como ANA, ANCA, factor reumatóide, anticorpo antifosfolípidos e anticorpos antimembrana basal do glomérulo exclui certas formas secundárias.
O aspirado gástrico também pode conter macrófagos com hemossiderina.
Torna-se fundamental proceder a ECG e Eco-CG para excluir causas cardíacas de HAD.
Na síndroma de Heiner os estudos anátomo-patológicos demonstram depósitos alveolares de IgG, IgA e C3. Algumas crianças têm títulos elevados de IgE, IgG e IgA contra as proteínas do leite de vaca e melhoram após supressão do leite no regime alimentar. Verifica-se eosinofilia periférica.
A biópsia pulmonar na forma idiopática é característica e demonstra a ausência de deposição de imunoglobulinas ou complemento na membrana basal alveolar. Este dado exclui síndroma de Goodpasture.
A referida biópsia inicialmente deve ser feita por fibroscopia (biópsia transbrônquica retirando-se amostras de diferentes lobos e segmentos). Se não for possível o diagnóstico por esta técnica, deverão ser colhidas amostras maiores e a biópsia deverá ser realizada por toracoscopia ou em “pulmão aberto”.
O estudo da função pulmonar demonstra um padrão de insuficiência respiratória restritiva (pela fibrose) e obstrutiva (por irritabilidade brônquica). A detecção de autoanticorpos deve ser negativa.
Tratamento
As formas agudas de HAD o objectivo terapêutico emergente é a estabilização do processo activo com medidas de suporte que incluem o tratamento da hipoxemia com eventual ventilação mecânica em unidade de cuidados intensivos e reanimação circulatória com transfusão de concentrado eritrocitário.
As diferentes etiologias de base requerem medidas específicas como seja por exemplo a supressão do leite no caso de síndroma de Heiner (hipersensibilidade às proteínas do leite de vaca).
A supressão do glúten na dieta nos casos de associação da HAD a doença celíaca (síndroma de Lane-Hamilton) conduz ao desaparecimento dos sintomas intestinais e do foro respiratório (comprovando-se tal com a regressão da sintomatologia respiratória e dos sinais radiológicos torácicos). (Quadro 1)
A hemossiderose pulmonar idiopática, dado o seu carácter recorrente e imprevisível, obriga a tratamento continuado com corticosteroides sistémicos, os fármacos de primeira linha. Em situações de hemorragia recorrente ou refractária, em associação aos esteroides estão indicadas ciclofosfamida, azatioprina, hidroxicloroquina, e IGIV.
Casos de HAD com capilarite pulmonar e ou mediada por imunocomplexos implicam utilizar esteroides, imunossupressores e IGIV.
De acordo com estudos recentes, em casos graves de HAD, com ou sem capilarite, preconizou-se a metilprednisolona em bolus (30 mg/kg IV , até máximo de 1 grama), prednisona oral (2 mg/kg/dia), ciclofosfamida oral (2 mg/kg/dia) e doses mensais de IGIV imunomoduladoras (2g/kg). Verificada a remissão, o tratamento de manutenção inclui doses mais baixas de prednisona, e azatioprina ou metotrexato.
Prognóstico
No que respeita às HAD em geral, e à HPI em especial, com os meios da terapia intensiva e a utilização mais enérgica de corticoides e de citostáticos, a sobrevivência dos doentes com qualidade de vida mais aceitável aumentou significativamente: de uma média de sobrevivência de 3 anos após o diagnóstico, evoluiu-se para uma sobrevivência de 80% aos 5 anos.
BIBLIOGRAFIA
Das S, Langston C, Fan LL. Interstitial lung disease in children. Curr Opin Pediatr 2011; 23:325-331
Godfrey S. Pulmonary hemorrhage/hemoptysis in children. Pediatr Pulmonol 2004; 37: 476-484
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Ioachimescu OC, Sieber S, Kotch A. Idiopathic pulmonary hemosiderosis revisited. Eur Respir J 2004; 24: 162-170
Kliegman RM, Stanton BF, StGeme JW, Schor NF (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2015
Moissidi SI, Chaidaron D, Vichyanond P, Bahna SL. Milk induced pulmonary disease infants (Heiner Syndrome). Pediatr Allergy Immunol 2005; 16: 545-562
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Nuesslein TG, Teig N, Rieger C. Pulmonary haemosiderosis in infants and children. Paediatr Respir Rev 2006; 7: 45- 48
Rudolph CD, Rudolph AM, Lister GE, First LR, Gershon AA(eds). Rudolph´s Pediatrics. New York: McGraw-Hill Medical, 2011
Susarla SC, Fan LL. Diffuse alveolar hemorrhage syndromes in children. Curr Opin Pediatr 2007; 19: 314-320
Wilmott R, Bush A, Deterding R, Ratjen F, Sly P, Zar H, Li A (eds). Kendig’s Disorders of the Respiratory Tract in Children. Philadelphia: Elsevier, 2019
Yao TC, Hung IJ, Jaing TH, et al. Pitfalls in the diagnosis of idiopathic pulmonary haemosiderosis. Arch Dis Child 2002; 86: 436-438