Definição e importância do problema
A fibrose quística (FQ) é uma doença hereditária multiorgânica que afecta as glândulas exócrinas e provoca ampla variedade de manifestações clínicas e complicações. Resulta de mutações no gene da CFTR (cystic fibrosis transmembrane conductance regulator), uma proteína transportadora que se localiza na membrana celular (MC) apical das células epiteliais de várias mucosas, nomeadamente da via aérea, da via biliar, intestino, ductos pancreáticos, glândulas sudoríparas, entre outras. Este transportador de membrana (canal de iões de cloro mediado pelo AMP- cíclico) está relacionado com o transporte de iões, havendo aumento da viscosidade das secreções, em caso de ausência ou défice funcional. Como resultado da disfunção sistémica e repercussão mais importante no pulmão e pâncreas, caracteriza-se essencialmente por doença pulmonar crónica e insuficiência pancreática.
Aspectos epidemiológicos e genéticos
A FQ é uma doença de transmissão autossómica recessiva, que atinge mais de 70.000 indivíduos em todo o mundo, 30.000 dos quais na Europa. A incidência é mais elevada nos países do Norte da Europa (1/1.400 na Irlanda), e menor em populações não caucasianas. (1/17.000 entre africanos e 1/90.000 entre asiáticos).
Em Portugal, o Programa Nacional de Diagnóstico Precoce, num estudo-piloto patrocinado pela DGS entre Novembro 2013 e Outubro 2014, incluindo o rastreio para a FQ, permitiu num total de 80.000 recém-nascidos (RN) o diagnóstico de 10 casos o que corresponde a uma incidência de 1/8.000, um valor menos elevado do que as estimativas anteriores.
Estão descritas mais de 1.900 mutações do gene da FQ no cromossoma 7, sendo, no entanto, a mutação F508del (phe508del) a que determina a deleção da fenilalanina na posição 508, a mais frequente. A referida deleção, variando de região para região, com uma frequência entre 45 e 55% no sul da Europa, corresponde a cerca de 67% dos casos de FQ em todo o mundo.
Em 2012, do total de 298 doentes tratados nos Centros de Referência em Portugal, 48% (143) eram homozigóticos e 31,9% (95) heterozigóticos para a mutação F508del, a qual é responsável por 63,9% dos alelos.
Fisiopatologia
A identificação do gene CFTR em 1989 permitiu grandes avanços na compreensão dos mecanismos fisiopatológicos da FQ. Este gene localizado no braço longo do cromossoma 7 codifica uma proteína, a CFTR.
As mutações do gene determinam alterações na função, ausência ou diminuição da produção da CFTR; consequentemente há alteração do transporte transmembranar de cloro, bem como diminuição da actividade dos canais de sódio das células epiteliais da via aérea, do que resulta diminuição da secreção de cloro e aumento da reabsorção de sódio.
Estas alterações, específicas do transporte iónico, predispõem à depleção do líquido de superfície das vias aéreas e alterações da depuração mucociliar. As secreções brônquicas tornam-se espessas, difíceis de eliminar, o que produz um ambiente nas vias aéreas favorável à sua obstrução, inflamação e infeção crónica por agentes bacterianos específicos como Pseudomonas aeruginosa. A infecção por este agente vai condicionar o aparecimento duma resposta inflamatória persistente e intensa com consequente aparecimento de atelectasias com formação de bronquiectasias e degradação progressiva da função pulmonar.
Além de Pseudomonas aeruginosa outros agentes podem estar envolvidos neste processo: Staphylococcus aureus, Haemophilus influenzae, Stenotrophomonas maltophilia, Achromobacter xylososidans, Aspergillus spp, e micobactérias atípicas, contribuindo para o processo destrutivo a nível do parênqima pulmonar.
A síndroma de má absorção está relacionada com o défice de secreção, quer enzimática, quer de bicarbonato. O défice de enzimas pancreáticas é agravado pela deficiente alcalinização do conteúdo duodenal, com inactivação dessas mesmas enzimas.
As mutações do gene CFTR são agrupadas em 6 classes de acordo com as suas características funcionais, resultantes do efeito da mutação genética na função da proteína CFTR. (Quadro 1)
As mutações de classe I a III, têm uma CFTR ausente ou com função mínima, enquanto nas de classe IV a VI a CFTR, mantendo-se uma função parcial geralmente associada a níveis de cloro mais baixo no suor, a função pancreática poderá estar preservada, não apresentando o doente insuficiência pancreática.
A referida classificação permite agrupar as mutações consoante a sua gravidade clínica, sendo que as 3 primeiras (classe I, II e III) correspondem a fenótipos mais graves, e as 3 últimas a fenótipos mais ligeiros.
QUADRO 1 – Classificação dos diferentes tipos de mutação que afectam o gene CFTR
| Classe | Exemplo Mutação | Impacto na estrutura e função da CFTR |
| I | G542X | Ausência de proteína CFTR funcional. Codão stop prematuro que produz um mRNA truncado |
| II | F508del | Defeito de tráfego. A CFTR é produzida, mas estruturalmente anormal sendo destruída no retículo endoplasmático antes de atingir a MC |
| III | G551D | Defeito de regulação. A CFTR é produzida, alcança a MC, mas o canal de cloro não responde ao estímulo para abrir |
| IV | R347P | Defeito de conductividade. A CFTR é produzida, alcança a MC, responde ao estímulo normal, mas a sua função é residual |
| V | A455E | Síntese reduzida. CFTR normal, mas quantidade reduzida na MC. Verifica-se alguma função residual da CFTR |
| VI | c.120del23 | Diminuição da retenção/ancoragem da CFTR a nível da superfície celular e estabilidade na MC |
No entanto, apesar da identificação de mais de 1.900 mutações da CFTR, o efeito funcional de muitas continua desconhecido, ou está por esclarecer. É também importante notar que algumas mutações partilham mais do que uma classe de defeito. O exemplo mais evidente é a F508del que, além do defeito de tráfego (classe II), tem também um defeito de abertura do canal de cloro (classe III) e um defeito de estabilidade na superfície celular (classe VI).
O conhecimento do defeito molecular veio permitir uma abordagem diferente a nível terapêutico com o desenvolvimento de novos medicamentos moduladores; estes, actuando a nível da alteração primordial, são chamados correctores ou potenciadores consoante o local de actuação.
Manifestações clínicas
No período neonatal pode manifestar-se como ileo meconial (15% dos doentes), peritonite meconial, icterícia intensa e prolongada (com hiperbilirrubinémia directa elevada), ou alcalose hipoclorémica (resultante de perda de sais). O referido quadro de oclusão intestinal neonatal é quase patognomónico; consequentemente torna-se obrigatória a investigação de FQ em tal circunstância (ver adiante: tripsina imunorreactiva, prova de suor logo que possível e/ou estudo genético).
As manifestações mais frequentes (51% dos casos nos EUA) da FQ são respiratórias, nomeadamente sibilância recorrente e infecções respiratórias de repetição, com colonização sucessivamente por Staphylococcus aureus, Haemophilus influenzae e Pseudomonas aeruginosa (colonização crónica com uma prevalência de cerca de 80%, dos 25 aos 34 anos). (Quadro 2)
QUADRO 2 – Manifestações clínicas na fibrose quística
| Respiratórias |
Tosse produtiva crónica e/ou expectoração purulenta
Episódios recorrentes de obstrução das vias aéreas:
Hemoptises
Pansinusopatia crónica |
| Gastrintestinais |
| Ileo meconial Icterícia prolongada Diarreia crónica Refluxo gastresofágico Má progressão estaturo-ponderal Prolapso rectal Síndroma de oclusão intestinal distal Pancreatite recorrente Cirrose biliar focal |
| Genito-urinárias |
| Azooespermia Agenésia dos canais deferentes |
| Outras |
| Diabetes mellitus associada a FQ Hipoproteínémia/edema Desidratação hiponatrémica Alcalose hipoclorémica Hipocratismo digital Défice de vitaminas lipossolúveis (A, D, E, K) e Zinco |
A colonização por estes agentes pode classificar-se em intermitente e crónica (se houver isolamento bacteriano em 6 meses consecutivos). A colonização por Pseudomonas aeruginosa começa por ser intermitente, e depois, persistente, uma vez que a bactéria tem a capacidade de adquirir uma alteração da expressão génica que permite a produção de um biofilme que dificulta a sua eliminação (forma mucóide). Após colonização definitiva verifica-se deterioração acelerada da função pulmonar. A colonização pelo referido agente é influenciada por vários factores, nomeadamente o genótipo, o sexo (as crianças do sexo feminino são colonizadas mais precocemente), a presença de insuficiência pancreática, e a eficácia do isolamento dos doentes em cada centro.
Outro agente – multirresistente aos antibióticos – (Burkholderia cepacea) pode colonizar de modo crónico as vias aéreas dos doentes com FQ. À infecção por este agente associam-se deterioração importante da função pulmonar e mau prognóstico, variando entre deterioração insidiosa, progressiva e evolução fatal, rápida.
Podem surgir infecções por outros agentes, como Stenotrophomonas maltophilia, Achromobacter xylosoxidans e Aspergillus fumigatus, assintomáticas ou originando diversos tipos de manifestações incluindo a forma de aspergilose broncopulmonar alérgica.
A infecção recorrente e/ou persistente conduz a uma resposta inflamatória intensa, com hipertrofia e hiperplasia das glândulas secretoras e lesão progressiva das vias aéreas; pode verificar-se evolução para bronquiectasias e outras alterações irreversíveis do parênquima pulmonar.
Surge, assim, o quadro de doença pulmonar crónica obstrutiva, com insuficiência respiratória progressiva. São habituais os períodos de exacerbação da sintomatologia, nomeadamente com tosse mais frequente, incremento de secreções brônquicas, agravamento da dificuldade respiratória, febre, perda acentuada de peso, hemoptises, e/ou agravamento radiológico e dos resultados das provas de função respiratória (diminuição do volume expiratório máximo por segundo/VEMS superior a 10% do valor basal e/ou da capacidade vital forçada).
Outra complicação respiratória possível é o pneumotórax espontâneo (5 a 8% dos casos de FQ), que pode resultar de mecanismos valvulares (obstrução de vias aéreas por secreções), com ruptura de espaços aéreos periféricos para a pleura. Trata-se duma situação com elevadas taxas de recorrência e de mortalidade.
Além das vias aéreas inferiores, também as superiores são afectadas: pansinusopatia e polipose nasal são frequentes.
Em cerca de 2% dos doentes surge um quadro clínico atípico, caracterizado apenas por doença sinopulmonar crónica, sem insuficiência pulmonar, e valores normais ou limite quanto à eliminação de cloro no suor (ver adiante-prova do suor). Outras formas de atipia do quadro clínico traduzem-se por má progressão ponderal na infância (cerca de 40% dos casos) relacionada com maior consumo energético, e síndroma de má absorção resultante da insuficiência pancreática (em cerca 85 a 90% dos doentes). Esta última conduz a diarreia crónica por má absorção (dejecções volumosas, fétidas e gordurosas), edema relacionado com a hipoproteinemia, anemia, défice de vitaminas lipossolúveis, com aumento do tempo de protrombina (por défice de vitamina K), neuropatia periférica, encurtamento de semi-vida dos eritrócitos (por défice de vitamina E). De referir que são também característicos os episódios recorrentes de pancreatite aguda.
Mais rara e tardiamente poderá surgir diabetes mellitus em relação com a lesão pancreática endócrina crónica (3% das crianças, 14% dos adultos).
Outras manifestações frequentes são: refluxo gastresofágico, síndroma de oclusão intestinal distal (10% dos casos), prolapso rectal (< 1% de pacientes), litíase biliar (5%), desidratação hiponatrémica ou alcalose metabólica graves, atraso pubertário e atrésia do canal deferente com infertilidade masculina (azoospermia em > 98% dos casos). Nas adolescentes pode surgir amenorreia secundária. Raramente surge cirrose biliar com hipertensão portal.
Exames complementares e diagnóstico
O diagnóstico é efectuado no primeiro ano de vida em 70% dos casos e, até aos 8 anos, em 90%. Existem situações de diagnóstico tardio, associadas a quadros clínicos menos exuberantes.
É feito com base na clínica (uma ou mais características fenotípicas clássicas), ou antecedentes familiares (consanguinidade, irmão ou primo em primeiro grau com FQ), ou resultado do rastreio neonatal positivo confirmado por duas provas do suor positivas (doseamento de Cloro no suor > 60 mEq/L através de iontoforese com pilocarpina; de salientar que valores de cloro < 40 mEq/L são considerados normais; e considerados no limite se entre 40 a 60 mEq/L), ou detecção de duas mutações do gene da fibrose quística, ou evidência de anomalias características do transporte do ião cloro (devidas à disfunção da proteína CFTR) a nível das células epiteliais da mucosa nasal, pela determinação da diferença de potencial nasal ou determinação da secreção de cloro a nível da mucosa intestinal na biópsia rectal. (Quadro 3)
QUADRO 3 – Diagnóstico de FQ
Presença de sinais clínicos típicos | + | 2 provas de Cloro no suor > 60 mEq/L |
O Quadro 4 sintetiza situações clínicas diversas em que a prova do suor pode evidenciar, quer resultados falsos positivos, quer falsos negativos.
QUADRO 4 – Prova do suor em diversas situações clínicas
| 1. VALORES FALSOS POSITIVOS (> 60 mEq/L) |
| Causas metabólicas |
| Fucosidose Glicogenose tipo I Mucopolissacaridoses Defice da desidrogenase da glicose 6-fosfato Hipotiroidismo Diabetes insípida resistente à vasopressina Insuficiência supra-renal Colestase familiar Hipoparatiroidismo familiar Anorexia nervosa Disfunção autonómica Doença celíaca Hipogamaglobulinémia |
| Doenças da pele e glândulas sudoríparas |
| Má-nutrição Displasia ectodérmica Dermite atópica |
| Causas iatrogénicas |
| Infusão de prostaglandinas E1 |
| 2. VALORES FALSOS NEGATIVOS (< 40 mEq/L) |
| Erros metodológicos |
| Amostra insuficiente Evaporação parcial da amostra Erros de cálculo Edema |
As figuras 1 e 2 mostram aspectos imagiológicos torácicos (radiografia convencional e TAC) de doentes com FQ e clínica de insuficiência respiratória (associada a escoliose), salientando-se enfisema, infiltrados bilaterais intersticiais e reticulonodulares, e bronquiectasias
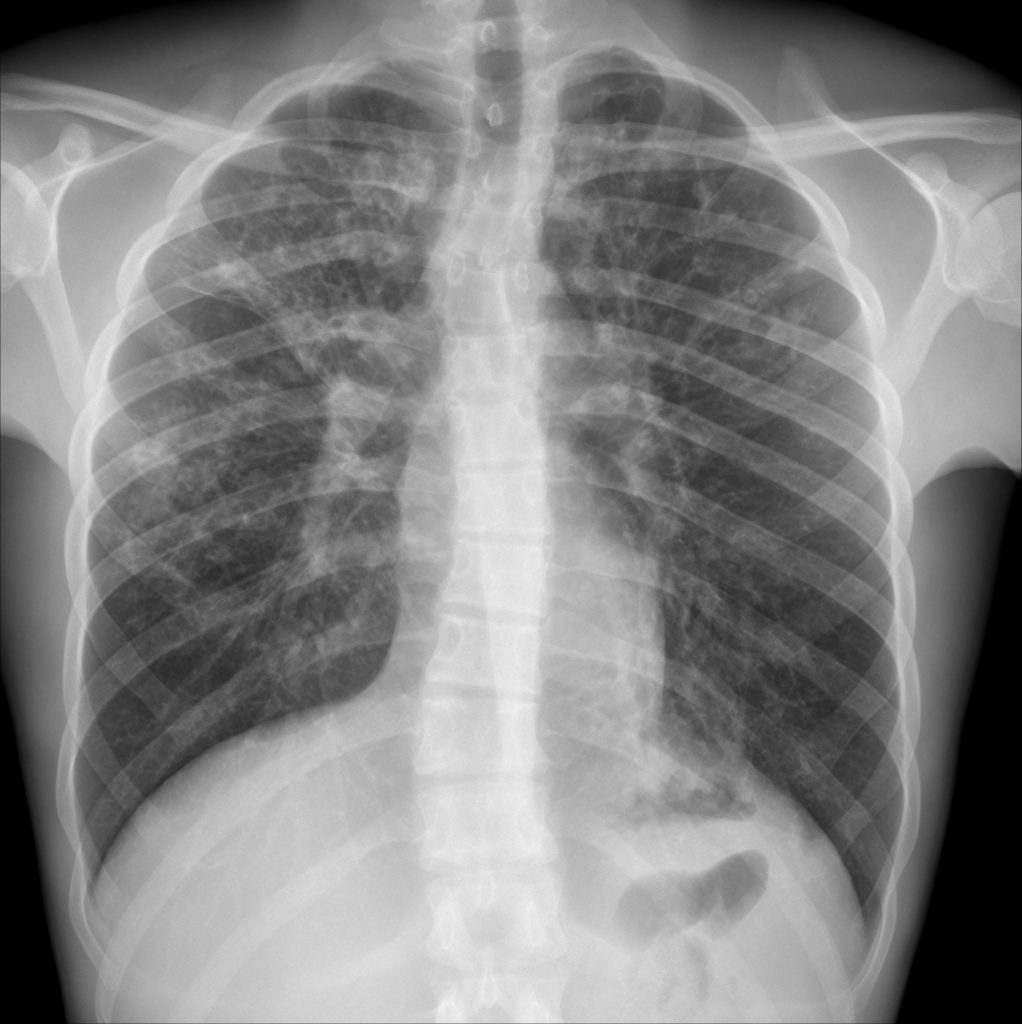
FIGURA 1. Radiografia póstero-anterior do tórax em doente com FQ e escoliose. Enfisema significativo e bronquiectasias
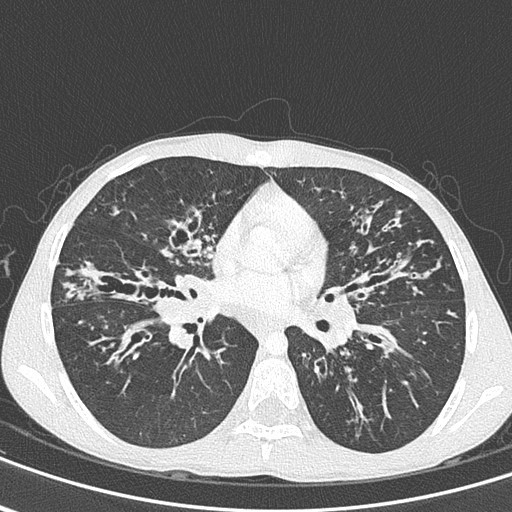
FIGURA 2. TAC torácica em doente com FQ. Áreas múltiplas de bronquiectasias
Para a identificação das mutações torna-se necessário proceder a análise extensa do ADN. A metodologia utilizada poderá ser a sequenciação completa da zona codificante dos 27 exões do gene CFTR com as regiões intrónicas adjacentes.
Em relação ao estudo genético por ADN salienta-se que devido ao grande número de mutações do gene CFTR já identificadas, a grande variação geográfica e racial na sua frequência e distribuição, habitualmente apenas são testadas as mutações mais frequentes numa determinada população. Em Portugal, no Laboratório de Genética Humana do INSA, o painel padronizado pesquisa 92,7% das mutações associadas à FQ na população portuguesa.
De referir que aproximadamente em cerca de 1% dos casos de FQ não são detectadas mutações; e em cerca de 18%, apenas um dos genes mutantes é identificado. Poderá ainda existir mais do que uma mutação em cada gene, com múltiplas combinações possíveis, o que poderá determinar diversidade considerável de fenótipos. Há também mutações que não são determinantes de doença.
Salienta-se ainda que algumas crianças ou adultos com sintomas sugestivos de FQ poderão evidenciar, através da prova do suor ou do estudo genético resultados não conclusivos. Em tais circunstâncias os pacientes deverão ser seguidos em centros especializados de FQ, procedendo-se a avaliações da função CFTR e da diferença de potencial nasal, e ainda a biópsia rectal, esta última susceptível de demonstrar diminuição da secreção de cloro a nível do epitélio da respectiva.
Outros exames complementares importantes para o diagnóstico da insuficiência pancreática incluem os estudos da função pancreática, nomeadamente através dos doseamentos de gorduras fecais (72 horas), e a determinação da elastase fecal.
O doseamento de tripsina imunorreactiva sérica (TIR) nos recém-nascidos (utilizando o cartão para a prova de Guthrie no âmbito do diagnóstico precoce) e a detecção de azoospermia obstrutiva após a puberdade (análise do esperma e ecografias, com confirmação por biópsia testicular), também podem contribuir para o diagnóstico. Outro aspecto quase patognomónico da fibrose quística é a pansinusite, detectada por radiografia ou TAC dos seios perinasais.
Actualmente já é possível o diagnóstico pré-natal, por pesquisa das mutações em células fetais obtidas por biópsia das vilosidades coriónicas, ou amniocentese.
O rastreio neonatal da FQ com início em Novembro 2013 (projeto-piloto patrocinado pela DGS) mantém-se em curso, estando prevista a sua inclusão no Programa Nacional de Diagnóstico Precoce. Consiste no doseamento, no cartão para a prova de Guthrie, dos níveis séricos da tripsina imunorreactiva (TIR) e da proteína associada à pancreatite (PAP) no caso de a TIR estar aumentada (de acordo com algoritmo de rastreio já aplicado em Portugal). O diagnóstico é confirmado com envio do RN aos Centros de Referência para realização da prova do suor e ulterior pesquisa das 50 mutações mais frequentes.
O rastreio neonatal modificou substancialmente o paradigma diagnóstico da FQ pelas seguintes razões: 1- permitindo a identificação dos doentes antes do surgimento das manifestações clínicas; 2- possibilitando a intervenção preventiva e instituição de tratamento precoce; 3- evitando as complicações da doença inerentes a um atraso no diagnóstico, tais como o estabelecimento de lesões pulmonares e o aparecimento de má-nutrição.
Vigilância e tratamento
A FQ implica um acompanhamento regular da criança e família por uma equipa multidisciplinar que inclui pediatra com experiência em FQ, enfermeira, dietista, fisioterapeuta, psicóloga, entre outros.
Nesta perspectiva está indicada a vigilância regular bi ou trimestral discriminada a seguir.
Avaliação seriada de determinados parâmetros
- Altura (deve manter-se acima do percentil 5)
- Peso (sinal de alarme: perda de peso em 2 meses consecutivos)
- Índices → índice nutricional (que se deve manter > 90%) de acordo com a fórmula: (Peso Actual(Kg) / Peso ideal para a altura) x 100
(normal – 90 a 110%; baixo peso – 85 a 89%; má-nutrição ligeira – 80 a 84%; má-nutrição moderada – 75 a 79%; má-nutrição grave <75%);
→ índice de massa corporal (IMC) após os 2 anos, segundo a fórmula: Peso em Kg /Altura em metros ao quadrado <> P(kg)/A(m2); consultar Parte V. - Sintomas gastrintestinais (náuseas, vómitos, saciedade precoce, dor abdominal)
- Sintomas respiratórios (tosse, expectoração, tolerância ao esforço)
- Sintomas sugestivos de diabetes (poliúria, polidipsia, perda de peso súbita)
- Oximetria para avaliação da saturação de O2-Hb por método transcutâneo (em todas as consultas)
- Provas de função respiratória (periodicidade de 3 meses, após os 5 anos)
- Exames laboratoriais: hemograma, velocidade de sedimentação, transaminases, fosfatase alcalina, tempo de protrombina, glicémia em jejum, ureia, creatinina, ácido úrico, ionograma sérico, cálcio, fósforo, gasometria, electroferese das proteínas, colesterol, triglicéridos, vitaminas A, E, 25-OH-vitamina D, ferro, ferritina, transferrina, imunoglobulinas, IgE total, IgE específica para Aspergillus (anualmente)
- Exame cultural da expectoração com TSA (3/3 meses e durante as exacerbações respiratórias)
- Radiografia de tórax postero-anterior e de perfil (anual e em cada exacerbação)
- TAC de alta definição de tórax (eventualmente de 3 em 3 anos)
- TAC dos seios perinasais (de 5/5 anos)
- Ecografia abdominal (anual)
- Osteodensitometria por DEXA (a partir dos 10 anos)
- Vigilância de efeitos tóxicos da terapêutica (audiograma, função renal)
Suprimento nutricional
Os cálculos são feitos na base de 150% das necessidades calóricas de uma criança saudável da mesma idade e sexo, incluindo suplementos vitamínicos, vitaminas lipossolúveis A, D, E e K, de enzimas pancreáticas – 500 a 2.000 Unidades de lipase/kg/refeição, e inibidores da secreção ácida gástrica (inibidores da bomba de protões e antagonistas H2). Administração de suplementos dietéticos orais (designadamente, englobando glutamina e magnésio) se se verificar perda de peso ou pausa no crescimento. Pode eventualmente ser necessário proceder a gastrostomia/PEG para alimentação por débito contínuo durante a noite rendibilizando o suprimento nutricional.
Prevenção de infecções respiratórias
Através da vacinação anual contra virus influenza e vacinação contra o pneumococo (vacina conjugada para 13 serótipos, seguida de vacina polissacarídea para 23 serótipos em doentes com >2 anos), vacina antivaricela e anti-hepatite A. Deve evitar-se o infantário antes dos 12 meses. Deve evitar-se o contacto entre doentes com FQ colonizados por agentes microbianos diferentes, devendo, os que estão colonizados com Pseudomonas aeruginosa e Burkholderia cepácea, ser consultados em dias diferentes dos restantes doentes.
Promoção do processo de depuração das vias aéreas
Através de cinesiterapia respiratória diária, broncodilatadores (β-agonistas de curta ação) se broncospasmo, fluidificantes das secreções e mucolíticos (N-acetil cisteína, dornase alfa recombinante, cloreto de sódio hipertónico).
Luta contra a inflamação das vias aéreas
Administração de anti-inflamatórios (maior benefício abaixo dos 15 anos de idade e em doentes colonizados por Pseudomonas aeruginosa). A prednisolona na dose de 1-2 mg/kg/dia em dias alternados reduz o declínio da função pulmonar, mas o efeito é modesto, não diminui o número de hospitalizações, aumenta a incidência de diabetes, de atraso de crescimento e de cataratas; ou seja, os riscos da sua utilização ultrapassam os benefícios. A corticoterapia sistémica deve ser utilizada apenas em casos de broncospasmo grave ou exacerbação, e apenas durante o tempo necessário para o controlo sintomático. A corticoterapia por via inalatória pode ser utilizada nos doentes que mantêm broncospasmo na presença de atopia.
O ibuprofeno em altas doses tem um efeito positivo na função pulmonar nas crianças com doença pulmonar moderada, mas comporta risco de hemorragia digestiva e de nefrotoxicidade. A azitromicina, que tem propriedades anti-inflamatórias e de imunomodulação, é utilizada para melhorar a função pulmonar, reduzir as exacerbações respiratórias e aumentar o índice de massa corporal. Na infecção por Pseudomonas aeruginosa pode diminuir a formação de biofilmes, reduzindo a carga inflamatória no pulmão com FQ.
Tratamento das infecções respiratórias.
Este procedimento deverá ter em consideração a gravidade do quadro clínico. Se o doente evidenciar estabilidade clínica poderá e deverá ser tratado em ambulatório em regime oral; pelo contrário, se o estado geral for precário, e perante sinais francos de compromisso respiratório (hipoxémia, dificuldade respiratória, diminuição de 10% nas provas de função respiratória), o tratamento deverá ser providenciado em regime de internamento com terapêutica por via IV.
A antibioticoterapia, inicialmente empírica, deverá passar a dirigida de acordo com o agente microbiano isolado no exame cultural da expectoração e respectivo TSA (Quadro 5). Muitas vezes são isolados mais do que um agente, o que implica necessidade de antibioticoterapia múltipla.
Nos doentes com infecção crónica, isto é, colonizados por determinado agente, as estratégias terapêuticas dependerão do referido agente.
Os principais micorganismos isolados nas vias aéreas dos doentes com FQ são Haemophilus influenzae, Staphylococcus aureus e pseudomonas aeruginosa.
A infecção por este último agente é responsável por uma deterioração pulmonar mais rápida e estabelecimento de lesão estrutural definitiva, pelo que é da maior importância a sua erradicação. Quando a colonização está já estabelecida é fundamental o tratamento da infecção/colonização persistente no sentido de travar o declínio progressivo da função pulmonar, instituindo terapêutica de supressão crónica com antibióticos inalados, em contínuo (colistina), ou em ciclos de 28 dias (tobramicina, aztreonan-lisina) alternando com períodos de pausa de 28 dias (Quadro 6).
A terapêutica antibiótica frequente implica a possibilidade de aparecimento de estirpes resistentes e de toxicidade (renal, otológica), o que obriga a vigilância rigorosa.
QUADRO 5 – FQ: Antibioticoterapia (AB) adequada a cada agente bacteriano
| Agente isolado | AB em Ambulatório | AB em Internamento |
| Haemophilus influenzae | Amoxicilina 50-100mg/kg/d, 8/8h, 14 dias, oral Se β-lactamase (+): Amoxicilina – ácido clavulânico, 80-100 mg/kg/d 8/8 h, 15 dias, oral | Amoxicilina – ácido clavulânico, 150 mg/kg/d 8/8 h, 14 dias, ev ou |
| Staphylococcus aureus | Flucloxacilina, 50-100 mg/kg/d, 6/6 ou 8/8h, 4 semanas, oral ou Flucloxacilina+macrólido ou Ácido fusídico, 30 mg/kg/d, 8/8 h, 3 semanas, oral | Flucloxacilina, 100 mg/kg/d, 6/6 ou 8/8 h, 14 a 21 dias, ev |
| Staphylococcus aureus (MSRA) | Ácido fusídico, 30 mg/kg/d, 8/8 h, 3 semanas, oral + rifampicina, 5-10 mg/kg/d, 1x dia, 3semanas, oral Se insucesso, Linezolida <12 anos:30 mg/kg/dia, 12/12h, >12 anos 600 mg 12/12h 3 semanas oral | Vancomicina, 40 mg/kg/d, 6/6 ou 8/8 h, 14 dias, ev ou Teicoplanina 10 mg/Kg/d 1x dia ev ou Linezolida <12 anos:30 mg/kg/dia, 12/12h, ev >12 anos 600 mg 12/12h, ev |
QUADRO 6 – Antibioticoterapia na FQ para a Pseudomonas aeruginosa
| Agente isolado | Antibioticoterapia em ambulatório | Antibioticoterapia em internamento |
| Pseudomonas aeruginosa 1º isolamento | Colistina, 1 a 2 milhões U, 12/12h, inalado 12 meses + Ciprofloxacina, 30mg/kg/d, 12/12h, 3 semanas, oral ou Tobramicina,300mg,12/12h, inalado, ciclos de 28 dias “on–off” até 12 meses | Ceftazidima (150-300 mg/kg/d, 8/8 h) (máx 6 gr) + Tobramicina (10 mg/kg/d, 24/24 h), 14 dias, ev |
| Pseudomonas aeruginosa 2º isolamento | Colistina, 1 a 2 milhões U, 12/12h, inalado 12 meses + Ciprofloxacina, 30mg/kg/d, 12/12h, 3 semanas, oral ou Tobramicina,300mg,12/12h, inalado, ciclos de 28 dias “on–off” até 12 meses ou Aztreonam-lisina, 75mg 8/8h inalado, ciclos de 28 dias “on-off”até 12 meses | Ceftazidima (150-300 mg/kg/d,8/8 h) (máx 6 gr) + Tobramicina (10 mg/kg/d, 24/24 h), 14 dias, ev |
| Infecção crónica | ||
| Pseudomonas aeruginosa Tratamento de supressão da infecção crónica (doente colonizado) | Colistina, 1 a 2 milhões U, 12/12h, inalado contínuo (diário) ou Tobramicina, 300mg/kg, 12/12h, em aerossol, ciclos de 28 dias “on–off” ou Aztreonam-lisina, 75mg 8/8h inalado, ciclos de 28 dias “on-off” Infecção crónica grave: | Nas excerbações graves: Ceftazidima (150-300 mg/kg/d,8/8 h) (máx 6 gr) + Tobramicina (10 mg/kg/d, 8/8 ou 12/12 h), 14 dias, ev (ou de acordo com antibiograma) |
Outras medidas
Ácido urso-desoxicólico
Para retardar a progressão da lesão hepática, o ácido urso-desoxicólico tem utilidade em pacientes com elevação das transaminases ou sinais de hipertensão portal. Poderá estar indicado o transplante hepático em situações de falência hepática.
Terapêutica da insuficiência respiratória
Com oxigenoterapia, ventilação não invasiva e como último recurso, transplante bipulmonar.
Terapêutica da oclusão intestinal (ileo meconial ou síndroma de oclusão intestinal distal)
Com esta finalidade procede-se à administração de N-acetilcisteína, clísteres hiperosmolares (gastrografina), ou a intervenção cirúrgica.
Moduladores da CFTR
Trata-se de fármacos cujo objectivo é corrigir o defeito primordial que afecta a proteína CFTR. Têm como alvo certas mutações específicas da CFTR.
Este grupo de agentes farmacológicos inclui os potenciadores e os correctores. Os potenciadores melhoram o transporte de cloro actuando na CFTR a nível da MC, permitindo a abertura do canal iónico; actuam nas mutações de classe III. Os correctores restauram a proteína CFTR e melhoram o tráfego intracelular promovendo a sua chegada à MC actuando nas mutações de Classe II. Agentes como o ataluren (PTC 124), correctores de produção (read throug agents), podem ter utilidade nas mutações que têm codons stop prematuros, em que não há síntese de CFTR, como acontece nas mutações de classe I.
Os fármacos que se revelaram mais eficazes foram os potenciadores; neste âmbito, em 2012 foi aprovado o ivacaftor (Kalydeco®) pela FDA para utilização em doentes com 6 anos ou mais de idade portadores da mutação G551D. Embora esta mutação de classe III represente apenas 4% dos doentes com FQ, com grandes variações geográficas (sendo menos de 1% na Dinamarca, Itália e Portugal e cerca de 14% na Irlanda), com a sua utilização verificou-se um incremento de cerca de 10% no VEMS, no peso, nos biomarcadores da CFTR e na qualidade de vida, a par duma diminuição de 50% nas exacerbações pulmonares. A sua indicação terapêutica foi recentemente alargada a mais 8 mutações de classe III e a indivíduos com a mutação R117H.
Em relação à mutação mais frequente a F508del (classe II) a combinação de um corrector com um potenciador lumacaftor/ivacaftor (Orkambi®) parece ser necessária para a restaurar parcialmente a função CFTR; embora modestos, os resultados parecem ser promissores, tendo a sua utilização em doentes homozigóticos para a mutação F508del, com idade superior a 12 anos, sido aprovada em 24 de Setembro de 2015, pela Agência Europeia do Medicamento (EMA).
Terapêutica génica
A terapêutica génica não obteve até à data resultados satisfatórios, por problemas relacionados com os vectores, ou o seu efeito evanescente, com desaparecimento rápido da sua expressão a nível da célula do hospedeiro.
Prognóstico
O prognóstico da FQ, embora evidenciando melhoria em relação a décadas anteriores graças a um diagnóstico mais precoce, implicando tratamento muito complexo, é ainda reservado.
Trata-se duma doença crónica com importante morbilidade e mortalidade cursando com vários episódios de agudização e múltiplos internamentos.
A comprovação do agravamento através das provas de função respiratória constitui o principal factor de mau prognóstico, sendo a insuficiência respiratória a principal causa de morte.
A evolução terapêutica tem sido significativa nos últimos 20 anos, permitindo incrementar a esperança média de vida que se situa actualmente por volta dos 38 anos.
Com efeito, o conhecimento do comportamento funcional das diversas mutações relacionadas com a FQ, e o desenvolvimento de novas terapêuticas dirigidas à correção do defeito primordial da FQ, permitirão num futuro próximo tratar os doentes de acordo com a alteração genética e o fenótipo molecular respectivos.
Para o doente importa aliar o incremento em anos de vida à qualidade dessa mesma vida. Torna-se, pois, fundamental garantir a qualidade dos cuidados, com programas efectivos de transição para consultas de adultos, e assegurando a continuidade dos cuidados especializados e multidisciplinares.
Igualmente importantes são os aspectos individuais e sociais da doença, atendendo designadamente aos problemas da adolescência, da escola, da integração no mercado de trabalho, da constituição de família, e do aparecimento cada vez maior de mães com fibrose quística com um ou mais filhos. Para abordagem destas situações torna-se crucial a criação de equipas multidisciplinares (englobando nomeadamente psicólogos e assistentes sociais), actuando em espírito de humanização, com eficácia, eficiência e efectividade.
BIBLIOGRAFIA
Alves SP, Frank MA, Bueno D. Medications used in pediatric cystic fibrosis population. Einstein 2018; 16: 1-8. DOI: 10.31744/Einstein_journal/2018AO4212
Amaral MD. Novel personalized therapies for cystic fibrosis: treating the basic defect in all patients. J Intern Med 2015; 277: 155-166.
Balfour –Lynn IM, et al. Radical new treatments for cystic fibrosis. Arch Dis Child 2015; 100: 727
Bell S. New pharmacological approaches for cystic fibrosis: promises, progress, pitfalls. Pharmacol Ther 2015; 145: 19-34.
Direcção Geral da Saúde. Norma Nº 031/2012 “Diagnóstico da Fibrose Quística em Idade Pediátrica e no Adulto” actualizada em 30/07/2015
Direcção Geral da Saúde. Norma Nº 032/2012 “Tratamento e Seguimento da Fibrose Quística em Idade Pediátrica e no Adulto” actualizada em 9/06/2015
Derichs N. Targeting a genetic defect: cystic fibrosis transmembrane conductance regulator modulators in cystic fibrosis. Eur Respir Rev 2013; 22: 127, 58-65
Döring G, Conway SP, Heijerman HGM, Hodson ME, et al. Antibiotic therapy against Pseudomonas aeruginosa in cystic fibrosis: a European consensus. Eur Respir J 2000; 16: 749-67.
Forrester DL, Knox AJ, Smyth AR, et al. Glutamine supplementation in cystic fibrosis: a randomized placebo-controlled trial. Pediatr Pulmonol 2016; 51: 253-257
Hodson ME, Geddes DM. Cystic Fibrosis. New York: Hodder Arnold (Oxford University Press Inc.), 2007
Isaiah A, Daher A, Sharma PB, et al. Predictors of sleep hypoxemia in children with cystic fibrosis. Pediatyr Pulmonol 2019; 54: 264-272
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Konstan MW, Plant BJ, Stuart Elborn J, et al. Efficacy response in CF patients treated with ivacaftor: post-hoc analysis. Pediatr Pulmonol 2015; 50: 447-455
Martiniano SL. Advances in the diagnosis and treatment of Cystic Fibrosis. Advances in Pediatrics 2014; 61:225-243
Milla CE, Moss RB. Recent advances in cystic fibrosis. Curr Opin Pediatr 2015; 27:317-324.
Ramsey BW, Pepe MS, Quan JM, Otto K et al. Intermittent administration of inhaled tobramycin in patients with cystic fibrosis. N Engl J Med 1999; 340: 23-30
Rueegg CS, Kuehni CE, Gallati S, et al. Comparison of two sweat test systems for the diagnosis of cystic fibrosis in newborns. Pediatr Pulmonol 2019; 54:273-279
Santi M, Milani GP, Simonetti GD, et al. Magnesium in cystic fibrosis – systematic review of the literature. Pediatr Pulmonol 2016; 51: 196-202
Sousa R. First year evaluation of the Portuguese pilot neonatal screening for cystic fibrosis. ePSO1.2. Proceedings of the 38th European Cystic Fibrosis Conference 10-13 June 2015
Vanstone MB, Egan ME, Zhang JH, et al. Association between serum 25-hydroyvitamin D level and pulmonary exacerbations in cystic fibrosis. Pediatr Pulmonol 2015; 50: 441-446
Wilmott R, Bush A, Deterding R, Ratjen F, Sly P, Zar H, Li A (eds). Kendig’s Disorders of the Respiratory Tract in Children. Philadelphia: Elsevier, 2019
Wong J. K. Staphylococcus aureus in early cystic fibrosis lung disease. Pediatr Pulmonol 2013; 48: 1151-1159
Wyllie R, Hyams JS, Kay M (eds). Pediatric Gastrointestinal and Liver Disease. Philadelphia: Elsevier, 2016