Importância do problema
Considerando os diversos tipos de tumores do sistema músculo-esquelético, apenas será feita uma referência sucinta aos tumores primitivos dos ossos, omitindo os secundários ou metastáticos.
Os tumores primitivos dos ossos ocorrem predominantemente nas idades jovens (crianças, adolescentes e adultos jovens), correspondendo a cerca de 20% do total de tumores registados nestas idades.
A sua localização é variável, dependendo do tipo e natureza do tumor; contudo mostram uma certa preferência pelos ossos longos, e nestes, pela região epifisiometafisária das chamadas epífises “férteis” dos membros. Denominam-se assim aquelas epífises que contribuem mais para o crescimento longitudinal dos membros, considerando-se que no membro superior correspondem às da região proximal do braço e distal do antebraço e, no membro inferior, às da região distal da coxa e proximal da perna. Isto significa que estas lesões, no membro superior, mostram predilecção pela região do ombro e do punho, e no membro inferior pela região do joelho.
O osteossarcoma é o tumor maligno primário mais comum em idade pediátrica (> 10 anos), seguindo-se em frequência o sarcoma de Ewing. Este último ultrapassa o primeiro em frequência abaixo dos 10 anos, sendo que ambos surgem sobretudo na 2ª década de vida com relação semelhante quanto ao sexo (M/F) cerca de 1,5/1.
Classificação e características
Os tumores primitivos dividem-se em dois grandes grupos, benignos e malignos, com características e prognóstico completamente diferentes, sendo os primeiros muito mais frequentes do que os segundos, e mostrando estes uma prevalência que ronda os 10 por milhão de habitantes com < 18 anos/ano. A classificação usualmente adoptada é a histológica, dividindo-os em grupos de acordo com a natureza e grau de diferenciação das células originárias predominantes do tumor; assim, pode considerar-se que tumores, tanto benignos como malignos, podem ser provenientes do tecido ósseo, cartilagíneo, fibroso, da medula óssea, dos vasos, ou do mesênquima.
Os tumores benignos caracterizam-se por serem capsulados, terem um crescimento gradual e não invasivo das estruturas vizinhas, não recidivarem quando correctamente tratados, nem metastizarem, não mostrarem alterações citológicas de malignidade no exame anátomo-patológico do tecido tumoral, e terem habitualmente bom prognóstico.
Os tumores ósseos benignos classificam-se em: 1) tumores formadores de osso (osteoma osteóide, osteoblastoma); e 2) tumores formadores de cartilagem (osteocondroma, osteocondromatose múltipla, encondroma, encondromatose múltipla, condroblastoma e fibroma condromixóide). Os quistos ósseos são considerados lesões pseudotumorais.
Pelo contrário, os tumores malignos têm crescimento rápido, invasivo e destrutivo, com limites muito mal definidos, infiltram os tecidos vizinhos, e o respectivo exame anátomo-patológico revela atipias celulares evidentes; por outro lado, recidivam e metastizam sempre, aparecendo as metástases muito precocemente, donde se depreende que o prognóstico é sempre mau.
Tendo como referência o osteossarcoma e o sarcoma de Ewing, cumpre referir algumas características distintivas. Assim – Sarcoma de Ewing -> Célula de origem: célula primitiva neuroectodérmica; Biologia: activação de oncogenes EWS-FLI1, EWS-ERG, EWS-ATF1; Osteossarcoma -> Célula de origem osteoblasto; Biologia: alteração dos antioncogenes (RB e TP53).
Manifestações clínicas
As manifestações clínicas dependem do tipo e natureza do tumor. Dum modo geral, a anamnese e a observação do doente, associadas à interpretação correcta dos exames imagiológicos adequados, são suficientes para se chegar a um diagnóstico provisório muito próximo do definitivo. Este exigirá ainda a identificação histológica do tumor a partir do material de biópsia, o que nem sempre é fácil pelas dificuldades de interpretação que muitas vezes se levantam.
Ainda como elementos orientadores do diagnóstico, e no que se refere ao exame clínico, podemos considerar a idade do doente (as lesões neoplásicas são raras antes dos cinco anos de vida), a sintomatologia geral (repercussão sobre o estado geral) e a local, destacando nesta a dor, a impotência funcional e a tumefacção.
A dor é o sintoma mais importante; sempre presente nos tumores malignos, mas não constante nos benignos, pode apresentar-se de forma peculiar, como a conhecida predominância nocturna no caso do osteoma osteóide, ou como fractura patológica num tumor que evolui silenciosamente até essa ocorrência. Importa ainda caracterizar, na dor, a sua natureza, se é espontânea ou provocada, a sua localização, evolução e condições que a exacerbam ou atenuam.
A impotência funcional está habitualmente associada à dor e constitui um sinal de defesa porque o movimento ou a contracção da musculatura regional a agrava; o seu significado patológico corresponde à compressão ou a infiltração e invasão dos tecidos vizinhos pela massa tumoral.
A tumefacção é geralmente um sinal mais tardio e a sua evidência depende da localização do tumor. Importa determinar a data do seu aparecimento e respectiva evolução, bem como os sinais associados (calor, rede vascular, repercussão articular, mobilidade anormal traduzindo a presença de fractura patológica, etc.).
Como nota orientadora para o médico que observa a criança em primeiro lugar, importa salientar o elevado nível de suspeição que deverá ter face a um quadro clínico com a sintomatologia referida, exigindo o encaminhamento atempado para centro especializado porque o êxito do tratamento e, consequentemente, o prognóstico, dependem sempre de um diagnóstico correcto e precoce.
Na actualidade já é possível utilizar biomarcadores, alguns, específicos para certos tipos de tumores, como acontece com o osteossarcoma. Tais biomarcadores permitem também avaliar o prognóstico. Como exemplo, citam-se, entre outros, a LDH, fosfatase alcalina, homocisteína, galectina-3, IGF-1 (factor de crescimento), VEGF (factor de crescimento endotelial vascular) e endostatina, moléculas identificadas pela metabolómica, micro RNA, células tumorais circulantes, etc..
Exames complementares
A avaliação laboratorial em geral é pouco informativa: poderá verificar-se elevação dos valores da lactato-desidrogenase e da fosfatase alcalina, relacionando-se, esta última, com a actividade osteoblástica, a qual poderá constituir, por sua vez, um marcador da resposta ao tratamento.
Quanto aos exames imagiológicos, a prioridade será dada à radiologia convencional cujos achados, na imensa maioria dos casos, permitem fazer a distinção entre lesões benignas e malignas. Assim, são indicadores de benignidade a integridade da cortical óssea, os limites nítidos da lesão, a ausência de reacção perióstica e o crescimento lento verificado nos exames sequenciais (Figura 1). Pelo contrário, no caso de a lesão ser maligna há interrupção irregular da cortical, bordos e contornos muito mal definidos, descolamento e/ou reacção perióstica, estrutura óssea anormal com destruição e/ou ossificação aberrante. (Figura 2)
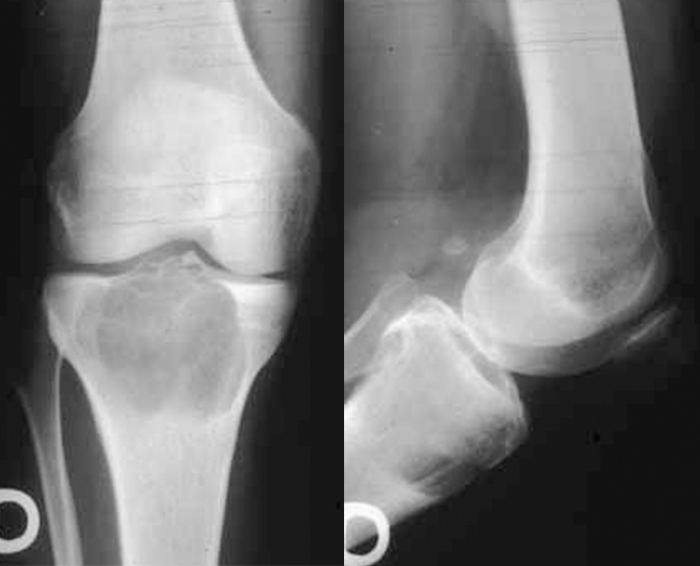
FIGURA 1. Radiografia de tumor benigno da metáfise proximal da tíbia – cortical íntegra e regular, osteólise uniforme, sem reacção perióstica
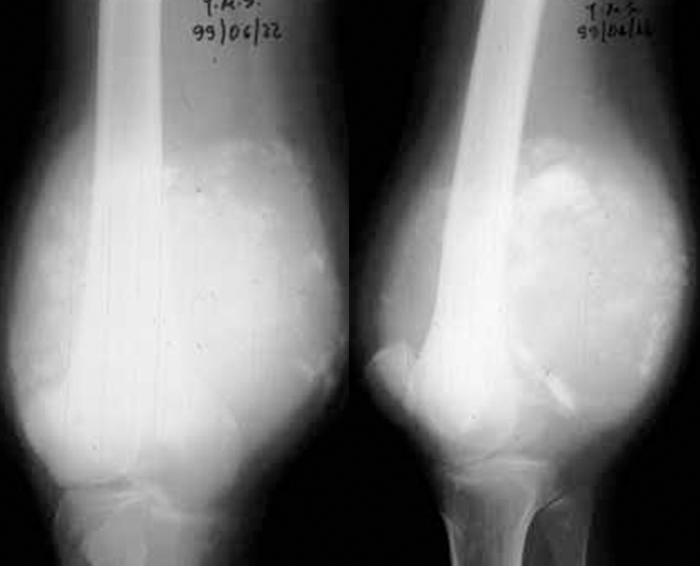
FIGURA 2. Radiografia de tumor maligno do 1/3 distal do fémur – aumento regional do volume do osso, rotura irregular da cortical, zona de osteólise e osteocondensação irregulares e reacção perióstica a nível da zona de implantação da massa tumoral
Os exames subsequentes são a TAC e a RM, pela ordem que se achar mais conveniente face à situação clínica concreta, não esquecendo que no primeiro se visualiza mais o tecido ósseo, enquanto o segundo é mais útil na identificação dos tecidos moles, permitindo ambos caracterizar a lesão e avaliar o estádio evolutivo, ou seja, o grau de extensão da doença.
A cintigrafia terá interesse para detectar a localização de lesões de pequenas dimensões e a possibilidade de disseminação da doença. A biópsia é um exame que deverá ser sempre muito ponderado e discutido com o cirurgião e com o imagiologista de intervenção.
Tratamento e Prognóstico
No caso do osteossarcoma está indicada a quimioterapia associada a cirurgia. No sarcoma de Ewing procede-se a quimioterapia mais cirurgia associada a radioterapia.
O prognóstico quanto à vida e função nos tumores benignos é geralmente bom; há, porém, a referir a possibilidade (rara) de recidiva local em determinadas situações, mesmo quando correctamente tratadas, e os casos muito mais raros de degenerescência maligna ocorrida nos doentes já adultos, portadores de lesões previamente benignas, como as descritas na osteocondromatose múltipla (também denominada exostose múltipla hereditária).
Nos tumores malignos, o prognóstico quanto à vida e função é reservado ou mau. Porém, nos últimos quinze anos, a introdução de novos protocolos terapêuticos em doentes com esta patologia, têm resultado numa melhoria significativa das taxas de sobrevida, aos cinco anos. Tal facto, associado às novas técnicas de cirurgia conservadora do membro, tem conduzido a diminuição drástica da percentagem de doentes amputados (Parte XVII).
Considerando o osteossarcoma e os tumores da “família” Ewing, na ausência de metástases, é obtida cura da ordem de 60-70%. Nos casos com metástases (mais frequentemente pulmonares) a sobrevivência é < 20% no primeiro caso e ~ 20-30% no segundo caso.
BIBLIOGRAFIA
Basu PS, Elsebaie H, Noordeen MH. Congenital spinal deformity: a comprehensive assessment at presentation. Spine 2002; 27: 225-2259
Beaty JH, Kasser JR, (eds). Rockwood and Wilkins’ Fractures in Children. Philadelphia: Lippincott-Williams & Wilkins, 2001
Boulnois I, Gouron R, Pluquet E, et al. Late recurrence of an osteoarticular infection caused by Klebsiella pneumoniae in a child. Arch Pédiatr 2018; 25: 497-499
Conrad DA. Acute hematogeneous osteomyelitis. Pediatr Rev 2010; 31: 464-471
Dormans JP. Pediatric Orthopaedics. Core Knowledge in Orthopaedics. St Louis: Elsevier Mosby, 2005
Edgar M. New classification of adolescent idiopathic scoliosis. Lancet 2002; 306: 270-271
Gereige R, Kumar M. Bone lesions: benign and malignant. Pediatr Rev 2010; 31: 355-363
Herring JA. Tachdjian’s Pediatric Orthopaedics. Philadelphia: Saunders, 2002
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lew DP, Waldvogel FA. Osteomyelitis. Lancet 2004; 364: 369-379
Lorrot M, Doit C, Ilharreborde B, et al. Antibiotic therapy of bone and joint infections in childhood: recent changes. Archives de Pédiatrie 2011; 18: 1016-1018
Mediamolle M, Mallet MC, Aupiais C, et al. Bone and joint infections in infants under three months of age. Acta Paediatrica 2019; 108: 933-939
Mooney JF, Murphy RF. Septic arthritis of the pediatric hip: update on diagnosis and treatment. Curr Opin Pediatr 2019; 31: 79-85
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015.
Morrissy R, Weinstein S, (eds). Lovell & Winter’s Pediatric Orthopaedics. Philadelphia: Lippincott-Williams & Wilkins Publishers, 2001
Otani Y, Aizawa Y, Hataya H, et al. Diagnostic errors in pediatric bacterial osteomyelitis. Pediatr Intern 2019; 61: 988-993
Paakkonen M, Peltola H. Bone and joint infections. Pediatr Clin North Am 2013; 60: 425-436
Podeszwa DA, Mubarak SJ. Physeal fractures of the distal tibia and fibula. J Pediatr Orthop 2012; 32: S62-S68
Robinette ED, Brower L, Schaffzin JK, et al. Use of a clinical care algorithm to improve care for children with hematogenous osteomyelitis. Pediatrics 2019; 143: e20180387; DOI: 10.1542/peds.2018-0387
Rosenberg JJ. Scoliosis. Pediatr Rev 2011;32: 397-398
Salter R. Textbook of Disorders and Injuries of the Musculoskeletal System. Baltimore: Williams & Wilkins, 1984
Slovis TL. Caffey’s pediatric diagnostic imaging. Philadelphia: Mosby, 2008
Staheli LT. Fundamentals of Pediatric Orthopedics. Philadelphia: Lippincott-Williams & Wilkins, 2003
Staheli LT. Practice of Pediatric Orthopedics. Philadelphia: Lippincott-Williams & Wilkins, 2006
Topol GA, Podesta LA, Reeves KD, et al. Hyperosmolar dextrose injection for recalcitrant Osgood-Schlatter disease. Pediatrics 2011; 128: e1121-e1128
White N, Sty R. Radiologic evaluation and classification of pediatric fractures. Clin Pediatr Emerg Med 2002; 3: 94-105
Yang S, Zusman N, Lieberman E, Rachel Y. Goldstein RY. Developmental dysplasia of the hip. Pediatrics 2019; 143: e20181147; DOI: 10.1542/peds.2018-1147