Definição e importância do problema
A osteomielite é uma infecção óssea frequentemente causada pela colonização e proliferação de germes bacterianos, e mais raramente fungos e vírus, atingindo todos os elementos constituintes do osso. De acordo com a evolução clínica distinguem-se as formas aguda e crónica; nas crianças é típica da primeira a chamada osteomielite hematogénica; na forma crónica distinguem-se dois tipos: a osteomielite crónica ab initio, sem fase aguda prévia – denominada abcesso de Brodie; e a crónica, como evolução de uma forma aguda precedente.
A osteomielite aguda surge com uma incidência de cerca de 1 / 5.000 crianças com idade inferior a 13 anos; metade desta relação verifica-se em idades inferiores a 5 anos (cerca de um terço com idades inferiores a 2 anos). Predomina no sexo masculino na razão de 2,5 / 1.
Neste capítulo é dada ênfase à osteomielite aguda hematogénica.
Etiopatogénese
Maioritariamente provocada por Staphylococcus aureus (sensível ou resistente à meticilina), afecta recém-nascidos, crianças e adolescentes, sendo cerca de duas vezes mais frequente do que a artrite séptica. Certas estirpes de S. aureus (que produzem uma toxina: leucocidina de Panton e Valentine ou LPV), estão associadas a formas graves de osteomielite e artrite. Tais estirpes são geralmente sensíveis à meticilina. Nas infecções adquiridas na comunidade existe maior probabilidade de se verificar a comparticipação de estirpes de S. aureus sensível à meticilina.
Outros germes poderão estar implicados como Kingella kingae (bacilo Gram-negativo cada vez mais frequente abaixo dos 5 anos, nalguns centros com maior incidência que o S. aureus), Streptococcus do grupo A, Salmonella (sobretudo em casos de drepanocitose), espécies Candida e bactérias Gram-negativas (sobretudo em infecções nosocomiais), Streptococcus do grupo B, Streptococcus pneumoniae e Treponema pallidum (sobretudo em recém-nascidos). Haemophilus influenzae do tipo b é hoje menos frequentemente implicado devido à imunização realizada a partir da idade dos 2 meses.
Os microrganismos atingem o osso essencialmente de duas formas: 1) disseminação hematogénica a partir de foco infeccioso vizinho; ou à distância (pele, amígdala, ouvido médio, etc.) que corresponde à forma mais frequente em crianças e lactentes; 2) inoculação directa na sequência, por exemplo, de acto cirúrgico, procedimento invasivo ou lesão traumática.
O microrganismo, atingindo o tecido ósseo, localiza-se habitualmente ao nível das metáfises dos ossos longos.
Esta localização explica-se pelas características regionais da própria rede vascular intra-óssea, derivada da artéria nutritiva do osso; tal rede é constituída por ansas longas, dilatadas, de paredes muito finas, responsável pela diminuição da velocidade circulatória, o que favorece a implantação e multiplicação dos germes com formação de um microabcesso. Com a antibioticoterapia precoce e em dose correcta, a situação não ultrapassa normalmente esta fase; se tal não acontecer, a lesão evolui e o material purulento difunde-se rapidamente através dos canais de Havers, progredindo para a cortical (abcesso subperióstico) e para o canal medular, com necrose isquémica do tecido ósseo perifocal e a possibilidade de formação de sequestros (fragmentos de osso necrosado) (Figura 1). Numa fase ainda mais avançada do processo infeccioso, o abcesso subperióstico pode perfurar os tecidos moles interpostos e fistulizar, com drenagem espontânea de pus para o exterior.
Se a metáfise onde ocorrem estas transformações é intra-articular, ou seja, se faz parte da extremidade óssea articular cuja respectiva cápsula se insere abaixo da cartilagem de conjugação, como acontece a nível da extremidade superior do fémur e da extremidade proximal do rádio, a perfuração do abcesso subperióstico faz-se para dentro da articulação, dando origem a uma artrite séptica. No caso do chamado abcesso de Brodie ou osteomielite crónica ab initio, a situação não evolui com a exuberância acima referida; por aumento da resistência do hospedeiro e/ou virulência moderada do germe, o organismo consegue delimitar o processo, conferindo-lhe características de cronicidade, sendo escassos ou moderados os sinais clínicos e imagiológicos.
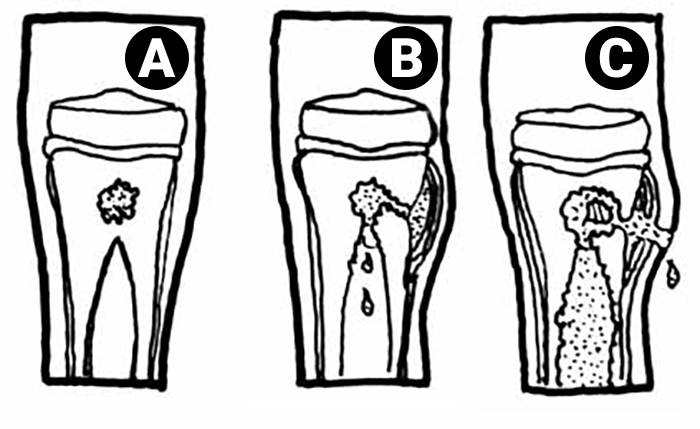
A – Formação metafisária de microabcesso com pus e osteólise focal;
B – Progressão do pus para a periferia, rotura do periósteo (abcesso subperióstico) e reacção periostal em “casca de cebola ” ;
C – Ossificação periostal, osteólise irregular, necrose óssea e formação do sequestro.
FIGURA 1. Representação esquemática da evolução de um foco de osteomielite aguda
Manifestações clínicas
O quadro clínico, que pode variar com a idade, é caracterizado habitualmente pelo início brusco, com dor intensa, metafisária, exacerbada à mínima pressão local, acompanhando-se de febre elevada e alteração do estado geral. Com a difusão da infecção verifica-se edema do segmento do membro afectado e marcha claudicante no caso de localização. Nos recém-nascidos podem surgir sinais sistémicos e quadro de pseudoparalisia ou imobilidade do membro, explicável pela dor.
Nas formas provocadas por S. aureus LPV o quadro clínico integra formas invasivas, sistémicas com choque e possibilidade de fascite e miosite necrosantes e ainda trombose séptica profunda e pneumonia.
Os ossos mais frequentemente afectados são o úmero, a tíbia e o fémur (70% a 75% dos casos). As infecções dos pequenos ossos das mãos e dos ossos achatados, no conjunto, surgem em 25 a 30% dos casos.
Diagnóstico diferencial
O diagnóstico diferencial da situação clínica com os sinais atrás descritos, em função de determinadas localizações, deve fazer-se, essencialmente, com artrite infecciosa, enfarte ósseo (no contexto da drepanocitose), celulite, fascite, discite, artrite reumatóide e neoplasia maligna óssea. Relativamente a esta última, cabe realçar, sobretudo nas crianças a partir dos cinco anos, o sarcoma de Ewing que, nas fases iniciais, tem um comportamento clínico e imagiológico muito semelhante.
Exames complementares
O hemograma pode revelar leucocitose com neutrofilia, por vezes acompanhada de aparecimento de neutrófilos imaturos no sangue periférico. A proteína C reactiva (PCR), a procalcitonina (PCT) e a velocidade de sedimentação com valores elevados revelam, em geral, sensibilidade para o diagnóstico e baixa especificidade; refira-se, no entanto, a importância da sua determinação seriada, a ponderar caso a caso para valorizar a situação; a descida dos valores da PCR constitui um dos critérios de evolução favorável, uma vez iniciado o tratamento antimicrobiano.
Nas formas causadas por S. aureus LPV é frequente leucopénia inicial.
A hemocultura é positiva em cerca de 30 a 60% dos casos.
Nas fases iniciais do processo infeccioso, o estudo radiográfico simples não revela alterações; em geral, somente a partir de duas a três semanas de evolução, são detectados os primeiros sinais anómalos – descolamento/elevação inicial e, ulteriormente, espessamento do mesmo periósteo (em estratos sobrepostos e concêntricos, correspondendo à descrição clássica da imagem em casca de cebola), associado a zonas de osteocondensação e osteólise metafisárias, com padrão desigual.
Mais tarde, no caso de a infecção prosseguir sem tratamento ou com tratamento inadequado, intensificam-se as imagens descritas a que se associam sinais de necrose/osteólise irregular. Como resultado da necrose, nas situações de processo crónico, formam-se os chamados sequestros ou fragmentos de osso esclerosado, não vascularizado que se traduz na radiografia simples por uma imagem de condensação cálcica, irregular, separada do osso adjacente. (Figura 2)
O diagnóstico inicial é essencialmente clínico, mas a partir das primeiras 48h de evolução, há a possibilidade de ser necessário o recurso à cintigrafia óssea simples ou com leucócitos marcados com Gálio, para indicar ou excluir a etiologia infecciosa.

FIGURA 2. Radiografia dos ossos do antebraço de uma criança com osteomielite crónica – reacção perióstica já ossificada, com consequente dismorfia e aumento do volume dos ossos, englobando sequestro bem visível no seu interior
A ressonância magnética (RM) representa para muitos autores a melhor prova de imagem para a osteomielite e artrite séptica. A ecografia tem interesse para evidenciar abcessos subperiósticos ou das partes moles sem que a sua normalidade exclua o diagnóstico. A TAC caiu em desuso pela excessiva radiação.
Tratamento
A osteomielite deve ser reconhecida e tratada adequada e precocemente, pois só assim se podem evitar (ou atenuar) as suas graves complicações.
Para além das medidas gerais de imobilização do membro e repouso em função da idade da criança, a escolha da antibioticoterapia inicial (empírica) antes do isolamento do agente deve basear-se na probabilidade do germe possivelmente em causa tendo em conta o contexto clínico (por ex. infecção adquirida na comunidade ou hospitalar), doenças associadas e a idade da criança.
Relativamente ao tratamento antimicrobiano por via IV existem diversos esquemas:
- No recém-nascido e lactente: antibiótico antiestafilocócico (flucloxacilina ou vancomicina) associado a aminoglicosídeo ou cefalosporina de largo espectro de modo a abranger os germes gram-negativos; após isolamento do germe, deve(m) ser escolhido(s) o(s) antibiótico(s) mais adequado(s). As doses (por via IV) devem ser iguais às utilizadas para o tratamento da septicémia e da meningite;
- Noutras idades: flucloxacilina ou clindamicina; nos doentes com drepanocitose a antibioticoterapia inicial deverá incluir a cefotaxima ou a ceftriaxona, com actividade anti-Salmonella.
Após isolamento do agente (antibioticoterapia dirigida), com esquema ponderado em função do contexto clínico de cada caso:
- se S. aureus meticilino-sensível está indicado o seguinte esquema: flucloxacilina ou amoxicilina/ácido clavulânico, ou clindamicina;
- se S. aureus meticilino-resistente: vancomicina + rifampicina;
- no caso de Kingella kingae: amoxicilina ou cefotaxima;
- se Streptococcus A: amoxicilina ou cefotaxima ou ceftriaxona;
- se Streptococcus pneumoniae: amoxicilina ou cefotaxima ou ceftriaxona;
- se S. aureus LPV: cefuroxima ou amoxicilina/ácido clavulânico + aminoglicosídeo + clindamicina ou rifampicina.
A duração do tratamento deve oscilar entre 4 a 6 semanas; de acordo com a evolução e a idade, a terapêutica por via endovenosa pode ser continuada por via oral desde que a mesma seja exequível. Em geral, verifica-se resposta favorável (clínica e laboratorial) à antibioticoterapia endovenosa ao cabo de 48-72 horas; se tal não acontecer estará indicada a drenagem cirúrgica/descompressão que, nesta fase inicial e na maioria dos casos, consiste numa intervenção simples, com perfurações múltiplas com broca fina, da zona metafisária atingida.
A drenagem cirúrgica está também indicada nos casos de compromisso da articulação da anca ou de compressão vertebral da espinhal medula.
Nota: A situação clínica poderá acompanhar-se de choque e/ou sépsis, aplicando-se os procedimentos descritos em capítulos próprios.
Prognóstico
Nas situações de osteomielite submetidas a tratamento precoce e adequado o prognóstico é favorável; o mesmo é mais reservado em recém-nascidos e lactentes com compromisso da anca e ombro. Poderá surgir recorrência em cerca de 5% dos casos, considerados todos os grupos etários. Como complicações referem-se as relacionadas com a perda do tecido ósseo e as deformidades mais ou menos acentuadas, resultantes do compromisso do crescimento ósseo local.
BIBLIOGRAFIA
Basu PS, Elsebaie H, Noordeen MH. Congenital spinal deformity: a comprehensive assessment at presentation. Spine 2002; 27: 225-2259
Beaty JH, Kasser JR, (eds). Rockwood and Wilkins’ Fractures in Children. Philadelphia: Lippincott-Williams & Wilkins, 2001
Boulnois I, Gouron R, Pluquet E, et al. Late recurrence of an osteoarticular infection caused by Klebsiella pneumoniae in a child. Arch Pédiatr 2018; 25: 497-499
Conrad DA. Acute hematogeneous osteomyelitis. Pediatr Rev 2010; 31: 464-471
Dormans JP. Pediatric Orthopaedics. Core Knowledge in Orthopaedics. St Louis: Elsevier Mosby, 2005
Edgar M. New classification of adolescent idiopathic scoliosis. Lancet 2002; 306: 270-271
Gereige R, Kumar M. Bone lesions: benign and malignant. Pediatr Rev 2010; 31: 355-363
Herring JA. Tachdjian’s Pediatric Orthopaedics. Philadelphia: Saunders, 2002
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Lew DP, Waldvogel FA. Osteomyelitis. Lancet 2004; 364: 369-379
Lorrot M, Doit C, Ilharreborde B, et al. Antibiotic therapy of bone and joint infections in childhood: recent changes. Archives de Pédiatrie 2011; 18: 1016-1018
Mediamolle M, Mallet MC, Aupiais C, et al. Bone and joint infections in infants under three months of age. Acta Paediatrica 2019; 108: 933-939
Mooney JF, Murphy RF. Septic arthritis of the pediatric hip: update on diagnosis and treatment. Curr Opin Pediatr 2019; 31: 79-85
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015.
Morrissy R, Weinstein S, (eds). Lovell & Winter’s Pediatric Orthopaedics. Philadelphia: Lippincott-Williams & Wilkins Publishers, 2001
Otani Y, Aizawa Y, Hataya H, et al. Diagnostic errors in pediatric bacterial osteomyelitis. Pediatr Intern 2019; 61: 988-993
Paakkonen M, Peltola H. Bone and joint infections. Pediatr Clin North Am 2013; 60: 425-436
Podeszwa DA, Mubarak SJ. Physeal fractures of the distal tibia and fibula. J Pediatr Orthop 2012; 32: S62-S68
Robinette ED, Brower L, Schaffzin JK, et al. Use of a clinical care algorithm to improve care for children with hematogenous osteomyelitis. Pediatrics 2019; 143: e20180387; DOI: 10.1542/peds.2018-0387
Rosenberg JJ. Scoliosis. Pediatr Rev 2011;32: 397-398
Salter R. Textbook of Disorders and Injuries of the Musculoskeletal System. Baltimore: Williams & Wilkins, 1984
Slovis TL. Caffey’s pediatric diagnostic imaging. Philadelphia: Mosby, 2008
Staheli LT. Fundamentals of Pediatric Orthopedics. Philadelphia: Lippincott-Williams & Wilkins, 2003
Staheli LT. Practice of Pediatric Orthopedics. Philadelphia: Lippincott-Williams & Wilkins, 2006
Topol GA, Podesta LA, Reeves KD, et al. Hyperosmolar dextrose injection for recalcitrant Osgood-Schlatter disease. Pediatrics 2011; 128: e1121-e1128
White N, Sty R. Radiologic evaluation and classification of pediatric fractures. Clin Pediatr Emerg Med 2002; 3: 94-105
Yang S, Zusman N, Lieberman E, Rachel Y. Goldstein RY. Developmental dysplasia of the hip. Pediatrics 2019; 143: e20181147; DOI: 10.1542/peds.2018-1147