Definição e importância do problema
O termo osteogénese imperfeita (OI) designa um grupo de displasias ósseas hereditárias, heterogéneas sob os pontos de vista clínico e genético, causadas por defeitos estruturais ou quantitativos do colagénio de tipo I, o componente principal da matriz extracelular do osso e pele.
Integrando diversos tipos (ver adiante), caracteriza-se por osteoporose (a OI é a causa genética mais frequente de osteoporose), fragilidade óssea, fracturas patológicas e outras anomalias do tecido conectivo tais como escleróticas azuis, dentinogénese imperfeita e surdez progressiva. Na infância a incidência da referida entidade oscila entre 1/10.000 e 1/20.000.
Etiopatogénese
- Os defeitos quantitativos ou estruturais do colagénio do tipo I originam o amplo espectro clínico da OI (sobretudo OI dos tipos I a IV – ver adiante), salientando-se que o colagénio do tipo I é o componente primário da matriz extracelular do osso e da pele.
A grande maioria dos indivíduos afectados evidencia mutações nos genes COL1A1 ou COL1A2, localizados em 17q21.31-q22 e 7q22.1; os referidos genes codificam a síntese das duas cadeias alfa do colagénio de tipo I.
A heterogeneidade clínica da OI explica-se possivelmente pela grande diversidade de mutações que se têm objectivado nos genes atrás referidos.
As mutações resultantes numa diminuição de cadeias pró-alfa-(I) podem dar lugar a fenótipos ligeiros de OI de tipo I, enquanto as deleções com perda de exões ou as inserções, de que resulta alteração da estrutura proteica, podem ser responsáveis por fenótipos mais exuberantes.
Refira-se, entretanto, que ainda não se conhece bem, nem a relação entre a mutação e o fenótipo do doente, nem a causa da variabilidade clínica dentro da mesma família. - O colagénio de tipo I é um heterodímero composto por duas cadeias, alfa-1 e alfa-2. As cadeias sintetizam-se como procolagénio, com um domínio helicoidal central formado por sequências de Gly-X-Y, em que Gly é a glicina, X é com frequência prolina, e Y a hidroxiprolina. A presença de glicina é importante para a formação da hélice. Nos extremos carboxilo ligam-se pequenas cadeias laterais, e coincidindo com a ligação, produz-se hidroxilação dos resíduos de prolina e lisina da hélice.
Na OI de tipo I ligeira observa-se um defeito quantitativo do colagénio que se origina porque, ainda que o alelo alfa-1 seja nulo, produzem-se pequenas quantidades de colagénio normal.
Os defeitos estruturais são de dois tipos – em 80% dos casos trata-se de mutações pontuais com substituição dos resíduos de glicina, sendo que a substituição de glicina nas duas cadeias alfa dá origem a quadros de distinta gravidade (em 1/3 dos pacientes, quando ocorre na cadeia alfa-1, o quadro é letal, enquanto se ocorrer na cadeia alfa-2, tal poderá não acontecer); e – em 20% dos casos trata-se de defeitos da ligação atrás referida.
Em duas regiões de união à cadeia alfa-1 a mutação é letal, assim como em oito regiões espaçadas regularmente na cadeia alfa-2 na zona de união a proteoglicanos.
Entre os tipos clássicos de OI a mais frequente e ligeira é a do tipo I.
Manifestações clínicas e classificação
Antes da abordagem dos diversos tipos de OI, faz-se uma referência geral às manifestações clássicas, sem especificação dos tipos da afecção.
1. Gerais
Esqueléticas
A fragilidade óssea e as fracturas patológicas de repetição condicionam um desenvolvimento anómalo do esqueleto, de gravidade muito variável em função do tipo de OI.
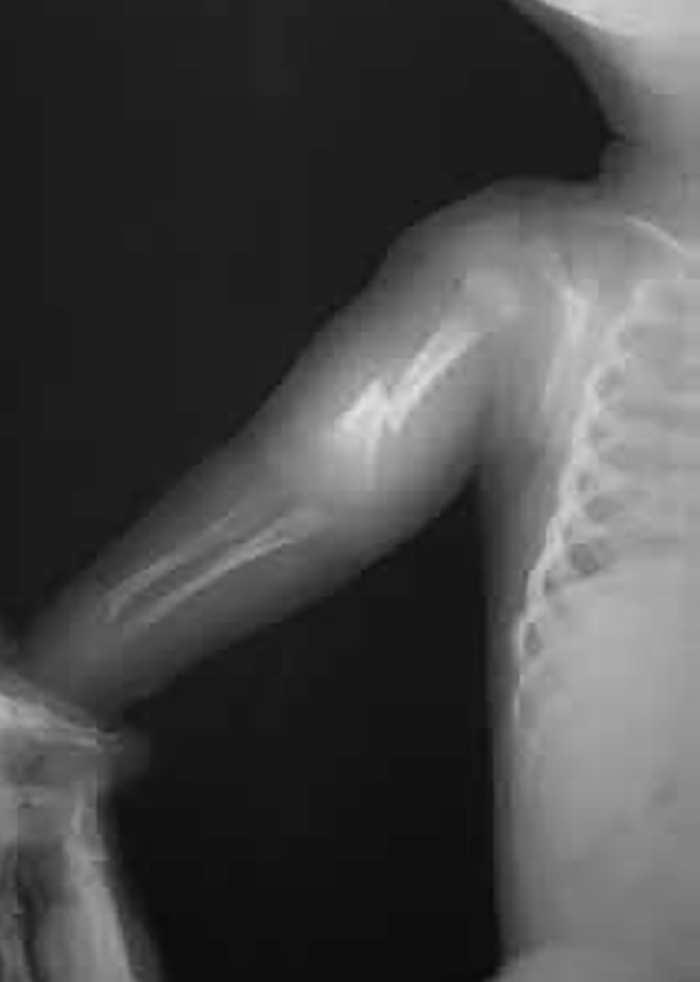
As fracturas ósseas recidivantes agravam ainda mais a fragilidade óssea por desmineralização subsequente, devida, esta, ao repouso que faz parte da actuação. As fracturas ósseas consolidam, no entanto, com normalidade. A verificação de extremidades inferiores curtas na idade adulta corresponde a sequela de fracturas diafisárias em idade pediátrica com consequente encurvamento das mesmas. (Figuras 1 e 2)
A face pode evidenciar conformação triangular, e verifica-se crânio de fronte proeminente, pavilhões auriculares de inserção baixa e de eixo oblíquo para trás.
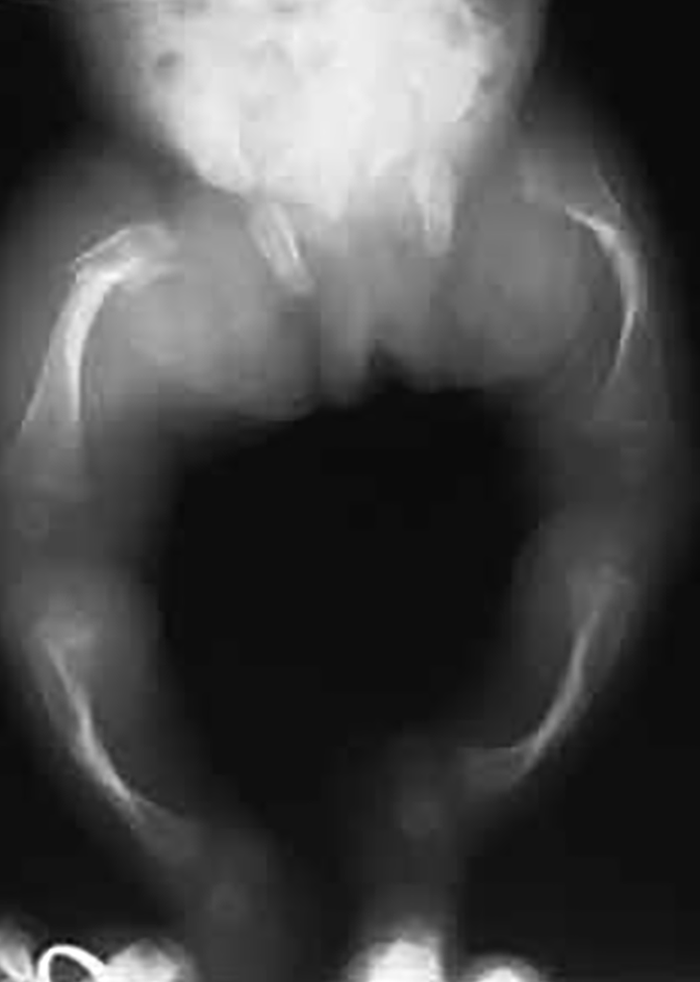
FIGURA 1. Osteogénese imperfeita em RN: aspecto radiológico esquelético sendo notórios o encurvamento dos ossos do membro inferior e sinal de fractura femoral. (NIHDE)
Oculares
A cor das escleróticas oscila entre branca e azul nítida, admitindo-se que tal aspecto seja devido ao adelgaçamento da esclerótica por alteração das respectivas fibras de colagénio, permitindo a visualização da coroideia subjacente.
Por vezes, a esclerótica pericorneana tem cor mais esbranquiçada, sinal conhecido por anel de Saturno.
Salienta-se que estão descritos casos de escleróticas azuis familiares sem relação com OI.
Défice auditivo
A surdez deve-se a alterações do desenvolvimento e de ossificação dos ossículos do ouvido, assim como a calcificações anómalas.
Inicialmente pode haver hipoacusia de transmissão, habitualmente para altas frequências, surgindo mais tarde hipoacusia de percepção (componente neurossensorial).
Dentárias
No tipo IB da OI surgem alterações dentárias, integrando o conceito de dentinogénese imperfeita.
As manifestações clínicas relacionadas com a deficiência em dentina incluem alteração da cor dos dentes definitivos, exibindo aspecto amarelado ou castanho-azulado. Existe facilidade de fractura dentária pelo escasso suporte dentinário. Os dentes deciduais são frequentemente hipotróficos e opalescentes.
II. Classificação etiopatogénica e clínica
A classificação de Sillence agrupa os diferentes tipos de osteogénese imperfeita atendendo a critérios clínicos e radiológicos, e estabelece subtipos em função dos estudos genéticos e das características radiológicas. Os chamados tipos clássicos de Sillence são os I, II, II e IV, de hereditariedade dominante (AD), surgindo respectivamente com as seguintes frequências, respectivamente 50%, 5%, 20%, 20%.
Tipo I (ligeira)
As principais características da OI do tipo I são: fragilidade óssea (com 10% dos casos evidenciando fracturas ao nascer), escleróticas azuis e estatura média normal ou ligeiramente inferior à normal; mutação no gene COL1A1.
Estão descritos dois subtipos: IA, com dentes normais, e IB, com dentinogénese imperfeita (com a particularidade de haver com maior frequência fracturas ao nascer, deformidades esqueléticas mais acentuadas e estatura final mais baixa). Quanto ao subtipo IB admite-se que possa dever-se a uma mutação do gene da fosforina, uma glicoproteína implicada na mineralização da matriz da dentina.
Tipo II (letal perinatal)
A OI do tipo II é letal no período perinatal, sendo a sua manifestação fundamental a fragilidade óssea extrema. Aparece de forma esporádica. Escleróticas azuis. Mutação nos genes COL1A1 ou COL1A2.
Tipo III (deformante progressiva)
A OI do tipo III evidencia osteopénia marcada com frequentes fracturas e deformidades secundárias progressivas. Escleróticas brancas ou azuis claras. Muito frequente a presença de cifoscoliose deformante, do que pode resultar disfunção respiratória restritiva. Baixa estatura e diminuição da expectativa de vida. Mutação nos genes COL1A1 ou COL1A2.
Tipo IV (moderada a grave)
A OI do tipo IV é dum modo geral mais benigna, não se lhe associando escleróticas azuis. Encurvamento tibial mais marcado. Escleróticas brancas. Mutação nos genes COL1A1 ou COL1A2.
Tipos V (calosa hiperplásica) e VI (hiperosteóide com deficiente mineralização)
Estes tipos, evidenciando alterações esqueléticas semelhantes às do tipo IV e igual frequência (< 5%) na população global de OI, distinguem-se entre si quanto às alterações histológicas definidas nos subtítulos. Escleróticas brancas. Tipo V com transmissão AD e mutação no gene IFITM5; tipo VI com transmissão autossómica recessiva (AR) e mutação no gene SERPINF1.
Tipos VII, VIII e IX (autossómicos recessivos/AR)
A OI dos referidos tipos mostra características semelhantes às dos tipo II e III. A do tipo VII, com rizomélia, símile acondroplasia, produzida por uma mutação no gene CRTAP evidencia características semelhantes às do tipo III, e a do tipo VIII (também com rizomélia e símile acondroplasia) semelhantes às do tipo II, mas de modo mais ligeiro e com mutação no gene LEPRE. (Os genes CRTAP e LEPRE codificam dois dos componentes do colagénio no retículo endoplásmico: prolil 3 hidroxilase/P3H1 ou da sua proteína associada).
O tipo IX, semelhante ao VIII, decorre de mutação no gene PPIB (peptidilpropilisomerase B).
Tipos X e XI, XII e XIII (autossómicos recessivos/AR)
A OI do tipo X apresenta características intermédias entre as do tipo I e II, com mutação no gene SERPINH. A do tipo XI mostra características da do tipo III, com mutação no gene FKBP10. Quanto à OI dos tipos XII e XIII, respectivamente com mutações nos genes SP7 e PMO1 são verificadas características similares às do OI do tipo III.
De referir que existem algumas formas de OI não classificadas, com quadros clínicos variáveis (entre formas moderadas e formas graves), correspondentes a defeitos nos genes SP7, TMEM38B e WNT1.
Exames complementares
No âmbito da vigilância pré-natal, cabe referir que a ecografia fetal poderá não detectar as OI dos tipos I e IV.
Em situações de história familiar com casos recorrentes, a biópsia das vilosidades coriónicas poderá ser utilizada para estudos moleculares ou bioquímicos.
O exame radiográfico pode mostrar sinais de osteopénia, diminuição da espessura da cortical dos ossos longos, deformações vertebrais, deformação dos ossos longos e calos de fractura.
O aspecto radiográfico dentário característico, na forma de OI tipo IB (dentinogénese imperfeita) evidencia estreitamento das câmaras pulpares, adelgaçamento do esmalte e das raízes, o que confere um aspecto em “sino”.
A densitometria óssea mostra, nos ossos não fracturados, densidade mineral óssea diminuída.
A histopatologia óssea pode evidenciar um vasto leque de alterações da mineralização, aumento da porosidade cortical e adelgaçamento trabecular, assim como alterações da distribuição e organização das fibras de colagénio I; contudo, estes achados sendo inespecíficos, não são utilizados para a fundamentação diagnóstica.
Na prática, o diagnóstico é confirmado pelos estudos bioquímicos do colagénio, utilizando fibroblastos cultivados a partir de biópsia da pele. Com efeito, a realização de culturas de fibroblastos demonstra diminuição da síntese das cadeias pró-alfa-1 (I) do procolagénio de tipo I.
Quanto a estudos moleculares, por vezes, recorre-se à análise de ADN para identificar a mutação associada ao quadro clínico e, se necessário, uma prova de PCR em membros da família.
Nos casos de complicações neurológicas – designadamente invaginação basilar e risco de compressão do tronco cerebral – mais prováveis nos tipos III e IV, a TAC espiral poderá ser de grande utilidade.
Diagnóstico diferencial
A presença de fracturas ósseas no período neonatal implica estabelecer o diagnóstico diferencial com maus tratos físicos, acondroplasia, displasia tanatófora, ou distrofia torácica asfixiante; a verificação de valores de fosfatase alcalina normais ou elevados na OI neste período permite fazer a destrinça com hipofosfatasia.
Na primeira e segunda infância, em função dos antecedentes, poderá admitir-se a possibilidade de maus tratos físicos, escorbuto, sífilis congénita, hiperostose cortical infantil, osteopetrose, picnodisostose e outras síndromas em que se verifica densidade óssea aumentada (de facto a fragilidade óssea tanto pode aparecer, quer em situações de osteopénia, quer em situações de hiperostose).
Na adolescência, a OI deve diferençar-se da osteoporose juvenil (entidade que parece dever-se a diminuição da formação do colagénio I nas vértebras), da homocistinúria, do hipercorticismo, da displasia fibrosa e da osteomalácia resultante de síndroma da má absorção.
Nos adultos, o diagnóstico de OI deve considerar-se sempre que se verique fractura patológica, osteopénia no sexo masculino ou em mulheres na pré-menopausa, ou ainda osteopénia grave em mulheres pós-menopáusicas; nos adultos ainda, o diagnóstico diferencial estabelece-se fundamentalmente com a osteoporose secundária a neoplasias hematológicas, endocrinopatias e osteomalácia. De salientar a probabilidade de casos descritos de osteoporose familiar constituírem, de facto, variantes ligeiras de OI.
Prevenção secundária e tratamento
Há que instruir a família e o doente sobre a necessidade de evitar traumatismos e actividades violentas, assim como sobre as medidas habituais de urgência (analgesia, imobilização, etc.) antes de observação por especialista de orto-traumatologia.
O tratamento ortopédico das fracturas, assim como as medidas de reabilitação incluindo fisioterapia, são fundamentais para reduzir o impacte da doença sobre a capacidade funcional.
As fracturas consolidam com facilidade, não se acompanhando, em geral, de angulações significativas dos topos; nos casos graves poderá ser necessário tratamento cirúrgico ortopédico.
Depois da puberdade há tendência para diminuir a probabilidade de fracturas, para voltar a aumentar nos períodos de gravidez e na pós-menopausa.
Tem-se preconizado o uso de bifosfonatos com o objectivo de aumentar a massa óssea e diminuir a taxa de fracturas; mas não existem ainda estudos controlados que permitam garantir a eficácia de tal medida. Estudos recentes sugerindo a utilização de pamidronato intravenoso nos casos de OI grave demonstraram diminuição da taxa de fracturas.
A hormona de crescimento (GH) tem sido utilizada com eficácia, sobretudo nos tipos I e IV.
A transplantação de células estaminais, contendo células de estroma com capacidade de diferenciação em osteoblastos, está a ser estudada em crianças com OI do tipo III grave.
A hipoacusia trata-se inicialmente com próteses auditivas sem dispensar, no entanto, em fase ulterior, tratamento cirúrgico do foro otorrinolaringológico.
O tratamento da dentinogénese é sintomático, preconizando-se a aplicação de selantes para reduzir a abrasão da superfície dentária.
Evolução e complicações
Os pacientes afectados pela forma I e alguns pela forma IV, dum modo geral têm marcha autónoma sem ajuda. Nas crianças com OI tipos II, V, VI, e XI necessitam de apoio mais ou menos complexo (canadianas, cadeira de rodas, etc.) beneficiando de fisioterapia e programa de natação.
As complicações mais frequentemente descritas são do foro cardiorrespiratório (pneumonias recorrentes, e cor pulmonale) e neurológico (invaginação basilar, compressão do tronco cerebral e hidrocefalia), entre outras.
BIBLIOGRAFIA
Barnes AM, Chang W, Morello R, et al. Deficiency of cartilage-associated protein in recessive lethal osteogenesis imperfecta. NEJM 2006; 355: 2757-2764
Byers PH, Pyott SM. Recessively inherited forms of osteogenesis imperfect. Annu Rev Genet 2012; 46: 475-497
Cheung MS, Glorieux FH. Osteogenesis imperfecta: update on presentation and management. Rev Endocr Metab Disor 2008; 9: 153-160
Forlino A, Cabral WA, Barnes AM, et al. New perspectives on osteogenesis imperfecta. Nat Rev Endocrinol 2011; 7: 540-557
Franzone JM, Shah SA, Wallace MJ, Kruse RW. Osteogenesis imperfecta: a pediatric orthopedic perspective. Orthop Clin North Am 2019 Apr; 50(2): 193-209. doi: 10.1016/j.ocl.2018.10.003
Goldman L, Schafer AI (eds). Goldman-Cecil Medicine. Philadelphia: Elsevier Saunders, 2016
Goodman RM, Gorlin RJ. The Malformed Infant and Child. An Illustrated Guide. Oxford: Oxford University Press, 1983
Hall CM, Offiah AC, Forzano F, et al. Dysplasias; an atlas of multimodality imaging. London: Radcliffe Publishing, 2012
Kliegman RM, StGeme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM (eds). Nelson Textbook of Pediatrics. Philadelphia: Elsevier, 2020
Kline MW, Blaney SM, Giardino AP, Orange JS, Penny DJ, Schutze GE, Shekerdemien LS (eds). Rudolph’s Pediatrics. New York: Mc Graw Hill Education, 2018
Krakow D. Skeletal dysplasias. Clin Perinatol 2015; 42: 301-319
Krakow D, Lachman RS, Rimoin DL. Guidelines for the prenatal diagnosis of fetal skeletal dysplasias. Genet Med 2009; 11: 127-133
Kruger KM, Caudill A, Rodriguez Celin M, et al. Mobility in osteogenesis imperfecta: a multicenter North American study. Genet Med 2019 Mar 28. doi: 10.1038/s41436-019-0491-4
Laine CM, Joeng KS, Campeau PM, et al. WNT1 mutations in early-onset osteoporosis and osteogenesis imperfecta. N Engl J Med 2013; 368: 1809-1816
Marini JC, Forlino A, Cabral WA, et al. Consortium for osteogenesis imperfecta mutations in the helical domain of type I collagen: regions rich in lethal mutations align with collagen binding sites for integrins and proteoglycans. Hum Mutata 2007; 28: 209-221
Marini JC, Blissett AR. New genes in bone development: what’s new in osteogenesis imperfecta. J Clin Endocrinol Metab 2013; 39: 3095-3103
Milks KS, Hill LM, Hosseinzadeh K. Evaluating skeletal dysplasias on prenatal ultrasound: an emphasis on predicting lethality. Pediatr Radiol 2017; 47: 134-145
Moro M, Málaga S, Madero L (eds). Cruz Tratado de Pediatria. Madrid: Panamericana, 2015
Parilla BV, Leeth EA, Kambich MP, et al. Antenatal detection of skeletal dysplasias. J Ultrasound Med 2003; 22: 255-258
Patel RM, Nagamani Sc, Cuthbertson D, et al. A cross-sectional multicenter study of osteogensis imperfecta in North America: results from the linked clinical research centers. Clin Genet 2015; 87: 133-140
Pyott SM, Tran TT, Leistriz DF, et al. WNT1 mutations in families affected by moderately severe and progressive recessive osteogenesis imperfecta. Hum Genet 2013; 92: 590-597
Salmon MA, Lindebaum RH. Developmental Defects and Syndromes. Aylesbury: HM+M Publishers, 1978
Smith DW. Recognizable Patterns of Human Malformation. Philadelphia: Saunders, 1982
Unger S. A genetic approach to the diagnosis of sleletal dysplasia. Clin Orthop Relat Res 2002; (401): 32-38
Warman ML, Cormier-DaireV, Hall C, et al. Nosology and classification of genetic skeletal disorders: 2010 revision. Am J Med Genet A 2011; 155 A: 943-968
Watson SG, Calder AD, Offiah AC, Negus S. A review of imaging protocols for suspected skeletal dysplasia and a proposal for standardisation. Pediatr Radiol 2015; 45: 1733-1737
Zambrano MB, Félix TM, Mello ED. Calcium intake improvement after nutritional intervention in paediatric patients with osteogenesis imperfecta. J Hum Nutr Diet 2019 Apr 29. doi: 10.1111/jhn.12657. [Epub ahead of print]